Структура мыщелкового хряща нижней челюсти у белых крыс после 60-суточного применения бензоата натрия и воздействия ионизирующего излучения
Автор: Степаненко И.Г., Лузин В.И.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Анатомия человека
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: изучить строение мыщелкового хряща нижней челюсти у крыс после 60-суточного введения бензоата натрия и воздействия ионизирующего излучения, как по отдельности, так и в комбинации, а также обосновать возможность профилактики и коррекции выявленных при этом изменений облепиховым маслом. Материал и методы. Исследование проведено на 240 белых крысах, разделенных на 8 групп. В течение 60 суток животные получали внутрижелудочно бензоат натрия в дозе 1500 мг / кг / сутки, ионизирующее облучение (4 сеанса суммарной дозой 4 Гр), а также облепиховое масло в дозе 300 мг / кг / сутки. При морфометрии мыщелковых хрящей оценивали их зональное строение, а также соотношение объемных компонентов. Результаты. Введение бензоата натрия сопровождалось сужением зон пролиферации и субхондрального остеогенеза, а также уменьшением количества первичной спонгиозы и остеобластов; в период реадаптации структура мыщелкового хряща постепенно восстанавливалась. Ионизирующее облучение приводило к аналогичным изменениям, но восстановление протекало медленнее. Сочетание бензоата натрия и ионизирующего излучения приводило к более грубым нарушениям, а восстановление практически не наблюдалось. При применении облепихового масла восстановление структуры мыщелкового хряща происходило быстрее. Заключение. Сочетанное воздействие бензоата натрия и ионизирующего излучения приводит к грубым нарушениям строения мыщелкового хряща нижней челюсти. Введение облепихового масла сопровождается сглаживанием выявленных изменений.
Бензоат натрия, ионизирующее излучение, мыщелковый хрящ, нижняя челюсть, облепиховое масло
Короткий адрес: https://sciup.org/149135304
IDR: 149135304 | УДК: 591.471:665.353.4
Текст научной статьи Структура мыщелкового хряща нижней челюсти у белых крыс после 60-суточного применения бензоата натрия и воздействия ионизирующего излучения
-
1 Введение. В различных отраслях производства, в быту, а также в научных исследованиях широко используются многочисленные агенты как физического, так и химического происхождения, которые оказывают влияние на состояние здоровья населения. Количество этих факторов постоянно увеличивается, поэтому возрастает и вероятность их одновременного воздействия на биологические объекты, то есть комбинирования, при котором биологическое действие агентов может потенцироваться [1].
Если 20 лет назад основным источником ионизирующего излучения (ИИ) являлся естественный радиационный фон, то сейчас ведущим является облучение населения за счет антропогенных ис-
точников: при ядерных испытаниях, производстве электроэнергии в ядерном топливном цикле, профессиональном облучении, а также медицинском облучении населения при различных диагностических и терапевтических процедурах [2]. Только в ядерной медицине прирост количества диагностических процедур с 1991 г. составлял 0,2 млн каждый год (около 1 % в год) [3].
С другой стороны, практически все население подвергается воздействию различных пищевых добавок, которые используются при производстве большинства пищевых продуктов для улучшения вкуса, аромата, внешнего вида продукта, а также для увеличения сроков хранения. Одной из наиболее распространенных пищевых добавок является Е211 — бензоат натрия (БН), который обладает консервирующими свойствами за счет подавления активности некоторых ферментов микроорганизмов, отвечающих за расщепление жиров и углеводов, а также дрожжевых культур и плесневых грибков. Употребление продуктов, содержащих БН, детьми приводит к нарушениям психического развития, таким как гиперактивность, дефицит внимания и снижение интеллекта, из-за его генотоксического и мутагенного действия [4]. По другим данным, использование БН может приводить к задержке внутриутробного развития плода и плаценты, сенсибилизации организма и развитию аллергических реакций, а также изменению биохимических показателей и форменных элементов крови [5]. Однако Международная программа по химической безопасности не выявила негативных влияний БН на здоровье человека [6].
В доступной литературе имеются разрозненные сведения о неблагоприятном воздействии на морфогенез зубочелюстной системы как ИИ, так и длительного употребления БН. Исследование же морфогенеза нижних челюстей (НЧ) при комбинированном воздействии данных агентов не проводилось. Не исследованы и способы коррекции выявленных в этих условиях изменений.
В качестве объекта исследования нами избран мыщелковый хрящ (МХ) НЧ, который у лабораторных крыс обеспечивает процессы продольного роста ветви НЧ, участвует в формировании височно-нижнечелюстного сустава, а также обладает высокой костеобразовательной активностью, вследствие чего активно реагирует на воздействие самых различных экзогенных факторов [7].
Цель: изучить строение мыщелкового хряща нижней челюсти у крыс после 60-суточного введения бензоата натрия и воздействия ионизирующего излучения, как по отдельности, так и в комбинации, а также обосновать возможность профилактики и коррекции выявленных при этом изменений облепиховым маслом.
Материал и методы. Экспериментальное исследование проведено на 240 белых лабораторных крысах-самцах с массой тела 180–200 г, распределенных на 8 групп. В частности, 1-ю группу составили контрольные животные. Во 2-ю группу вошли животные, получавшие интрагастрально через зонд БН в дозе 1500 мг/кг/сутки в течение 60 суток. В 3-й группе животные облучались в течение 60 суток ИИ в 4 сеанса (4 Гр суммарно). В 4-й группе крысы в течение 60 суток подвергались комбинированному воздействию БН и ИИ. Животные 5-й группы внутрижелудочно получали облепиховое масло (ОМ) в дозе 300 мг/кг/сут-ки; в 6-й группе — БН и ОМ; в 7-й группе — ИИ и ОМ. В 8-й группе животные на фоне сочетания приема БН и облучения ИИ получали ОМ.
Содержание лабораторных животных и все манипуляции над ними проводились в соответствии с Хельсинкской декларацией 1975 г. и ее пересмотром 1983 г., а также с требованиями приказа Министерства здравоохранения РФ от 23 августа 2010 г. №708-н «Об утверждении Правил лабораторной практики». Расчет дозы используемых препаратов проводили на основе рекомендаций Ю. Р. и Р. С. Рыболовлевых [8].
На 1, 7, 15, 30 и 60-е сутки после окончания воздействий животных декапитировали под эфирным наркозом и скелетировали НЧ. Выделенные мыщелковые отростки фиксировали в 10%-м растворе нейтрального формалина, декальцинировали в 5%-м растворе муравьиной кислоты, обезвоживали в спиртах возрастающей концентрации и заливали в парафин. Готовили гистологические срезы толщиной 4–6
мкм, которые окрашивали гематоксилином-эозином. Полученные гистологические препараты исследовали на цифровом морфометрическом комплексе на базе микроскопа Olympus BX 41 при объективе 40х и анализировали их с помощью компьютерной программы для морфометрических исследований Morpholog, модифицированной для изучения реактивных отделов нижних челюстей [9]. На полученных срезах исследовали гистологическое строение МХ НЧ: его общую ширину, а также ширину зон покоя, пролиферации, гипертрофического хряща, эрозивной и зоны субхондрального остеогенеза (ЗСО). В зоне субхондрального остеогенеза также определяли объемное содержание первичной спонгиозы и удельное количество клеток [7]. Полученные цифровые значения обрабатывали методами вариационной статистики с использованием лицензионного программного обеспечения Microsoft Office Excel 2007 (Microsoft, США), BIOSTAT 2008 Professional 5.1.3.1. Распределение соответствовало нормальному, рассчитывали минимальное и максимальное значения, среднюю арифметическую и ее отклонение. Использовали t-критерий Стьюдента с поправкой Бонферрони; статистически значимыми различия считали при p<0,05.
Результаты. Все полученные цифровые данные в обязательном порядке сравнивались с показателями соответствующей одновозрастной контрольной группы; все приведенные в статье цифровые отличия являются статистически значимыми (р≤0,05).
Внутрижелудочное введение подопытным животным БН в дозе 1500 мг/кг/сутки в течение 60 суток сопровождалось угнетением костеобразовательной функции МХ НЧ. На 1-е сутки после окончания введения БН общая ширина МХ была меньше значений 1-й группы на 5,8%, что происходило за счет сужения в первую очередь зоны пролиферации (на 7,0%) и ЗСО (на 7,9%). Кроме того, в ЗСО содержание первичной спонгиозы и количество остеобластов было меньше контроля на 6,4 и 7,3% соответственно (рис. 1).
В реадаптационный период после введения БН структура МХ НЧ после 15 суток наблюдения постепенно восстанавливалась, и к 60-м суткам лишь количество остеобластов в ЗСО оставалось меньше значений 1-й группы на 3,65%.
Облучение животных на протяжении 60 суток ИИ в 4 сеанса (4 Гр суммарно; 3-я группа) сопровождалось более выраженным угнетением костеобразовательной функции МХ НЧ. На 1-е сутки после окончания облучения общая ширина мыщелкового хряща была меньше значений 1-й группы на 8,24%, а ширина зон пролиферации и субхондрального остеогенеза — на 8,7 и 9,8%. При этом содержание первичной спонгиозы и количество остеобластов в ЗСО было меньше контроля на 7,3 и 8,3%.
В реадаптационный период после воздействия облучения угнетение костеобразовательной функции МХ НЧ сохранялось приблизительно на одном уровне до 30-х суток наблюдения и лишь затем незначительно нивелировалось. К 60-м суткам наблюдения общая ширина мыщелкового хряща оставалась меньше значений 1-й группы на 3,6%, ширина зоны пролиферации — на 4,9%, а количество остеобластов в ЗСО — на 4,9%.
При воздействии комбинации БН и ИИ в течение 60 суток определялось более выраженное угнетение костеобразовательной функции МХ НЧ: на 1-е сутки наблюдения общая ширина мыщелкового хряща была меньше значений 2-й группы на 4,50%, а ши-
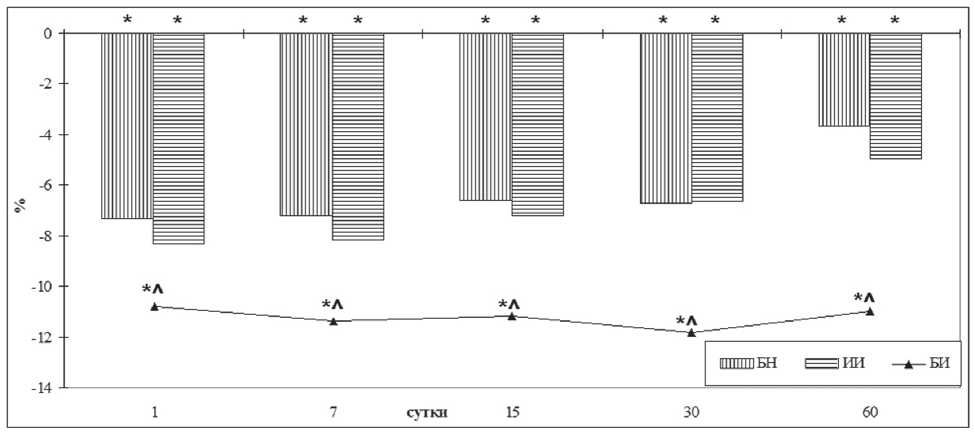
Рис. 1. Динамика изменения количества остеобластов в зоне субхондрального остеогенеза у подопытных животных в зависимости от вида воздействия и длительности периода реадаптации, % по отношению к 1-й группе Примечания: БН — подопытные животные, получавшие БН; ИИ — подопытные животные, подвергавшиеся ИИ; БИ — подопытные животные подвергавшиеся воздействию комбинации БН и ИИ; * — статистически значимые отличия от 1-й группы (р<0,05); ^ — статистически значимые отличия от 2-й группы (р<0,05)
рина зоны пролиферации и ЗСО — на 4,5 и 4,5%. При этом в ЗСО содержание первичной спонгиозы и количество остеобластов были меньше значений 2-й группы на 4,1 и 3,8%.
В реадаптационный период после воздействия комбинации БН и ИИ статистически значимые различия показателей гистоморфометрии МХ от значений 2-й группы сохранялись в течение всего наблюдения с незначительными признаками восстановления к 60-м суткам. К этому сроку общая ширина МХ оставалась меньше значений 2-й группы на 4,90%, а ширина зоны пролиферации и ЗСО — на 5,8 и 4,7%; в ЗСО содержание первичной спонгиозы и количество остеобластов оставались меньше значений 2-й группы на 7,7 и 7,6%.
Интрагастральное введение подопытным животным ОМ в дозе 300 мг/кг/сутки в течение 60 суток (5-я группа) сопровождалось слабовыраженными явлениями оптимизации морфофункциональной активности МХ НЧ. На 1-е сутки после прекращения введения ОМ общая ширина МХНЧ была больше значений 1-й группы на 3,17%, ширина зоны пролиферации — на 5,3%, ширина ЗСО — на 4,2%, а количество остеобластов в ЗСО — на 3,8%.
В реадаптационный период после применения ОМ признаки оптимизации строения МХ НЧ сохранялись до 60 суток наблюдения, когда ширина ЗСО оставалась больше значений 1-й группы на 3,7%, а ширина зоны эрозии на 7-е и 30-е сутки на 3,4 и 3,5%.
Применение ОМ на фоне введения БН (6-я группа) в значительной степени сглаживало негативное влияние условий эксперимента на гистологическое строение МХ НЧ с максимальными проявлениями корригирующего эффекта на 30-е сутки восстановления. К этому сроку общая ширина МХ НЧ была больше значений 2-й группы на 4,53%, ширина зоны пролиферации и ЗСО — на 5,8 и 5,1%.
Интрагастральное введение ОМ на фоне воздействия ИИ (7-я группа) также несколько сглаживало и негативное влияние условий эксперимента на гистологическое строение мыщелковых хрящей нижней челюсти в сравнении с группой без применения
ОМ в ходе всего реадаптационного периода. В итоге к 60-м суткам исследования общая ширина МХ НЧ была больше значений 3-й группы на 2,40%, ширина ЗСО на 6,00%, а количество остеобластов в ЗСО на 3,68% (рис. 2).
Наконец, введение ОМ на фоне комбинациии БН и ИИ (8-я группа) также несколько сглаживало негативное влияние условий эксперимента на гистологическое строение МХ НЧ в ходе всего реадаптационно-го периода. В итоге к 6-м суткам после прекращения воздействия общая ширина МХ НЧ была больше значений 4-й группы на 3,8%, ширина зоны пролиферации — на 4,2%, ширина ЗСО — на 7,3%, а содержание первичной спонгиозы и количество остеобластов в ЗСО — на 7,8 и 8,4%.
Обсуждение. МХ НЧ обладает высокой костеобразовательной активностью и является основным источником роста ветви НЧ, причем характерны процессы как аппозиционного, так и интерстициального роста. При всем этом МХ НЧ активно реагирует на воздействие как внутри-, так и внешнесредовых факторов изменением зонального строения и соотношения основных структурных компонентов, что ведет и к изменениям его костеобразовательной активности. Основной вклад в эти изменения вносят структурные преобразования в зонах пролиферации и ЗСО [7].
Интрагастральное 60-суточное введение НБ подопытным животным в дозе 1500 мг/кг/сутки сопровождается сужением зоны пролиферации и ЗСО, а также уменьшением количества первичной спон-гиозы и остеобластов в ЗСО, что свидетельствует об угнетении его костеообразовательной потенции. Это может быть связано с тем, что бензоат натрия при пероральном поступлении в организм в тонкой кишке вступает в химическую реакцию с аскорбиновой кислотой и образует ароматический углеводород — бензол. Бензол вызывает прямое повреждение молекулы ДНК митохондрий, что приводит к нарушению синтеза АТФ в клетках организма, в том числе в хондроцитах МХ НЧ [5]. Кроме того, бензойная кислота в клетках организма вызывает оксидативный
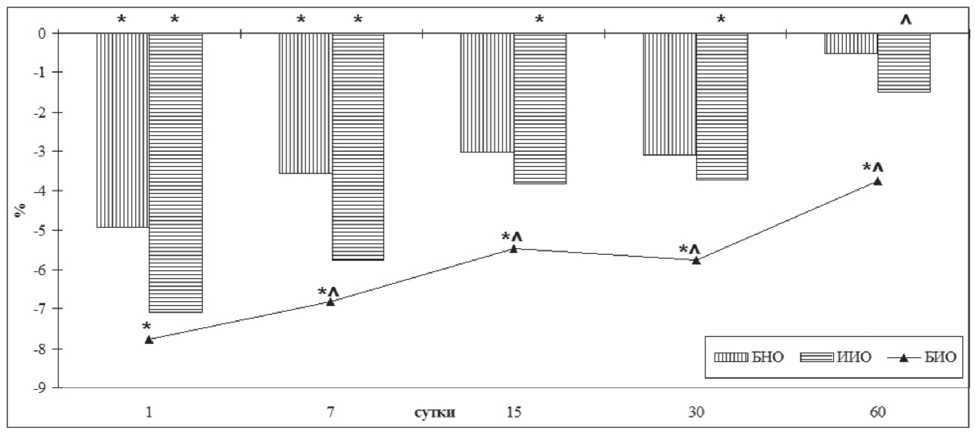
Рис. 2. Динамика изменения количества остеобластов в зоне субхондрального остеогенеза у подопытных животных, получавших ОМ, в зависимости от вида воздействия и длительности периода реадаптации, % по отношению к 1-й группе Примечания: НБО — подопытные животные, получавшие БН и ОМ; ИРО — подопытные животные, подвергавшиеся облучению ИИ и получавшие ОМ; БИО — подопытные животные, подвергавшиеся воздействию комбинации БН и ИИ и получавшие ОМ; * — статистически значимые отличия от 1-й группы (р<0,05); ^ — статистически значимые отличия от группы без коррекции (р<0,05)
стресс, вызывая усиленное образование малонового диальдегида, что является симптомом активации перекисного окисления липидов. В культивируемых гепатоцитах крысы БН вызывает снижение глутатиона, что также является проявлением стресса [4].
Данные изменения находят отражение в снижении функциональной активности хондроцитов МХ НЧ, в первую очередь в ЗСО, что проявляется в уменьшении ее ширины, а также в количестве первичной спонгиозы и остеобластов.
Воздействие ИИ, помимо развития оксидативно-го стресса, также индуцирует эффекты преимущественно опосредованно через системы регуляции, иммунного ответа и дестабилизацию генома [2]. В частности, доказано, что воздействие ИИ приводит к изменению концентрации первичных мессенджеров (катехоламинов, кортикостероидов, серотонина и других биологически активных соединений) в тканях и периферической крови млекопитающих [10]. Вследствие этого угнетение морфофункционального состояния МХ НЧ после воздействия ИИ является более выраженным, чем после интрагастрального введения НБ; значительно медленнее происходит и восстановление структуры МХ после прекращения воздействия ИИ.
Комбинирование БН и ИИ сопровождается еще более выраженным нарушением гистологического строения МХ НЧ, а восстановление их костеобразовательной активности в сравнении со 2-й группой в реадаптационный период практически не наблюдается. Можно предположить, что комбинирование обоих повреждающих агентов потенцирует их негативное влияние на структуру МХ НЧ.
Выявленные признаки угнетения костеобразовательной активности МХ НЧ после длительного применения БН и ИИ диктуют необходимость поиска путей их медикаментозной профилактики и коррекции.
В качестве корректора нами было избрано облепиховое масло, в составе которого содержатся витамины (A, C, E, K, рибофлавин, фолиевая кислота), каротиноиды, фитостерины, органические кислоты (яблочная кислота, щавелевая кислота), полиненасы- щенные жирные кислоты и незаменимые аминокислоты, микроэлементы [11]. Обладая антиоксидантной активностью, ОМ предотвращает образование свободных радикалов в митохондриях, которые могут способствовать ингибированию радиационно-индуцированных апоптоза и цитотоксичности [12].
Витамины и микроэлементы также являются важными кофакторами многих ферментных систем, а флавоноиды обладают антиоксидантными свойствами, чем и можно объяснить уменьшение проявлений оксидативного стресса, индуцированного введением БН и воздействием ИИ. Это выражается в меньшем уровне угнетения костеобразовательной активности МХ НЧ непосредственно по окончании затравки и более быстром восстановлении изучаемых параметров гистологического строения МХ в сравнении с группами без введения ОМ в реадаптационный период.
Заключение. Полученные в ходе исследования результаты позволяют сделать следующие выводы:
-
1. 60-суточное внутрижелудочное введение БН в дозе 1500 мг/кг/сутки сопровождалось угнетением костеобразовательной функции МХ НЧ. В период реадаптации гистологическое строение МХ НЧ к 60-м суткам эксперимента постепенно восстанавливалось.
-
2. 4-кратное воздействие ИИ в суммарной дозе 4 Гр приводило к аналогичным по характеру изменениям гистологического строения МХ НЧ, однако процессы восстановления по времени протекали медленнее, и достоверные изменения исследуемых морфометрических показателей регистрировались и на 60-е сутки периода реадаптации.
-
3. Сочетанное воздействие БН и ИИ приводило к более грубым нарушениям морфофункционального состояния МХ НЧ, а восстановление гистологического строения в период реадаптации практически не регистрировалось.
-
4. Использование в качестве корректора ОМ в дозе 300 мг/кг/сутки сопровождалось снижением неблагоприятного влияния условий эксперимента на исследуемые параметры гистологического строения МХ НЧ. Восстановление гистологического стро-
- ения МХ НЧ происходило быстрее в течение всего периода реадаптации, что в первую очередь было связано с восстановлением функциональной активности зон пролиферации и субхондрального остеогенеза.
Список литературы Структура мыщелкового хряща нижней челюсти у белых крыс после 60-суточного применения бензоата натрия и воздействия ионизирующего излучения
- Петин В. Г., Жураковская Г. П. Влияние интенсивности действующих агентов на проявление синергического взаимодействия. Радиационная биология. Радиоэкология 2015; 55 (6): 598-606
- Верещако Г. Г., Чуешова Н. В., Горох Г. А. и др. Влияние внешнего облучения и иммобилизационного стресса на репродуктивную систему крыс-самцов. Радиационная биология. Радиоэкология 2016; 56 (1): 56-63
- Большов Л. А., Арутюнян Р. В., Линге И. И., Абалкина И. Л. Ядерные аварии: последствия для человека, общества и энергетики. Радиационная гигиена 2016; 9 (3): 43-52
- Piper JD, Piper PW. Benzoate and Sorbate Salts: A Systematic Review of the Potential Hazards of These Invaluable Preservatives and the Expanding Spectrum of Clinical Uses for Sodium Benzoate. Comprehensive Reviews in Food Science and Food Safety 2017; 16 (5): 1-5
- Saatci C, Erdem Y, Bayramov R, et al. Efect of sodium benzoate on DNA breakage, micronucleus formation and mitotic index in peripheral blood of pregnant rats and their newborns. Biotechnology and biotechnological equipment 2016; 30 (6): 1179-83
- International Programme on Chemical Safety: Concise International Chemical Assessment Document №26: Benzoic Acid and Sodium Benzoate / World Health Organization (WHO): Geneva, Switzerland, 2006; p. 1-48
- Лузин В. И., Морозов В. Н. Современные представления о морфофункциональной организации нижней челюсти крыс. Український морфологiчний альманах 2011; 9 (4): 161-6
- Рыболовлев Ю. Р., Рыболовлев Р. С. Дозирование веществ для млекопитающих по константе биологической активности. Доклады АН СССР 1979; 247 (6): 1513-6
- Овчаренко В. В., Маврич В. В. Комп"ютерна програма для морфометричних дослiджень "Master of Morphology": Свiд. про реєстрацiю авт. права на винахiд № 9604, дата реєстрацiї 19.03.2004)
- Шишкина Л. Н., Загорская Н. Г., Шевченко О. Г. Роль антиоксидантного статуса ткани в ответе организма мыши на хроническое облучение в раннем онтогенезе. Радиационная биология. Радиоэкология 2015; 55 (1): 91-6
- Zielińska A, Nowak I. Abundance of active ingredients in sea-buckthorn oil. Lipids Health Dis 2017; 16 (1): 95
- Zeb A, Ullah S. Sea buckthorn seed oil protects against the oxidative stress produced by thermally oxidized lipids. Food Chem 2015; 186: 6-12.


