Структура переднего эпителия роговицы Sus scrofa domesticus при криофиксации
Автор: Хомякова Н.В., Колоскова Э.Л., Сидоров И.И.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Дискуссии
Статья в выпуске: 3 т.31, 2023 года.
Бесплатный доступ
Классическая гистологическая картина переднего эпителия роговицы, известная по результатам стандартной гистологической техники и световой микроскопии препаратов химически фиксированного материала, описывает наличие трех клеточных слоев: базального - герминативного, среднего и поверхностного. На препаратах криофиксированного материала над клетками третьего слоя определяется еще один гомогенный слой, который принято идентифицировать как прекорнеальную слезную пленку, то есть слой жидкости. Анализ и сопоставление известных данных позволяют обозначить научную проблему, которая заключается в следующем. Структура гомогенного слоя ранее не изучалась, строение его неизвестно, следовательно, идентификация гомогенного слоя с прекорнеальной слезной пленкой не обоснована. Мы предполагаем, что гистологическая картина переднего эпителия на препаратах химически фиксированного материала является неполной, а гомогенный слой является структурным компонентом переднего эпителия. Цель исследования: изучить структуру переднего эпителия и гомогенного слоя на препаратах криофиксированного материала. Материал исследования - кадаверные глаза свиньи домашней (Sus scrofa domesticus). Методы исследования - световая микроскопия. В результате исследования впервые установлено, что гомогенный слой является структурным компонентом переднего эпителия роговицы. Между гомогенным слоем и слоем плоских клеток переднего эпителия определяется еще один слой в виде микроскопически выявляемой тонкой полоски. С учетом установленного факта следует заключить, что передний эпителий роговицы состоит из пяти слоев. Клетки в слоях находятся в уплотненном состоянии, степень которого увеличивается от базальной мембраны к фронтальной поверхности эпителия, достигая максимума на уровне гомогенного слоя. Клетки поверхностного слоя безъядерные, заполнены оксифильной массой, предположительно кератином, что указывает на процесс ороговения эпителиоцитов. Результаты исследования подтвердили предположение о том, что гистологическая картина на препаратах химически фиксированного материала является неполной. Идентификация гомогенного слоя с прекорнеальной слезной пленкой безосновательна.
Орган зрения, роговица, передний эпителий роговицы, криофиксация, свинья домашняя
Короткий адрес: https://sciup.org/143181187
IDR: 143181187 | DOI: 10.20340/mv-mn.2023.31(3).762
Текст научной статьи Структура переднего эпителия роговицы Sus scrofa domesticus при криофиксации
Доказано морфологическое единообразие переднего эпителия роговицы человека и млекопитающих (обезьяны, свиньи, кошки, коровы, кролика, морской свинки, крысы, мыши, тюленя, кита, кашалота и морской свиньи). Количество рядов эпителиальных клеток варьирует от 3-5 у мыши до 12-18 у голубого кита [2]. Этот факт позволяет использовать глаза животных в качестве модели для клинических и экспериментальных исследований. Анализ научных данных более чем за столетний период позволяет сделать вывод о том, что трехслойная структура переднего эпителия роговицы специфична только для препаратов химически фиксированного материала. На препаратах криофик-сированного материала над клетками тре- тьего слоя определяется еще один - гомогенный слой, который принято идентифицировать как прекорнеальную слезную пленку [10-11]. Гомогенный слой в виде хлопьевидного материала на поверхности эпителия (т.н. the delicate flocculent layer on the surface of the epithelium) ранее был обнаружен и на некоторых препаратах, приготовленных для электронной микроскопии [4].
Важно обратить внимание на то, что представление о прекорнеальной слезной пленке, как слое жидкости, сложилось задолго до микроскопической визуализации гомогенного слоя. Структура прекорнеальной слезной пленки, основанная на наблюдении глазной поверхности и компонентном составе слезной жидкости, всегда рассматривалась во взаимосвязи с трехслойной структурой переднего эпителия роговицы. И в настоящее время прекорнеальной слезной пленкой (precorneal tear film) в научной литературе обозначают слой жидкости на поверхности роговицы, состоящий из трех компонентов: водного, муцинового (слизистого) и липидного. Муциновый компонент вырабатывают бокаловидные клетки конъюнктивы, крипты Генле и железы Манца. Водный компонент, то есть слезу (lacrimam), вырабатывают дополнительные железы конъюнктивы Краузе и Вол-фринга. Липидный компонент - смесь секретов сальных (мейбомиевых и Цейса) и потовых желез Молля. Формирование прекорнеальной слезной пленки связывают с функцией век. Полностью заполняя капиллярную щель между стенками конъюнктивального мешка, слезная жидкость каждые 7-10 секунд равномерно распределяется веками по поверхности роговицы, после чего начинается ее испарение. С каждым новым миганием цикл повторяется. Полагают, что в отношении переднего эпителия роговицы прекорнеальная слезная пленка выполняет защитную, метаболическую и светопреломляющую функции [12-15].
Следуя существующим представлениям о прекорнеальной слезной пленке Chen с соавт. (1997) поставили цель зафиксировать циклично формирующийся слой жидкости. Для этого они использовали ме- тод криофиксации in vivo с замещением замораживанием (так называемый метод VC-FS, то есть «in vivo cryofixation with freeze substitution»). Под инсталляционной анестезией роговицу животного фиксировали смесью изопентана-пропана охлажденную жидким азотом, затем выполняли энуклеацию, помещали глаз в жидкий азот, после чего следовала биотомия и стандартная процедура приготовление препаратов. Методом световой и электронной микроскопии авторы визуализировали гомогенный слой толщиной 2-6 мкм над клетками переднего эпителия роговицы, который идентифицировали как слезную пленку (the tear film as a layer of homogeneous and fine network-like structure on the corneal surface). Гомогенный слой не исследовали, его удалили, применив 1020% раствор ацетилцистеина [16].
Все приведенные выше данные являются общепризнанными. Они положены в основу концепции об анатомофизиологическом взаимодействии многослойного плоского неороговевающего эпителия, покрытого мириадами микроворсин, с прекорнеальной слезной пленкой. Тем не менее, анализ и сопоставление известных данных позволяют обозначить дискуссионный вопрос, который заключается в следующем. Структура гомогенного слоя не изучалась, строение его неизвестно, следовательно, идентификация гомогенного слоя с прекорнеальной слезной пленкой не обоснована. Как следствие, существующая концепция содержит в себе множество противоречий, главным из которых является несоответствие структуры переднего эпителия роговицы его основным функциям - оптической и барьерной. Во-первых, рельеф фронтальной поверхности переднего эпителия с мириадами подвижных микроворсин на апикальной части поверхностных клеток не соответствует понятию оптической поверхности. Во-вторых, морфология поверхностных клеток не согласуется с барьерными функциями переднего эпителия [17]. Функцией микроворсин (microvilli) является увеличение площади всасывающей поверхности, а их подвижность за счет актиновых микрофиламентов предполагает наличие системы транспорта, что соотно- сится с функцией клиренса и характерно для железистых эпителиев, но не покровных, к числу которых относится многослойный плоский эпителий роговицы. В-третьих, слезная пленка, в понимании ее как слоя жидкости на поверхности роговицы, не может быть отнесена ни к одной из известных групп тканей, а, следовательно, не может наделяться функциями тканей - защитной (барьерной) и метаболической (трофической).
Выявленные противоречия существующих представлений, дали нам основание предположить, что гистологическая картина переднего эпителия на препаратах химически фиксированного материала является неполной. Гомогенный слой может быть структурным компонентом переднего эпителия и может быть подробно исследован на препаратах крио-фиксированного материала.
Цель исследования: определить структуру переднего эпителия роговицы на гистологических препаратах криофик-сированного материала.
Материалы и методы исследования. В качестве модели ex vivo использованы глаза свиньи домашней (вида свинья домашняя/Sus domesticus/ Sus scrofa domesticus), на основании анатомического и гистологического сходства ее роговицы с роговицей человека, включая гистологию переднего эпителия (количество рядов клеток 6-9) и анатомию слезных желез [1720]. При выборе вида животного учитывался тот факт, что именно свиная роговица в настоящее время рассматривается в качестве каркаса для тканевой инженерии роговицы и в качестве ксеногенного субстрата для трансплантации роговицы [2122]. Следовательно, результаты исследований могут пополнить базу данных по изучаемой проблеме. Глаза Sus domesticus получены на ферме крестьянского хозяйства через 30 минут после убоя здоровых животных для мясопереработки, то есть животные не были специально принесены в жертву для исследований. Глаза помещали в контейнер на влажный ватный диск, поверхность роговицы однократно увлажняли препаратом искусственной слезы. В течение двух часов материал транспортировали в гистологическую лабораторию.
Требованием к исследуемому материалу было сохранение его витальных характеристик. На момент криофиксации роговица глаза должна была быть визуально прозрачной, гладкой, зеркальной. В тоже время, условия получения материала исследования исключали возможность образования прекорнеальной слезной пленки.
Для криофиксации и биотомии глазного яблока использовали криостат-микротом СМ 2850, Hestion Scientific Pty Ltd (Австралия). Криофиксацию выполняли при температуре –21-23C° до равномерного замораживания глазного яблока. Биотомию толщиной 5-7 мкм проводилась в вертикальной плоскости относительно положения глаза в орбите. Сагиттальные срезы помещали на предметное стекло. Для исследования переднего эпителия роговицы использовали микроскоп Nikon 4550S с цифровой специализированной камерой DS-Fi2 и блоком автономного управления Nikon DS-L3. Выбор и порядок применения отдельных приемов гистотехники преследовал одну цель - минимизировать воздействие на передний эпителий роговицы для максимального сохранения его структуры. В экспериментальных целях применяли 4% раствор натрия гидрокарбоната (NaHCO3), меняющий кислотность внутриклеточной среды и приводящий к увеличению объема клеток переднего эпителия. Раствор гидроксида натрия (NaOH), способный изменять структуру кератина и растворять его, использовался для проверки предположения о наличии кератина в поверхностных клетках переднего эпителия [23]. Следуя поставленным целям, эмпирическим путем была подобрана 0,04N концентрация раствора NaOH для обработки поверхности роговицы. Окраску срезов проводили путем нанесения нескольких капель красителя на его поверхность с экспозицией 3-5 минут, после чего осторожно смывали краситель физиологическим раствором. Применяли растворы красителя-фиксатора эозина-метиленового синего по Май-Грюнвальду, гематоксилина и эозина. Исследовали свежеокрашенные (влажные) срезы на временных препаратах. Воздействие на срезы спиртами, ксилолом, толуолом исключалось. В качестве кон- трольного образца был приготовлен препарат сагиттального среза роговицы Sus scrofa domesticus в обычной последовательности, фиксацией формалином, заливкой в парафин, окраской гематоксилином и эозином.
Результаты исследования и обсуждение. На контрольном препарате переднего эпителия определено три слоя клеток. Базальный слой – один ряд столбчатых клеток, средний слой – четыре ряда клеток крыловидной формы, поверхностный слой – пять рядов плоских клеток с ядрами палочковидной формы, ориентированными параллельно поверхности клеточного пласта. Общее количество рядов эпителиальных клеток на препарате химически фиксированного материала – десять (рис. 1). Исследование переднего эпителия на препаратах криофиксированного материала начинали с обзорной микроскопии неокрашенного препарата. На препарате сагиттального среза роговицы определяется строма, базальная мембрана и клетки переднего эпителия. Естественную завершенность архитектонике переднего эпителия придает поверхностно расположенный однородный слой с четкими границами в виде оптически плотных линий. Внутренняя граница слоя неровная, внешняя - идеально ровная. Содержимое слоя прозрачно (рис. 2). Мы обозначили оптически однородный слой как гомогенный (по его первоначальному виду).
На препарате сагиттального крио-статного среза роговицы, окрашенного красителем-фиксатором эозином-метиле-новым синим по Май-Грюнвальду, визуализировано три слоя клеток и гомогенный компонент на их поверхности. Первый -базальный слой, состоит из одного ряда клеток, прилежащих основанием к базальной мембране. Второй слой формируют три ряда клеток овальной формы с крупными ядрами и неровными границами. Третий слой формируют четыре ряда плоских по форме клеток с палочковидными ядрами, ориентированными параллельно фронтальной поверхности эпителия. Следующий компонент в виде однородного слоя имеет четкие внешнюю и внутреннюю границы. Внутренняя граница гомогенного слоя определяется как тонкая полоска ткани, окрашенная в насыщенный синий цвет. На фоне гомогенного слоя с неопределенной регулярностью расположены неравномерно окрашенные объекты овальной формы, что указывает на относительную неоднородность внутри слоя. Таким образом, на препарате криофиксированного материала можно различить пять слоев: ранее известные три слоя клеток, тонкую полоску ткани, которая интенсивно окрашивается в синий цвет и гомогенный слой над ней (рис. 3).
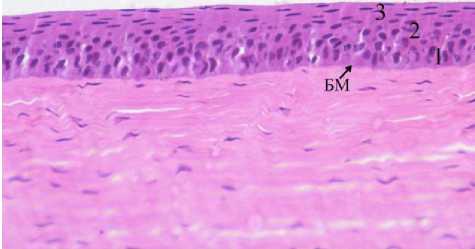
Рис. 1. Микрофото препарата переднего эпителия роговицы глаза домашней свиньи. Обозначения: БМ - базальная мембрана, 1 - базальный слой, 2 - средний слой полигональных (крыловидных) клеток, 3 - поверхностный слой плоских неороговевающих клеток. Фиксация формалином. Окр. гематоксилином и эозином. Ув.: х400

Рис. 2. Микрофото препарата сагиттального среза роговицы глаза домашней свиньи. Обозначения: A - увеличенный фрагмент микроскопического изображения, БМ - базальная мембрана переднего эпителия, ПЭ - клетки переднего эпителия, стрелка указывает на оптически прозрачный гомогенный слой. Криофиксация. Нативный препарат. Ув.: х100
После воздействия на срез ткани 4% раствором NaHCOg, микроскопическая картина переднего эпителия роговицы изменяется. Толщина переднего эпителия увеличивается, исчезает внутренняя граница гомогенного слоя, он трансформируется в ряды плоских клеток, в структуре переднего эпителия появляются ряды клеток с зернистостью в цитоплазме. Поверхность эпителия остается идеально ровной (рис.4). При микроскопии препарата на большем увеличении (х1000) определяется выраженный вертикальный полиморфизм клеток, отличающихся по форме, состоянию ядра и цитоплазмы, типу межклеточных контактов. Клетки базального ряда имеют столбчатую форму, их ядра ориентированы перпендикулярно базальной мембране и немного смещены в апикальную часть клеток. Над базальными клетками видны четыре ряда клеток овальной формы с равномерно окрашенным ядром и цитоплазмой, мембраны клеток окрашиваются неравномерно. Над ними определяются три ряда клеток в форме горизонтально ориентированных овалов с пикнотическим ядром и выраженной базофильной зернистостью в цитоплазме. Мембраны клеток прокрашиваются более интенсивно, между клетками видны щелевидные пространства. Непосредственно над слоем клеток с базофильной зернистостью определяется один ряд безъядерных клеток с неокрашенной цитоплазмой. Поверхностные ряды переднего эпителия состоят из уплощенных клеток с плотной плазмолеммой, в большинстве своем безъядерных. Клетки плотно прилежат друг к другу, мембраны соседних клеток сливаются, их общее число рядов на криофик-сированных препаратах составляет 19, что на 9(!) рядов больше, чем на препаратах химически фиксированного материала.
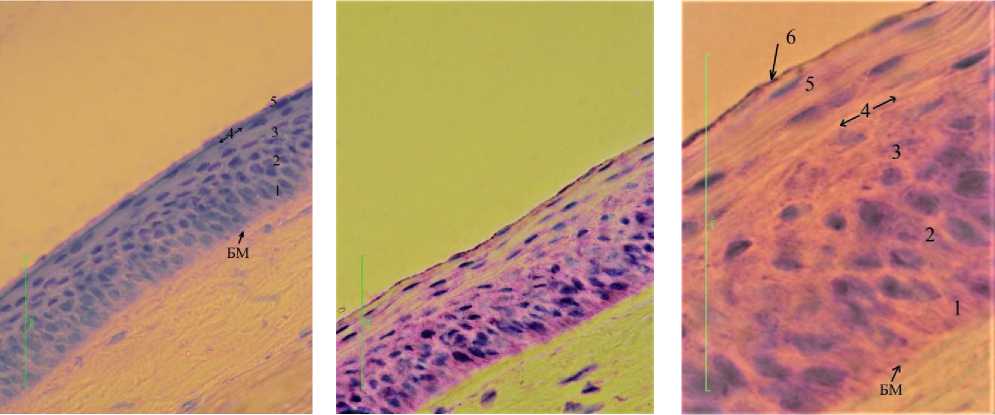
Рис. 3. Микрофото переднего эпителия роговицы домашней свиньи. о бозначения : БМ – базальная мембрана, 1 – базальный слой, 2 – средний слой полигональных клеток, 3 – слой плоских клеток, 4 – полоска ткани, интенсивно окрашенная в синий цвет, 5 – гомогенный слой. Криофиксация. Окр. эозином-метиленовым синим по Май-Грюнвальду. Ув.: х400
Рис. 4. Микрофото переднего эпителия роговицы домашней свиньи. Расслоение клеточных слоев роговицы 4% раствором натрия гидрокарбоната (NaHCO 3 ). Криофиксация. Окр. эозином-метиленовым синим по Май-Грюнвальду. Ув.: х400
Рис. 5. Микрофото переднего эпителия роговицы домашней свиньи (то же, что и на рис. 4). о бозначения : бм – базальная мембрана, 1 - ряд базальных клеток, 2 – шиповатые клетки, 3 – зернистые клетки, 4 – ряд неокраши-вающихся клеток, 5 - плоские безъядерные клетки, 6 – неклеточный компонент. Криофиксация. Окр. эозином-метиленовым синим по Май-Грюнвальду. Ув.: х1000
Над клетками пятого слоя определяется очень тонкий неклеточный компонент, неравномерно поглощающий метиленовый синий (рис. 5).
На препарате сагиттального среза роговицы, окрашенного гематоксилином и эозином, также видны пять слоев. Первый – слой базальных клеток, второй -слой полигональных клеток, третий - слой плоских клеток, четвертый слой – интенсивно окрашенная тонкая полоска ткани, пятый – гомогенный слой. Поверхность переднего эпителия идеально ровная (рис. 6). Нанесение 0,04N раствора NaOH касательно к поверхности гомогенного слоя вызывает набухание содержимого поверхностных клеток, изменение контура поверхности, появление выпуклой деформации. В поверхностном слое переднего эпителия визуализируются плотно прилежащие друг к другу безъядерные клетки, заполненные однородной оксифильной массой с мелкими гранулами базофильного вещества в центре (рис. 7). Однородная оксифильная масса, заполняющая клетки пятого слоя, изменяет свой объем под дей- ствием 0,04N раствора NaOH, что косвенно указывает на присутствие кератина. На препарате c расслоением под рядами безъядерных клеток определяются клетки округлой формы с признаками пикноза, неплотными контактами по типу десмо-сом. Обобщая полученные результаты можно сделать вывод о том, что передний эпителий роговицы Sus scrofa domesticus состоит из пяти клеточных слоев. Общее количество клеточных рядов на препаратах криофиксированного материала почти вдвое превышает количество рядов на препаратах химически фиксированного материала. Ряды клеток в слоях переднего эпителия находятся в уплотненном (сжатом) состоянии. Степень уплотнения постепенно увеличивается по направлению от базальной мембраны к фронтальной поверхности эпителия, достигая максимума на уровне гомогенного слоя. Клетки в слоях отличаются по форме, состоянию ядра и типу межклеточных контактов. Клетки пятого слоя безъядерные, заполнены оксифильной массой, предположительно кератином. На поверхности перед-
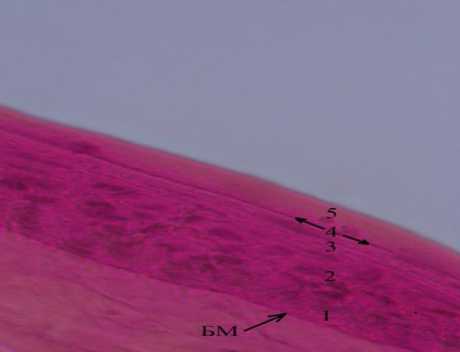
Рис. 6. Микрофото переднего эпителия роговицы домашней свиньи. Обозначения: БМ – базальная мембрана, 1 – базальный слой, 2 – средний слой полигональных клеток, 3 – слой плоских клеток, 4 – тонкая полоска ткани, 5 – гомогенный слой. Криофиксация. Окр. гематоксилином и эозином. Ув.: х400
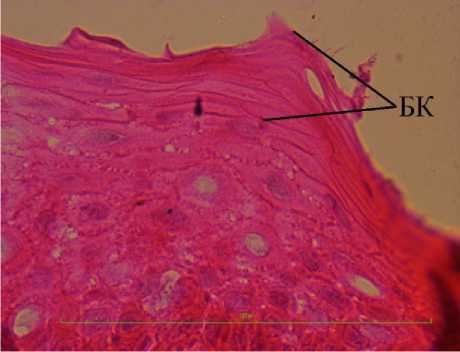
Рис. 7. Микрофото переднего эпителия роговицы домашней свиньи при обработке поверхности роговицы раствором 0,04N NaOH. Обозначения: БК - ряды безъядерных клеток Криофиксация. Окр. гематоксилином и эозином. Ув.: х1000
него эпителия определяется мембраноподобный неклеточный компонент, интенсивно поглощающий метиленовый синий.
Заключение. Таким образом, согласно существующим представлениям, передний эпителий роговицы человека и животных состоит из трех слоев клеток. Однако эти представления основаны исключительно на данных микроскопии препаратов химически фиксированного материала. На препаратах криофиксиро-ванного материала определяется четвертый, гомогенный слой, который принято идентифицировать с прекорнеальной слезной пленкой – метастабильным слоем жидкости, циклично формирующимся на поверхности роговицы каждые 7-10 секунд. Мы исследовали передний эпителий роговицы кадаверных глаз Sus scrofa domesticus, фиксированных в криостате, как минимум, через 2,5 часа после энуклеации. Эти условия исключают присутствие прекорнеальной слезной пленки. Установлено, что передний эпителий роговицы состоит из пяти слоев. Ряды клеток в слоях находятся в уплотненном (сжатом) состоянии, степень уплотнения постепенно увеличивается по направлению от базальной мембраны к фронтальной поверхности эпителия, достигая максимума на уровне гомогенного слоя. Для визуали- зации клеточных рядов гомогенного слоя необходимо было создать условия для набухания клеток. Мы использовали раствор NaHCO3 в физиологической концентрации 4%. Клетки поверхностных рядов увеличивались в объеме, контур поверхности эпителия не изменялся. Над клетками пятого слоя определяется очень тонкий неклеточный компонент, неравномерно поглощающий метиленовый синий. Для проверки предположения о наличия кератина в поверхностных клетках переднего эпителия применяли 0,04N раствор NaOH. Содержимое клеток поверхностных рядов увеличивалось в объеме, контур поверхности эпителия изменялся, появлялись выпуклые деформации и неровности поверхности эпителия. Увеличение объема клеток гомогенного слоя позволило визуализировать их содержимое, эти клетки безъядерные, заполнены оксифильной массой, предположительно кератином. Результаты исследований подтвердили предположение о том, что гистологическая картина на препаратах химически фиксированного материала является неполной и показывают, что идентификация гомогенного слоя над третьим слоем клеток переднего эпителия с пре-корнеальной слезной пленкой, то есть со слоем жидкости, безосновательна.
Список литературы Структура переднего эпителия роговицы Sus scrofa domesticus при криофиксации
- Metz А. The Anatomy and Histology of the Human Eye. Philadelphia, 1868. URL: https://archive.org/details/anatomyhistology00metzuoft
- Ehlers N. Morphology and histochemistry of the corneal epithelium of mammals. Cells Tissues Organs. 1970;75(2):161-198. DOI.lO.l 159/000143448
- Bülow N, Ehlers N. Morphology and dopa reaction of cultivated corneal epithelial cells. Acta Ophthalmologica. 2009;46(4):749-56. D0I:10.1111/j.1755-3768.1968. tb02873.x
- McTigue JW. The human cornea: a light and electron microscopic study of the normal cornea and its alterations in various dystrophies. Trans Am Ophthalmol Soc. 1967;65:591-660. URL: https://pubmed.ncbi.nlm.nih.gov/4170533
- DelMonte DW, Kim T. Anatomy and physiology of the cornea. J Cataract Refract Surg. 2011;37(3):588-598. D0I:10.1016/j.jcrs.2010.12.037
- Mannis MJ, Holland EJ, et al. Cornea: Fundamentals, Diagnosis and Management, 4th ed. New York: Elsevier, 2017.- 2016pp
- Pfister RR. The normal surface of corneal epithelium: a scanning electron microscopic study. Invest Ophthalmol. 1973;12:654-668. URL: https://pubmed.ncbi.nlm.nih.gov/4582462/
- Pearton DJ, Ferraris C, Dhouailly D. Transdifferentiation of corneal epithelium: Evidence for a linkage between the segregation of epidermal stem cells and the induction of hair follicles during embryogenesis. Intern J of Dev Biol. 2004;48(2-3):197-201. DOI: 10.1387/ijdb. 1527238510.1387/ijdb. 15272385
- Kao WW. Keratin expression by corneal and limbal stem cells during development. Exp Eye Res. 2020;200:108206. DOI:10.1016/j.exer.2020.108206
- Chen HB, Yamabayashi S, Ou B, et al. Ultrastructural studies on the corneal superficial epithelium of rats by in vivo cryofixation with freeze substitution. Ophthalmic Res. 1995;27:286-295. DOI:10.1159/000267738.
- Chen HB, Ou B, Yamabayashi S, et al. Ultrastructural study on rat precorneal tear film by the quick freezing freeze-substitution method. J Jpn Ophthalmol Soc. 1996;100:453-457. URL: https://pubmed.ncbi.nlm.nih.gov/8712077/
- Mishima S. Some Physiological Aspects of the Precorneal Tear Film. Arch of Ophthalmol. 1965;73(2):233-241. DOI:10.1001/archopht.1965.00970030235017
- Lemp M. The Precorneal Tear Film. Archives of Ophthalmology. 1970;83(1):89. DOI:10.1001/archopht.1970.00990030091017
- Lemp MA. Perspective Advances in Understanding and Managing Dry Eye Disease. Am J of Ophthalmol. 2008;146(3):350-356. DOI:10.1016/j.ajo.2008.05.016
- Lee WB, Holland EJ, Mannis MJ. Ocular Surface Disease: Cornea, Conjunctiva and Tear Film. New-York: Elsevier Health Sciences. 2013. 472 pp. DOI:10.1016/B978-1-4557-2876-3.00001-8
- Chen HB, Yamabayashi S, Ou B, et al. Structure and composition of rat precorneal tear film. A study by an in vivo cryofixation. Invest. Ophthal. Vis. Scien.1997;38:381-387. URL: https://pubmed.ncbi.nlm.nih.gov/9040471/
- Camber O, Rehbinder C, Nikkila T, et al. Morphology of the pig cornea in normal conditions and after incubation in a perfusion apparatus. Acta Vet Scand. 1987;28(2):127-134. DOI: 10.1186/BF03548232
- Barros RC, Van Kooten TG, Veeregowda DH. Investigation of Friction-induced Damage to the Pig Cornea. The Ocular Surface, 2015;13(4):315-320. DOI:10.1016/j.jtos.2015.05.004
- Abhari S, Eisenback M, Kaplan HJ, et al. Anatomic Studies of the Miniature Swine Cornea. Anat Rec (Hoboken). 2018 Nov;301(11): 1955-1967. DOI: 10.1002/ar.23890
- Hammond GM, Young RD, Muir DD, et al. The microanatomy of Bowman's layer in the cornea of the pig: Changes in collagen fibril architecture at the corneoscleral limbus. Eur J of Anat. 2020;24(5):399-406. URL: http://www.eurjanat.com/web/paper.php?id=200195gh
- Oh JY, Kim MK, Lee HJ, et al. Processing porcine cornea for biomedical applications. Tissue Eng Part C Methods. 2009 Dec;15(4):635-645. DOI: 10.1089/ten
- Yoeruek E, Bayyoud T, Maurus C, et al. Decellularization of porcine corneas and repopulation with human corneal cells for tissue-engineered xenografts. Acta Ophthalmol. 2012 Mar;90(2):e125-131. DOI:10.1111/j.1755-3768.2011.02261.x
- Christophers E, Kligman AM. Visualization of the cell layers of the stratum corneum. J Invest Dermatol. 1964;42:407-409


