Структурирование химических элементов по объемной матрице
Автор: Борис Владимирович Гусев, Самуэл Иен-Лян Ин, Анатолий Алексеевич Сперанский
Журнал: Нанотехнологии в строительстве: научный интернет-журнал @nanobuild
Статья в выпуске: 5 т.13, 2021 года.
Бесплатный доступ
В статье отмечается, что благодаря открытию Д.И. Менделеева и существующей уже более 150 лет Периодической таблице химических элементов, а также международной таблице IUPAC активно развивалась и развивается химия. Предложено новое видение структурирования химических элементов в виде объемной матрицы. Это позволяет прогнозировать новые элементы с обозначением ядерных масс и электронным строением оболочек. Сформулированы новые закономерности по цикличности и блочности строения горизонтальных рядов, уточнено строение вертикальных групп и их физическое осмысливание
Цикличность и блочность, объемная матрица химических элементов, ядерные массы, протонно-нейтронное строение ядер, электронные уровни, электронные характеристики уровней и подуровней (орбиталей), прогноз новых элементов.
Короткий адрес: https://sciup.org/142228329
IDR: 142228329 | УДК: 54.01 | DOI: 10.15828/2075-8545-2021-13-5-282-292
Текст научной статьи Структурирование химических элементов по объемной матрице
П ериодический закон и его представление в виде таблиц химических элементов Д.И. Менделеева и международной IUPAC – это выдающееся открытие человечества. В конце 2019 года все мировое научное сообщество под эгидой ООН отмечало 150-летний юбилей этого события. В настоящее время в таблицах представлены 118 элементов, однако в натуральном виде встречаются далеко не все, так как некоторые получены искусственным путем. Авторами написана новая работа по Объемной матрице химических элементов [3].
Рассмотрены представления о Вселенной, и для описания возникновения химических элементов принята физическая модель взрыва и расширяющейся Вселенной, поставлена задача описать их в виде Объемной расширяющейся матрицы химических элементов. В вершине матрицы представлены водород (Н) и гелий (Не) как основа создания всех последующих элементов, и далее по расширяющейся спирали рас- положены другие элементы, а групповые принципы валентностей являются гранями такого построения.
Другим важнейшим моментом является общее представление о возникновении и развитии Вселенной, всего неживого и живого в ней по спирали [10, 11]. Если для живой природы это очевидно, то для неживой природы сделано предположение, что кирпичиками этой спирали могут быть химические элементы, которые будут в дальнейшем при взаимодействии между собой образовывать молекулы. Из молекул формируется весь материальный неорганический мир. А далее уже происходят природные процессы, создание живой материи: растений, животных и людей. Таким образом, все развитие минерального и живого мира протекает по спиралям.
В представленных обобщениях показано, что при структурировании системы химических элементов , помимо периодичности образования валентных групп внешних орбиталей, предпочтительными являются представления о цикличности и блочном структурировании элементов по горизонтали .
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ
ОСНОВНАЯ ЧАСТЬ
1. Цикличность и блочность в структуре химических элементов
В основу современной периодической системы положен заряд ядра (Z), определяющий место элемента в системе [1, 13, 14]. Ядерная периодичность выражается в периодическом изменении свойств ядер атомов. Основным параметром, определяющим эту периодичность, является число протонов (Р) и нейтронов (N) в ядре. На рис. 1 представлена зависимость массы ядер элементов (протоны и нейтроны) и массы нейтронов для открытых 118 химических элементов.
Авторами подсчитаны соотношения количества нейтронов и протонов в ядрах химических элементов. В короткопериодной таблице 1a представлены усредненные показатели этих соотношений для блоков. Следует обратить внимание, что эти усредненные величины для блоков равны как в короткопе-риодной таблице, так и в таблице IUPAC (табл. 1b). Поэтому блочная структура, по нашему мнению, соответствует понятию цикличности – завершенности системы периодичности двух периодов, включая семейства лантаноидов и актиноидов.
Изучение Объемной периодичной матрицы химических элементов на основе многопараметрической системы координат наглядно демонстрирует устойчивое формирование блочных закономерностей в циклической периодичности свойств химических элементов в периодах и блоках с увеличением их порядковых номеров и объединяет все описанные ранее варианты периодичности [4, 7]. Следует отметить, что понятия «период» двух видов таблиц идентичны (их по 7), но важным обстоятельством, требующим особого внимания, является явное несоответствие «рядов» групповому валентному принципу периодичности в длиннопериодной таблице.
В работах [3, 4] сделан вывод, что 3D-спирально расходящаяся система матрицы химических элементов имеет 4 блока периодичности и 7 периодов. Анализ структуры периодообразования подтверждает, что периоды можно разделить на простые, в которых образуются по одному элементу в каждой группе (2 элемента с внешней сигнальной орбиталью и 6 элементов с внешней валентной орбиталью, всего 8 в периоде), и более сложные, содержащие сгруппириованные «семейства» элементов внутри одной группы ( III или VIII ). Таким образом, по блокам все можно представить следующим образом (табл. 1):
– Первому блоку А соответствуют короткие одноэлементные периоды (и ряды 0–1 ) матрицы, где представлены первые элементы водород и гелий ( Н 1 -водород и Не 2 - гелий). Для первого блока соотношение нейтронов (N) к протонам (P) можно принять равным 1.
– Второй блок В структурно позиционирует завершенность циклической восьмиэлементной пери-
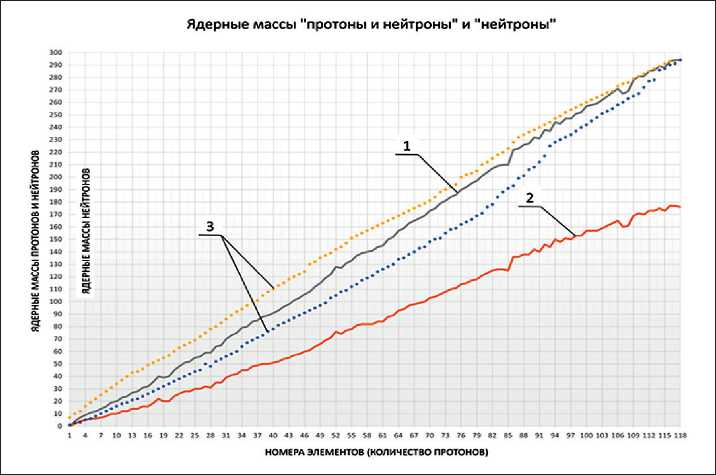
Рис. 1. Зависимости ядерных масс (протоны и нейтроны) и массы нейтронов (нейтроны) для 118 химических элементов: 1 – количество протонов и нейтронов; 2 – количество нейтронов; 3 – изотопы
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ
Таблица 1
Соотношение нейтронов и протонов в ядрах атомов химических элементов
-
а) Таблица Д.И. Менделеева
Соотношение нейтроны (n) / протоны (р)
Блоки, периоды / ряды
1
II
III
IV
V
VI
VII
VIII
А 1
н 1
1,008 1
2 2
He 4 1,0
менее
1,1
В
2
3 4
Li 7 1,33
4 5
Be 9 1,25
5 6
В
11 1.20
6 6
c 12 1,0
7 7
N 14 1,0
8 8
О 16 1.0
9 10
F 19 1,11
10 10
Ne 20 1.0
В
3
II 12
Na 23 1.09
12 12
Mg 24 1.0
13 14
Al 27 1.08
14 14
Si
28 1.0
15 16
P 31 1,07
16 16
s 32 1,0
17 18
Cl 35 1,09
18 22
Ar
40 М2
менее м
с 4/4-5
19 20
К 39 1,05
20 20
Ca
40 1,0
21 24
Sc 45 1,14
22 26
Ti 48 1,18
23 28
V 51 1,22
24 28
Cr 52 1,17
25 30
Mn
55 1,20
26 30
Fe 56 1,15
27 32
Co
59 1,19
28 31
Ni 59 1,11
29 35
Си
63 Ml
30 35
Zn 65 147
31 39
Ga 70 1,26
32 41
Ge 73 1.28
33 42
As 75 1,27
34 45
Se
79 М2
35 45
Br
80 1.29
36 48
Kr
84 М3
С 5/6-7
37 49
Rb 85 М2
38 50
Sr
88 1,32
39 50
Y 89 1,28
40 51
Zr 91 1,28
41 52
Nb
93 1,27
42 54
Mo 96 1,29
43 55
Tc
96 1,28
44 57
Ru
101 MO
45 58
Rh 103 1.29
46 60
Pd 106 1,30
47 61
Ag 108 МО
48 64
Cd
112 М3
49 66
In 115 MS
50 69
Sn 119 M8
51 71
Sb
122 M9
52 76
Те 128 1,46
53 74
1 127 1,40
54 77
Xe 131 1.43
менее 1,55
D 6/8-9
55 78
Cs 133 1.42
St KI
Ba 137 1.45
57 82
La 139 1,44
72 106
Hf
179 1.49
73 108
Ta 181 1.48
74 110
w 184 1,49
75 111
Re 186 1,48
76 114
Os 190 1.50
77 115
Ir 192 1.49
78 117
Pt 195 1.50
79 118
Au 197 1,49
80 121
Hg 201 1,50
81 123
TI 204 1,52
82 125
Pb
207 М2
83 126
Bi 209 1,52
84 126
Po 210 1,50
85 125
At 210 1,47
86 136
Rn 222 158
D 7/9-11
87 136
Fr
223 1,56
88 138
Ra
226 1,57
89 138
Ac
227 1.55
104 161
Rf 265 1,55
105 163
Db 268 1,55
106 165
Sg 271 1,56
107 160
Bh
267 1,50
108 161
Xs 269 1,49
109 169
Mt 278 1,55
IIO 171
Ds 281 1.55
III 170
Rk
281 М3
112 173
Cn
285 1.54
113 173
Nh
286 1,53
114 175
Fl 289 1.54
115 173
Me
288 1.50
116 177
Lv
293 М3
117 177
Ts 294 1.51
118 176
og
294 1.49
58 82
Ce 140 1,41
59 82
Pr 141 1,39
60 84
Nd 144 1,40
61 84
Pm 145 MS
62 88
Sm 150 1,42
63 89
Eu 152 1.41
64 93
Gd 157 1,45
65 94
Tb 159 1,45
66 97
Dy 163 1,47
67 98
Ho
165 1.46
68 99
Er 167 1,46
69 100
Tm
169 1.45
70 103
Yb 173 1,47
71 104
Lu
175 1,46
90 142
Th
I 232 1.58
91 140
Pa
231 1.53
92 146
и 238 1.59
93 144
Np
237 1,55
94 ISO
Pu 244 1.60
95 148
Am
243 1.56
96 151
Cm
247 1.57
97 150
Bk
247 1.55
98 153
Cf
251 1.56
99 153
Es
252 1,55
100 157
Fm
257 1.57
101 157
Md
258 1.55
102 157
No
259 1,54
103 159
Lr
262 1.54
-
b) Таблица IUPAC
ноше
n/p
период
1
11
HI
IV
V
VI
VII
VIII
IX
X
XI
XII
XIII
XIV
XV
XVI
XVII
XVIII
О
A
1
И 1
1,008 1
2 2
He 4 1.0
7
В
2
3 4
Li
7 1,33
4 5
Be
9 1,25
5 6
В
II MO
6 6
C 12 1,0
7 7
N 14 1,0
8 8
0
16 1,0
9 10
F 19 1,11
10 10
Ne
20 1,0
В
3
11 12
Na
23 1,09
12 12
Mg
24 1,0
13 14
Al
27 1,08
14 14
Si
28 1.0
15 16
P
31 1,07
16 16
S 32 1.0
17 18
Cl 35 1,09
18 22
Ar
40 1,22
tn w
s
с 4
19 20
К
39 1.05
20 20
Ca
40 1.0
21 24
Sc 45 1.14
22 26
Ti
48 1.18
23 28
V
51 1.22
24 28
Cr 52 1.17
25 30
Mn
55 1.20
Z6 30
Fe se t,is
27 32
Co
59 1.19
28 31
Ni 59 1,11
29 35
Cu
64 Ml
30 35
Zn
65 1,17
31 39
Ga
70 1.26
32 41
Ge
73 1.28
33 42
As
75 1.27
34 45
Se
79 132
35 45
Br
80 M9
36 48
Kr
84 133
С
5
37 49
Rb 85 132
38 50
Sr
88 132
39 50
Y
89 1,28
40 51
Zr
91 1,28
41 52
Nb 93 1,27
42 54
Mo
96 1.29
43 55
Tc
98 М3
44 57
Ru 101 130
45 58
Rh
103 1.29
46 60
Pd
106 MO
47 61
Ag
108 MO
48 64
Cd
112 М3
49 66
In
115 MS
50 69
Sn
119 138
51 71
Sb
122 1,39
52 76
Те
128 1,46
53 74
1
127 1,40
54 77
Xe
131 1,43
if) tn
V у =
D
6
55 78
Cs
133 1.42
56 81
Ba
137 1.45
57 82
La
139 1,44
72 106
Hf
179 1,49
73 108
Ta
181 1,48
74 110 w
184 1,49
75 HI
Re 186 1,48
76 114
Os
190 1,50
77 115
Ir
192 1,49
78 117
Pt
195 130
79 118
Au 197 1,49
80 121
Hg
201 1,50
81 123
TI
204 1,52
82 125
Pb
207 132
83 126
Bi
209 1 32
84 126
Po
210 1.50
85 125
At
210 1,47
86 136
Rn
222 158
О
7
87 136
Fr
223 1,56
88 1381
Ra
226 1371
89 138
Ac
227 135
104 161
Rf
265 131
105 163
Db
268 1,55
106 165
Sg 271 136
107 160
Bh
267 130
108 161
Xs 269 1,49
109 169
Mt
278 1,55
110 171
Ds
281 1,55
111 170
Rg 281 133
112 173
Cn
285 134
113 173
Nh
286 133
114 175
Fl
289 1,54
115 173
Me
288 1,50
116 177
Lv
293 133
117 177
Ts
294 1,51
118 176
Og
294 1,49
одичности, которому соответствуют простые периоды (и ряды) 2 (включает 8 элементов с Li 3 по Ne 10 ) и 3 матрицы (включает 8 элементов с Na 11 по Ar 18 ). Для второго блока N:P менее 1,1.
– Третий блок С структурно представляет завершенность циклической 10-и и 8-элементной периодичности в блоке, появились два дополнительных
«семейства»: от железа ( Fe ) до платины ( Pt ) и от рутения ( Ru ) до палладия ( Pd ).
В третьем блоке С представлены первая короткая пара рядов 4 (включает 10 элементов с K 19 по Ni 28 ) и 5 короткопериодной таблицы (включает 8 элементов с Cu 29 по Kr 36 ) и вторая короткая пара рядов 6 (включает 10 элементов с Rb 37 по Pd 46 ) и 7 коротко-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ периодной таблицы (включает 8 элементов с Ag47 по Xe54). В длиннопериодной таблице паре рядов 4 и 5 соответствует период 4, а паре рядов 6 и 7 соответствует период 5. Для третьего блока соотношение N:P менее 1:1,3.
– Четвертый блок D структурно представляет завершенность циклической 24-х и 8-элементной периодичности в качестве блока химических элементов D , в который дополнительно вошли «семейства» лантаноидов ( La ) и актиноидов ( Ac ), а также два «cемейства»: осмий ( Os ), иридий ( Ir ), платина ( Pt ) и хассий ( Hs ), мейтнерий ( Mt ), дармштадтий ( Ds ).
Четвертому блоку соответствует первая пара длинного ряда лантаноидов 8 (включает 24 элемента с Cs 55 по Pt 78 ), и короткого ряда 9 короткопериод-ной таблицы (включает 8 элементов с Au 79 по Rn 86 ), и вторая пара длинного ряда актиноидов 10 (включает 24 элемента с Fr 87 по Ds 110 ), и короткого ряда 11 короткопериодной таблицы (включает 8 элементов с Rg 111 по Og 118 ). В длиннопериодной таблице паре рядов 8 и 9 соответствует период 6 , а паре рядов 10 и 11 соответствует период 7 . «Семейства» лантаноидов, актиноидов и некоторых сгруппированных металлов требуют особого изучения и внимания исследователей. Для блока D соотношение N:P менее 1,55.
Таким образом, блочная структура Объемной матрицы химических элементов с использованием трехмерной системы координат может обеспечить существенное повышение информативности (многомерности) по сравнению с короткопериодной и длин-нопериодной таблицами химических элементов.
2. Объемная периодическая матрица химических элементов
В различных литературных источниках отмечается вклад в развитие периодической системы химических элементов Д.И. Менделеева , Ю.Л. Мейера , А. Шанкуртуа , Дж. Ньюлендса , В. Одлинга [6].
Можно выделить основные предпосылки для создания Объемной периодической матрицы химических элементов:
– исходя из закономерностей развития Вселенной авторы предлагают рассматривать структуру расположения химических элементов в виде расширяющейся конической спирали. В начале спирали располагаются основные первоначальные элементы – водород и гелий;
– пространственная спираль обеспечивает, по сравнению с табличной формой, последовательное непрерывное расположение элементов с возможностью включения лантаноидов, актиноидов и всех обнаруженных (открытых) и прогнозируемых семейств. На спирали должны найти свое отображение все известные структуры на основании глубокого изучения короткопериодной и длиннопериодной таблиц, принятых за основу в разных странах.
Таким образом, в основе Объемной матрицы представлены:
– Распределение всех известных элементов по осям координат, что формирует планетарную модель их строения. Атомные номера n с размерностью непрерывного ряда натуральных чисел от 1 до 118 (и более) равномерно распределены по спирали сверху вниз.
– Порядковый номер элемента совпадает с величиной заряда ядра (Z) и таким же суммарным количеством энергетически уравновешивающих электронов на орбиталях оболочек. Подход универсален как для короткопериодной, так и для длиннопериодной таблицы.
– Показано прогрессивное увеличение количества элементов в периодах с первого по одиннадцатый (и далее), что образует 3D-спиральную пространственную систему каркаса матрицы химических элементов (рис. 2) [4].
Предлагаемое представление Объемной периодической матрицы химических элементов в виде расширяющейся конической спирали является универсальным инструментом, который позволяет изучать большое многообразие физико-химических свойств уже известных и еще не открытых элементов и их соединений [5]. Универсальность объемной матрицы еще и в том, что помимо обязательного порядкового номера и строгой координатной привязки химических элементов к группам появляются широкие возможности структурного анализа физико-химических свойств элементов и закономерностей их взаимодействия.
-
3. Электронные характеристики элементов и анализ их цикличности в структуре Объемной матрицы химических элементов
Пространственная форма Объемной периодической матрицы позволила структурировать аномальные семейства III-й (лантаноиды и актиноиды) и VIII-й (металлоиды) групп третьего C и четвертого D уровней блочной периодичности, а уровневые формулы электронных оболочек облегчают изучение системных закономерностей периодичности, включая механизмы насыщения и перехода электронов по разным энергетическим уровням (орбитали) электронных оболочек [2, 3]. Системность периодичности актуальна при изучении тонких механизмов межуровневых переходов и устойчивых сбоев процесса синтеза электронных орбиталей (табл. 2).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ
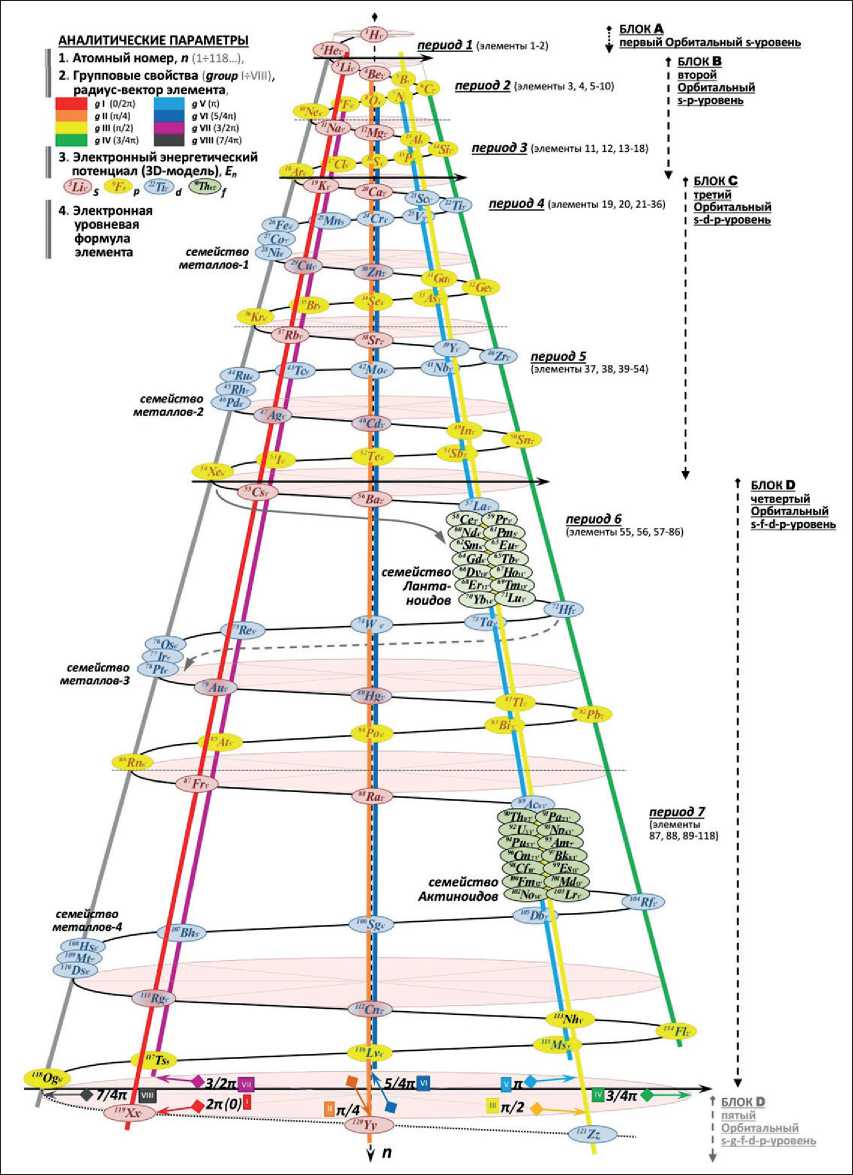
Рис. 2. Объемная матрица химических элементов с аналитическими параметрами
Распределение электронов по энергетическим уровням (состояниям) оболочек K, L, M, N, O, P, Q, Х (ЭУ), состоящих из подуровней (орбиталей) s-, p-, d-, f-, g-, h- на каждом уровне, удовлетворяет принципу минимума потенциальной энергии. Максимальное число электронов на энергетическом уровне вычисляется по формуле R = 2n2, где n – номер уровня или главное квантовое число (1, 2, 3 и т.д.). Каждому заполненному уровню соответствует определенный набор подуровней (орбиталей) (табл. 3).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ
Таблица 2
Структура энергетических уровней и подуровней (орбиталей) для блоков
Блок А – 1 энергетический уровень ( валентная орбиталь Кs ≡ 1 s2 ) заканчивается Гелием He
Блок В – 3 энергетических уровня
КsLs-pMs-p- ( валентная орбиталь M2-6- ≡ 3 s2 3 p6 ) заканчивается Аргоном Ar
Блок C – 5 энергетических уровней
КsLs-pMs-p-dNs-p-d-Os-p- ( валентная орбиталь O2-6- ≡ 5 s2 5 p6 ) заканчивается Ксеноном Xe
Блок D – 7 энергетических уровней
К s L s-p M s-p-d N s-p-d-f O s-p-d-f- P s-p-d- Q s-p- ( валентная орбиталь Q2-6- ≡ 7 s2 7 p6 ) заканчивается Оганесоном Og
Прогнозируемые энергетические уровни и электронное строение орбиталей (подуровней) Блока Е
Блок E – прогнозируется 9 энергетических уровней с элемента №119 по элемент №218
К s L s-p M s-p-d N s-p-d-f O s-p-d-f-g P s-p-d-f-g- Q s-p-d-f- R s-p-d- X s-p- ( валентная орбиталь Х2-6- ≡ 9 s2 9 p6 ) заканчивается элементом № 218
Таблица 3
Энергетические уровни, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях
(сигнализирует) завершение заполнения валентной оболочки предшествующего периода. II- ю группу химических элементов с двумя электронами на s2 -подуровне составляют Ве 4 – Ra 88 и т.д. Заполнение
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ s2-подуровня двумя электронами показывает его насыщение и предстоящее образование подуровня р-валентной оболочки, начиная с первого электрона р1-подуровня и последующего за ним набора подуровней валентного периода. Для наглядности и удобства анализа использованы электронные формулы химических элементов.
Таким образом, объединение элементов в новые периоды начинается с системно связанной пары химических элементов I и II групп, показывающих завершение заполнения валентных электронных оболочек атомов элементов предшествующего периода и готовности к образованию валентной электронной оболочки нового периода. При этом в химических элементах I группы происходит акт образования новой двухэлектронной начальной орбитали подуровня ns соответствующего энергетического уровня (из К, L, М, N, Р , О, Q, X ) путем заполнения образовавшейся энергетической оболочки первым электроном ( п s 1 ,электронное формульное обозначение К , L1, М1 и т.д.), а в последующем химическом элементе группы II происходит заполнение этой же атомной орбитали вторым насыщающим электроном ( ns 2 , электронное формульное обозначение К2, L2, М2 и т.д.), образующим устойчивую пару электронов внешней атомной орбитали. Эта начальная пара завершает заполнение подуровня 1s2 , после чего происходит заполнение следующих слоев соответствующего энергетического уровня периодической последовательности химических элементов Объемной матрицы.
С другой стороны, заполнение устойчивой парой электронов внешней атомной орбитали всегда предшествует началу процесса образования нового слоя валентной оболочки атома. Начальные элементы всех периодов матрицы образуют новые периоды, на новой валентной орбитали ( пр1 ) путем заполнения первым электроном соответствующего энергетического уровня и отражают периодические закономерности образования элементов материального мира. Механизм блочной периодичности заполнения атомных орбиталей присутствует на всех уровнях Объемной периодической матрицы химических элементов.
С точки зрения понимания закономерностей периодичности образования химических элементов просматривается особая роль начальных атомных орбиталей двух последовательных элементов. Первый элемент пары констатирует факт завершения образования устойчивого состояния структуры электронных слоев предшествующего, полностью завершенного периода с предельным заполнением электронами оболочек всех энергетических уровней. Все первые элементы – нечетные. Опыт подтверждает, что электронные слои оболочек элементов полностью завершенного периода обладают высокой степенью устойчивости к внешним энергетическим влия- ниям и явным тяготением к стационарному взаимодействию с энергетическим полем ядра атома [9, 12]. Из этой закономерности вытекает индифферентность электронных слоев предельно заполненных оболочек атомов к проявлению валентности (химическому взаимодействию).
Второй элемент является предвестником начала образования новых электронных слоев элементов последующего периода, состоящего из электронов новых оболочек энергетических уровней. Все вторые элементы – четные. Электронные слои оболочек элементов формирующегося периода не обладают высокой степенью устойчивости к внешним энергетическим влияниям и обладают меньшим стремлением к взаимодействию с энергетическим полем ядра атома. Из этой закономерности вытекает способность внешних электронных слоев незаполненных оболочек атомов к проявлению поливалентности при объединении в молекулы.
Первые элементы валентных р -орбиталей нового периода в каждом энергетическом уровне образуют элементы с р1 -орбиталью с одним валентным электроном ( В 5 – Nh 113 и т.д). Все подобные элементы нечетные и относятся к III группе химических элементов. Второй элемент – с двумя валентными электронами р2 -орбитали в каждом энергетическом уровне ( С 6 – Fl 114 и т.д). Все элементы четные и относятся к IV группе химических элементов. Аналогично структурируются последующие элементы с тремя валентными электронами p3 - орбитали и иным количеством электронов валентной орбитали в каждом энергетическом уровне, относящиеся соответственно к V , VI , VII и VIII группам химических элементов.
Закономерности образования моделей электронных оболочек атомов с использованием электронно-уровневых формул позволяют на основе блочного подхода и структурного анализа прогнозировать химические элементы за пределами 118-го элемента, сформировать структуру новых периодов, начиная с еще не открытых химических элементов 11-го периода таблицы Д.И. Менделеева или 8-го периода таблицы IUPAС [15]. Электронно-орбитальные формулы предполагают на основе блочного подхода предельно сокращенное описание структуры химических элементов.
4. Прогнозирование новых химических элементов
Из известных химических элементов коротко-периодной системы только 83 встречаются на Земле, самый легкий из них – водород (его атомный номер – Z = 1), а самый тяжелый – уран (Z = 92). Очевидно, в Солнечной системе и на планете Земля сохранились лишь те элементы, время жизни которых больше возраста Земли (4,5 миллиарда лет).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ
Другие распались и не дожили до наших дней. Уран, период полураспада которого около 4,5 миллиардов лет, еще распадается. Он является радиоактивным элементом [14]. В природе стабильные образования (ядра элементов, состоящие из разного числа протонов и нейтронов) существуют только до свинца и висмута, затем следует небольшой «полуостров», включающий в себя торий и уран, обнаруженные на Земле. Но как только порядковый номер элемента превышает номер урана, время его жизни резко уменьшается. Например, ядро 100-го элемента в 20 раз менее стабильно, чем ядро урана, а в дальнейшем эта нестабильность только усиливается из-за спонтанного деления ядер. При дальнейших попытках получения новых элементов ученые всего мира сталкиваются с возрастающей трудностью синтеза [16–20]. И только малая часть ядерных исследований завершается успешным синтезом нового элемента. Ни одна лаборатория не может сравниться с нейтронной звездой, которая может создать иные формы материи. В процессе жизни звезд происходят ядерные реакции, которые человеку не подвластны.
Ученые пытаются находить новые виды элементов, но пока эксперименты по поиску «природных» сверхтяжелых элементов продолжаются [17]. Возникает вопрос, а в чем практический смысл этого дорогого мероприятия по созданию новых нестабильных элементов? Несмотря на это разработка экспериментальных методов превращения элементов привела к расширению периодической таблицы за счет трансурановых элементов, проблема границы таблицы остается одной из важнейших в современной теоретической химии.
Сформулированное авторами представление об орбитальных структурах позволяет прогнозировать блочную закономерность появления новых элементов, с образованием семейств с d -, f -, g -, h -орбиталями в обратном порядке между s - и p -орбиталями в III-й группе . Особая перспектива по прогнозу химических элементов семейств III -й группы за пределами блока D . Причина в том, что если циклические семейства лантаноидов и актиноидов III -й группы в парном блоке D состоят из 14 -ти f -элементов в каждом периоде, то семейства элементов в парном блоке Е будут со-
Таблица 4
Блочный структурный анализ для таблицы Д.И.Менделеева с блоками E и F
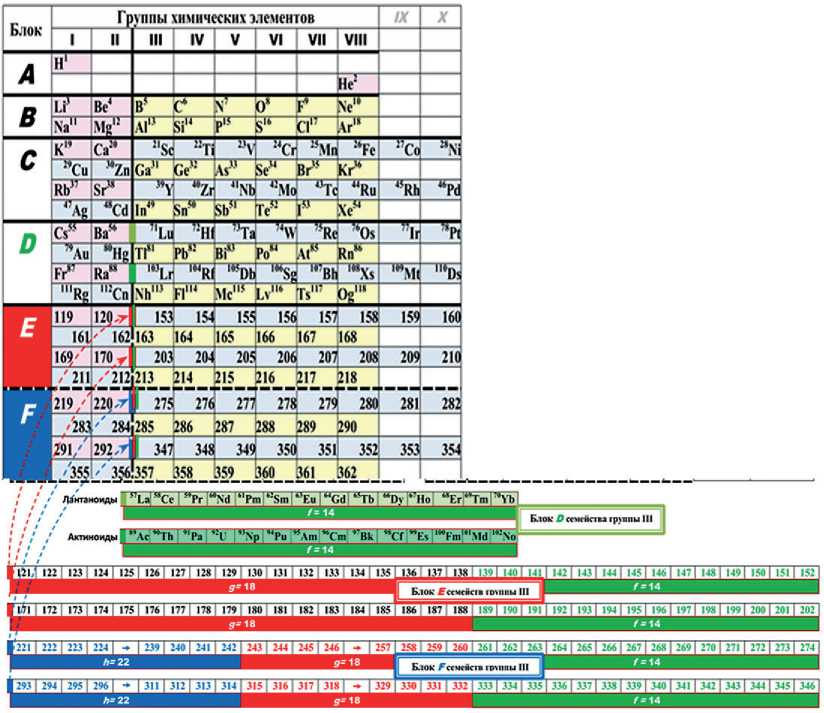
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ стоять из 32-х g-f-элементов в каждом периоде, а семейства элементов в парном блоке F будут состоять из 54-х h-g-f-элементов в каждом периоде и т.д. [15]
Пока не рассматриваются вопросы, определяющие возможность существования прогнозируемых элементов в специальных физических условиях. Но с учетом «теории островов устойчивости», поддерживаемой открывателем элемента Og118 академиком РАН Ю.Ц. Оганесяном, такое существование будущих химических элементов возможно [16, 17], и при этом снова возникает вопрос о прогнозировании новых элементов. Возможности структурного анализа позволяют выполнить прогнозирование структуры неизвестных пока элементов периодической системы в пределах 119–168 элементов 8 -го периода и в пределах 169–218 элементов 9 -го периода блочной структуры Е , а также в пределах 219–290 элементов 10 -го периода и в пределах 291-362 элементов 11 -го периода блочной структуры F и последующих блоков.
Впервые представлен предварительный структурный анализ короткопериодной таблицы на основе прогноза четырех новых периодов прогнозируемых химических элементов (табл. 4). Таким образом, представление о блочности позволило обосновать электронно-уровневые формулы, в том числе для предполагаемых новых химических элементов 5-го блока Е с номерами от 119 по 218 и далее.
В дальнейшем рассматривается применение цифровых моделей для исследования в химии, что может существенно повысить эффективность применения методов компьютерного моделирования. С учетом важнейшей роли материаловедения уместен вывод – кто раньше других освоит цифровую систему, тот может стать лидером во многих сферах жизнедеятельности человека .
ЗАКЛЮЧЕНИЕ (ОСНОВНЫЕ ВЫВОДЫ)
-
1. Периодический закон и его представление в виде таблиц химических элементов – величайшее открытие в химии . Плоские таблицы химических элементов Д.И. Менделеева и IUPAK сыграли огромную роль в развитии химии. Однако факт наличия в настоящее время более 500 вариантов по их модернизации, в том числе высказывания Н.Н. Семенова, свидетельствуют о необходимости продолжения работы в этом направлении на новом уровне осмысливания.
-
2. Прежде всего, это формирование физической модели вероятных процессов происхождения химических элементов . Убедительными обстоятельствами являются представления о Вселенной как расширяющейся системе – работы Стивена Хокинга и Мартина Риса. По нашему мнению, физическая интерпретация (модель) по происхождению и раз-
- витию Вселенной позволяет сформулировать более общее понятие о процессе структурирования химических элементов и его представлении в виде расширяющейся конической спирали и сделать ряд новых выводов.
-
3. Предлагаемая Объемная периодическая матрица представляет собой, так же как и Вселенная, расширяющуюся систему (спираль) и непрерывную последовательность в расположении элементов от водорода (1) и гелия (2) до оганесона (118) с включением в нее лантаноидов и актиноидов и возможного включения другой информации с сохранением периодичности групп элементов и валентного каркаса матрицы, предложенного Д.И. Менделеевым. Водород и гелий, очевидно, являются структурообразующими элементами, и на их основе были образованы все другие элементы.
-
4. Авторами сформулировано понятие цикличности в расположении горизонтальных уровней химических элементов в блоках Объемной матрицы химических элементов. В каждом из блоков обеспечивается примерное равенство соотношения масс нейтронов и протонов в ядрах химических элементов. Сформулирована закономерность о наличии 4-х уровней блочной цикличности структуры в существующей системе химических элементов . В блоки включены дополнительно все кластерные образования, а также семейства лантаноидов и актиноидов. Получены новые закономерности периодичности в блочной матричной структуре химических элементов от блока А до блока D , объединяющие периоды, представленные в таблицах химических элементов Д.И. Менделеева и IUPAK.
-
5. На основе цикличности представлены структуры электронных оболочек для известных 118 элементов в четырех блоках А , В , С , D , что позволяет также получить электронно-орбитальные формулы, в том числе и для новых элементов (119–218) блока Е периодической системы и последующего блока F. В блоке Е для 100 новых элементов представлены их порядковые номера и ядерные массы . Элементы 119 и 218 можно было бы назвать именем Н.Н. Семенова Sm 1 и Sm 2 .
-
6. Следует отметить, что прогрессирующее количество новых элементов находится в III группе объемной матрицы, и надо обратить особое внимание на формирование химических элементов в этой группе для блоков С , D и последующих, количество которых прогрессирующе возрастает для новых блоков Е и F . Это обстоятельство 100 лет тому назад вызвало необходимость вынесения групп лантаноидов и актиноидов за пределы таблиц Д.И. Менделеева и IUPAС.
-
7. Таким образом, Объемная матрица химических элементов является более общей структурой для дальнейшего обобщения основных особенностей хими-
- РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ УЧЕНЫХ И СПЕЦИАЛИСТОВ
-
8. Использование Объемной матрицы химических элементов позволяет применить математические методы и создать цифровые модели по взаимодействию химических элементов между собой, что даст возможность получать новые виды молекул для новых материалов.
-
10. Рис М . Всего 6 чисел: главные силы, формирующие Вселенную. / Мартин Рис, пер. с англ. / М.: Альпина ион-фикшн, 2018. 226 с.
-
11. Стивен Хокинг. О вселенной в двух словах. ОГИЗ. М.: Издательство АСТ. 223 с.
-
12. Дикерсон Р., Грей Г., Хайт Дж. Основные законы химии. М.: Мир, 1993. 258 с.
-
13. Новошинский И.И. , Новошинская Н.С. Химия. Углубленный уровень. Учебник . Русское слово. Серия: Инновационная школа, 2018. 440 с.
-
14. Кораблева Т.П., Корольков Д.В . Теория Периодической Системы. Издательство Санкт-Петербургского Университета. 2005 г. 305 с.
-
15. Гусев Б.В. Новые представления по объемной матрице химических элементов и формирование возможности существования 100 дополнительных новых элементов // Вторые Международные Косыгинские чтения «Энергоресурсо-эффективные экологические безопасные технологии и оборудование». Материалы пленарной сессии. Москва: РГУ, 2019. С. 25–29.
-
16. История синтеза сверхтяжелых элементов. Материал подготовлен на основе информации РИА. Новости открытых источников. Интернет-ресурс: https://ria.ru/20111201/503670512.html .
-
17. Максимчук А. «Остров стабильности» среди химических элементов.Специально для R& D.CNews.ru . Интернет-ресурс: https://maxpark.com/community/6285/content/2676531 .
-
18. Хартри Д. Расчеты атомных структур. М.: Изд-во Иностранной литературы, 1960. 272 с.
-
19. Zahed Allahyari, Arttem R.Oganov . Nonempirical Defibition of the Mendeleev Numbers: Organizing the Chemical Space. Journal Of Physical Chemistry C. 2020,124, 43, 23867–23878.
-
20. Audi G., Kondev F.G., Wang M., Huang W.J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. – 2017. – Vol. 41, iss. 3. – P. 030001-1–030001-138.
Таблица 5
Сравнение таблиц Д.И.Менделеева, IUPAC и ОМХЭ
Список литературы Структурирование химических элементов по объемной матрице
- Менделеев Д.И. Основы химии. М.-Л.: Государственное научно-техническое изд-во химической литературы. В 2-х томах. 13-е издание. 1947. Т. 1. 624 с.; Т. 2. 708 с.
- Семенов Н.Н. Химия и электронные явления. (УФН, 4. 1924) // Избранные труды. М.: Наука, 2005. Т.2. 357 с.
- Гусев Б.В., Ин Иен-Лян С., Сперанский А.А. Объемная матрица химических элементов. М.: РИА, 2021. 126 с.
- Гусев Б.В., Сперанский А.А. Закономерности блочного подхода для анализа структуры химических элементов и проблемы материаловедения // Нанотехнологии в строительстве. 2019. № 1. С. 76–88. DOI: dx.doi.org/10.15828/2075-8545-2019-11-1-76-68.
- Гусев Б.В., Ин Иен-Лян С., Сперанский А.А. Блочная структура периодичности и прогнозирование новых химических элементов // Промышленное и гражданское строительство. 2021. С. 4-9. DOI: 10.33622/0869-7019.
- Гладышев В.П. Современное состояние и методологическое значение Периодической системы химических элементов. Томский государственный педагогический университет. Вестник ТГПУ. Выпуск 2 (18). Серия: Естественные науки (Спецвыпуск). 2000. С. 28–32.
- Общая и неорганическая химия. Т.1. Теоретические основы Химии. Учебник для вузов в 2-х томах. Под ред. А.Ф. Воробьева. М.: ИКЦ «Академкнига», 2004. 371 с.
- Коулсон Ч. Валентность. М. 1965. 360 с.
- Кузнецов В.И. Общая химия. Тенденции развития [Науч.-попул.]. М.: Высш.шк., 1989. 288 с.: ил.
- Рис М. Всего 6 чисел: главные силы, формирующие Вселенную. / Мартин Рис, пер. с англ. / М.: Альпина ион-фикшн, 2018. 226 с.
- Стивен Хокинг. О вселенной в двух словах. ОГИЗ. М.: Издательство АСТ. 223 с.
- Дикерсон Р., Грей Г., Хайт Дж. Основные законы химии. М.: Мир, 1993. 258 с.
- Новошинский И.И., Новошинская Н.С. Химия. Углубленный уровень. Учебник. Русское слово. Серия: Инновационная школа, 2018. 440 с.
- Кораблева Т.П., Корольков Д.В. Теория Периодической Системы. Издательство Санкт-Петербургского Университета. 2005 г. 305 с.
- Гусев Б.В. Новые представления по объемной матрице химических элементов и формирование возможности существования 100 дополнительных новых элементов // Вторые Международные Косыгинские чтения «Энергоресурсо-эффективные экологические безопасные технологии и оборудование». Материалы пленарной сессии. Москва: РГУ, 2019. С. 25–29.
- История синтеза сверхтяжелых элементов. Материал подготовлен на основе информации РИА. Новости открытых источников. Интернет-ресурс: https://ria.ru/20111201/503670512.html.
- Максимчук А. «Остров стабильности» среди химических элементов.Специально для R&D.CNews.ru. Интернет-ресурс: https://maxpark.com/community/6285/content/2676531.
- Хартри Д. Расчеты атомных структур. М.: Изд-во Иностранной литературы, 1960. 272 с.
- Zahed Allahyari, Arttem R.Oganov. Nonempirical Defibition of the Mendeleev Numbers: Organizing the Chemical Space. Journal Of Physical Chemistry C. 2020,124, 43, 23867–23878.
- Audi G., Kondev F.G., Wang M., Huang W.J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. – 2017. – Vol. 41, iss. 3. – P. 030001-1–030001-138.


