Структурная организация астроцитов центрального ядра миндалевидного комплекса крыс линии DAT-HET
Автор: Давлетбаева А.Р., Федорова А.М., Хисматуллина З.Р.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.31, 2023 года.
Бесплатный доступ
Центральное ядро миндалевидного комплекса является интегративным центром и основным каналом связи с остальным мозгом. Показано, что оно связано с важнейшими гипоталамическими и висцеральными центрами. Изучение морфологии его нейронов и их ответной реакции необходимо для понимания того, как эта структура регулирует различные аспекты поведения в норме и при психических расстройствах. Цель настоящего исследования состояла в изучении морфологической организации астроцитов центрального ядра миндалевидного комплекса крыс линии DAT-HET. Крысы линии DAT-HET являются гетерозиготами (HET) по нокауту гена белка - дофаминового транспортера (DAT), имеют ряд поведенческих особенностей, повышенную двигательную и исследовательскую активность и одновременно повышенную поведенческую тревожность. Исследование выполнено на лабораторных крысах-самцах двух линий: линии Wistar (n=8), линии DAT-HET (n=7) с массой тела от 200 г до 265 г в возрасте 5-6 месяцев. Центральное ядро миндалевидного комплекса было изучено на серии фронтальных срезов головного мозга крыс. В структуре центрального ядра миндалевидного комплекса у изучаемых групп животных хорошо дифференцируются медиальное и латеральное субъядра и объединяющая их промежуточная часть. Исследование морфометрических показателей площади субъядер центрального ядра миндалевидного комплекса показало, что у крыс линии Вистар площадь латерального субъядра достоверно выше при сравнении с аналогичным показателем крыс линии DAT-HET и эта разница составляет 29%. Сравнение степени экспрессии иммунопозитивных клеток к маркеру глиального фибриллярного кислого белка - белка промежуточных филаментов III типа, который экспрессируется многочисленными типами клеток центральной нервной системы, включая астроциты и эпендимальные клетки выявило, что у крыс линии DAT-HET площадь, занимаемая иммунопозитивными клетками также достоверно больше. Полученные результаты свидетельствуют о возможных процессах ремоделирования формы и размеров астроцитов, которые возникают в ответ на изменения дофаминергической трансмиссии, вызванные нокаутом соответствующего гена.
Миндалевидный комплекс, центральное ядро, астроциты, дофамин, крысы линии dat-het
Короткий адрес: https://sciup.org/143181188
IDR: 143181188 | DOI: 10.20340/mv-mn.2023.31(3).809
Текст научной статьи Структурная организация астроцитов центрального ядра миндалевидного комплекса крыс линии DAT-HET
Давлетбаева А.Р., Федорова А.М., Хисматуллина З.Р. Структурная организация астроцитов центрального ядра миндалевидного комплекса крыс линии DAT-HET. Морфологические ведомости. 2023;31(3):809. (3).809
Davletbaeva AR, Fedorova AM, Khismatullina ZR. The structural organization of astrocytes of the amygdala complex central nucleus of the DAT-HET line rats. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(3):809. (3).809
Article received 31 May 2023
Article accepted 6 August 2023
Введение. Миндалевидный комплекс (далее - МК) мозга - важнейший компонент лимбической системы, играет важную роль в разнообразных сложных поведенческих реакциях, включая эмоциональные реакции, мотивацию, обучение, память и питание [1]. Центральное ядро (далее - СЕ) является интегративным центром МК и основным каналом связи с остальным мозгом. Показано, что оно связано с важнейшими гипоталамическими и висцеральными центрами [2]. Центральное ядро имеет гетерогенную структуру и содержит многочисленные субпопуляции ГАМК-эргических и глутаматэргических нейронов. Изучение морфологии нейронов и их ответной реакции необходимо для понимания того, как эта структура регулирует различные аспекты социального поведения в норме и при различных психических расстройствах [3]. Источники дофаминергических проекций мезолим-бической дофаминергической субсистемы расположены в области вентральной покрышки мозга, в компактной части черной субстанции. Их отростки идут в поясную извилину, энториальную кору, миндалевидный комплекс, гиппокамп, перегородку и другие структуры лимбической системы мозга [4]. Нейротрансмиссия дофамина связана с двигательной функцией, эмоциональным поведением и реакцией на стресс [5-6]. Нарушения уровня дофамина у человека способствуют развитию различных неврологических состояний, включая синдром дефицита внимания и гиперактивности (далее - СДВГ), болезнь Паркинсона (далее - БП) и шизофрению [7], а также сердечно-сосудистую недостаточность и почечную недостаточность [8]. По завершении нейротрансмиссии передача сигналов дофамина прекращается поглощением внеклеточного дофамина через переносчика дофамина (далее - DAT), являющегося трансмембранным белком. Было показано, что передача сигналов от дофаминовых рецепторов и вторичных мессенджеров изменяет активность DAT и выраженность его наличия в мембране. Модели генетического дефицита переносчика дофамина крысы DAT характеризуются повышением концентрации внеклеточного дофамина в синапсах головного мозга, что приводит к фенотипу, сходному с фенотипами нейродегенеративных заболеваний, такими как синдром дефицита внимания и гиперактивности, шизофрения и биполярное расстройство.
В последние годы все большее внимание привлекает роль астроцитов центральной нервной системы (далее - ЦНС) в функционировании мозга и неврологических заболеваниях. Реагируя на сигналы в своем микроокружении, астроциты могут стимулировать или останавливать воспаление и нейродегенерацию, играя активную роль при множественных неврологических заболеваниях, включая рассеянный склероз (далее - РС) [9-11], болезнь Альцгеймера (далее - БА) [12-14], БП [15-16], и поведенческие нейропсихические расстройства [17-18]. Астроциты становятся реактивными в ответ на травму или другие патологические процессы. Активация глиального фибриллярного кислого белка (далее - GFAP), основного компонента промежуточных филаментов астроцитов, считается отличительной чертой реактивных астроцитов у приматов и грызунов [19-21]. Увеличение числа и активности GFAP-позитивных процессов, выявляемых иммунным окрашиванием на GFAP, было обнаружено при различных патологических состояниях и часто использовалось для определения морфологических изменений астроцитов, таких как явление их гипертрофии [22].
Цель исследования: изучение морфологической организации астроцитов центрального ядра миндалевидного комплекса крыс линии DAT-HET.
Материалы и методы исследования. Исследование выполнено на лабораторных крысах-самцах двух линий: линии Wistar (n=8), линии DAT-HET (n=7) с массой тела от 200 г до 265 г в возрасте 5-6 месяцев. Крысы содержались в виварии кафедры физиологии и общей биологии Уфимского университета науки и технологий при температуре 20-22°С в стандартных клетках по 3-4 животных без ограничения подвижности, освещенности и доступа к воде и пище, на сбалансированном рационе.
Эксперименты проведены в соответствии с этическими нормами, и рекомендациями по гуманной работе с лабораторными животными, отраженными в приказе № 742 от 13.11.1984 «Об утверждении Правил проведения работ с использованием экспериментальных животных» Минздрава СССР. Проведенное исследование согласовано с локальным этическим комитетом Уфимского университета науки и технологий.
Образцы головного мозга фиксировали в растворе 10% забуференного формалина по Лилли и заливали в парафин. Срезы толщиной 8-10 мкм изготовлялись на микротоме LEICA 4RM 2145 (LEICA, Германия). После депарафинизации срезы окрашивали крезиловым фиолетовым по Нисслю. На окрашенных срезах проводили изучение цитоархитектонических особенностей центрального отдела МК, цитологию нейронов центрального отдела, особенности хромотофильной субстанции в них. Подсчитывали площадь субъядер центрального ядра.
Иммуногистохимическим методом выявляли GFAP, характерный для промежуточных филаментов астроцитов. Оценку экспрессии проводили на парафиновых срезах толщиной 5-8 мкм. Непрямым иммунопероксидазным методом производили выявление белка на автоматизированном гистостейнере для иммуногистохимии и гибридизации in situ Leica Microsystems Bond™(Германия) с применением первичных поликлональных антител (2E1; 1:300; Santa Cruz Biotechnology, USA). Использовали поликлональную непрямую стрептавидин-биотиновую систему детекции Leica BOND (Novocastra™, Германия). Оценку специфичности реакции проводили при окрашивании срезов без первичных антител. Для изучения препаратов использовали микроскоп AxioImager Z1, оснащенный фотонасадкой ProgRes C3 и программой анализа изображений AxioVision (Zeiss, Германия).
Статистическую данные представлены в виде среднего арифметического и стандартного отклонения. Оценку различий показателей двух независимых выборок проводили с помощью непараметрического критерия Манна-Уитни. Различия считали статистически значимыми при p<0,05.
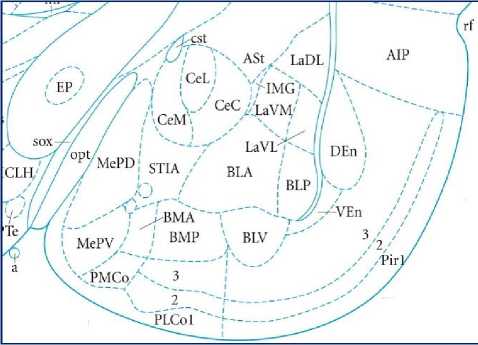
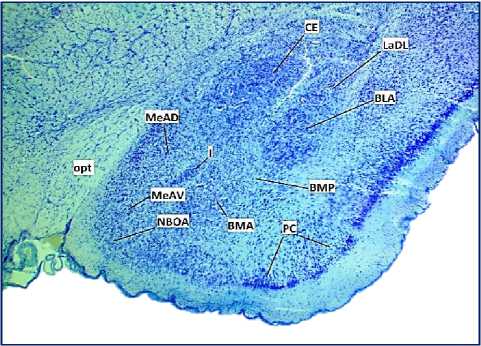
Результаты исследования и обсуждение. Центральное ядро МК было изучено на серии фронтальных срезов головного мозга крысы, окрашенных крезилом фиолетовым на уровне центрального отдела МК (рис. 1-а, 1-б). На данном уровне площадь СЕ увеличивается по сравнению с передним отделом МК, где начинают визуализироваться нейроны, формирующие данное ядро. На уровне центрального отдела у крыс изучаемых групп можно увидеть CE, которое разграничено волокнами оптического тракта и продольной ассоциативной связкой. Верхней границей СЕ является скорлупа, а нижней границей служат вставочные массы, благодаря наличию таких структур границы CE достаточно четко определяются. Большинство нейронов, которые формируют СЕ имеют размер от малого до среднего, но встречаются и более крупные нейроны (рис. 1-б). На участках, параллельных оптическому тракту, многие нейроны имеют веретенообразную форму. В структуре СЕ МК у изучаемых групп животных хорошо дифференцируются медиальное и латеральное субъядра СЕ МК и объединяющая их промежуточная часть (рис. 1-а). Медиальное субъядро сформировано у крыс линии Вистар мелкими и средними по размеру нейронами, которые имеют овальную, веретенообразную форму. В центре нейрона хорошо визуализируется ядро, цитоплазма клеток имеет выраженную зернистость, благодаря развитой хроматофильной субстанции. Вытянутая форма клетки определяется отходящими от ее тела начальными сегментами дендритов, в которых также можно рассмотреть хроматофильную субстанцию (цитохромные нейроны). Часть клеток, которые формируют данное субъядро являются кариохромными. Латеральное субъядро CE сформировано более крупными по размеру нейронами, полигональной формы, среди них преобладают кариохромные нейроны. Между нейронами и на нейронах можно рассмотреть клетки глии, где отмечаются просветы. У крыс линии DAT-HET хорошо визуализируются латеральное и медиаль- ное субъядра СЕ МК. Необходимо отметить, что нейроны, входящие в состав СЕ МК у крыс линии DAT-HET в основном имеют вытянутую форму перикариона, хроматофильная субстанция слабо выражена, клетки преимущественно кариохромные, между нейронами практически отсутствуют просветы (рис. 1-б).
Исследование морфометрических показателей площади субъядер CE показало, что у крыс линии Вистар площадь латерального субъядра СЕ МК достоверно выше при сравнении с крысами линии DAT-HET, разница составляет 29% (р<0,05), (табл. 1).
Таблица 1
Сравнительная характеристика площади СЕ МК мозга крыс в мкм2
|
Структура |
Крысы линии Вистар (n=8) |
Крысы линии DAT-HET (n=7) |
|
Латеральное субъядро СЕ |
216,26±13,16 |
153,04±8,32* |
|
Медиальное субъядро СЕ |
183,34±6,62 |
161,78±14,57 |
Примечание: * – различия значимы с соответствующим показателем, р<0,05
Была проведена оценка интенсивности окрашивания маркера экспрессии астроцитов, GFAP в области центрального ядра крыс линии Вистар и крыс линии DAT-HET. Сравнение степени экспрессии иммунопозитивных клеток к GFAP выявило, что у крыс линии DAT-HET относительная площадь, занимаемая иммунопо-зитивными клетками, достоверно больше (р<0,05), (табл. 2).
Таблица 2 Оценка экспрессии GFAP+ - астроцит-ной глии в СЕ МК мозга крыс в % иммунопозитивных клеток
|
Экспрессия GFAP+ - клеток |
Крысы линии Вистар (n=8) |
Крысы линии DAT-HET (n=7) |
|
14,20±3,56 |
38,20±4,79* |
Примечание: * – различия значимы с соответствующим показателем, р<0,05
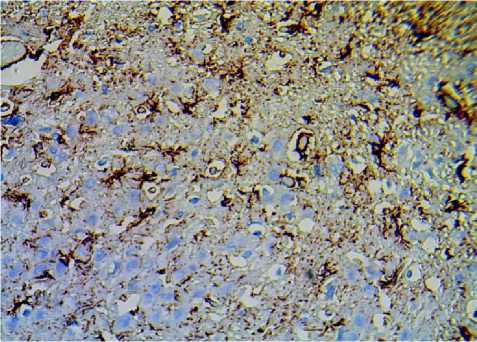
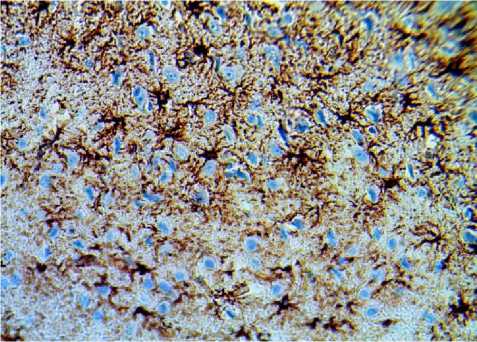
На препаратах, окрашенных иммуногистохимическим методом к GFAP можно увидеть, что у крыс линии DAT-HET архитектура астроцитов является наиболее выраженной, они плотно заполняют промежутки между нейронами, формируя своеобразную сеть, при этом у крыс линии Вистар, астроциты располагаются немного разрозненно (рис. 2).
Патологические процессы в ЦНС (например, воспаление, нейродегенерация или повреждения, вызванные травмами), обычно связаны с астроглиозом, ответом астроцитов, характеризующимся функциональным, морфологическим и молекулярным ремоделированием [24]. Реактивные астроциты очень гетерогенны и вносят собственный вклад в патологию нейродегенеративных и нейропсихиатри-ческих заболеваний, а также в восстановление ЦНС. Был описан ген Ndrg2, который относится к семейству Ndrg, члены которого контролируют множество функций в клеточной пролиферации, дифференцировке и реакциях на стресс. Ndrg2 широко распространен в ЦНС и экспрессируется астроцитами. Мыши с нокаутом Ndrg2 (Ndrg2-/-) проявляли симптомы, подобные СДВГ, характеризующиеся дефицитом внимания, гиперактивностью, импульсивностью и нарушением памяти. Кроме того, уровни интерстициального глутамата и возбуждающая передача были заметно повышены в мозге мышей Ndrg2-/- из-за сниженного астроглиального клиренса глутамата [25].
Глутамат является наиболее распространенным возбуждающим нейротрансмиттером в ЦНС, однако чрезмерные уровни глутамата могут вызывать гибель нейронов, этот процесс называется эксайтотоксичностью [26-27]. В этом контексте астроциты удаляют внеклеточный глутамат из синаптической щели с помощью высокоаффинных транспортеров глутамата, возбуждающих аминокислотный транспортер 1 (EAAT1) и EAAT2, которые играют ключевую роль в гомеостазе глутамата, синаптической пластичности и выживании нейронов [28]. Следовательно, нарушение захвата глутамата астроцитами может привести к нейрональной эк-сайтотоксичности, которая обычно связана с нейродегенерацией. Кроме того, астроциты в экспериментальных моделях на животных демонстрируют пониженную экспрессию EAAT2, связанную с дисфункцией нейронов [29-30]. Астроциты человека, полученные от пациентов с БА, демон-
А Б
Рис. 1. Структурная организация центрального ядра миндалевидного комплекса крыс линии DAT-HET. А - схематическое изображение миндалевидного тела согласно атласу мозга крысы [23]; Б – микрофото гистологического препарата миндалевидного комплекса мозга крыс линии DAT-HET. Окр.: крезиловым фиолетовым по Нисслю. Ув. х200. Обозначения: СЕ – центральное ядро; LaDL – латеральное ядро, дорсолатеральная часть; BLA – базолатеральное ядро; BMA, BMP – базомедиальное ядро; MeAD, MeAV – медиальное ядро; NBOA – ядро добавочной обонятельной луковицы; I – вставочные массы; opt – оптический тракт; РС – пириформная кора
А
Рис. 2. Микрофото гистологического препарата миндалевидного комплекса мозга крыс линии Вистар (А) и крыс линии DAT-HET (Б). Окр.: иммуногистохимическая на экспрессию кислого фибриллярного белка астроцитов. Ув.: х400
Б
стрируют снижение поглощения глутамата, сопровождающееся снижением экспрессии EAAT2 и EAAT1 [31]. Астроциты проявляют структурную пластичность в ответ на синаптическую активность и поведение, что, в свою очередь, способствует ремоделированию окружающих синапсов.
Таким образом, полученные нами результаты о более выраженной экспрессии GFAP на срезах СЕ МК у крыс линии DAT-HET и меньшие размеры латерального субъядра МК вероятно связаны с реактивными изменениями астроцитов у крыс линии DAT-HET, которые являются нока-утными по переносчику дофамина. Изменения дофаминергической трансмиссии вероятно вызвала ремоделирование астроцитарной глии у крыс линии DAT-HET. Это согласуется с литературными данными, изучение экспресии GFAP у мышей нокаутных по гену Ndrg2-/-, выявило повышение экспрессии GFAP, что свидетельствует об активации астроцитов [32].
Астроциты могут реагировать посредством продукции иммунорегулятор-ных молекул, которые в свою очередь мо- гут способствовать или ограничивать воспаление в ответ на множественные сигналы в микроокружении ЦНС [33-34], что подчеркивает функциональную гетерогенность реактивных астроцитов в контексте их роли в нейровоспалении и повреждении ЦНС.
Заключение. Изучение морфологической организации астроцитов центрального ядра миндалевидного комплекса крыс линии DAT-HET, гетерозиготных по нокаутному гену мембранного белка переносчика дофамина, выявило достоверные различия, выражающихся в меньшей площади латерального субъядра центрального ядра миндалевидного комплекса, сложной организации сети астроцитов и выраженной экспрессии иммунопозтив-ных клеток к GFAP. Полученные результаты свидетельствуют о возможных процессах ремоделирования астроцитов, которые возникают в ответ на изменения дофаминергической трансмиссии, вызванные нокаутом гена DAT.
Список литературы Структурная организация астроцитов центрального ядра миндалевидного комплекса крыс линии DAT-HET
- Cardinal RN, Parkinson JA, Hall J, Everitt BJ. Emotion and motivation: the role of the amygdala, ventral striatum, and prefrontal cortex. Neu-rosci Biobehav Rev. 2002;26(3):321-352. DOI: 10.1016/s0149-7634(02)00007-6
- Ahmadeev AV, Kalimullina LB. Central'noe yadro mindalevidnogo kompleksa mozga: struktura, neyrohimiya, svyazi i funktsii. Uspekhi fizio-logicheskikh nauk. 2020;51(3):69-86. DOI: 10.31857/S0301179820030030. In Russian
- Morales L, Castro-Robles B, Abellan A, Desfilis E. A novel telencephalon-opto-hypothalamic morphogenetic domain coexpressing Foxg1 and Otp produces most of the glutamatergic neurons of the medial extended amygdala. J Comp Neurol. 2021;529:2418-2449. DOI: 10.1002/cne.25103
- Kolotilova OI, Korenyuk II, Khusainov DR, Cheretaev IV. Dofaminergicheskaya sistema mozga. Vestnik Bryanskogo gosudarstvennogo univer-siteta. 2014;(4):97-106. In Russian
- Giros B, Caron MG. Molecular characterization of the dopamine transporter. Trends Pharmacol Sci. 1993;14(2):43-49. DOI: 10.1016/0165-6147(93)90029-j
- Hyman SE. Addiction to cocaine and amphetamine. Neuron. 1996;16(5):901-904. DOI: 10.1016/s0896-6273(00)80111-7
- Mehler-Wex C, Riederer P, Gerlach M. Dopaminergic dysbalance in distinct basal ganglia neurocircuits: implications for the pathophysiology of Parkinson's disease, schizophrenia and attention deficit hyperactivity disorder. Neurotox res. 2006;10(3-4):167-179. DOI: 10.1007/BF03033354
- Doggrell SA. The therapeutic potential of dopamine modulators on the cardiovascular and renal systems. Expert Opin Investig Drugs. 2002;11(5):631-644. DOI: 10.1517/13543784.11.5.631
- Wheeler MA, Clark IC, Tjon EC et al. MAFG-driven astrocytes promote CNS inflammation. Nature. 2020;578(7796):593-599. DOI: 10.1038/s41586-020-1999-0
- Linnerbauer M, Wheeler MA, Quintana FJ. Astrocyte crosstalk in CNS inflammation. Neuron. 2020;108(4):608-622. DOI: 10.1016/j.neuron.2020.08.012
- Wheeler MA, Quintana FJ. Regulation of astrocyte functions in multiple sclerosis. Cold Spring Harb Perspect Med. 2019;9(1):a029009. DOI: 10.1101/cshperspect.a029009
- Habib N, McCabe C, Medina S, et al. Disease-associated astrocytes in Alzheimer's disease and aging. Nat Neurosci. 2020;23(6):701-706. DOI: 10.1038/s41593-020-0624-8
- Mathys H, Davila-Velderrain J, Peng Z, et al. Single-cell transcriptomic analysis of Alzheimer's disease. Nature. 2019;570(7761):332-337. DOI: 10.1038/s41586-019-1195-2
- Zhou Y, Song WM, Andhey PS, et al. Human and mouse single-nucleus transcriptomics reveal TREM2-dependent and TREM2-independent cellular responses in Alzheimer's disease. Nat Med. 2020;26(1):131-142. DOI: 10.1038/s41591-019-0695-9
- Yun SP, Kam TI, Panicker N, et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nat Med. 2018;24(7):931-938. DOI: 10.1038/s41591-018-0051-5
- Booth HDE, Hirst WD, Wade-Martins R. The role of astrocyte dysfunction in Parkinson's disease pathogenesis. Trends Neurosci. 2017;40(6):358-370. DOI: 10.1016/j.tins.2017.04.001
- Yu X, Taylor AMW, Nagai J, et al. Reducing astrocyte calcium signaling in vivo alters striatal microcircuits and causes repetitive behavior. Neuron. 2018;99(6):1170-1187.e9. DOI: 10.1016/j.neuron.2018.08.015
- Nagai J, Yu X, Papouin T, et al. Behaviorally consequential astrocytic regulation of neural circuits. Neuron. 2021;109(4):576-596. DOI: 10.1016/j.neuron. 2020.12.008
- Perez-Alvarez A, Navarrete M, Covelo A, et al. Structural and functional plasticity of astrocyte processes and dendritic spine interactions. J Neurosci. 2014;34(38):12738-12744. DOI: 10.1523/JNEUROSCI.2401-14.2014
- Molofsky AV, Krencik R, Ullian EM, et al. Astrocytes and disease: a neurodevelopmental perspective. Genes Dev. 2012;26(9):891-907. DOI: 10.1101/gad.188326.112
- Burda JE, Sofroniew MV. Reactive gliosis and the multicellular response to CNS damage and disease. Neuron. 2014;81(2):229-248. DOI: 10.1016/j.neuron.2013.12.034
- Pekny M, Pekna M. Astrocyte reactivity and reactive astrogliosis: costs and benefits. Physiol Rev. 2014;94(4):1077-1098. DOI: 10.1152/physrev. 00041.2013
- Paxinos G, Watson C. The rat brain in stereotaxic coordinates. Sydney: Academic, 1998. 300 pp
- Anderson MA, Ao Y, Sofroniew MV. Heterogeneity of reactive astrocytes. Neurosci Lett. 2014;565:23-29. DOI: 10.1016/j.neulet.2013.12.030
- Li Y, Yin A, Sun X, et al. Deficiency of tumor suppressor NDRG2 leads to attention deficit and hyperactive behavior. J Clin Invest. 2017;127(12):4270-4284. DOI: 10.1172/JCI94455
- Dong XX, Wang Y, Qin ZH. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmacol Sin. 2009; 30(4):379-387. DOI: 10.1038/aps.2009.24
- Meldrum BS. Glutamate as a neurotransmitter in the brain: review of physiology and pathology. J Nutr. 2000;130(4S Suppl): 1007-1015. DOI: 10.1093/jn/130.4.1007S
- Anderson CM, Swanson RA. Astrocyte glutamate transport: review of properties, regulation, and physiological functions. Glia. 2000;32(1):1-14
- Hefendehl JK, LeDue J, Ko RW, et al. Mapping synaptic glutamate transporter dysfunction in vivo to regions surrounding Aft plaques by iG-luSnFR two-photon imaging. Nat Commun. 2016;7:13441. DOI: 10.1038/ncomms13441
- Chung EK, Chen LW, Chan YS, Yung KK. Downregulation of glial glutamate transporters after dopamine denervation in the striatum of 6-hydroxydopamine-lesioned rats. J Comp Neurol. 2008;511(4):421-437. DOI: 10.1002/cne.21852
- Liang Z, Valla J, Sefidvash-Hockley S, et al. Effects of estrogen treatment on glutamate uptake in cultured human astrocytes derived from cortex of Alzheimer's disease patients. J Neurochem. 2002;80(5):807-814. DOI: 10.1046/j.0022-3042.2002.00779.x
- Wang J, Liu M, Hou W, et al. N-myc Downstream-Regulated Gene 2 (Ndrg2): A Critical Mediator of Estrogen-Induced Neuroprotection Against Cerebral Ischemic Injury. Mol Neurobiol. 2022;59(8):4793-4804. DOI: 10.1007/s12035-022-02877-5
- Safieh-Garabedian B, Mayasi Y, Saadé NE. Targeting neuroinflammation for therapeutic intervention in neurodegenerative pathologies: a role for the peptide analogue of thymulin (PAT). Expert Opin Ther Targets. 2012;16(11): 1065-1073. DOI: 10.1517/14728222.2012.714773
- Colombo E, Farina C. Astrocytes: Key Regulators of Neuroinflammation. Trends Immunol. 2016;37(9):608-620. DOI: 10.1016/j.it.2016.06.006


