Структурная реорганизация реиннервируемой скелетной мышцы при низкочастотной электростимуляции
Автор: Щудло Михаил Моисеевич, Щудло Наталья Анатольевна, Филимонова Галина Николаевна, Степанова Галина Анатольевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2010 года.
Бесплатный доступ
В опытах на 7 собаках выполнен гистологический, стереологический и морфометрический анализ структурных изменений реиннервируемой передней большеберцовой мышцы на ранней стадии посттравматической регенерации седалищного нерва собак под влиянием терапии аппаратом «Миоритм», проводимой в период от 4 до 11 недель после перерезки и первичного шва нерва. Установлено, что васкуляризация реиннервируемой мышцы к концу курса стимуляции превышает не только нестимулированный контроль, но даже показатель интактной мышцы, что создаѐт условия для выживания мышечных волокон в атрофическом и нормотрофическом статусе и активации вторичного миогенеза.
Регенерация нерва, реиннервация мышц, электростимуляция
Короткий адрес: https://sciup.org/142121379
IDR: 142121379
Текст научной статьи Структурная реорганизация реиннервируемой скелетной мышцы при низкочастотной электростимуляции
Клиническая практика и экспериментальные исследования свидетельствуют, что восстановление функции скелетных мышц при травматических нейропатиях или заболеваниях, вызывающих нарушение либо снижение нервномышечной активности, часто не достигает оптимального уровня. Для решения этой проблемы применяется электротерапия, цель которой состоит в предотвращении либо компенсации атрофии мышечных волокон, стимуляции реиннервации, увеличении силы мышцы. Результаты электростимуляции оцениваются противоречиво: она может улучшить регенерацию нерва, но при несоответствующем режиме применения может навредить [11]. Некоторые авторы располагают 50-летним опытом исследования эффектов нейростимуляции в экспериментах на животных [4]; в последние годы количество пуб- ликаций этого направления возросло: исследуется влияние разных способов и протоколов электростимуляции на размеры мышечных волокон, экспрессию нейротрофических факторов, механические, электрофизиологические, гистохимические и биохимические характеристики мышцы [5, 6, 7, 8]. Остаётся недостаточно изученным влияние электростимуляции на васкуляризацию мышцы в период де- и реиннервации, неясны возможности модуляции численности мышечных волокон и восстановления свойственного интактной мышце спектра распределения метаболических типов.
Цель работы – исследование эффектов низкочастотной нейромиостимуляции на структурную реорганизацию мышцы в ходе денерваци-онно-реиннервационного процесса.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на 7 собаках. Под внутривенным барбитуровым наркозом в асептических условиях ножницами Millesi рассекали седалищный нерв на уровне середины бедра и сшивали с применением микрохирургической техники (инструментарий фирмы Aesculap, нить фирмы Ethicon калибра 8/0, увеличение 8-16× микроскопа Opton). В послеоперационном перио- де у трёх собак из 7 не применяли воздействий на регенераторный процесс (нестимулированный контроль – группа 1), у других четырёх собак (опыт – группа 2) в период от 4 до 11 недель после операции проводили нейромиостимуляцию аппаратом «Миоритм». Всего было выполнено по 18 сеансов (3 раза в неделю) длительностью 40 минут каждый. Катод располагали в проекции малоберцового нерва, второй электрод – на двигательных точках мышц стопы. Стимуляция проводилась в режиме 2:2: две секунды пачка импульсов, две секунды – пауза. Сила тока подбиралась индивидуально, до появления едва заметных видимых сокращений мышц.
Животных выводили из опыта через 11 недель после операции. При проведении экспериментальных исследований руководствовались требованиями приказов № 1179 МЗ СССР от 10.10.1983, № 267 МЗ РФ от 19.06.2003, «Правилами проведения работ с использованием экспериментальных животных», «Правилами по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных», утвержденными МЗ СССР (1977) и МЗ РСФСР (1977), принципами Европейской конвенции (Страсбург, 1986) и Хельсинской декларации Всемирной медицинской ассоциации о гуманном обращении с животными (1996).
После эвтаназии для морфологических исследований забирали фрагменты передней большеберцовой мышцы. Изготавливали поперечные криостатные срезы, в которых выявляли активность миозиновой АТФ-азы, а также продольные и поперечные эпоксидные полутонкие срезы, окрашенные по M. Ontell. Препараты изучали и фотографировали, используя большие исследовательские микроскопы фирмы «Opton» (ФРГ). Изображения криостатных препаратов оцифровывали на АПК «ДиаМорф» (Россия) при увеличении 200х. Используя тестовую решетку, состоящую из 100 точек, в программе А. Photoshop осуществляли точко-счетную объемометрию, определяли: относительный объем мышечных волокон (VVmf), микрососудов (VVmv), эндомизия (VVend). В каждом поле зрения определяли число мышечных волокон и микрососудов, рассчитывали их численную плотность (NAmf и NAmv соответственно), индекс васкуляризации (Ivasc). Результаты стерео-логического анализа мышц экспериментальных животных сопоставляли с данными, полученными в аналогичных исследованиях мышц 3 интактных собак. По результатам измерений среднего ортогонального диаметра каждого мышечного волокна в выборке из 300 волокон от каждого животного оценивали размерную вариативность мышечных волокон в условиях опыта и контроля в сравнении с интактной мышцей. Методом визуальной экспертной оценки определяли представительство волокон I и II типов в каждой выборке, строили гистограммы их распределения по диаметрам. Статистическую обработку данных осуществляли с использованием программных возможностей M.Excel-2000 – применением описательной статистики и непарного двухвыборочного t-теста.
РЕЗУЛЬТАТЫ
При микроскопии криостатных срезов передней большеберцовой мышцы оперированных животных установлено, что в некоторых участках мышцы при высокой активности АТФ-азы в стенках сосудов мышечные волокна практически не дают реакции на этот фермент, поэтому дифференцировка их на типы невозможна. Наряду с этим встречаются участки мышцы с чётко различимыми типами волокон. Из-за кластерного расположения волокон, являющегося характерным признаком реиннервации мышцы, в одних полях зрения отмечается преобладание волокон типа I, в других – II. В некоторых полях зрения есть отдельные участки со свойственным нормальной мышце (рис. 1) мозаичным расположением волокон, что более характерно для группы «Миоритм».
У животных контрольной гр уппы значительно увеличена размерная вариативность мышечных волокон как по сравнению с группой «Миоритм», так и интактной мышцей. Выявляются единичные гипертрофированные волокна – они имеют округлые контуры, диаметр более 80 мкм и в большинстве своём обладают низкой активностью АТФ-азы.
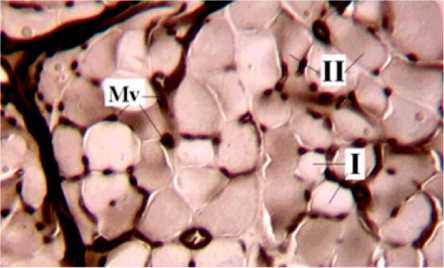
Рис. 1. Фрагмент поперечного криостатного среза передней большеберцовой мышцы животного из группы «Миоритм». Реакция на АТФ-азу. Увеличение 180×. Mv – микрососуды. I – мышечные волокна с низкоинтенсивной реакцией на АТФ-азу, II – мышечные волокна с высокой реакцией на АТФ-азу
В группе «Миоритм» по сравнению с интактными и контролем значительное количество мышечных волокон имеет малое поперечное сечение и ангулярные контуры, что является характерным признаком атрофии. С другой стороны, по сравнению с нестимулированным контролем чаще встречаются волокна, имеющие диаметр менее
10 мкм, но с округлыми контурами и с очень интенсивной реакцией на АТФ-азу, что свойственно мионам, регенерирующим de novo. Гипертрофированных мышечных волокон (диаметром более 80 мкм) в группе «Миоритм» нет. Обращает на себя внимание гиперваскуляризация эндомизия: отмечается расширение сосудов артериального звена и увеличение численности микрососудов, прежде всего капилляров.
При исследовании полутонких срезов животных контрольной группы отмечается увеличение количества регенераторных ядер в мышечных волокнах, занимающих преимущественно периферическое расположение и нередко образующих двух-, трёх- или четырёхчленные группы. В интерстициальной ткани увеличено содержание фибробластов, встречаются коллагеновые депозиты и вакуолизированные макрофаги, иногда миобласты – одиночные или в виде малочисленных скоплений, напоминающих миотубы.
При исследовании полутонких срезов передней большеберцовой мышцы собак из группы «Миоритм» в межпучковых соединительнотканных прослойках увеличено содержание адипоцитов; в пучках мышечных волокон встречаются участки жировой дегенерации. В продольных артериях отмечается гиперплазия мышечной оболочки, отдельные гладкие миоциты в состоянии вакуольной дистрофии. Артериолы и многочисленные капилляры имеют дилатированные просветы. Эндомизий содержит боль- шое количество клеточных элементов: среди них регулярно встречаются тучные клетки с крупными гранулами, располагающиеся в основном периваскулярно; многочисленны активированные макрофаги округлой формы, некоторые имеют форму ракетки, содержат единичные вакуоли; регулярно встречаются клетки, фенотипически напоминающие миобласты, формирующие растущие миотубы (рис. 2, справа). Количество внутримышечных ядер в группе «Миоритм» также увеличено, довольно часто встречаются крупные (переживающие) волокна с центральной их локализацией (рис. 2, слева).
Стереологический анализ (табл. 1) показал, что объёмная и численная плотности мышечных волокон у оперированных животных достоверно превышают интактные показатели, особенно в опыте. При очень незначительно (хотя и достоверно) уменьшенной объёмной плотности мышечных волокон в опытной группе по сравнению с нестимулированным контролем численные плотности мышечных волокон и микрососудов увеличены в 1,7 раза и 2,8 раза соответственно. Объёмные плотности микрососудов в контроле и у интактных собак сопоставимы, а в опыте этот показатель достоверно повышен. Индекс васкуляризации мышцы в контроле на 27,3 % снижен по сравнению с интактной мышцей. В группе «Миоритм» этот показатель превышает контрольный на 38,3 % и даже превышает интактный показатель – на 17,7 %.
Таблица 1
Результаты стереологического анализа передней большеберцовой мышцы оперированных и нтактных животных
|
Группа |
Мышечные волокна |
Микрососуды |
Эндомизий |
|||
|
VVmf (мм3/мм3) |
NA mf (мм -2) |
VVmv (мм3/мм3) |
NA mf (мм -2) |
I vasc |
VVend (мм3/мм3) |
|
|
Контроль |
0,936±0,005* |
1001,7±22,6*** |
0,025±0,003*** |
1014,9±36,2*** |
1,013 |
0,041±0,003 |
|
Миоритм |
0,920±0,004 |
1719,5±50,7 |
0,044±0,002 |
2822,3±90,6 |
1,641 |
0,037±0,002 |
|
Интактная группа |
0,908 □□ |
504,0 □□□ |
0,026 □□□ |
702,8 □□□ |
1,394 |
0,066 □□□ |
Различия достоверно значимы: *** Р<0,001, ** Р<0,01, * Р<0,05; *** – Контроль – Миоритм; □□□ – Интактная группа – Миоритм.
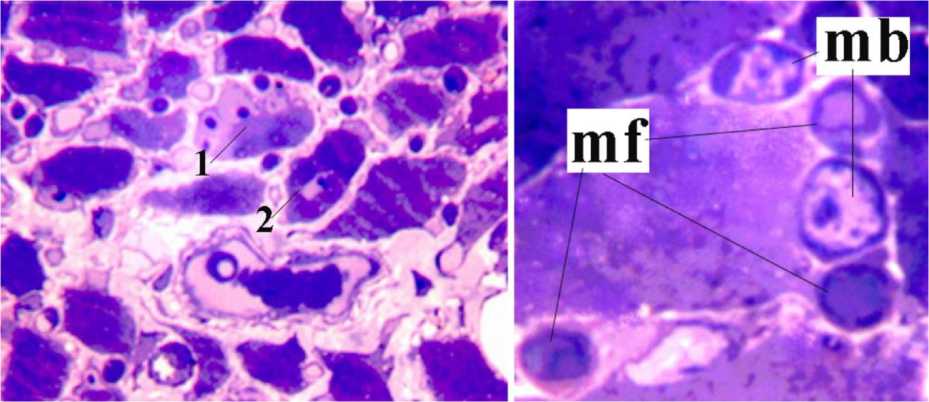
Рис. 2. Фрагменты поперечного полутонкого среза мышцы собаки из группы «Миоритм». Окраска по M.Ontell. Слева – увеличение 500х, справа – 1250×. 1 – мышечное волокна с периферическим расположением регенераторных ядер, 2 – регенерирующее мышечное волокно с центрально расположенным ядром. Mf – макрофаги, mb – миобласты в составе конусов роста миотуб
Представляется несколько парадоксальным уменьшенное относительное содержание эндоми-зия в мышцах оперированных животных по сравнению с интактными. Можно предположить, что денервационная атрофия затрагивает не только мышечные волокона, но и интерстиций.
По данным морфометрии, диаметры мышечных волокон в контроле широко варьируют от 6 до 95 мкм (средний диаметр 40,6±0,9 мкм), в опыте – от 5 до 62 мкм (средний диаметр 23,4±0,6 мкм), в интактной мышце – от 11 до 80 мкм (средний диаметр 43,4±0,6 мкм).
В контроле гистограммы распределения мышечных волокон I и II типов по диаметрам имеют 9 классов (рис. 3), асимметричны, волокна II типа распределены бимодально (пики в 3 и 5 классах), гистограмма волокон II типа смещена на один класс влево по отношению к гистограмме распределения волокон I типа.
В группе «Миоритм» гистограммы распределения волокон I и II типов (рис. 4) практически идентичны по соотношению высоты пиков, унимодальны, имеют соответственно 6 и 7 классов.
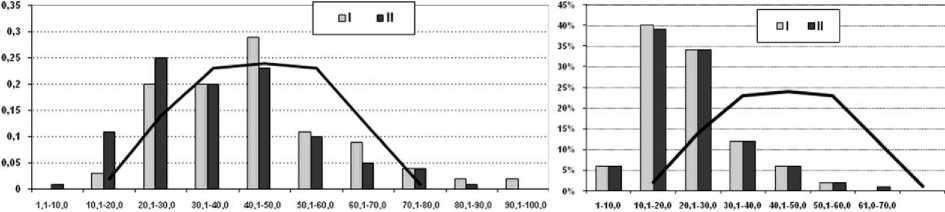
Рис. 3. Гистограмма частотного распределения мышечных волокон I и II типов по диаметрам у животных контрольной группы в сопоставлении с графиком распределения мышечных волокон обоих типов у интактных собак
Рис. 4. Гистограмма частотного распределения мышечных волокон I и II типов по диаметрам у животных опытной группы в сопоставлении с графиком распределения мышечных волокон обоих типов у интактных собак
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведённые исследования показали, что через 11 недель после перерезки и первичного шва седалищного нерва в отсутствии каких-либо терапевтических воздействий на регенерационный процесс размеры мышечных волокон хорошо восстанавливаются – средний диаметр мышечных волокон уменьшен всего лишь на 6 % по сравнению с интактной мышцей. Однако индекс васкуляризации мышечных волокон снижен на 27,3 % по сравнению с интактным показателем. Характерное для интактной мышцы нормальное распределение волокон в этих условиях не восстанавливается, увеличена их размерная вариативность, причём волокна II типа распределены бимодально, а среди волокон I типа встречаются гипертрофированные.
Аналогичные изменения у людей с облитерирующими заболеваниями сосудов выявлены в мышцах, которые оказываются полностью или частично денервированными из-за вызванной ишемией дегенерации нервных окончаний [10]. Известно, что даже в отсутствии повреждений или патологии сосудов денервация снижает васкуляризацию мышцы на 80 % и более [2]. По нашим ранее полученным данным [1], восстановление индекса васкуляризации мышцы не происходит даже после успешной реиннервации: через год после восстановительной операции на нерве этот параметр остаётся сниженным на 39,5 % по сравнению с интактной мышцей, при этом у многих животных сохраняется повышенная размерная вариативность мышечных волокон, а у некоторых особей – и бимодальный характер их распределения по диаметрам. Эти изменения не являются оптимальными для восстановления функциональных возможностей мышц.
В литературе нам не удалось найти объяснений, почему в условиях ишемии и денервации в мышце появляются гипертрофированные волокна, но известно, что аналогичное явление наблюдается при удалении части мышцы [12]. Денервационная атрофия включает не только уменьшение размеров волокон, но и их гибель. Возможно появление гипертрофированных волокон в денервированной мышце связано с компенсацией утраты численности мионов и вызванной ишемизацией перестройкой метаболизма.
Через 11 недель после восстановительной операции на пересечённом седалищном нерве и курса электростимуляции аппаратом «Миоритм», васкуляризация мышечных волокон передней большеберцовой мышцы значительно превышает не только контроль, но даже интактную мышцу; диаметры мышечных волокон I и II типов пропорционально уменьшены по сравнению с интактной мышцей. «Простой» вид атрофии, почти в равной степени затрагивающий волокна обоих типов, в большей мере характерен для состояния бездействия мышц, но не денервационных изменений. Следует также отметить, что уменьшение среднего диаметра мышечных волокон по сравнению с интактной мышцей на 46 %, уменьшение ширины гистограммы распределения мышечных волокон по диаметру и сдвиг её пика влево, обусловлены не только и не столько атрофией, сколько значимым представительством регенерирующих мио-нов, образующихся de novo.
Долгое время считалось, что численность волокон в мышце остаётся постоянной в течение всей постнатальной жизни индивида. Увеличение объёма мышц при разных видах тренировок объяснялось увеличением размеров мышечных волокон, но не их числа. Мета-анализ экспериментальных исследований [9] показал, что увеличение численности мышечных волокон (гиперплазия) играет существенную роль в адаптации мышцы к нагрузкам у многих видов животных. Гиперплазия мышечных волокон при определённых видах нагрузки выявлена и у взрослых людей; в мышцах бодибилдеров отмечена и небольшая пролиферация жировой ткани [13]. В нашем исследовании увеличение содержания адипоцитов в межпучковых соединительнотканных прослойках и липоидная дегенерация мышечных волокон отмечена в опытах с электростимуляцией; для нестимулиро-ванного контроля более характерны фиброзные изменения эндомизия.
Некоторые авторы в опытах на крысах [3] описывали не зависящие от гибели мышечных волокон или реиннервации явления регенерации и вторичного миогенеза в денервированных мышцах.
Полученные нами данные свидетельствуют, что при денервации и последующей реиннервации у собак формирование миотуб de novo также происходит, причём в условиях электростимуляции оно более выражено. Наблюдаемое нами появление в интерстиции стимулированной мышцы наряду с миобластами большого количества активированных макрофагов при электростимуляции мышечных сокращений в процессе де- и реиннервации согласуется с представлениями других авторов о существенной роли макрофагов в адаптации атрофированной от бездействия мышцы к повышению механических нагрузок [14]. Следует иметь в виду, что разные морфо-функциональные популяции макрофагов фагоцитируют повреждённые мышечные волокна, стимулируют их репарацию и промотируют миогенез.
В настоящее время невозможно утверждать, что применённый способ и режим электростимуляции оптимален для восстановления морфофункциональных характеристик мышцы в процессе де- и реиннервации, но доказанная возможность модулировать васкуляризацию, регенерацию и неогенез мышечных волокон обосновывает перспективность дальнейших экспериментальных исследований этого вида физиотерапии, в том числе в отдалённые сроки реиннервации.
ЗАКЛЮЧЕНИЕ
Проведён гистологический, стереологический и морфометрический анализ структурных изменений реиннервируемых скелетных мышц на ранней стадии посттравматической регенерации нерва в условиях терапии аппаратом «Миоритм». Установлено, что под влиянием электротерапии васкуляризация реиннервируемой мышцы усиливается и на ранней стадии регенерационного процесса превышает не только нестимулирован-ный контроль, но даже показатель интактной мышцы, при этом предотвращаются характерные для полной или частичной денервации изменения численно-размерного состава мышечных волокон. Результаты исследований позволяют предположить, что применение низкочастотной электростимуляции в период денервации и последующей реиннервации создаёт условия для выживания мышечных волокон в атрофическом и нормотрофическом статусе и активации вторичного миогенеза. Вероятные клеточные механизмы обнаруженных эффектов – стимуляция миграции и рост-регулирующей секреторной активности клеток костномозгового происхождения – лаброцитов и макрофагов.


