Структурно-функциональная характеристика ADAMTS-4 и ADAMTS-5: обзор
Автор: Корчагина Анастасия Александровна, Деревщикова Людмила Владимировна
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 1 т.10, 2020 года.
Бесплатный доступ
Резюме: ADAMTS-4 и -5 - это аггреканазы, которые участвуют в процессе развития остеоартроза, одного из самых распространенных на данный момент заболеваний, из-за которого ежегодно страдает большое количество населения. По некоторым оценкам 9,6 % мужчин и 18 % женщин в возрасте после 60 лет имеют симптоматический остеоартроз. В данном обзоре рассматриваются известные на сегодняшний день данные о структурных особенностях и ферментативной активности данных ферментов. Структуры ADAMTS-4 и -5 схожи, они содержат 7 доменных участков: сигнальная область, N-концевой продомен, каталитический домен, дезинтегринподобный домен, мотив тромбосподина, богатый цистеином домен и спейсерный домен. Помимо всех этих элементов, у ADAMTS-5 имеется в конце дополнительный мотив тромбосподина. ADAMTS-4 и -5 расщепляет аггрекан в 5 различных участках связывания. Однако наиболее важную роль в патогенезе, вероятно, играет участок Glu373-Ala374, поскольку при разрушении этой связи вся молекула аггрекана теряет целостность, что приводит к разрушению хряща и развитию заболевания. В ходе анализа информации было обнаружено, что участие ADAMTS-4 и ADAMTS-5 в развитии остеоартроза сильно разнится в зависимости от вида организма. Выяснено, что у мышей наибольшую роль в разрушении аггрекана играет ADAMTS-4, в то время как у человека ADAMTS-5 или обе аггреканазы влияют на развитие остеоартроза. Выявленные различия до конца не описаны, поэтому данный обзор обобщает уже известные результаты в этой области, что будет способствовать дальнейшему проведению исследования в этом направлении.
Структура, домены, участки связывания, остеоартроз
Короткий адрес: https://sciup.org/149131483
IDR: 149131483 | УДК: 576 | DOI: 10.15688/nsr.jvolsu.2020.1.2
Текст научной статьи Структурно-функциональная характеристика ADAMTS-4 и ADAMTS-5: обзор
DOI:
Цитирование. Корчагина А. А., Деревщикова Л. В. Структурно-функциональная характеристика ADAMTS-4 и ADAMTS-5: обзор // Природные системы и ресурсы. – 2020. – Т. 10, № 1. – С. 12–21. – DOI:
Введение. ADAMTS-4 и -5 являются аггреканазами суставного хряща. Они представляют собой внеклеточные протеолитические ферменты, которые являются членами семейства ADAMTS (дезинтегрин и металлопротеиназа с мотивами тромбоспондина). Аг-греканазы действуют на аггреканы – хрящевые специфичные протеогликановые ядерные белки, которые обеспечивают хрящу сжимаемость и эластичность путем набухания и увлажнения коллагеновой сети [42]. Потеря аг-грекана считается критическим ранним событием при остеоартрозе (ОА), происходящим первоначально на поверхности сустава и прогрессирующим в более глубокие зоны. За этим следует деградация коллагеновых фибрилл и механическое разрушение ткани [9]. Аг-греканаза-1 (ADAMTS-4) и аггреканаза-2 (ADAMTS-5) расщепляют аггрекан на уникальном сайте, названном «сайтом аггрека-назы» – Glu373-Ala374 [25; 26].
Структура белков ADAMTS-4 и ADAMTS-5. Белки ADAMTS представляют собой семейство цинк-зависимых ферментов в металлопротеиназах семейства метцинцин [15; 20; 35; 37]. Они состоят из сигнальной области (Signalsequence, SS), N-концевого продомена (Pro), каталитического домена
(Catalytic, Cat), дезинтегринподобного домена (Disintegrinlike, Dis), одного или нескольких мотивов тромбоспондина (TS), богатого цистеином домена (Cysteinrich, CysR) и спейсер-ного домена (Spacer, Sp) [12; 36]. Структура белков ADAMTS-4 и ADAMTS-5 схожа и отличается только одним доменом: у ADAMTS-5 есть дополнительный второй мотив тромбоспондина, следующий за спейсерным [4] (рис. 1).
Cигнальная последовательность – короткая аминокислотная последовательность в составе белка, которая обеспечивает котранс-ляционный или посттрансляционный транспорт белка в соответствующую органеллу. После доставки белка в органеллу сигнальный пептид может отщепляться под действием специфической сигнальной протеазы.
Домены имеют различные консервативные последовательности, которые играют ту или иную важную роль, которые известны на данный момент (см. рис. 2). Доменные участки, играющие важную роль в разрушении аг-грекана, представлены в таблице.
Продомен содержит три консервативных остатка Cys, обнаруженных в других ADAMTS [18; 34]. Первые два Cys находятся в консервативных последовательностях

Рис. 1. Структура белков ADAMTS-4 и -5
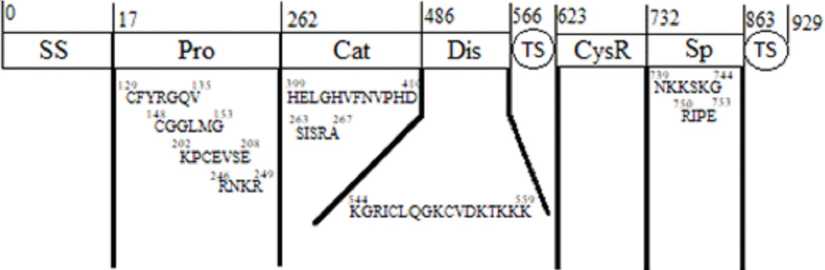
Рис. 2. Консервативные последовательности и участки доменов на примере ADAMTS-5
Краткая характеристика доменов ADAMTS-4 и ADAMTS-5
|
Наименование домена |
Сокращение |
Длина аминокислотной последовательности |
Участки доменов * |
|
Сигнальная область |
SS |
0–17 |
– |
|
Продомен |
Pro |
18–262 |
CFYRGQV (129–135) |
|
CGGLMG (148–153) |
|||
|
KPCEVSE (202–208) |
|||
|
RNKR (246–249) |
|||
|
Каталитический домен |
Cat |
263–486 |
HELGHVFNVPHD (399–410) |
|
Дезинтегринподобный домен |
Dis |
487–566 |
KGRICLQGKCVDKTKKK (544–559) |
|
Мотив тромбоспондина |
TS1, TS2 ** |
566–623, 864–929 ** |
– |
|
Богатый цистеином домен |
CysR |
624–732 |
– |
|
Спейсерный домен |
Sp |
733–863 |
NKKSKG (739–744) |
Список литературы Структурно-функциональная характеристика ADAMTS-4 и ADAMTS-5: обзор
- A Disintegrin and Metalloproteinase with Thrombospondin Motifs-5 (ADAMTS-5) Rormscatalytically Active Oligomers / H. J. Kosasih [et al.] // J Biol Chem. - 2016. - Vol. 291, №> 7. - P. 31973208. - DOI: https://doi.org/10.1074/jbc.M115.704817.
- ADAMTS4 Cleaves at the Aggrecanase Site (Glu373-Ala374) and Secondarily at the Matrix Metalloproteinase Site (Asn341-Phe342) in the Aggrecan Interglobular Domain / J. Westling [et al.] // J Biol Chem. - 2002. - Vol. 277, .№18. - P. 1605916066. - DOI: https://doi.org/10.1074/jbc.M108607200.
- ADAMTS-5 Deficiency Does not Block Aggrecanolysis at Preferred Cleavage Sites in the Chondroitin Sulfate-Rich Region of Aggrecan / C. J. East [et al.] // J Biol Chem. - 2007. - Vol. 282, № 12. - P. 86328640. - DOI: https://doi.org/10.1074/jbc.M605750200.
- ADAMTS-5 : the Story so Far / A. J. Fosang [et al.] // Eur Cell Mater. - 2008 - Vol. 15. - P. 11-26. -DOI: https://doi.org/10.22203/eCM.v015a02.
- ADAMTS-7: a Metalloproteinase that Directly Binds to and Degrades Cartilage Oligomeric Matrix Protein / C. J. Liu [et al.] // FASEB J. - 2006. -Vol. 20, № 7. - P. 988-990. - DOI: https://dx.doi.org/ 10.1096%2Ffj.05-3877fje.
- Adaptor Proteins and Ras Synergistically Regulate IL-1-Induced ADAMTS-4 Expression in Human Chondrocytes / R. Ahmad [et al.] // J Immunol. -2009. - Vol. 182, № 8. - P. 5081-5087. - DOI: https:// doi.org/10.4049/jimmunol.0803544.
- Aggrecan Degradation in Human Articular Cartilage Explants is Mediated by Both ADAMTS-4 and ADAMTS-5. / R. H. Song [et al.] // Arthritis Rheum. -2007. - Vol. 56, № 2. - P. 575-585. - DOI: https://doi.org/ 10.1002/art.22334.
- Aggrecanolysis in Human Osteoarthritis: Confocal localization and Biochemical Characterization of ADAMTS5-Hyaluronan Complexes in Articular Cartilages / A. Plaas [et al.] // Osteoarthritis Cartilage. -2007. - Vol. 15, № 7. - P. 719-734. - DOI: https://doi.org/ 10.1016/j .joca.2006.12.008.
- Apte, S. S. A Disintegrin-Like and Metalloprotease (Reprolysin-Type) with Thrombospondin Type 1 Motif (ADAMTS) Superfamily: Functions and Mechanisms / S. S. Apte // J Biol Chem. - 2009. - Vol. 284, № 46. - P. 3149331497. - DOI: https://doi.org/10.1074/jbc.R109.052340.
- Apte, S. S. Anti-ADAMTS5 Monoclonal Antibodies: Implications for Aggrecanase Inhibition in Osteoarthritis / S. S. Apte // Biochem J. - 2016. - Vol. 473, № 1. - P. e1-e4. - DOI: https://doi.org/10.1042/BJ20151072.
- Association Between the Abnormal Expression of Matrix-Degrading Enzymes by Human Osteoarthritic Chondrocytes and Demethylation of Specific CpG Sites in the Promoter Regions // H. I. Roach [et al.] // Arthritis Rheum. - 2005. - Vol. 52, № 10. -P. 3110-3124. - DOI: https://doi.org/10.1002/art.21300.
- Association of a nsSNP in ADAMTS14 to Some Osteoarthritis Phenotypes / J. Rodriguez-Lopez [et al.] // Osteoarthritis and Cartilage. - 2009. - Vol. 17, № 3. - P. 321-327. - DOI: https://doi.org/10.1016/ j.joca.2008.07.012.
- Autocatalytic Cleavage of ADAMTS-4 (Aggrecanase-1) Reveals Multiple Glycosaminoglycan-Binding Sites / C. R. Flannery [et al.] // J Biol. Chem. -2002. - Vol. 277, № 45. - P. 42775-42780. - DOI: https:// doi.org/10.1074/jbc.M605750200.
- Blocking Aggrecanase Cleavage in the Aggrecan Interglobular Domain Abrogates Cartilage Erosion and Promotes Cartilage Repair / C. B. Little [et al.] // J Clin Invest. - 2007. - Vol. 117, № 6. - P. 1627-1636. -DOI: https://dx.doi.org/10.1172%2FJCI30765.
- Cerda-Costa, N. Architecture and Function of Metallopeptidase Catalytic Domains / N. Cerda-Costa, F.X. Gomis-Rüth // Protein Sci. - 2014. - Vol. 23, № 2. - P. 123-144. - DOI: https://dx.doi.org/10. 1002%2Fpro.2400.
- Functional Differences of the Catalytic and Non-Catalytic Domains in Human ADAMTS-4 and ADAMTS-5 in Aggrecanolytic Activity / K. Fushimi [et al.] // J Biol Chem. - 2008. - Vol. 283, № 11. - P. 67066716. - DOI: https://doi.org/10.1074/jbc.M708647200.
- Genetic Variation Including Nonsynonymous Polymorphisms of a Major Aggrecanase, ADAMTS-5, in Susceptibility to Osteoarthritis / J. Rodriguez-Lopez [et al.] // Arthritis Rheum. - 2008. - Vol. 58, № 2. -P. 435-441. - DOI: https://doi.org/10.1002/art.23201.
- Gomis-Rüth, F. X. Catalytic Domain Architecture of Metzincin Metalloproteases / F. X. Gomis-Rüth // J Biol Chem. - 2009. - Vol. 284, № 23. - P. 15353-15357. - DOI: https://doi.org/10.1074/ jbc.R800069200.
- Gottschall, P. E. ADAMTS Expression and Function in Central Nervous System Injury and Disorders / P. E. Gottschall, M. D. Howell // Matrix Biology. - 2015. - Vol. 44, № 46. - P. 70-76. - DOI: https://doi.org/10.1016Zj.matbio.2015.01.014.
- Hooper, N. M. Families of Zinc Metalloproteases / N. M. Hooper // FEBS Lett. - 1994. -Vol. 354, № 1. - P. 1-6. - DOI: https://doi.org/10.1016/ 0014-5793(94)01079-X.
- Human Ehlers-Danlos Syndrome Type VII C and Bovine Dermatosparaxis are Caused by Mutations in the Procollagen I N-Proteinase Gene / A. Colige [et al.] // Am. J. Hum. Genet. - 1999. - Vol. 65. - P. 308317. - DOI: https://doi.org/10.1086/302504.
- Hyaluronan Inhibits Expression of ADAMTS4 (Aggrecanase-1) in Human Osteoarthritic Chondrocytes / T. Yatabe [et al.] // Ann Rheum Dis. -2009. - Vol. 68, № 6. - P. 1051-1058. - DOI: https:// dx.doi.org/10.1136%2Fard.2007.086884.
- Identification of Aggrecanase Activity in Medium of Cartilage Culture / K. Sugimoto [et al.] // J. Biochem. - 1999. - Vol. 126. - P. 449-455. - DOI: https://dx.doi.org/10.1136%2Fard.2007.086884.
- Induction of Aggrecanase 1 (ADAM-TS4) by Interleukin-1 Occurs Through Activation of Constitutively Produced Protein / M. A. Pratta [et al.]
- // Arthritis Rheum. - 2003. - Vol. 48, № 1. - P. 119133. - DOI: https://doi.org/10.1002/art.10726.
- Inhibition of ADAM-TS4 and ADAM-TS5 Prevents Aggrecan Degradation in Osteoarthritic Cartilage / A. M. Malfait [et al.] // J Biol Chem. - 2002. -Vol. 277, № 25. - P. 22201-22208. - DOI: https://doi.org/ 10.1074/jbc.M200431200.
- Lin, E. A. The Role of ADAMTSs in Arthritis /E. A. Lin, C. J. Liu// Protein & Cell. - 2010. -Vol. 1, № 1. -P. 33-47. - DOI: https://doi.org/10.1053/joca. 2001.0427.
- MMPs are Less Efficient than ADAMTS5 in Cleaving Aggrecan Core Protein / M. Durigova [et al.] // Matrix Biol. - 2011. - Vol. 30, № 2. - P. 145-153. - DOI: https://dx.doi.org/10.1016%2Fj.matbio.2010.10.007.
- Nagase, H. Aggrecanases and Cartilage Matrix Degradation / H. Nagase, M. Kashiwagi // Arthritis Res Ther. - 2005. - Vol. 5, № 2. - P. 94-103. - DOI: https:// dx.doi.org/10.1186%2Far630.
- Proteolytic Activities of Human ADAMTS-5: Comparative Studies with ADAMTS-4 / C. Gendron [et al.] // J Biol Chem. -2007. - Vol. 282, № 25. - P. 1829418306. - DOI: https://doi.org/10.1074/jbc.m701523200.
- Purification and Cloning of Aggrecanase-1: A Member of the ADAMTS Family of Proteins / M. D. Tortorella [et al.] // Science. - 1999. - Vol. 284, № 5420. - P. 1664-1666. - DOI: https://doi.org/10.1126/ science.284.5420.1664.
- Relative Messenger RNA Expression Profiling of Collagenases and Aggrecanases in Human Articular Chondrocytes in vivo and in vitro. / B. Bau [et al.] // Arthritis Rheum. - 2002. - Vol. 46, № 10. -P. 2648-2657. - DOI: https://doi.org/10.1002/art.10531.
- Roughley, P. J. The Role of Aggrecan in Normal and Osteoarthritic Cartilage / P. J. Roughley, J. S. Mort // Journal of Experimental Orthopaedics. -2014. - Vol. 1, № 8. - P. 1-11. - DOI: https://doi.org/ 10.1186/s40634-014-0008-7.
- Structural and Inhibition Analysis Reveals the Mechanism of Selectivity of a Series of Aggrecanase Inhibitors / M. D. Tortorella [et al.] // The Journal of Biological Chemistry. - 2009. - Vol. 284, № 36. -P. 24185-24191. - DOI: https://dx.doi.org/10.1074% 2Fjbc.M109.029116.
- Tang, B. L. ADAMTS: a Novel Family of Extracellular Matrix Proteases / B. L. Tang // The International Journal of Biochemistry & Cell Biology. -2019. - Vol. 33, № 1. - P. 33-44. - DOI: https://doi.org/ 10.1016/s1357-2725(00)00061-3.
- Tang, B.L. ADAMTS: a Novel Family of Proteases with an ADAM Protease Domain and Thrombospondin 1 Repeats / B. L. Tang, W. Hong // FEBS Lett. - 1999. - Vol. 445, № 2-3. - P. 223-225. - DOI: https:// doi.org/10.1016/s0014-5793(99)00119-2.
- The ADAMTS Metalloproteinases / S. Porter [et al.] // Biochem J. - 2005. - Vol. 386, № 1. - P. 15-27. -DOI: https://dx.doi.org/10.1042%2FBJ20040424.
- The Metzincins: A Superfamily of Structurally Related Metalloproteinases / W. Bode [et al.] // Zoology. - 1996. - Vol. 99, № 4. - P. 237-246. - DOI: https://doi.org/10.1026/jzo.6182.
- The Role of ADAM-TS4 (Aggrecanase-1) and ADAM-TS5 (Aggrecanase-2) in a Model of Cartilage Degradation / M. D. Tortorella [et al.] // Osteoarthritis Cartilage. -2001. - Vol. 9, № 6. - IP 539-552. - DOI: https:// doi/org/10.1053/joca.2001.0427.
- The Structure of Aggrecan Fragments in Human Synovial Fluid. Evidence for the Involvement in Osteoarthritis of a Novel Proteinase Which Cleaves the Glu373-Ala374 Bond of the Interglobular Domain / J. D. Sandy [et al.] // J Clin Invest. - 1992. - Vol. 89, №5. - P. 1512-1516. - DOI: https://dx.doi.org/ 10.1172%2FJCI115742.
- Transgenic Mice with Inactive Alleles for Procollagen N-Proteinase (ADAMTS-2) Develop Fragile Skin and Male Sterility / S. W. Li [et al.] // Biochem J. - 2001 - Vol. 355. - P. 271-278. - DOI: https://dx.doi.org/10.1042%2F0264-6021%3A3550271.
- Verma, P. ADAMTS-4 and ADAMTS-5: Key Enzymes in Osteoarthritis. / P. Verma, K. Dalal // J Cell Biochem. - 2011. - Vol. 112, № 12. - P. 3507-3514. -DOI: https://doi.org/10.1002/jcb.23298.
- Vertel, B. M. Aggrecan / B. M. Vertel, A. Ratcliffe // Proteoglycans: Structure, Biology and Molecular Interactions. - 2000. - P. 343-377. - DOI: https://doi.org/10.1002/jcb.23298.


