Структурно-функциональная характеристика бактериального консорциума, выделенного из техногенных почв Верхнекамского месторождения солей
Автор: Ястребова О.В., Кошелева И.А., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Из почвы района солеразработок (г. Березники, Пермский край), выделен бактериальный консорциум SMB1, способный к эффективному росту на нафталине в качестве единственного источника углерода и энергии в присутствии до 10% NaCl. В его состав входят два галотолерантных деструктора нафталина рода Arthrobacter (штаммы SMB145 =ВКМ Ac-2551, SMB11 =ВКМ Ac-2552), а также галотолерантный штамм Brevibacterium permense SMB14 (=ВКМ Ас-2280Т =LMG 22207Т) и галофильный штамм Chromohalobacter sp. SMB17, не утилизирующие нафталин. При совместном культивировании трех штаммов: Arthrobacter sp. SMB145, Brevibacterium permense SMB14 и Chromohalobacter sp. SMB17 на нафталине при повышенной минерализации среды (7% NaCl) наблюдались более высокие ростовые показатели штамма-деструктора Arthrobacter sp. SMB145 по сравнению с аналогичными данными, полученными при его культивировании индивидуально. Интенсивность дыхания бактериального консорциума SMB1 также была выше таковой штамма SMB145 при выращивании на нафталине в присутствии 5%-ного NaCl. Выделенный бактериальный консорциум SMB1 может быть рекомендован для разработки новых биотехнологий очистки загрязненных почв и стоков в условиях засоления.
Биодеградация, полициклические ароматические углеводороды, ассоциации бактерий, галотоле-рантные и галофильные бактерии
Короткий адрес: https://sciup.org/147204779
IDR: 147204779 | УДК: 579.262:57.083.18
Текст научной статьи Структурно-функциональная характеристика бактериального консорциума, выделенного из техногенных почв Верхнекамского месторождения солей
Полициклические ароматические углеводороды (ПАУ) относят к числу наиболее распространенных, экологически опасных, устойчивых соедине ний, накапливающихся в окружающей среде как в результате природных процессов, так и в результате промышленной деятельности человека. Способ-
(С Ястребова О. В., Кошелева И. А., Плотникова Е Г., 2016
ность к утилизации или трансформации ди- и три-кольцевых ароматических углеводородов (нафталин, фенантрен) обнаружена у многих природных бактерий [Cemiglia 1992; Habe, Omori, 2003]. В ряде случаев загрязнение почв и водоемов промышленными отходами. содержащими токсичные соединения сопровождается другими неблагоприятными факторами, в частности, повышенной концентрацией солей. В таких условиях возможность биодеградации ПАУ определяется устойчивостью бактерий к повышенной минерализации среды и способностью проявлять при этом биодеградатив-ные свойства.
Из высокоминерализованных сред, таких как моря, лиманы, солончаковые болота, морские осадки, пластовые воды нефтедобычи выделены галотолерантные и галофильные бактерии, способные разлагать алканы, моно- и полиароматические углеводороды в условиях повышенной солености среды (1.0-10%) [Dalvi et al.. 2012; Feng et al., 2012; Al-Mailem et al., 2013]. В литературе приводятся данные о способности штаммов родов ^г- hodom onas, Мarinobacter, Haiom on as, Cbrom o-halobacter к деструкции моноароматических углеводородов (бензола. толуола. фенола, бензоата, салицилата) в присутствии 1-10%^ного NaCl в среде культивирования [Kim et at. 2008: Berlendis ct at, 2010; Dalvi et aL 2012: Bonfa ct al.. 2013]. Бактериальная деструкция ПАУ, в частности нафталина, фенантрена и антрацена, при высокой солености среды (до 9% NaCl) описана для бактерий родов Micrococcus, Pseudomonas, Mannobacter, Marteleda, Arthrobacter [Плотникова и др,. 2001: Ashok et al.. 1995; Feng et al., 2012: Al-Mailem et al.. 2013].
В ряде исследований показано, что сообщества микроорганизмов, выделенные из засоленных почв, солончаковых болот, прибрежных зон, более эффективно утилизируют ПАУ в условиях высокого засоления среды, чем индивидуальные штаммы-деструкторы [Таш, 2002; Dastgheib et al., 2012; Moghadam ct al., 2014]. В составе бактериального консорциума Qplie, растущего на фенантрене в присутствии до 17% NaCl, выявлен штамм-деструктор фенантрена рода A/flrtrtoZwcter и штамм Halomonas sp., утилизирующий метаболиты фенантрена [Dastgheib et al., 2012]. На примере нафталин- и фенантрен- утилизирующих сообществ показано влияние повышенного засоления среды на филогенетический состав и активность ферментов ШТаММОБ-ДССТруКТОрОБ микробного КОНСОр-циума [Castle ct al.. 2006; Guo ct aL 2016].
Из почв района разработок Верхнекамского месторождения солей (г. Березники, Пермский край) нами были выделены и описаны галотолерантные бактерии родов Rhodococcus, Bacillus, Arthrobacter и Pseudomonas, способные к активной деструкции ПАУ (нафталина. фенантрена) при содержании 6-9% NaCl в ростовой среде [Плотникова и др., 2001. 2011]. Из образца засоленной почвы методом на копительного культивирования получена ассоциация бактерий (именуемая далее SMB1). растущая на нафталине как единственном источнике углерода и энергии б присутствии до 10% NaCl [Плотникова и др., 2001].
Цель настоящей работы - структурно-функциональная характеристика ассоциации бактерий SMB1, а также изучение влияния повышенных концентраций хлорида натрия на ростовые характеристики ассоциации и составляющих ее бактерий.
Материалы и методы исследования
Ассоциация бактерий, условия культивирования. Объектом исследования являлась ассоциа ция микроорганизмов SMB1, которая была изолирована методом накопительного культивирования из образца почвы, отобранной в районе солеразработок (г. Березники, Пермский край) [Плотникова и др., 2001]. Культивирование ассоциации проводили аэробно в 100 мл минеральной среды Раймонда [Розанова, Назина, 1982], содержащей нафталин (1 г/л) и 6% (вес/объем) NaCl, на термостатируемой качалке (100 об/мин) при 28°С. Последовательные пассажи ассоциации осуществляли каждые 2-3 недели путем выращивания при описанных выше условиях. Исследование данной ассоциации проводили после 2 месяцев культивирования.
Рост бактерий поддерживался в минеральной среде Раймонда с нафталином (штаммы SMB11 и SMB145), в полноценной среде Раймонда (штаммы SMB14 и SMB17X где в качестве субстратов использовались триптон («Sigma». Германия) и дрожжевой экстракт («Sigma». Германия) в концентрации 5 г/л и 2.5 г/л. соответственно. Содержание хлорида натрия в средах составляло 3%.
ДНК-1 инн рован не штаммов проводили методом REP-ПЦР (полимеразная цепная реакция повторяющихся экстрагенетических палиндромных последовательностей ДНК. как описано Vcrsalovic с соавт. [Vcrsalovic ct al., 1994].
Идентификация бактерии. Выделение то тальной ДНК бактерий проводили согласно работе М. Ferrero et al. [2002]. Для амплификации нуклеотидных последовательностей гена 16S рРНК использовали бактериальные праймеры 27F и 1492К а ПЦР проводили при условиях, описанных ЕЮ. Гавриш с соавт. [Гавриш и др., 2004]. Нуклеотидные последовательности гена 16S рРНК определяли с применением набора реактивов DYEiiamic ЕТ Dye Terminator Cy cle sequencing Kit на автоматическом секвенаторе Genetic analyser 35OOXL (Applied Biosystems. США) и сравнивали с таковыми типовых штаммов близкородственных видов из базы данных GenBank с помощью программы CLUSTAL W.
Параметры роста бактерии в составе ассоциации SMB1 и индивидуально оценивали при выра щивании их в жидкой минеральной среде Раймонда при 2 8 °C с нафталином в качестве субстрата (1 г/л). При инкубировании бактерий на минеральной агаризованной среде (1.5%) нафталин добавляли в крышку перевернутой чашки Петри. Оптическую плотность (ОП) культуральной жидкости определяли на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при 600 нм и толщине кюветы 0.5 см. Количество колониеобразутощих единиц (КОЕ) определяли методом серийных разведении с последующим высевом и подсчетом колоний бактерий на чашках с агаризованной богатой средой Раймонда* Количество хлорида натрия в средах культивирования варьировали от 0 до 10%.
Для изучения взаимного влияния штаммов на характер роста в составе ассоциации проводились эксперименты по их совместному культивированию в жидкой минеральной среде Раймонда с нафталином (1 г/л) в качестве единственного источника углерода и энергии в присутствии 3, 5 и 7% NaCl. В качестве посевного материала исполыювали суспензии штаммов Arthrobacter sp. SMB 145* В. permense SMB 14 и SMB 17 в экспоненциальной фазе роста с тигром клеток около 104 КОЕ. Морфологические различия колоний штаммов позволили исследовать особенности роста отдельных штаммов в составе ассоциации. КОЕ каждого штамма определяли методом серийных раз-ведений с последующим высевом и подсчетом колоний бактерий на чашках с агаризованной полноценной средой Раймонда.
Интенсивность дыхания бактерий измеряли с использованием респирометра Micro-Oxymax respirometer (Columbus Instruments International Corp. Columbus* ОН). Накопление CO? и потребление O2 измерялось сенсорами одновременно через определенные интервалы времени. В ходе эксперимента использовались 250-мл флаконы. содержащие 100 мл минеральной среды Раймонда и нафталин в качестве субстрата в концентрации 0*5 мг/мл. Содержание хлорида натрия в среде культивирования составляло 0 и 5%* В качестве посевного материала использовали суспензии штаммов Arthrobacter sp. SMB 145, В. permease SMB 14 и SMB 17 в экспоненциальной фазе роста с титром клеток около К)4 КОЕ.
Результаты и их обсуждение
Выделение и состав бактериального сообщества SMB1. Сообщество микроорганизмов SMBL выделенное из почвы района солеразработок (г. Березники, Пермский край), способно к эффективное росту на нафталине в качестве единственного источника углерода и энергии в присутствии до 10% NaCl. Установлен состав консорциума SMB1: грамположительные бактерии-деструкторы нафталина - Arthrobacter sp. SMB 11 и Arthrobacter sp SMB 145. а также штаммы Brevibacterium sp. SMB 14 и Chromohaiohacier sp. SMB 17. не способные утилизировать нафталин*
Грамположительный штамм SMB14 образовывал матовые колонии, которые на свету приобретали ярко-оранжевую окраску. На основании проведенных исследований штамм SMB14 был описан как новый вид Brevibacterhun permease (=ВКМ Ас-2 2 801) [Гавриш и др*. 2004]* Данный штамм способен к росту на бензойной и пара-оксмбензойнои кислотах как единственном источнике углерода и энергии. В. permease SMB 14 растет на полноценной среде Раймонда как без добавления NaCl, так и при повышенной концентрации соли - до 12% (таблица).
Рост микробного сообщества SMB1 и индивидуальных штаммов на агаризованной минеральной среде Раймонда в присутствии разных концентраций NaCl
|
Штамм |
Рост на минеральной среде с нафталином |
Рост на полноценной среде |
||||||||||
|
Без NaCl |
3% |
7% |
10% |
14% |
Без NaCl |
3% |
6% |
12% |
18% |
24% |
29% |
|
|
SMBll |
+ |
+ |
+ |
— |
— |
+ |
+ |
+ |
+ |
— |
— |
— |
|
SMB 145 |
+ |
+ |
— |
— |
+ |
+ |
+ |
+ |
— |
— |
— |
|
|
SMB14 |
— |
— |
— |
— |
— |
+ |
+ |
+ |
+ |
— |
— |
— |
|
SMB17 |
— |
— |
— |
— |
— |
— |
+ |
+ |
+ |
4- |
± |
+ |
|
SMI* |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
± |
+ |
Примечание. «+» - рост (колонии размером 1-3 мм); «±» - слабый рост (колонии размером менее 1 мм); «-» -отсутствие роста бактерий
Штамм SMB17 при росте на полноценной агаризованной среде образует прозрачные, плоские колонии желтоватого цвета. Клетки - подвижные палочки. Грамотрицательный, аэроб, катал азо- и оксидазоположителен. Растет на средах при 3-29% NaCl и не растет в отсутствии соли, те. является га лофильным микроорга низмом [Ка шнер, 1981] (таблица). Сравнительный анализ нуклеотидной последовательности 16S рДНК (около 1470 п.н.) показал, что штамм входит в филогенетический кластер, включающий представителей рода Chro-mohaiobacter, наиболее близок (около 99%) к Chromohalobacter canadensis АТСС 43984т [Arahal et al.. 2001 ], Ch rom oh alobacter b eijermckt / ATCC 19372T [Pe^onek et al, 2006] и Chromohalobacter japonic us [Sanchez-Porro et* al*. 2007]. Дан- ный штамм растет в минеральной среде с бензойной и /1<7/?<7-оксибензойной кислотами в качестве субстрата*
Штаммы SMB11 и SMB145 на коринс-бак-тсриальном агаре образовывали круглые ровные* выпуклые, блестящие светло-желтые колонии. Изучение физиолого-биохимических и генетических характеристик позволили отнести вышеперечисленные штаммы к роду Arthrobacter (группе «А. globijormis») [Определитель..., 1997], Анализ нуклеотидных последовательностей гена 16S рРНК штаммов (около 1400 п.н.) выявил 99.7%-ное сходство со штаммом A. crvsiaUopoletes DSM 20117т [Ensign. Rittenberg, 19631. В то же время, штаммы SMB11 и SMB145 отличались морфологическими характеристиками (цвет, размер колоний при выращивании на полноценной среде Раймонда). Проведенный анализ REP-ПЦР профилей показал различия в организации геномов этих штаммов, что указывают на неидентичность изо-лятов(рис. 1).
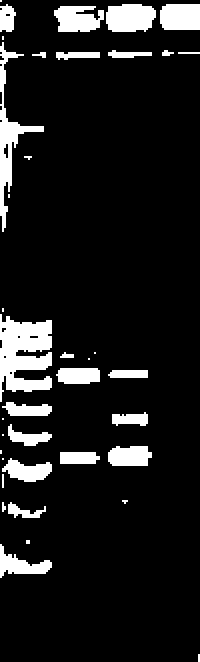
М 1 2
Рис. L Электрофореграмма продуктов амплификации REP-ПЦР штаммов Arthrobacter spp, выделенных из сообщества микроорганизмов SMB1:
М - маркер 1 kb («Силекс», Россия), 1 -SMB145, 2 - SMB11
Штаммы-деструкторы Arthrobacter spp. SMB 11 и SMB 145 являются галотолерантными микроорганизмами: растут на полноценной среде как в отсутствии, так и в присутствии NaCl (до 12%) [Кашнср, 1981]. На полноценной среде Раймонда данные штаммы способны к росту при концентрации NaCl от 0 до 12% (таблица).
Кроме того, штаммы Arthrobacter sp. SMB11, SMB 145 растут на нафталине и фенантрене в качестве единственного источника углерода и энергии при концентрации до 7% NaCl. Данные штаммы способны использовать в качестве субстрата также салицилат, бензоат, л^^-гидроксибензоат, орто- фталевую кислоту* ацетат.
К настоящему времени имеются ограниченные сведения о микроорганизмах, осуществляющих дс-струкцию ПАУ в условиях высокой минерализа ции среды* Большинство подобных микроорганизмов-деструкторов было выделено из нефтезагрязненных морских отложений и воды И ОТНОСЯТСЯ к грамотрицательным бактериям [Dastghcib et al*, 2012; Feng ct al** 2012; Al-Mailein ct al** 2013]. Описаны га л ого лерантные грам положительные бактерии родов Bacillus, Paembaciilus, Micrococcus, утилизирующие ПАУ* в частности нафталин, при солености среды 0-10%, [Ashok et al., 1995; Kumar et al., 2007]. Ранее нами были обнаружены и охарактеризованы бактерии-деструкторы нафталина и фенантрена родов Rhodococcus, Bacillus, Arthrobacter и Pseudomonas. утилизирующие ПАУ в присутствии NaCl до 6% [Плотникова и др., 2001; Ястребова и др., 2008; Anan'ina et al., 2 011].
Рост ассоциации бактерий SMB1 и штам-мов-дсструкторов на нафталине при повышенной солености среды* При росте ассоциации на агаризоваиной минеральной среде в парах нафталина наблюдалось формирование биопленки на агаре при содержании хлорида натрия до 14% (таблица). В то же время, эффективный рост сообщества в жидкой минеральной среде на нафталине как единственном источнике углерода и энергии был зафиксирован при содержании соли не более 8%. Наибольшие показатели роста сообщества были установлены в отсутствие NaCl в ростовой среде (ОД54о=0.66 оптических единиц), тогда как в присутствии 5, 7 и 8%-ного NaCl оптическая плотность культуры уменьшалась и достигала 0.25, 0.19 и 0.11 оптических единиц, соответственно.
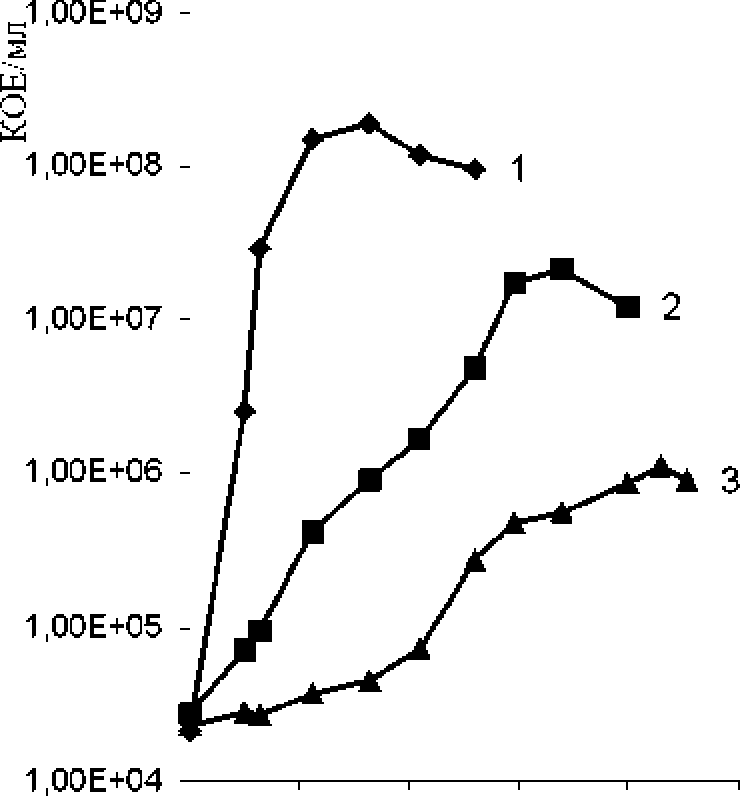
Штаммы Arthrobacter sp. SMB 11 и SMB 145 растут на агаризоваиной и в жидкой минеральных средах с нафталином в качестве субстрата, как без соли, так и при содержании до 7% NaCl в среде культивирования (таблица). Кривые роста штамма Arthrobacter sp* SMB 145 на среде с нафталином в присутствии различных концентраций хлорида натрия представлены на рис* 2. Наибольший титр клеток (l*9xlOs) достигается при отсутствии соли в среде культивирования, тогда как при 5%-ного NaCl максимальное число КОЕ - 2.1-1O7. а при 7% - l.lxlO6* Максимальная скорость роста в отсутствие соли наиболее высокая и составляет 0*15 ч"1* тогда как в присутствии 5 и 7%-ного NaCl достигает 0*024 и 0*02 ч"1* соответственно. Таким образом, повышение концентрации соли в среде отрицательно влияет на ростовые характеристики Arthrobacter sp. SMB 145 при выращивании на нафталине. Негативное влияние высокой солености среды на бактериальную деструкцию ПАУ может объясняться снижением растворимости ароматических углеводородов и доступности кислорода, а также ингибированием метаболических процессов бактериальных клеток при высокой минерализации среды [McGenity, 2010; Martins, Peixoto, 2012; Guo et al, 2016].
Рост штаммов на нафталине в составе ассоциации (модельный эксперимент). Изучены ростовые характеристики штаммов микробной ассоциации Arthrobacter sp. SMB 145, Brevibacterium per-mense SMB 14 и Chranohalobacter sp. SMB 17 при культивировании в минеральной среде Раймонда на нафталине в качестве единственного источника углерода и энергии в присутствии 7% соли. Установлено, что у штамма Arthrobacter sp. SMB 145 происходило увеличение ростовых параметров при культивировании в сообществе, по сравнению с ростом чистой культуры при тех же условиях (рис. 2. 3). Максимальное значение КОЕ штамма достигало 3.4x107 за 190 ч. культивирования в сообществе (рис. 3). в то время как при росте индивидуальной культуры -1. 1х Ю6 за 215 ч. (рис. 2).
0 50 1 00 1 50 200 250
Время, ч
Рис. 2, Рост штамма.4 rihrobacier sp.
SMB 145 в минеральной среде Раймонда на нафталине в присутствии различных концентраций NaCk
1 - без соли, 2 - 5% NaCI, 3 - 7% NaCI
В ряде исследований показана более эффективная деструкция ПАУ бактериальными сообществами, чем индивидуальными штаммами-деструкторами в тех же условиях вследствие более широкой субстратной специфичности и снижения концентрации токсичных метаболитов в процессе ко-метаболизма бактерий микробных сообществ [Casellas et al., 1998; Moghadam et ak, 2014].
Интересно, что в эксперименте со смешанной культурой у В. perntense SMB 14 происходило увеличение значения КОЕ с 9.8x10" до 1.7x10' (рис. 3), в то время как при индивидуальном культивировании штамма на нафталине, как единственном источнике углерода и энергии, роста не наблюдалось.
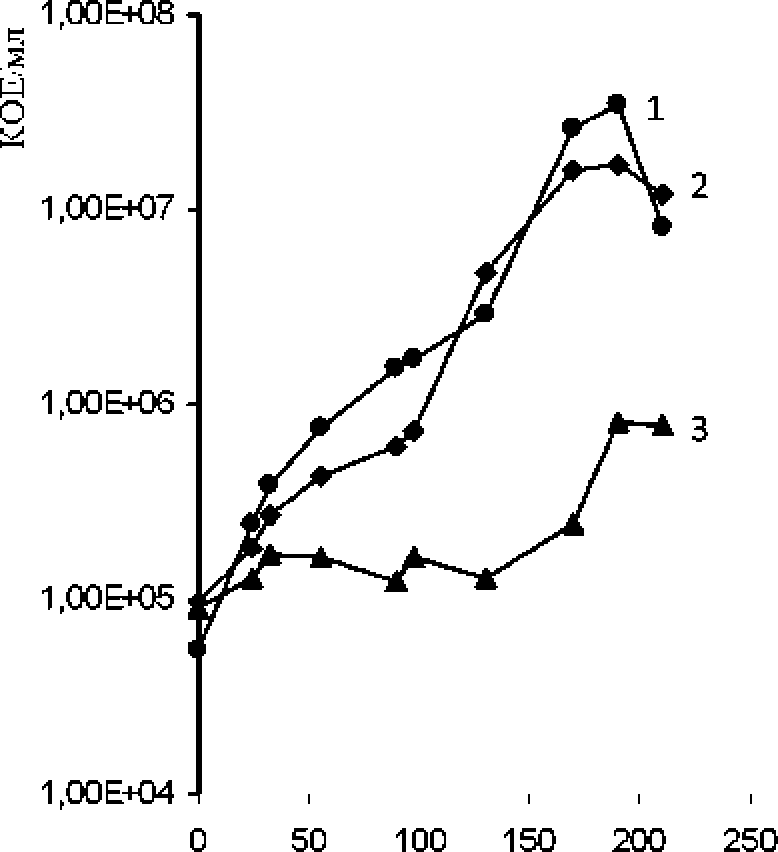
Бремя, ч
Рис. 3* Рост штаммов бактериального сообщества SMB1 в минеральной среде Раймонда на нафталине в присутствии 7%-ного
NaCI:
1 -Arthrobacter sp. SMB 145,2 -Brevibactenum permense SMB 14; 3 - Chrotnohalobacter sp. SMB 17
Количество клеток галофильного штамма Chromuhalubacter sp. SMB 17 увеличивалось не более чем на порядок: с 9.1х104до 8.0x10^ (рис. 3). Данный штамм не способен к деструкции нафталина. однако стабильно поддерживается в данной наспал ин-деградирующей микробной ассоциации. Как показали Tagger с соавторами. в состав наф-талин-утилизирующего м икробного сообщества входят бактерии, способные к росту на нафталине, а также бактерии, использующие в качестве ростового субстрата ряд органических кислот образующихся штаммами-деструкторами при росте на на^палине [Tagger el ak. 1990]. Можно предположить. что клетки галофильного штамма Chronto-halobacler sp. SMB 17 из исследуемого консорциума поддерживают свое существование в сообществе за счет продуктов метаболизма, накапливаемых в среде культивирования штаммами-деструкторами при росте на нафталине. а также лизиса клеток бактерий.
Интенсивность дыхания бактерий. В ряде исследований показана положительная корреляция между уровнем накопления углекислого газа и такими параметрами, как степень и скорость утилизации ПАУ [Bouchez et ak, 1997; Zaidi, Imam, 1999]. Как показывает суммарное накопление углекислого газа (рис. 4), бактериальное сообщество SMB1 осуществляет более интенсивную деструкцию нафталина, по сравнению с индивидуальной ку лыурой Arthrobacter sp. SMB145.
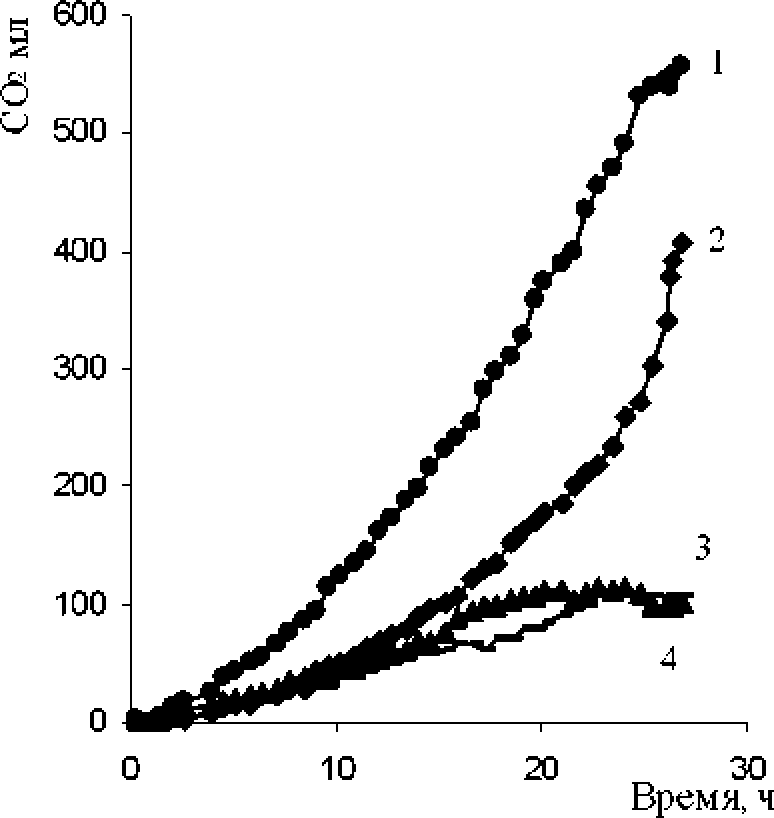
Рис. 4. Суммарное накопление СО2 (мл) при выращивании бактериального сообщества SMB1 и чистых культур в минеральной среде Раймонда с нафталином (0,5 мг/мл) в присутствии 5%-ного NaCL
1 - SMB1; 2 - SMB145; 3 - SMB14; 4 - контроль (среда Раймонда, нафталин)
При выращивании штамма Brevibacienum рег-mense SMB 14 накопление углекислого газа остается на уровне контроля. ЧТО свидетельствует об отсутствии деструкции нафталина данной культурой.
Время, ч
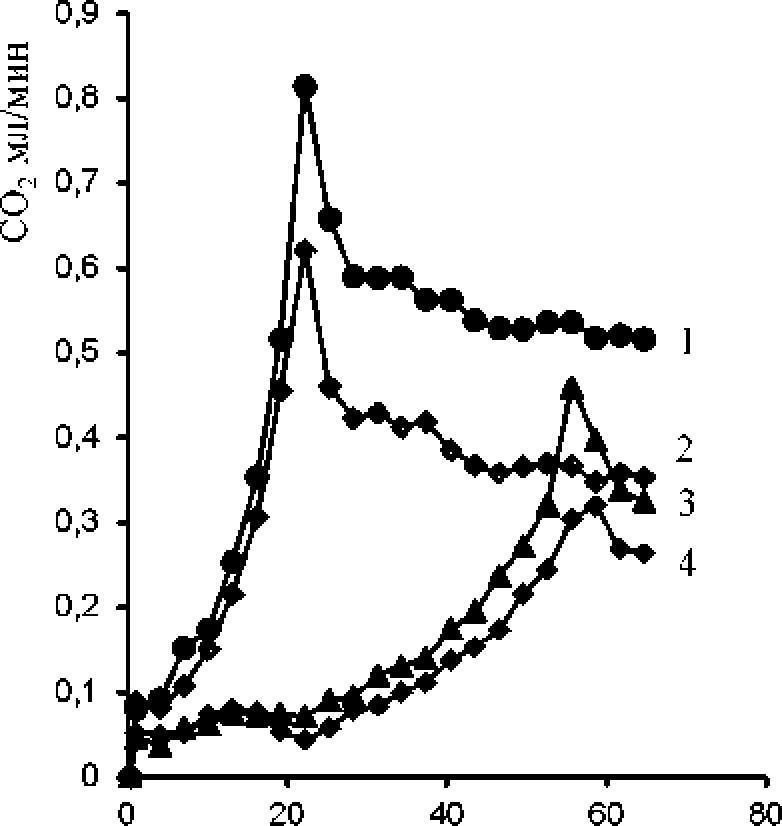
Рис. 5. Удельная скорость выделения СО2 бактериального сообщества SMB1 и штамм-ма SMB145 при выращивании в минеральной среде Раймонда с нафталином (0.5 мг/мл) и разной концентрацией NaCl:
1 - SMB1 (0% NaCl); 2 - SMB 145 (0% NaCl); 3 -SMB1 (5% NaCl); 4 - SMB 145 (5% NaCl)
Удельная скорость выделения CO2 бактериального сообщества SMB1 была на 24% выше таковой штамма SMB145 в среде без добавления соли и на 30% выше в среде с 5%-ного NaCl (рис. 5), что также свидетельствует о более эффективной деструкции нафталина сообществом SMB1 по сравнению со штаммом-деструктором Arthrobacter sp. SMB145.
Заключение
Выделенный бактериальный консорциум SMB1, растущий на нафталине как единственном источнике углерода в присутствии до 10% NaCl, включает два галоголерантных штамма-деструктора нафталина рода^гйго^^с/е/* (штаммы SMB11, SMB145), а также галотолерантный штамм Brevibacterium perntense SMB 14 и галофил ьный штамм Chromohatobacter sp. SMB 17. не утилизирующие нафталин. В результате исследований установлено. что штамм-деструктор Arthrobaaer sp. SMB 145 менее эффективно растет на нафталине в условиях повышенного засоления Среды при культивировании индивидуально, чем в составе бактериального сообщества SMBL Можно предположить положительное влияние экзо-метаболитов галофильного штамма обладающих осмопротекторными свойствами, таких как сахара, аминокислоты и их производные [Келлэм et al, 199SJ. на способность штаммов-деструкторов к росту и утилизации нафталина при повышенном засолении среды. В то же время штаммы сообщества, не утилизирующие нафталин, могут использовать в качестве субстрата метаболиты нафталина, выделяемые штаммами-деструкторами в среду ку л ьтивирова ния
Помимо вышеописанной микробной ассоциации, из образцов почв, отобранных в районе солеразработок, было выделено еще несколько сообществ микроорганизмов, также деградирующих ПАУ при повышенных концентрациях хлорида натрия. В состав этих сообществ также входили га-лотолерантные бактерии-деструкторы ПАУ и сопутствующие галофильные и/или галотолерантные бактерии [Ананьина и др., 2005: Ананьина и др., 2007]. прослеживается закономерность формирования в экосистемах с повышенным содержанием солей устойчивых аэробных микробных ассоциаций, способных использовать как источник углерода и энергии сложные органические соединения (нафталин) в условиях засоления. Изучение таких микробных сообществ, имеющих большой потенциал для использования их при биоремедиации засоленных почв, загрязненных полициклическими ароматическими углеводородами, внесет существенный вклад в понимание механизмов взаимоотношений отдельных штаммов микробного сообщества.
Работа поддержана грантом РФФИ-Урал № 16-44-590968 р_а.
Список литературы Структурно-функциональная характеристика бактериального консорциума, выделенного из техногенных почв Верхнекамского месторождения солей
- Ананьина Л.Н., Алтынцева О.В., Плотникова Е.Г. Изучение сообщества микроорганизмов, выделенного из района солеразработок//Bестник Пермского университета. 2005. Bi>ni. 6. Биология. С. 109-114
- Ананьина Л.Н. и др. Salinicola socius gen. nov., sp. nov. -новая умеренно галофильная бактерия из ассоциации микроорганизмов, утилизирующей нафталин//Микробиология. 2007. Т. 76, № 3. С. 369-376
- Гавриш Е.Ю. и др. Три новых вида бревибактерий -Brevibacterium antiquum sp. nov., Brevibacterium aurantiacum sp. nov. и Brevibacterium permense sp. nov.//Микробиология. 2004. Т. 73, № 2. C. 218-225
- Кашнер Д. Жизнь микробов в экстремальных условиях. М.: Мир. 1981. 365 с
- Определитель бактерий Берджи: пер. с англ./под ред. Дж. Хоулта и др. М.: Мир. 1997. Т. 1, 2
- Плотникова Е.Г. и др. Бактерии-деструкторы полициклических ароматических углеводородов, выделенные из почв и донных отложений района солеразработок//Микробиология. 2001. Т. 70, № 1. С. 61-69
- Плотникова Е.Г. и др. Галотолерантные бактерии рода Arthrobacter -деструкторы полициклических ароматических углеводородов//Экология. 2011. № 6. С. 459-466
- Розанова Е.П., Назина Т.Н. Углеводородокисляю-щие бактерии и их активность в нефтяных пластах//Микробиология. 1982. Т. 51. С. 324-348
- Ястребова О.В., Ананьина Л.Н., Плотникова Е.Г. Бактерии рода Bacillus, выделенные из почв района солеразработок//Bестник Пермского университета. 2008. Bi>ni. 9 (25). Биология. С. 58-62
- Anan'ina L.N. et al. Naphthalene-degrading bacteria of the genus Rhodococcus from the Verkhne-kamsk salt mining region of Russia//Antonie Van Leeuwenhoek. 2011. Vol. 100, Is. 2. P. 309316
- Al-Mailem D.M., Eliyas M., Radwan S.S. Oil-bioremediation potential of two hydrocarbonoclas-tic, diazotrophic Marinobacter strains from hy-persaline areas along the Arabian Gulfcoasts//Extremophiles. 2013. Vol. 17. P. 463-470
- Arahal D.R. et al. Transfer of Halomonas canadensis and Halomonas israelensis to the genus Chromo-halobacter as Chromohalobacter canadensis comb. nov. and Chromohalobacter israelensis comb. nov.//Int J Syst Evol Microbiol. 2001. Vol. 51. P. 1443-1448
- Ashok, T., Saxena, S., Musarrat J. Isolation and char acterization of four polycyclic aromatic hydrocarbon degrading bacteria from soil near an oil refinery//Lett. Appl. Microbiol. 1995. Vol. 21, Is. 4. P. 246-248
- Berlendis S. et al. First evidence of aerobic biodegra-dation of BTEX compounds by pure cultures of Marinobacter//Appl. Biochem. Biotechnol. 2010. Vol. 160. P. 1992-1999
- Bonfa M.R.L. et al. Phenol degradation by halophilic bacteria isolated from hypersaline environments//Biodegradation. 2013. Vol. 24. P. 699-709
- Bouchez M., Blanchetl D., Vandecasteele J.-P. An interfacial uptake mechanism for the degradation of pyrene by a Rhodococcus strain//Microbiology. 1997. Vol. 143. P. 1087-1093
- Casellas M. et al. Isolation and characterization of a fluorine-degrading bacterial strain and its role in synergistic degradation of fluorene by a consortium//Can. J. Microbiol. 1998. Vol. 44. P. 734742
- Castle D.M., Montgomery M.T., Kirchman D.L. Effects of naphthalene on microbial community composition in The Delaware estuary//FEMS Microbiol. Ecol. 2006. Vol. 56. P. 55-63
- Cerniglia C.E. Biodegradation of polycyclic aromatic hydrocarbons//Biodegradation. 1992. Vol. 3. P. 351-368
- Dalvi S., Azetsu S., Patrauchan M.A., Aktas D.F., Fa-thepure B.Z. Proteogenomic elucidation of the initial steps in the benzene degradation pathway of a novel halophile, Arhodomonas sp. Strain Rozel, isolated from a hypersaline environment//Appl. Environ. Microbiol. 2012. Vol. 78. P. 7309-7316
- Dastgheib S.M.M. et al. Biodegradation of polycyclic aromatic hydrocarbons by a halophilic microbial consortium//Appl. Microbiol. Biotechnol. 2012. Vol. 95. P. 789-798
- Ensign J.C., Rittenberg S.C. A crystalline pigment produced from 2-hydro-xypridine by Arthrohacter crvstallopoites n.sp.//Arch.Mikrobiol. 1963. Vol. 47. P. 137-153
- Ferrero M. et al.. Coexistence of two distinct copies of naphthalene degradation genes in Pseudomonas strains isolated from the western mediterranean region//Appl. Environ. Microbiol. 2002. Vol. 68. P. 957-962
- Guo G. et al. Effect of salt contents on enzymatic activities and halophilic microbial community structure during phenanthrene degradation//International Biodeterioration & Biodegradation. 2016. Vol. 110. P. 8-15
- Habe H., Omori T. Genetics of Polycyclic Aromatic Hydrocarbon Metabolism in Diverse Aerobic Bacteria//Biosci. Biotechnol. Biochem. 2003. Vol. 67, № 2. P. 225-243.
- Kim, D. et al. Molecular cloning and functional characterization of the genes encoding benzoate and p-hydroxybenzoate degradation by the halophilic Chro-mohalobacter sp. strain HS-2//FEMS Microbiol. Lett. 2008. Vol. 280. P. 235-241
- Kumar M. et al. A halotolerant and thermotolerant Bacillus sp. degrades hydrocarbons and produces tensionactive emulsifyingagent//World J. Microbiol. Biotechnol. 2007. Vol. 23. P. 211-220
- Martins L.F., Peixoto R.S. Biodegradation of petroleum hydrocarbons in hypersaline environments//Brazilian Journal of Microbiology. 2012. P. 865872
- McGenity T.J. Halophilic hydrocarbon degraders. In: K. N. Timmis (ed). Handbook of Hydrocarbon and Lipid Microbiology. Berlin: Springer-Verlag, 2010. P. 1939-1951
- Moghadam M.S. et al. Biodegradation of polycyclic aromatic hydrocarbons by a bacterial consortium enriched from mangrove sediments//Journal of Environmental Health Science & Engineering. 2014. 12:114 URL: http://www.ijehse.com/content/12/1/114
- Pec,onek J. et al. Reclassification of Pseudomonas beijerinckii Hof 1935 as Chromohalobacter bei-jerinckii comb. nov., and emended description of the species//Int. J. Syst. Evol. Microbiol. 2006. Vol. 56. P. 1953-1957.
- Sanchez-Porro C. et al. Chromohalobacter japonicus sp. nov., a moderately halophilic bacterium isolated from a Japanese salty food//Int. J. Syst. Evol. Microbiol. 2007. Vol. 57. P. 2262-2266
- Tagger S., Truffaut N., Le Petit J. Preliminary study on relationship among strains forming a bacterial community selected on naphthalene from a marine sediment//Can. J. Microbiol. 1990. Vol. 36. P. 676-681
- Ventosa A., Nieto J. J., Oren A. Biology of moderately halophilic aerobic bacteria//Microbiology and Molecular biology reviews. 1998. Vol. 62, № 2. P. 504-544
- Versalovic J., Schneider M., de Bruijn F.J. Genomic fingerprinting of bacteria using repetitive sequence based polymerase chain reaction//Meth. Mol. Cell. Biol. 1994. Vol. 5. P. 25-40
- Zaidi B.R., Imam S.H. Factors afecting microbial degradation of Polycyclic Aromatic Hydrocarbon phe-nanthrene in the Caribbean Coastal Water//Marine Pollution Bulletin. 1999. Vol. 38, № 8. P. 737-742
- Feng T.-C. et al. Phenanthrene biodegradation by halophilic Martelella sp. AD-3//Journal of Applied Microbiology. 2012. Vol. 113. P. 779-789.
- Tam N.F. et al. Preliminary study on biodegradation of phenanthrene by bacteria isolated from mangrove sediments in Hong Kong.//Mar. Pollut. Bull. 2002. Vol. 45. P. 316-324


