Структурно-функциональная характеристика фотосинтетического аппарата галофитов, отличающихся по типу накопления солей
Автор: Розенцвет Ольга Анатольевна, Нестеров Виктор Николаевич, Богданова Елена Сергеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Наземные экосистемы
Статья в выпуске: 3-7 т.15, 2013 года.
Бесплатный доступ
Исследовали структурные (состав и содержание липидов) и функциональные (концентрация хлорофиллов a и b, каротиноидов, соотношение хлорофиллов a/b, соотношение хлорофиллы/каротиноиды, доля хлорофиллов в ССК) особенности фотосинтетического аппарата эвгалофитов, криногалофитов и гликогалофитов. Установлено, что разделение растений по соленакапливающему признаку поддерживается различным соотношением содержания пигментов и липидов, а вариации в их содержании позволяют судить об экологической пластичности фотосинтетического аппарата галофитов в условиях засушливого климата и высокого содержания солей в почве.
Галофиты, регуляция солевого обмена, пигменты, липиды, вариативность
Короткий адрес: https://sciup.org/148202183
IDR: 148202183 | УДК: 577.125.528
Текст научной статьи Структурно-функциональная характеристика фотосинтетического аппарата галофитов, отличающихся по типу накопления солей
О дним из главных экологических факторов, который лимитирует рост и продуктивность многих растений является засоление почв [6, 23]. Известно, что ионы солей в высоких концентрациях могут дезинтегрировать клеточные мембраны, подавлять активность ферментов и приводить к нарушению таких жизненно важных функций как клеточное деление, ассимиляция углерода, поглощение элементов минерального питания и др. [2]. Галофиты, как правило, успешно растут и развиваются даже при высоком содержании солей в почве, благодаря молекулярно-генетическим особенностям, обуславливающим специфичные защитные механизмы [9, 19].
Основой биопродуктивности растений является хорошо функционирующий процесс фотосинтеза, неразрывно связанный с мембранами хлоропластов. Функциональная активность пигмент-белковых комплексов фотосинтетического аппарата (ФА), зависит от организации мембран тилакоидов, в которые они погружены [28]. Критериями оценки функционирования ФА являются содержание и соотношение хлорофиллов (Хл) a и b , доля хлорофиллов в ССК, содержание каротиноидов [18]. Основными компонентами мембран тилакоидов являются галактолипиды - монога-лактозилдиацилглицерол (МГДГ) и дигалакто-зилдиацилглицерол (ДГДГ), сульфолипид суль-фохиновозилдиацилглицерол (СХДГ) и фосфати-дилглицерол (ФГ) [13, 25, 28].
Исследованиями последних лет установлена специфичность состава липидов отдельных субъединиц фотосистем (ФС) I и II, а также специализированная роль отдельных классов липидов в процессе фотосинтеза [10, 15, 16, 28]. Например,
МГДГ создает условия для функционирования виолаксантин-деэпоксидазы – фермента, осуществляющего на свету превращение виолаксантина в зеаксантин [14]; а ФГ способствует тримериза-ции мономеров светособирающего комплекса (ССК), что влияет на формирование гран; ДГДГ поддерживает структуру полипептидных комплексов реакционного центра ФС II [11, 26]; сульфолипид стабилизирует белковые комплексы, участвующие в транспорте электронов, и АТФ-синтазы, осуществляющей синтез АТФ [20, 22, 24].
Эффективность работы пигментной системы зависит от соответствия ее структуры и функций климатическим и/или экологическим условиям. Тесное взаимодействие пигмент-белковых комплексов с липидным окружением дает основание предполагать, что существует определенная связь между количественным содержанием гликолипидов (ГЛ) и пигментов в листьях растений, обусловленная как совокупным действием абиотических факторов внешней среды, так и особенностями вида растений. Сведения об изменениях, происходящих в пигментном и липидном комплексе дикорастущих галофитов, различающихся типом регуляции солевого обмена, практически отсутствуют. С этой точки зрения представляют интерес галофиты, произрастающие в регионах с экстремальными условиями обитания. Таким регионом, в частности, является бассейн оз. Эльтон (Приэльтонье), климатические условия которого отличаются широкой амплитудой температурного режима (от –50°С зимой до +50°С – летом), а также крайне низким количеством осадков.
Цель настоящей работы – изучить структурнофункциональные особенности фотосинтетического аппарата галофитов, отличающихся по механизмам регуляции солевого обмена, в связи с условиями произрастания.
МАТЕРИАЛ И МЕТОДИКА
Район исследования расположен на территории Волгоградской области, характеризуется близостью залегания грунтовых вод, засоленностью почвогрунтов, что обуславливает формирование солончаковости и солонцеватости почв и определенного типа растительности [3]. Растительный материал отбирали в первой половине дня в середине июня 2012 г. Было заложено 5 площадок (20 х 20 м), расположенных в устьевых участках рек Чернавка (49°12´с.ш., 44°40´в.д.), Ланцуг (49°12´с.ш., 46°38´в.д.), Хара (49°12´с.ш., 46°39´в.д.), Солянка (49°10´с.ш., 46°35´в.д.), Большая Смарогда (49°07´с.ш., 46°50´в.д.).
Объектами исследования были выбраны представители эвгалофитов – Suaeda salsa (L.) Pall. и Salicornia perennans Willd. из семейства Cheno-podiaceae , криногалофитов – Limonium gmelinii (Willd.) O. Kuntze из семейства Plumbaginaceae , гликогалофитов – Artemisia santonica L. из семейства Asteraceae .
Для биохимических анализов использовали 10–12 листьев среднего яруса из 15–20 растений (в случае S. perennans – среднюю часть побега), произрастающих в пределах одного биотопа. Из объединенной биомассы растений одного вида составляли три независимых биологических пробы и использовали для анализов. Одновременно отбирали пробы почвы на глубине 15–20 см для определения кислотности, влажности и минерального остатка почвенной вытяжки [1].
Экстракцию, идентификацию, анализ липидов и пигментов проводили, как описано ранее [4]. В таблицах и рисунках использованы средние арифметические значения из трех независимых биологических проб для каждого биотопа. Статистическую обработку результатов анализов проводили с использованием программ Statistica 6.0 for Windows, Microsoft Excel 2007 и Statgraphics Centurion XV.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Условия произрастания исследованных видов галофитов в устьевых участках пяти рек различались по температурному режиму, содержанию влаги в почве, кислотности и содержанию солей (табл. 1).
Наибольшая амплитуда изменчивости характерна для влажности и солености водной вытяжки почвы – минимальные и максимальные значения различались в 10–20 раз. Вариации температурного режима на поверхности почвы на момент сбора растений и кислотности почвы были менее выражены.
Как известно, первичными фоторецепторами в процессе фотосинтеза являются пигменты [8]. Среднее содержание суммы Хл а и b в надземной части галофитов уменьшалось в ряду L. gmelinii – S. salsa – S. perennans – A. santonica (4,9; 4,5; 3,1 и 2,5 мг/г сухой массы, соответственно) (табл. 2). Учитывая неоднородность условий обитания, был рассчитан коэффициент вариации ( K v ) содержания зеленых и желтых пигментов в зависимости от условий произрастания. Оказалось, что у эвгалофитов S. perennans и S. salsa содержание зеленых пигментов варьировало в равной степени ( K v = 31%), у криногалофита L. gmelinii – отличалось стабильностью ( K v = 13%), а у A. santonica – большей вариабельностью ( K v = 43%) и меньшим их количеством в сравнении с другими видами.
Содержание каротиноидов было примерно равным у двух видов S. salsa и L. gmelinii (0,98 и 0,91 мг/г) и выше, чем у растений S. perennans и A. santonica , (0,70 и 0,63 мг/ г сухой массы, соответственно). Размах вариабельности в содержании каротиноидов был аналогичным размаху вариабельности суммы хлорофиллов, то есть наибольший у гликогалофита A. santonica (35%), а наименьший у криногалофита L. gmelinii (21%). Концентрация каротиноидов по отношению к Хл убывала в том же порядке, что и сумма Хл а + b , то есть в ряду L. gmelinii – S. salsa – S. perennans – A. santonica , что, вероятно, связано с видовыми морфологическими особенностями. Так, растения L. gmelinii отличаются от остальных видов самыми крупными размерами листьев и в тоже время меньшим содержанием каротиноидов в пигментном фонде (наибольшими значениями отношения Хл a + b /Кар). Известно, что каротиноиды защищают реакционные центры ФА от фотоингибирования и фотоокисления Хл [17, 18]. Известна также способность каротиноидов осуществлять функцию дополнительных светосбор-щиков. Более высокое содержание каротиноидов в растениях с более мелкими листьями ( S. salsa , S. perennans и A. santonica ), отличающихся более высоким содержанием каротиноидов, вероятно, способствует более эффективному использованию солнечный света по сравнению с L. gmelinii.
Таблица 1 . Физико-химические характеристики условий в местах отбора растений.
|
Место произрастания, река |
Орографические параметры |
Температура воздуха, о С |
||
|
Влажность, % |
Содержание солей, мг/мл |
Кислотность |
||
|
Чернявка |
46,0–48,0 |
0,6–0,8 |
9,2–9,3 |
30,0 |
|
Ланцуг |
33,0–35,0 |
1,0–1,2 |
8,9–9,1 |
35,0 |
|
Хара |
2,3–36,0 |
0,1–1,0 |
8,6–9,7 |
35,0 |
|
Солянка |
37,8–39,8 |
0,5–0,7 |
9,7–9,8 |
35,0 |
|
Б. Смарогда |
13,3–17,4 |
0,8–0,9 |
9,0–9,8 |
31,0 |
|
Таблица 2. Некоторые фотосинтетические характеристики надземной части галофитов в зависимости от места произрастания |
|||||||
|
Место произрастания, река |
Хл a , мг/г сух. массы |
Хл b , мг/г сух. массы |
Кар, мг/г сух. массы |
Хл a + b , мг/г сух. массы |
Хл a / b |
(Хл a + b )/Кар |
Доля Хл в ССК, % |
|
Чернавка |
3,14 |
0,68 |
1,02 |
Suaeda salsa 3,82 |
4,62 |
3,75 |
39,2 |
|
Ланцуг |
3,94 |
1,01 |
1,21 |
4,95 |
3,90 |
4,09 |
44,9 |
|
Хара |
3,31 |
1,13 |
0,92 |
4,44 |
2,93 |
4,83 |
56,0 |
|
Солянка |
1,94 |
0,72 |
0,58 |
2,66 |
2,69 |
4,59 |
59,5 |
|
Б. Смарогда |
4,83 |
1,61 |
1,15 |
6,44 |
3,00 |
5,60 |
55,0 |
|
Чернавка |
2,94 |
1,01 |
Sa 0,83 |
icornia perenn 3,95 |
ans 2,91 |
4,76 |
56,3 |
|
Ланцуг |
1,62 |
0,43 |
0,51 |
2,05 |
3,77 |
4,02 |
46,1 |
|
Хара |
1,51 |
0,56 |
0,48 |
2,07 |
2,70 |
4,31 |
59,5 |
|
Солянка |
2,55 |
1,36 |
0,91 |
3,91 |
1,88 |
4,30 |
76,5 |
|
Б. Смарогда |
2,56 |
1,05 |
0,75 |
3,61 |
2,44 |
4,81 |
64,0 |
|
Чернавка |
3,84 |
1,32 |
L 1,00 |
imonium gmelin 5,16 |
ii 2,91 |
5,16 |
56,3 |
|
Ланцуг |
2,87 |
0,96 |
0,77 |
3,83 |
2,99 |
4,97 |
55,1 |
|
Хара |
4,11 |
1,27 |
1,16 |
5,38 |
3,24 |
4,64 |
51,9 |
|
Солянка |
3,67 |
1,25 |
0,93 |
4,92 |
2,94 |
5,29 |
55,9 |
|
Б. Смарогда |
3,36 |
1,96 |
0,68 |
5,32 |
1,71 |
7,82 |
61,1 |
|
Чернавка |
2,59 |
0,8 |
Ar 0,78 |
temisia santoni 3,39 |
ca 3,24 |
4,35 |
51,9 |
|
Ланцуг |
2,75 |
0,83 |
0,86 |
3,58 |
3,31 |
4,16 |
51,0 |
|
Хара |
1,23 |
0,42 |
0,49 |
1,65 |
2,93 |
3,37 |
56,0 |
|
Солянка |
0,89 |
0,29 |
0,32 |
1,18 |
3,07 |
3,69 |
54,1 |
|
Б. Смарогда |
1,87 |
0,66 |
0,69 |
2,53 |
2,83 |
3,67 |
57,4 |
Примечание. Стандартная ошибка составляет 5-7%.
Для нормальной работы ФА важно не только абсолютное значение содержания пигментов, но и их соотношение, которое указывает на взаимодействие комплексов реакционных центров ФС и ССК в хлоропластах. Полагают, что увеличение содержания Хл а приводит к снижению содержание ССК и нарушению упаковки гран [27]. Средние значения отношение Хл а/b для всех исследованных видов растений варьировали в пределах 2,7-3,4. Вариативность этого признака ( K v ) в зависимости от условий произрастания у трех видов галофитов S. salsa , L. gmelinii и S. perennans составила 22-25%, а у A. santonica - лишь 7%, что может свидетельствовать о более стабильном состоянии гран данного гликогалофита. Дополнительным аргументом стабильности состояния тилакоидов этого вида является и наименьшая вариативность показателя доли хлорофиллов в ССК (K v = 5%) в сравнении с другими видами ( K v = 1720%).
Как отмечалось выше, функциональная активность ФА зависит от структурной организации мембран тилакоидов. Известно, что у фотосинтезирующих растений тилакоидные мембраны превалируют над цитоплазматическими. В результате главные липиды хлоропластов - ГЛ, как правило, доминируют среди общих липидных (ОЛ) экстрактов растений [5]. В наших исследованиях содержание ОЛ в надземной части растений различалось как у отдельных видов галофитов, так и внутри вида в зависимости от места их произрастания (рис. 1). Наибольшее содержание ОЛ в расчете на 1 г сухой массы отмечено у гликогалофита A. santonica - 66-159, а наименьшее - у эвгалофита S. perennans - 38-50 мг. Галофиты L. gmelinii и S. salsa в этом отношении занимали промежуточное положение - 53-123 и 46-80 мг/г, соответственно. Концентрация ОЛ в листьях L. gmelinii отличалась большей степенью вариации (Kv =38%), что, вероятно, связано с анатомоморфологическими свойствами, поскольку листья этого растения отличаются от остальных большими размерами и площадью листовой поверхности. В надземной массе A. santonica содержания ОЛ варьировало в пределах 32%, S. salsa -24%, S. perennans - 14%. В целом, очевидно, что содержание липидов зависело от действия факторов внешней среды и индивидуальных особенностей вида.
Доля ГЛ, которые имеют непосредственное отношение к структуре ФА, в пуле ОЛ составляла в среднем от 26 до 32%, а по отношению к мембранным липидам (МЛ) - от 65 до 85% (рис. 2). Например, листья A. santonica содержали наибольшее количество ГЛ - до 55 мг/г сух. массы (табл. 3), или 80-84% от МЛ (рис. 2).
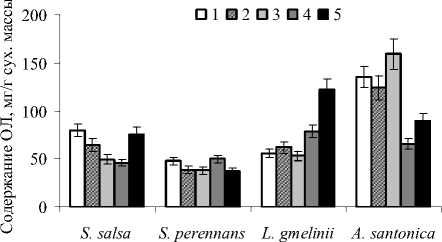
Рис. 1 . Содержание общих липидов в надземной части галофитов в зависимости от места произрастания. Место произрастания, река: 1 - Чернавка, 2 -Ланцуг, 3 - Хара, 4 - Солянка, 5 - Б. Смарогда.
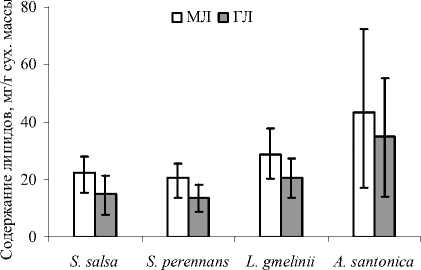
Рис. 2 . Содержание мембранных и гликолипидов в надземной части галофитов, собранных на 5 исследованных участках. Представлены минимальные, средние и максимальные величины.
Вариация этой группы липидов была выше, чем ОЛ. Самый высокий K v был зафиксирован у A. santonica (54%). Далее в порядке уменьшения следовали: S. salsa (40%), L. gmelinii и S. peren-nans (26%). Отметим, что у A. santonica была самая высокая вариация в содержании, как пигментов, так и ГЛ, что может быть связано со способностью регулировать интенсивность фотосинтеза за счет изменения числа хлоропластов.
Была проанализирована также структура пула ГЛ и вариации индивидуальных классов липидов тилакоидных мембран. В количественном отношении МГДГ доминировал у всех образцов растений S. salsa (39-48% от суммы липидов тилакоидных мембран) независимо от места произрастания (табл. 3). В других видах в равном или большем, чем МГДГ количестве, было отмечено содержание другого класса галактолипидов -ДГДГ (34-43%). Относительное содержание СХДГ составляло в среднем 7-16%. Еще меньшим был вклад ФГ (2-16%) (табл. 3).
Отношение МГДГ/ДГДГ имеет особое значение для работы ФА [28]. Считают, что данные липиды играют важную роль в стабилизации сильно искривленных участков мембраны [21]. Обычно соотношение МГДГ/ДГДГ в хлоропластах высших растений бывает около 1,5. По нашим данным, средние значения отношения МГДГ/ДГДГ у всех исследованных видов составили 1,0-1,3. Из литературных источников известно, что у некоторых чувствительных к засолению почвы видов, например, у томата Lycoper-sicum esculentum Mill. и огурца Curcumis sativus L., данное отношение составляет 1,8-2,0, а у солеустойчивых с Salicornia europaea и Atriplex gmelinii стремится к 1, т.е. является более низким [12]. По-видимому, устойчивость галофитов к засолению почвы достигается, в том числе, за счет большего содержания ДГДГ, что подтверждается и результатами наших исследований.
В отличие от суммарных ГЛ относительное содержание (% от суммы) индивидуальных классов в надземной части всех исследованных видов растений было более стабильным: Kv для МГДГ имел диапазон варьирования 6-14%, для ДГДГ -6-12%, для СХДГ - 12-27%. Можно видеть, что вариация сульфолипида несколько выше, чем галактолипидов. В отличие от галакто- и сульфолипидов относительное содержание ФГ имело большую степень изменчивости (Kv = 21-45%), что в сравнении с суммарными и индивидуальными ГЛ является самым высоким показателем. Например, для A. santonica Kv содержания ФГ составил 77%. Отметим, что минимальное значение Kv для содержания ФГ (16%) зафиксировано у L. gmelinii. Как ФГ, так и СХДГ, являются липидами, несущими отрицательный заряд, что, по-видимому, и обуславливает их участие в стабилизации комплексов АТФ- синтазы и ССК [22]. Повышенная вариация СХДГ в составе мембран хлоропластов исследованных галофитов может быть связана с необходимостью регуляции энергетических процессов в разных условиях произрастания, в то время как большая степень изменчивости ФГ - с изменением структуры тилакоидов за счет изменения количества гран. Это особенно характерно для фотосинтезирующих органов A. santonica, у которых к тому же была наиболее высокая вариабельность содержания зеленых пигментов. По имеющимся в литературе данным [7], структура хлоропластов - длина гран и количество стопок в гране, может быть демонтирована и сформирована вновь в течение нескольких минут. Этот эффект отмечен для растений в условиях повышенной инсоляции. Возможно, что у растений гликогалофита A. santonica, для которых характерно ограничение поступления солей в надземные органы, существует аналогичный эффект - динамичность структуры гран, поддерживаемая модуляцией липидов тилакоидных мембран.
Для выявления связи количественного содержания ГЛ и пигментов в надземной части растений, было проведено сравнение структурных и функциональных характеристик ФА. Оказалось, что отношение ГЛ/пигменты было самым высо- ким у соленепроницаемого вида A. santonica 9,2– 13,0 в сравнении с соленакапливающими S. salsa (1,6–6,4), S. perennans (2,7–6,0) и солевыделяющим L. gmelinii (2,8–4,5). Кроме того, для A. san- tonica была обнаружена прямая зависимость между содержанием пигментов и гликолипидов (рис. 3). У остальных видов подобная связь была менее выражена.
Таблица 3. Содержание ГЛ в надземной части галофитов в зависимости от места произрастания.
|
Место произрастания, река |
Липиды, мг/г сух. массы (% от суммы ГЛ и ФГ) |
|||
|
ФГ 1 |
МГДГ ! |
ДГДГ ! |
СХДГ |
|
|
Чернавка |
1,40 (16) |
Suaed 3,60 (39) |
a salsa 2,95 (33) |
1,08 (12) |
|
Ланцуг |
1,37 (6) |
9,99 (44) |
8,46 (38) |
2,76 (12) |
|
Хара |
1,04 (8) |
5,53 (44) |
4,14 (34) |
1,71 (14) |
|
Солянка |
1,31 (6) |
10,78 (48) |
8,55 (39) |
1,53 (7) |
|
Б. Смарогда |
2,24 (14) |
6,78 (42) |
4,50 (28) |
2,51 (16) |
|
Чернавка |
1,83 (12) |
Salicornia 5,60 (38) |
perennans 5,38 (37) |
1,86 (13) |
|
Ланцуг |
0,91 (6) |
7,69 (47) |
5,58 (34) |
2,11 (13) |
|
Хара |
0,91 (9) |
3,18 (33) |
3,96 (42) |
1,59 (16) |
|
Солянка |
1,45 (7) |
7,34 (37) |
8,02 (42) |
2,82 (14) |
|
Б. Смарогда |
2,33 (15) |
5,63 (37) |
5,27 (36) |
1,88 (12) |
|
Чернавка |
1,44 (6) |
Limonium 10,48 (40) |
gmelinii 10,16 (40) |
3,56 (14) |
|
Ланцуг |
1,45 (10) |
5,87 (38) |
5,57 (37) |
2,35 (15) |
|
Хара |
1,57 (7) |
10,41 (46) |
8,23 (36) |
2,45 (11) |
|
Солянка |
1,62 (9) |
6,10 (34) |
7,85 (42) |
2,66 (15) |
|
Б. Смарогда |
2,07 (7) |
11,95 (40) |
11,28 (39) |
3,94 (14) |
|
Чернавка |
2,67 (5) |
Artemisia 26,63 (46) |
santonica 20,94 (37) |
6,59 (12) |
|
Ланцуг |
2,17 (4) |
25,99 (45) |
23,78 (42) |
5,28 (9) |
|
Хара |
0,37 (2) |
8,63 (41) |
9,18 (43) |
2,95 (14) |
|
Солянка |
0,46 (4) |
5,89 (41) |
6,06 (42) |
1,88 (13) |
|
Б. Смарогда |
1,06 (3) |
13,21 (42) |
12,97 (41) |
4,33 (14) |
Примечание. Стандартная ошибка составляет 5–7 %.
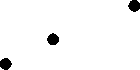
Содержание пигментов, мг/г сух. массы
Рис. 3. Зависимость содержания гликолипидов и пигментов в надземной части A. santonica , произрастающей на 5 исследованных участках.
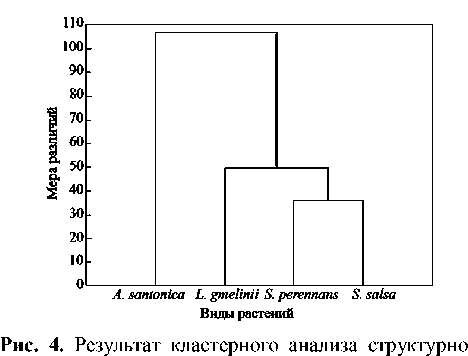
функциональных показателей исследуемых видов галофитов.
С помощью кластерного анализа удалось выявить сходство (различия) структурных и функциональных признаков у разных типов галофитов, отличающихся по типу накопления солей, с использованием всех характеристик, проанализированных в данной работе (рис. 4). Было установлено, что соленакапливающие виды S. salsa и S. perennans объединены в одну группу, затем за ними следует солевыделяющий вид L. gmelinii и соленепроницаемый вид A. santonica. При этом, криногалофит L. gmelinii имеет большее «родство» с эвгалофитами S. salsa и S. perennans, что может быть связано, в том числе с тем, что вместе эти 3 вида образуют группу облигатных галофитов в отличие от факультативного галофита A. santonica.
Изучение количественных характеристик пигментного и липидного комплекса 4-х видов дикорастущих галофитов, различающихся типом регуляции солевого обмена, показало, что разделение растений по соленакапливающему признаку имеет четкую биохимическую основу – более высокое суммарное содержание хлорофиллов на фоне низкого уровня суммарных мембранных липидов характерно для эвгалофитов и криногалофита в сравнении с гликогалофитом.
На основании данных по изменчивости исследуемых параметров в зависимости от места произрастания установлено, что общее содержание мембранных липидов, отвечающих за структуру ФА, в основном менялось сильнее ( K v = 26–54%), чем содержание зеленых пигментов ( K v = 13– 43%). В то же время соотношение индивидуальных компонентов ГЛ было более жестко детерминировано ( K v = 6–27 %). Следовательно, эффективное функционирование ФА галофитов в условиях засушливого климата и высокого содержания солей в почве обеспечивается сочетанием экологически пластичных и экологически стабильных компонентов.
Работа выполнена при поддержке гранта РФФИ № 12-04-0111-а.
Список литературы Структурно-функциональная характеристика фотосинтетического аппарата галофитов, отличающихся по типу накопления солей
- Аринушкина Е.В. Руководство по химическому анализу почв. Изд. Московского Университета, 1970. 489 с.
- Балнокин Ю.В., Строганов Б.П. Солевой обмен и проблема солеустойчивости растений. Новые направления в физиологии растений. М.: Наука, 1985. С. 199-213.
- Лысенко Т.М., Митрошенкова А.Е., Шарпило Н.И., Круглов А.А. Материалы к флоре Приэльтонья//Фиторазнообразие восточной Европы. 2010. № 8. С. 97-107.
- Нестеров В.Н., Розенцвет О.А., Мурзаева С.В. Изменение состава липидов у пресноводного растения Hydrilla verticillata (L. fil.) Royle в условиях аккумуляции и элиминации ионов тяжелых металлов//Физиология растений. 2009. Т. 56. № 1. С. 85-93.
- Санина Н.М. Мембранообразующие липиды. Физико-химические основы термоадаптации морских беспозвоночных и макрофитов/Автореферат дисс… Владивосток, 2006. С. 22-27.
- Строганов Б.П. Физиологические основы солеустойчивости растений (при разнокачественном засолении почвы). М.: АН СССР, 1962. 336 с.
- Anderson J.M., Chow W.S., Rivas J.L. Dynamic flexibility in the structure and function ofphotosystem II in higher plant thylakoid membranes: the grana enigma//Photosynth. Res. 2008. V. 98. P. 575-587.
- Blankenship R.E. Molecular mechanisms of photosynthesis. Oxford: Blackwell Science Ltd, UK. 2002. 321 p.
- Flowers T.J., Colmer T.D. Salinity tolerance in halophytes//New Phytol. 2008. V. 179. P. 945-963.
- Guskov A., Kern J., Gabdulkhakov A. et al. Cyanobacteria photosystem II at 2.9 A resolution: role of quinones, lipids, channels and chloride//Nat. Struct. Mol. Biol. 2009. V. 16. P. 334-342.
- Hagio M., Sakurai I., Sato S. et al. Phosphatidylglycerol is essential for the development of thylakoid membranes in Arabidopsis thaliana//Plant Cell Physiol. 2002. V. 43. P. 1456-1464.
- Hirayama O., Mihara M. Characterization of Membrane Lipids of Higher Plants Different in Salt Tolerance//Agric. Biol. Chem. 1987. V. 51. P. 3215-3221.
- Hölzl G., Dörman P. Structure and Function of Glycerolipids in Plants and Bacteria//Prog. Lipid res. 2007. V. 46. P. 225-243.
- Jahns P., Latowski D., Strzalka K. Mechanism and regulation of violaxanthin cycle: The role of antenna proteins and membrane lipids//Biochim. Biophys. Acta. 2009. V. 1787. P. 3-14.
- Jordan P., Fromme P., Witt H.T. et al. Three-dimensional structure of cyanobacterial photosystem I at 2.5 A resolution//Nature. 2001. V. 411. P. 909-917.
- Kern J., Loll B., Luneberg C. et al. Purification, characterization and crystallization of photosystem II from Thermosynechococcus elongatus cultivated in a new type of photobioreactor. Biochim Biophys Acta. 2005. V. 1706. P. 147-157.
- Lichtenthaller H.K. Chlorophylls and Carotenoids: Pigments of Photosynthetic Biomembranes//Methods in enzymology. 1987. V. 148. Р. 350-382.
- Lichtenthaller H.K., Buschmann C. Chlorophylls and Carotenoids: Measurement and Characterization by UV-VIS Spectroscopy//Current Protocols in Food Analytical Chemistry. 2001. F4.3.1-F4.3.8.
- Lokhande V.H., Suprasanna P. Prospects of Halophytes in Understanding and Managing Abiotic Stress Tolerance. In: Ahmad P., Prasad M.N.V. (eds.), Environmental adaptations and Stress Tolerance of Plants in the Era of Climate Change. Springer science + Business Media, 2012. P. 29-56.
- Minoda A., Sato N., Nozaki H. et al. Role of sufoquinovosyl diacylglycerol for the maintenance of photosystem II in Chlamydomonas reinhardtii//Eur. J.Biochem. 2002. V. 269. P. 2353-2358.
- Murata N., Hoshi H. Sulfoquinovosyl diacylglycerols in chilling sensitive and chilling resistant plants//Plant Cell Physiol. 1984. V. 25. №. 7. P. 1241-1245.
- Okanenko A.A., Taran N.Yu., Kosyk O.I. Plant sulfolipid. 1. Functions. Бiополiмери i клiтина. 2008. Т. 24. № 6. С. 431-440.
- Parida A.K., Das A.B. Effects of NaCl stress on nitrogen and phosphorus metabolism in a true mangrove Bruguiera parviflora grown under hydroponic culture//J. Plant Physiol. 2004. V. 161. P. 921-928.
- Ramani B., Papenbrock J., Schmidt A. Connecting sulfur metabolism and salt tolerance mechanisms in the halophytes Aster tripolium and Sesuvium portulacastrum//Trop. Ecol. 2004. V. 45. № 1. P. 173-182.
- Rawyler A., Sieganthaler P.A. Transversal localization of monogalactosyldiacylglycerol and digalactosyldiacylglycerol in spinach thylakoid membranes//Biochim. Biophys. Acta. 1985. V. 815. P. 287-298.
- Siegenthaler P.A., Trémolières A. Role of acyl lipids in the function of photosynthetic membranes in higher plants. In: Siegenthaler P.A., Murata N. (eds.), Lipids in photosynthesis: structure, function and genetics. Advances in photosynthesis and respiration. Dordrecht: Springer, 1998. V. 6. Р. 79-98.
- Sui N., Li M., Li K. et al. Increase in unsaturated fatty acids in membrane lipids of Suaeda salsa L. enhances protection of photosystem II under high salinity//Photosynthetica. 2010. V. 48. P. 623-629.
- Wada H., Murata N. Lipids in Thylakoid membranes and Photosynthetic Cells. In: Wada H., Murata N. (eds.), Lipids in Photosynthesis: Essential and Regulatory Function. N. Dordrecht: Springer, 2009. P. 1-9.


