Структурно-функциональная характеристика тимуса крыс с аллоксановым диабетом при различных способах лечения глубоких гнойных ран нижних конечностей
Автор: Нузова Ольга Борисовна, Стадников Александр Абрамович, Студеникин Александр Викторович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.26, 2018 года.
Бесплатный доступ
Лечение гнойных ран у пациентов с сахарным диабетом является трудной и актуальной проблемой медицины. Нарушение иммунного статуса представляет одно из патогенетических звеньев каскада патологических процессов при гнойных ранах у пациентов с сахарным диабетом. Цель исследования - установить особенности морфофункциональной реорганизации тимуса при различных способах лечения гнойных ран на фоне аллоксанового диабета в экспериментальных условиях. Лечебная эффективность препарата милиацила и КВЧ-терапии изучена на 128 белых беспородных крысах у которых моделировали раневой процесс задних конечностей на фоне аллоксанового диабета. У 32 крыс основной группы в местном лечении ран использовали милиацил и КВЧ-терапию. У 32 животных первой контрольной группы лечение ран не проводилось. Раны у 32 крыс второй контрольной группе лечили милиацилом. У 32 животных третьей контрольной группе в лечение ран применяли КВЧ-терапию. Проводили гистологические и иммуноцитохимические исследования тимуса у животных всех групп на 7, 14, 21 и 28 день лечения...
Строение тимуса, акцидентальная инволюция, аллоксановый диабет, гнойные раны, милиацил, квч-терапия
Короткий адрес: https://sciup.org/143177273
IDR: 143177273 | DOI: 10.20340/mv-mn.18(26).04.20-24
Текст научной статьи Структурно-функциональная характеристика тимуса крыс с аллоксановым диабетом при различных способах лечения глубоких гнойных ран нижних конечностей
Нузова О.Б., Стадников А.А., Студеникин А.В. Структурно-функциональная характеристика тимуса крыс с аллоксановым диабетом при различных способах лечения глубоких гнойных ран нижних конечностей// Морфологические ведомости.- 2018.- Том 26.- № 4.- С. 20-24. (26).04.20-24
Nuzova OB, Stadnikov AA, Studenikin AV. Structural and functional characteristics of the thymus of rats with alloxan diabetes at different methods of treatment of deep purulent wounds of the lower limbs. Morfologicheskie Vedomosti – Morphological Newsletter. 2018 Dec 30;26(4):20-24. (26).04.20-24
Введение. В последние годы отмечается увеличение заболеваемости сахарным диабетом 2-го типа, что связано с социально-экономическими и демографическими изменениями [1]. Лечение гнойных ран у пациентов с сахарным диабетом является трудной и актуальной проблемой медицины и во многом зависит от местного лечения. Поэтому важен поиск новых методов и средств местного лечения, обладающих разносторонним воздействием, обеспечивающим антимикробный, противовоспалительный и репаративный эффект [2-3]. Таким требованиям отвечает разработанный в Оренбургском государственным медицинском университете препарат милиацил - просяное масло (Miliacylum) [4-5]. В последние годы в комплексном лечении гнойных ран используются также и физические методы воздействия, в том числе КВЧ-терапия. Нарушение иммунного статуса представляет одно из патогенетических звеньев каскада патологических процессов при гнойных ранах у пациентов с сахарным диабетом [6]. До сих пор остается недостаточно изученным морфофункциональное состояние тимуса при сахарном диабете, в том числе и при его лечебной коррекции, что предопределяет актуальность дальнейших исследований [7-8].
Цель исследования - установить особенности морфофункциональной реорганизации тимуса при различных методах лечения гнойных ран на фоне аллоксанового диабета в экспериментальных условиях.
Материалы и методы исследования. Лечебная эффективность милиацила и КВЧ-терапии изучена в опытах на 128 белых беспородных крысах-самцах, массой 260-330 г. Все манипуляции с животными выполнены в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1985); Хельсинкской декларацией от 2000 г. «О гуманном отношении к животным»; приказом Министерства здравоохранения Российской Федерации № 708н от 23.08.2010 «Об утверждении правил лабораторной практики». У подопытных животных после суточного голодания был вызван аллоксановый диабет путем введения подкожно 5% раствора аллоксана. Диабет возникал через 2 суток после введения указанного раствора. С 6-х суток после возникновения диабета с целью его компенсации ежедневно в течение всего периода наблюдений крысам вводили подкожно раствор протамин-цинк-инсулина в дозе 4 ЕД. Через 30 дней после получения аллоксанового диабета у животных была воспроизведена модель гнойной раны. У крыс моделировали гнойно-воспалительный процесс задних конечностей, в том числе при инфицировании 64 животных Staphylococcus aureus с антилактоферриновой активностью (АЛфА+) и 64 крыс штаммом стафилококка без антилактоферриновой активности (АЛфА-). В работе использованы штаммы S. aureus из коллекции Института клеточного и внутриклеточного симбиоза УрО РАН. Подопытным крысам после удаления волосяного покрова и обработки кожи настойкой йода и спиртом в стерильных условиях внутримышечно в область бедра вводился 1 мл взвеси суточной культуры стафилококка (2 млрд. микробных тел) и 0,25 мл 25% раствора сульфата магния. Гнойный очаг у подопытных животных возникал через 5-7 дней. После получения экспериментальной модели гнойно-воспалительного очага производилась его хирургическая обработка в объеме, обеспечивающем удаление нежизнеспособных тканей. Оперативное вмешательство проводилось под общей анестезией.
Далее у крыс основной группы в местном лечении ран использовали милиацил (на рану наносилось 0,3 мл милиацила, накладывалась марлевая повязка) и КВЧ-терапию аппаратом «Явь-1» с рабочей длиной волны 7,1 мм (частота 42194±10 МГц). В первой контрольной группе был исследован характер течения гнойно-воспалительного процесса без лечебной коррекции. Во второй контрольной группе лечение гнойно-воспалительного очага осуществлялось милиацилом. В третьей контрольной группе применяли КВЧ-терапию аппаратом «Явь-1». Продолжительность проводимых ежедневно воздействий составляла от 5 до 6 минут. В каждой группе было взято по 32 крысы (16 крыс инфицированных S. aureus АЛфА+ и 16 крыс - S. aureus АЛфА-). У подопытных животных в динамике течения раневого процесса оценивалось противовоспалительное и репаративное воздействие различных способов лечения. Динамику течения патологического процесса оценивали по клиническим признакам: срокам исчезновения инфильтрации и гиперемии краев раны, характеру и количеству раневого отделяемого, срокам очищения ран от гнойно-некротического содержимого, срокам появления грануляций, краевой эпителизации и заживления. Проводили гистологические и иммуноцитохимические исследования тканей раневой зоны, а также тимуса у животных всех групп на 7, 14, 21 и 28 день лечения. В указанные сроки эвтаназии подвергали по восемь крыс каждой группы (четыре крысы, инфицированные S. aureus АЛфА+, и четыре крысы - S. aureus АЛфА - ) путем ингаляции летальной дозы эфира. Образцы тканей фиксировали в 10% растворе нейтрального формалина. Парафиновые срезы толщиной 6-8 мкм, изготовленные на ротационном микротоме, окрашивали гематоксилином Майера и эозином, пикрофуксином по Ван-Гизон, метиловым зеленым и пиронином по Браше, периодатом калия и реактивом Шиффа по Мак-Манусу. Гистохимические реакции сопровождались энзиматическими контролями. Для определения экспрессии проапоптотического белка р53, антиапоптотического белка bcl-2, а также маркера пролиферации белка Ki-67, серийные гистосрезы инкубировали с соответствующими моноклональными антителами (фирма «Dako», Дания) в рабочем разведении 1:50. Использовали стрептавидин-биотиновый пероксидазный метод (Dako LSAB-kit, Дания) с дополнительным окрашиванием ядер клеток гематоксилином Майера для визуализации структур. Для определения внутрифазной фрагментации ДНК использовали набор реактивов «Apoptag Plus Peroxidazein Situ Apoptosis Detection Kit» (фирма «Intergеn», Канада). Полученные данные были обработаны с помощью программы «Статистика 6.1». Количественные признаки были подвергнуты статистической обработке путём подсчёта основных статистических характеристик: выборочного среднего значения, ошибки среднего значения (стандартной ошибки).
Результаты исследования и обсуждение. Сроки заживления гнойных ран у животных на фоне аллоксанового диабета, в основной группе, лечение, которым проводилось местно милиацилом и КВЧ-терапией (11,91±0,28 суток), статистически значимо меньше аналогичных сроков у животных, которым использовали милиацил (13,88±0,26 суток) и животных, которым лечение не проводилось или использовалась только КВЧ-терапию (их раны не заживали к 28 суткам). Анализ серии гистологических препаратов тимуса позволил сделать следующие обобщение. У крыс с гнойными ранами на фоне аллоксанного диабета мы наблюдали морфологические явления явного иммунодефицита. Была обнаружена атрофия паренхимы тимуса (коры и мозгового вещества), в сочетании с гиперплазией междолевых периваскулярных пространств с одновременным увеличением жировой ткани (рис. 1). В некоторых дольках тимуса обнаружены инверсия слоев с опустошением корковой зоны от лимфоцитов. Атрофия тимуса сопровождалась перестройкой архитектуры долей, уменьшением паренхиматозных элементов, замещением тимических структур жировой и фиброзной тканью. Особенно эти явления были выражены у крыс, инфицированных S. aureus с антилактоферриновой активностью. При этом была отмечена дезорганизация долек, расширение междольковых соединительнотканных перегородок, возрастание числа фагоцитирующих макрофагов. Отмечены также явления деструктивных изменений ретикулоэндотелиоцитов (рис. 2).
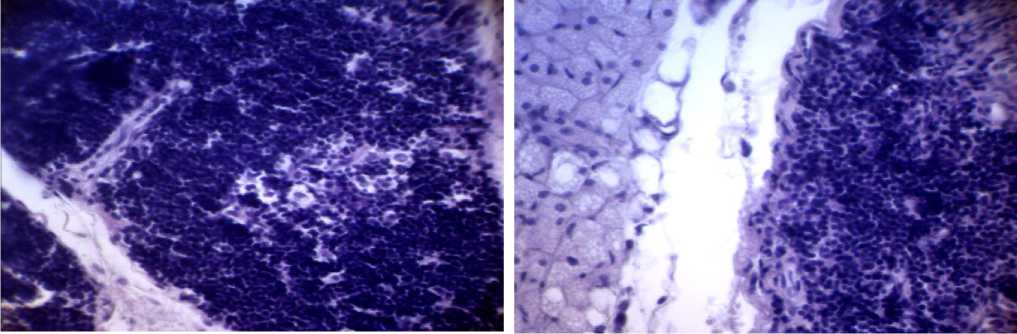
Рис. 2. Мозговое вещество дольки тимуса крысы первой контрольной группы, инфицированной S. aureus с антилактоферриновой активностью на фоне аллоксанового диабета через 21 день с момента образования гнойной раны. Окр.: гематоксилин Майера и эозин. Ув.: х400.
Рис. 1. Фрагмент тимуса крысы первой контрольной группы, инфицированной S. aureus с антилактоферриновой активностью на фоне аллоксанового диабета через 14 дней с момента образования гнойной раны. Фиксация: 10% раствор нейтрального формалина. Окр.: гематоксилин Майера и эозин. Ув.: х400.
Таблица 1
Доля иммунопозитивных клеток (в %) в корковом (КВ) и мозговом веществе (МВ) тимуса экспериментальных животных, инфицированных S. Aureus (uSA) в зависимости от способа их лечения
|
Количество иммунопозитив-ных клеток, % |
Показатель в % на 7-е сутки эксперимента (n=4) |
||||||||||
|
Контр. группа № 1 |
Контрольная группа № 2 |
Контрольная группа № 3 |
Основная группа |
||||||||
|
Тимоциты КВ крыс, иSA (АЛфА– ) |
Ki - 67 |
2,7±0,6 |
1,8±0,6* |
3,8±0,3 |
|||||||
|
bcl-2 |
0,8±0,3* |
0,5±0,1* |
2,5±0,7 |
||||||||
|
p53 |
6,8±0,5* |
2,9±0,5 * |
4,0±0,4* |
2,7±0,3 * |
|||||||
|
Тимоциты КВ крыс, иSA (АЛфА+) |
Ki 67 |
2,5±0,6 |
1,4±0,4 |
3,0±0,7 |
|||||||
|
bcl-2 |
0,5±0,1* |
0,4±0,1* |
2,0±0,4 |
||||||||
|
p53 |
8,0±0,5* |
5,3±0,6 |
5,5±0,6 |
4,8±0,5 |
|||||||
|
Тимоциты МВ крыс, и SA (АЛфА– ) |
Ki 67 |
2,8±0,1* |
5,5±0,6 |
||||||||
|
bcl-2 |
1,0±0,1* |
2,3±0,3 |
|||||||||
|
p53 |
11,5±0,6* |
2,7±04* |
10,8±0,5* |
1,0±0,1 * |
|||||||
|
Тимоциты МВ крыс, иSA (АЛфА+) |
Ki 67 |
2,0±0,4* |
5,0±0,4 |
||||||||
|
bcl-2 |
0,5±0,1 |
1,5±0,1 |
|||||||||
|
p53 |
12,5±0,6* |
3,0±0,4 |
11,5±0,6* |
2,3±0,2 |
|||||||
Примечание: * - статистическая значимость различий показателей от таковых по сравнению с основной группой (p<0,05);
-
♦ - статистическая значимость различий показателей при инфицировании S. aureus без антилактоферриновой активности (АЛфА – ) по сравнению с показателями при инфицированием S. aureus с антилактоферриновой активностью (АЛфА+) (p<0,05)
Наличие инволютивных процессов в тимусе подтвердили и иммуноцитохимические данные, представленные в таблице 1 по показателям экспрессии синтеза протеинов Ki-67, bcl-2 и p53 в тимоцитах. Количество bcl-2 положительных тимоцитов коркового вещества у крыс инфицированных S. aureus с антилактоферриновой активностью (АЛфА+), было больше по сравнению с этим показателем у животных второй и третьей контрольных групп в 4 и 5 раз, соответственно. У крыс первой контрольной группы bcl-2 положительные тимоциты определены не были. У животных основной группы, инфицированных S. aureus с антилактоферриновой активностью (АЛфА+), Ki-67 положительных тимоцитов коркового вещества было больше в сравнении с таковым показателем у крыс второй и третий контрольных групп в 1,2 и 2,1 раза, соответственно. У крыс первой контрольной группы Ki-67 положительные тимоциты обнаружены не были. Количество p53 положительных тимоцитов коркового вещества у крыс основной группы, инфицированных S. aureus с антилактоферриновой активностью (АЛфА+), было меньше по сравнению с таковым показателем у животных контрольных групп в 1,7; 1,1 и 1,2 раза. У животных, инфицированных S. aureus без антилактоферриновой активности (АЛфА - ), количество bcl-2 положительных тимоцитов коркового вещества было больше, чем аналогичный показатель у крыс второй и третьей контрольных групп в 3,1 и 5 раза, соответственно. У крыс первой контрольной группы bcl-2 положительные тимоциты не выявлялись. Количество Ki-67 положительных тимоцитов коркового вещества у крыс основной группы, инфицированных S.
aureus без антилактоферриновой активности (АЛфА - ), было больше в сравнении с таковым показателем у животных второй и третьей контрольных групп в 1,4 и 2,1 раза, соответственно. У животных первой контрольной группы Ki-67-положительные тимоциты обнаружены не были. У крыс основной группы, инфицированных S. aureus без антилактоферриновой активности (АЛфА - ), количество p53-положительных тимоцитов коркового вещества было меньше по сравнению с таковым показателем у животных контрольных групп в 2,5, 1,1 и 1,5 раза, соответственно. Количество bcl-2-положительных тимоцитов мозгового вещества у крыс, инфицированных S. aureus с антилактоферриновой активностью (АЛфА+), было больше по сравнению с таковым показателем у животных второй контрольно группы в 3 раза. У крыс первой и третьей контрольных группы bcl-2-положительные тимоциты определены не были. На 7-е сутки лечения у крыс основной группы, инфицированных S. aureus с антилактоферриновой активностью (АЛфА+), Ki-67 положительных тимоцитов мозгового вещества было больше в сравнении с таковым показателем у крыс второй контрольной группы в 2,5 раза. У крыс первой и третьей контрольных групп Ki-67 положительные тимоциты обнаружены не были. Количество р53 положительных тимоцитов мозгового вещества у крыс основной группы, инфицированных S.aureus с антилактоферриновой активностью (АЛфА+), было меньше по сравнению с таковым показателем у животных контрольных групп в 5,4; 1,3 и 5 раза.
У животных основной группы, инфицированных S. aureus без антилактоферриновой активности (АЛфА - ), количество bcl-2 положительных тимоцитов мозгового вещества было больше, чем аналогичный показатель у крыс второй контрольной группы в 2,3 раза. У крыс первой и третьей контрольных групп bcl-2 положительные тимоциты не выявлялись. Количество Ki-67 положительных тимоцитов мозгового вещества у крыс основной группы, инфицированных S. aureus без антилактоферриновой активности (АЛфА - ), было больше в сравнении с таковым показателем у животных второй контрольной группы в 2 раза. У животных первой и третьей контрольных групп Ki-67 положительные тимоциты обнаружены не были. У крыс основной группы, инфицированных S. aureus без антилактоферриновой активности (АЛфА - ), количество p53 положительных тимоцитов мозгового вещества было меньше по сравнению с таковым показателем у животных контрольных групп в 11,5, 2,7 и 10,8 раза, соответственно. При гистологическом исследовании тимуса пролеченных крыс, мы наблюдали явление акцидентальной инволюции, однако оно носило менее выраженный характер у животных основной группы, чем у крыс контрольных групп. Мы отметили увеличение коркового слоя долек тимуса, за счет возрастания числа лимфобластов.
На основании анализа результатов экспериментальных исследований было выявлено, что у крыс основной группы по сравнению с таковыми при использовании только милиацила (вторая контрольная группа) очищение ран наступало быстрее в 1,4 раза, появление грануляций – в 1,4 раза, начало эпителизации – в 1,4 раза и заживление ран – в 1,2 раза. По сравнению с применением только КВЧ-терапии у крыс третьей контрольной группы очищение ран наступало быстрее в 2,2 раза, появление грануляций – в 2,1 раза, начало эпителизации – в 1,8 раза, раны не заживали к 28 суткам. При сопоставлении этих результатов у крыс основной серии с результатами, полученными на крысах первой контрольной группы, у которых лечение гнойно–воспалительного очага не проводилось, установлено, что очищение ран происходило быстрее в 2,6 раза, появление грануляций – 2,6 раза, начало эпителизации – в 2,5 раза, к 28 суткам раны не заживали.
Анализ экспериментального материала по изучению эффективности действия милиацила и КВЧ-терапии в лечении гнойных ран позволяет сделать заключение, что разработанный способ обладает выраженным противовоспалительным и стимулирующим репаративную регенерацию тканей действием. О более эфффективном воздействии милиацила в сочетании с КВЧ-терапией на течение раневого процесса по сравнению с таковым при применении только милиацила крысам второй контрольной группы, или только КВЧ-терапии крысам третьей контрольной группы и первой контрольной группы, которым лечебная коррекция не проводилась, свидетельствуют также данные, полученные при морфофункциональном исследовании тимуса. Наши результаты согласуются с наблюдениями других исследователей, которые показали, что многие вирусные и бактериальные инфекции вызывают акцидентальную инволюцию тимуса [8]. Патогенетической основой подобной острой атрофии тимуса является нарушение развивающихся тимоцитов и клеток ретикуло-эпителиального микроокружения.
Заключение. Таким образом, предложенный авторами лечения глубоких гнойных ран конечностей с использованием препарата милиацила и КВЧ-терапии обеспечивает не только оптимизацию репаративных процессов в раневой области, но и лимитирует инволюцию вилочковой железы, что подтверждено морфологическими и иммуногистохимическими данными. В свою очередь это опосредованно доказывает предотвращение нарушений в центральном органе иммуногенеза. Полученные в работе результаты свидетельствуют о достаточной эффективности предлагаемого способа лечения гнойных ран в условиях аллоксанового диабета.
Заявление о конфликтах интересов.
Список литературы Структурно-функциональная характеристика тимуса крыс с аллоксановым диабетом при различных способах лечения глубоких гнойных ран нижних конечностей
- Blatun LA. Mestnoe medikamentoznoe lechenie ran. Khirurgija. 2011;4:51-59.
- Frank DN, Wysocki A, Specht-Glick DD. Microbial diversity in chronic open wounds. Wound Repair Regen. 2009;2:163-172.
- Wunderlich R, Peters E, Lavery L. Systemic hyperbaric oxygen therapy: lower extremity wound healing and the diabetic foot. Diabetes Care. 2000;23:1551-1555.
- Nuzova OB. Lechenie troficheskih jazv nizhnih konechnostej miliacilom i magnitolazerterapiej. Khirurgija - Zhurnal im N.I. Pirogova. 2008;3:30-33.
- Nuzov BG, Nuzova OB. Strukturno-funkcional'naja ocenka vozdejstvija sochetannogo mestnogo primenenija miliacila i lazernogo izluchenija pri lechenii troficheskih jazv. Morfologija. 2003;124(5):31-33.
- Dibirov MD, Proshin AV, Gadzhimuradov RU. Immunokorrigirujushhaja terapija bol'nyh s gnojno-nekroticheskimi formami sindroma diabeticheskoj stopy. Khirurgija. 2013;1(71):31-34.
- Bahmet AA. Morfologicheskaja harakteristika nekotoryh organov immunnoj sistemy krys pri vozdejstvii ostrogo stressa v jeksperimente. Morfologija. 2006;129(4):20.
- Moskvichev EV, Merkulova LM, Struchko GJu. Immunogistohimicheskaja harakteristika apoptoza i kletochnoj proliferacii v timuse pri jeksperimental'noj opuholi tolstoj kishki. Immunologija. 2012;33(6):303-305.


