Структурно-функциональные изменения в листьях картофеля при поражении вирусом М и грибом Alternaria solani
Автор: Розенцвет О.А., Богданова Е.С., Нестеров В.Н., Саблина Н.А., Бакунов А.Л., Милехин А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технические культуры и секвестрация
Статья в выпуске: 1 т.60, 2025 года.
Бесплатный доступ
Грибы и вирусы, вызывающие болезни растений, становятся причиной значительного снижения урожайности картофеля. Симптомы инфекционных болезней различаются в зависимости от типа заражения. Гриб Alternaria solani Sorauer - возбудитель альтернариоза, или сухой пятнистости картофеля, образует на листьях вначале очень мелкие, а затем разрастающиеся концентрическими кольцами некрозы. Один из распространенных вирусных возбудителей заболеваний картофеля вирус М (potato virus M, PVM) вызывает деформацию листьев в виде скручивания и морщинистости. Во многие клеточные процессы при инфицировании вовлечены биологические мембраны, представляющие собой важные составляющие растительных клеток. В настоящем исследовании впервые установлены сходства и различия структурно-функциональных изменений в листьях картофеля при инфицировании вирусом М и грибом A. solani. Цель работы состояла в оценке изменений структуры тканей, хлоропластов, липидного профиля мембран и окислительно-восстановительного потенциала листьев картофеля при инфицировании вирусом М и грибом Alternaria solani . Среднеранний сорт картофеля Тана выращивали на опытном поле Самарского НИИ сельского хозяйства им. Н.М. Тулайкова (Самарская обл.) в 2022-2023 годах. Клубни растений высаживали во II декаде мая в четырех повторностях по 50 растений в каждой. Картофель выращивали без орошения и внесения удобрений при естественном освещении. Листья отбирали в начале цветения растений на естественном фоне заражения. Диагностику фитопатогенов осуществляли в полевых условиях визуально, затем подтверждали методом ПЦР. Образцы включали незараженные листья (контроль), а также пораженные латентным вирусом М и грибом A. solani . Для определения морфологических параметров листа отбирали высечки из свежих листьев с 3-4 растений и фиксировали в 3,5 % растворе глутарового альдегида в стандартном фосфатном буфере (рН 7,4). Параметры листа - структурные характеристики мезофилла, число устьиц, число и размеры хлоропластов - определяли с помощью микроскопа B-500TPL («Optika S.r.l.», Италия), оснащенного камерой С-P20. Для биохимических анализов собирали свежие листья, объединяли в общую массу для каждого опытного варианта, формировали три навески по 0,5-1,0 г и до проведения аналитических работ хранили их в жидком азоте. Физиологические и биохимические методы включали определение сухой массы листа, количества фотосинтетических пигментов, белков, липидов и жирных кислот, продуктов перекисного окисления липидов и низкомолекулярных антиоксидантов. Установлено, что вирус M вызывал деформацию листьев, а A. solani - некроз тканей. Внутренняя архитектура листьев, пораженных патогенами, характеризовалась плотным сложением губчатой паренхимы, меньшим межклеточным пространством, изменением структуры хлоропластов. Выявлено снижение количества фотосинтетических пигментов (хлорофиллы a и b, каратиноиды) в листьях, особенно при действии A. solani , в 1,7-2 раза. Установлена специфичность влияния инфекций на окислительно-восстановительный потенциал и состояние мембран: под воздействием A. solani уровень маркера окислительных процессов малондиальдегида (МДА) повышался с 0,18 до 0,37 мкмоль/г сухой массы, концентрация свободного пролина снижалась c 10 до 1,6 мкг/г сухой массы (примерно в 5 раз), водорастворимых фенольных соединений - с 128 до 95,0 мг/г сухой массы (в 1,4 раза). Вирус М не оказывал влияния на содержание МДА, но вирусная инфекция приводила к снижению количества мембранных белков на 35 %. При заражении A. solani выявлено уменьшение индекса ненасыщенности жирных кислот липидов с 1,8 до 1,5.
Белки, жирные кислоты, липиды, перекисное окисление липидов, пигменты, свободный пролин, фенольные соединения, фитопатогены
Короткий адрес: https://sciup.org/142244134
IDR: 142244134 | УДК: 633.491:632.3/.4:581.2:581.19 | DOI: 10.15389/agrobiology.2025.1.153rus
Текст научной статьи Структурно-функциональные изменения в листьях картофеля при поражении вирусом М и грибом Alternaria solani
Грибы и вирусы — основные возбудители заболеваний картофеля (4-7). Грибная инфекция проникает в растения с помощью гиф или фер- ментов, разрушающих кутикулу и клеточную стенку листьев и стеблей (8, 9). Заражение вирусом происходит при повреждении внешних покровов — механическом или осуществленном организмом-переносчиком (насекомыми, клещами, нематодами и др.) (10). Оба типа патогенов также способны проникать в клетки растений через устьица, расположенные на поверхности листа (11-13).
Симптомы инфекционных болезней различаются в зависимости от типа заражения (1, 14). Гриб Alternaria solani Sorauer — возбудитель альтер-нариоза, или сухой пятнистости картофеля, образует на листьях вначале очень мелкие, а затем разрастающиеся концентрическими кольцами некрозы (15). Один из распространенных вирусных возбудителей заболеваний картофеля вирус М (potato virus M, PVM) вызывает деформацию листьев в виде скручивания и морщинистости (8). В обоих случаях происходит уменьшение ассимиляционной поверхности листа за счет изменения ультраструктуры хлоропластов, содержания пигментов (16-18), метаболизма аминокислот (19) и иммунного ответа растений (20), что влияет на продукционный процесс в целом.
Установлены патоген-зависимые метаболиты и биомаркеры устойчивости картофеля к вирусам и грибам (21). Однако сравнительных исследований действия разных по своей природе фитопатогенов при проникновении в клетки растений картофеля на структурные и физиологические процессы не проводилось.
Во многие клеточные процессы при инфицировании вовлечены биологические мембраны, представляющие собой важные структуры растительных клеток (22). Именно на мембранах протекают фотохимические, элек-трон-транспортные, энергетические и другие реакции. В частности, пиг-мент-белковые комплексы фотосинтетического аппарата встроены во внутренние мембраны хлоропластов и разделены на два морфологических домена: тилакоиды гран и тилакоиды стромы (23, 24). Их дифференциация и функциональная активность поддерживаются специфическим составом липидов и жирных кислот (ЖК) (25). Необходимо отметить, что индуцированное патогенами ремоделирование мембран и изменение гомеостаза клеточных липидов у растений картофеля изучены недостаточно.
В настоящем исследовании впервые установлены сходства и различия структурно-функциональных изменений в листьях картофеля при инфицировании вирусом М и грибом A. solani.
Цель работы состояла в оценке изменений структуры тканей, хлоропластов, липидного профиля мембран и окислительно-восстановительного потенциала в листьях картофеля при инфицировании вирусом М и грибом Alternaria solani .
Методика. Среднеранний сорт картофеля Тана выращивали на опытном поле Самарского НИИ сельского хозяйства им. Н.М. Тулайкова (п.г.т. Безенчук, Самарская обл.) в 2022-2023 годах. Клубни растений высаживали во II декаде мая в четырех повторностях по 50 растений в каждой. Картофель выращивали без орошения и внесения удобрений при естественном освещении.
Диагностику фитопатогенов осуществляли в полевых условиях визуально, затем подтверждали методом ПЦР. Для выделения нуклеиновых кислот из листьев использовали набор реагентов Фитосорб (ООО «НПФ Син-тол», Россия). Растительный материал (100 мг) гомогенизировали в 1 мл буфера, добавляли 500 мкл лизирующего раствора и 15 мкл протеиназы К. Образцы инкубировали в течение 30 мин при 60 °С. ДНК элюировали в 200 мкл бидистиллированной воды при 60 °С в течение 10 мин с последу- ющим центрифугированием при 13500 g на высокоскоростной центрифуге MicroSpin 12 («SIA Biosan», Латвия). Качество и количество выделенной ДНК (OD260/280) оценивали с помощью флуориметра Qubit 4 («Thermo Fisher Scientific», США).
Идентификацию и дифференциальную диагностику вирусов проводили методом полимеразной цепной реакции в реальном времени, совмещенной с реакцией обратной транскрипции (ОТ-ПЦР-РВ), с использованием коммерческого набора реагентов Potato Virus M, Potato Virus Y, Potato Virus S-РВ (ООО «НПФ Синтол», Россия). Амплификацию осуществляли на приборе для ПЦР-РВ Quant Studio 5 («Thermo Fisher Scientific», США) по следующей программе: 15 мин при 45 ° С, 5 мин при 95 ° С; 15 с при 95 ° С, 40 с при 60 ° С (для данного этапа включено считывание сигнала флуоресценции) (50 циклов).
Для проведения физиологических и биохимических анализов на естественном фоне заражения в начале цветения собирали листья среднего яруса с 3-4 растений, зараженных вирусом М (ВМ) и грибом A . solani (A). Контролем (К) служили листья незараженных растений. Листья в каждом из вариантов объединяли в общую массу, из них формировали три навески по 0,5-1,0 г и хранили в жидком азоте.
Для определения оводненности листьев 1 г сырой массы высушивали до постоянной массы при температуре 60 ° С. Содержание воды рассчитывали как отношение сухой массы к сырой массе и выражали в % от сырой массы.
Высечки из свежих листьев ( n = 30) фиксировали в 3,5 % растворе глутарового альдегида (ООО «Новохим», Россия) в фосфатном буфере (0,2 М водный раствор монофосфата калия, рН 7,4) («Merck», Германия). Структуру мезофилла определяли на поперечных срезах листьев, сделанных с помощью микротома HM 525 («Thermo Fisher Scientific», Германия). Препараты анализировали с использованием светового микроскопа B-500TPL («Optika S.r.l.», Италия). Определяли линейные размеры и объем хлоропластов. Число хлоропластов подсчитывали в суспензии клеток после мацерации листовых высечек в растворе 1 N соляной кислоты (ООО «АО Реахим», Россия) при нагревании до 50 ° С в течение 10 мин (26). Число устьиц подсчитывали на нижней стороне листа на площади 1 см2, одновременно измеряли их длину в мкм с помощью светового микроскопа B-500TPL («Optika S.r.l.», Италия), оснащенного камерой С-P20.
Белки выделяли из 0,5 г свежезамороженных листьев с помощью холодного натрий-фосфатного буферного раствора. Для приготовления 1 л буфера брали 8,0 г хлорида натрия, 0,2 г хлорида калия, 1,4 г гидрофосфата натрия, 0,24 г монофосфата калия («Merck KGaA», Германия), все растворяли в дистиллированной воде и доводили до pH 7,4 гидроксидом натрия («Merck KGaA», Германия). Полученный гомогенат разделяли в течение 15 мин при 8000 g с помощью центрифуги ОПн-8 (СССР). К осадочному материалу добавляли 10 мл 0,05 % Triton Х-100 («Panreac Qu i mica SLU», Испания), суспензию перемешивали и выдерживали 1 сут при 4 ° С. Количество мембранных белков (МБ) определяли по методу O.H. Lowry с соавт. (27) c детекцией продукта реакции на спектрофотометре PromEcoLab PE-3000UV («Shanghai Mapada Instruments Co., Ltd.», Китай) при λ = 750 нм, использовали калибровочные графики со стандартным раствором бычьего сывороточного альбумина Calbiochem™ BSA («Merck KGaA», Германия).
Фотосинтетические пигменты экстрагировали из 0,5 г свежих листьев холодным ацетоном (90 %) (АО «Химреактив», Россия). Количественное содержание хлорофиллов а, b и каротиноидов определяли спектрофотометрически (PromEcoLab PE-3000UV) соответственно при λ = 662 нм, λ = 645 нм и λ = 470 нм (28).
Водорастворимые фенольные соединения выделяли из сухого растительного материала. Навеску (0,25-0,5 г) заливали 20 мл дистиллированной воды и экстрагировали при комнатной температуре в течение 1 сут. К 1 мл аликвоты экстракта добавляли 9 мл дистиллированной воды, 1 мл реактива Folin-Denis’ reagent («Sigma-Aldrich», Швейцария), 1 мл насыщенного раствора карбоната натрия и оставляли на 40 мин для развития устойчивого окрашивания. Оптическую плотность раствора определяли при λ = 725 нм (PromEcoLab PE-3000UV) (29). В качестве стандарта для построения калибровочной кривой использовали галловую кислоту.
Содержание свободного пролина в предварительно высушенном растительном материале определяли с кислым нингидриновым реактивом (30). К навеске (0,025 г) добавляли 3 мл дистиллированной воды, кипятили на водяной бане в течение 10 мин. Отбирали 1 мл отфильтрованного экстракта, добавляли 1 мл уксусной кислоты, 1 мл нингидринового реактива, состоящего из нингидрина (1,25 г) (АО «Купавнареактив», Россия), растворенного в 20 мл 6 М ортофосфорной кислоты (ООО «АО Реахим», Россия) и 30 мл ледяной уксусной кислоты (ООО «АО Реахим», Россия). Смесь растительного экстракта и реагента инкубировали в кипящей водяной бане 1 ч. Реакцию останавливали, помещая пробирки в лед. Оптическую плотность раствора измеряли при λ = 520 нм (PromEcoLab PE-3000UV). При построении калибровочной кривой для количественного определения использовали химически чистый пролин («Sigma-Aldrich», США).
Интенсивность перекисного окисления липидов (ПОЛ) оценивали по содержанию малонового диальдегида (МДА) после реакции с тиобарби-туровой кислотой (АО «Вектон», Россия). Для этого 0,5 г свежезамороженных листьев гомогенезировали в 10 мл 0,1 М Tris-HCI. К 3 мл гомогената добавляли 2 мл 0,5 % трихлоруксусной кислоты (ООО «АО Реахим», Россия) и выдерживали полученную смесь на кипящей бане в течение 30 мин. Количество МДА определяли при λ = 532 нм (PromEcoLab PE-3000UV) (31).
Липиды экстрагировали из 1 г свежезамороженных листьев смесью хлороформ: метанол 1:1 (v/v) (33). Липиды разделяли методом высокоэффективной тонкослойной хроматографии (ТСХ) на пластинах с закрепленным силикагелем марки Sorbfil (ООО «ИМИД», Россия). Фосфолипиды (ФЛ) разделяли с помощью систем растворителей хлороформ:метанол:бен-зол:аммиак 130:60:20:12 (v/v, первое направление); хлороформ:метанол:бен-зол:ацетон:уксусная кислота 140:60:20:10:8 (v/v второе направление) (производители реактивов АО «База ¹ 1 Химреактивов», АО «ЭКОС-1», ООО «СигмаТек»», Россия). Гликолипиды (ГЛ) разделяли методом одномерной ТСХ в системе растворителей ацетон: бензол: вода 91:30:8 (v/v). Нейтральные липиды (НЛ) анализировали методом одномерной 2-кратной ТСХ с последовательным использованием растворителей толуол: гексан: муравьиная кислота 140:60:1 (v/v, первое направление), гексан:диэтиловый эфир:му-равьиная кислота 60:40:1 (v/v, второе направление). Хроматографические пластины проявляли опрыскиванием 10 % H2SO4 в метаноле с последующим прогреванием в течение 15 мин при 180 °С. Производители реактивов — АО «База ¹ 1 Химреактивов», ООО «СигмаТек», ООО «Компонент-Реактив», ООО «Кузбассоргхим» (Россия). Количество липидов определяли денситометрически (ДенСкан-04, Россия). Хроматограммы анализировали в режиме параболической аппроксимации по градуировочным кривым. В качестве стандартов для построения калибровочных графиков использовали моногалактозилдиацилглицерин (МГДГ), фосфатидилхолин и холестерин («Sigma-Aldrich», США) (32).
Метиловые эфиры ЖК получали кипячением липидного экстракта листьев в 2,5 % растворе соляной кислоты (ООО «СигмаТек», Россия) в метаноле. Полученные эфиры анализировали на газовом хроматографе Кристалл 5000.2 (ЗАО СКБ «Хроматэк», Россия) в изотермическом режиме с использованием капиллярной колонки 105 м½0,25 мм (Rtx-2330, «Restek Corp.», США). Температура колонки — 180 ° С, испарителя и детектора — 260 ° С, скорость тока газа-носителя (гелий) — 2 мл/мин. Индекс ненасыщенности ЖК (ИНЖК) рассчитывали по формуле: X P / /100, где P j — содержание (масса, %) каждой ненасыщенной ЖК, умноженное на число ее двойных связей.
Для статистического анализа параметров листьев (число и размеры устьиц и хлоропластов в клетках мезофилла) использовали среднее значение из 30 повторностей ( n = 30). Биохимический анализ проводили в 3 биологических пробах, составленных из листьев 3-4 растений в каждом варианте, которые анализировали в 3 аналитических повторностях для каждой биологической пробы ( n = 3, N = 3). Данные таблиц и рисунков представлены в виде средних значений ( M) со стандартными ошибками (±SEM). Дополнительно был проведен дисперсионный анализ (one-way ANOVA) для проверки) значимых различий между средними значениями групп данных при p < 0,05. Статистическую обработку выполняли в программах Statistica 8.0 for Windows («StatSoft, Inc.», США), Past 3 (« 0 yvind H.», Норвегия) и Microsoft Excel 2003 и 2010 ( «Microsoft Corp.», США).
Результаты. Инфицированные листья картофеля сорта Тана отличались от контрольных деформацией при заражении вирусом и наличием некротических пятен при заражении грибом. Исследование поперечных срезов выявило ряд структурных изменений в строении фотосинтетических тканей у инфицированных растений.
Мезофилл контрольных и зараженных растений был представлен одним слоем палисадной и четырьмя слоями губчатой паренхимы. Клетки палисадной ткани плотно прилегали друг к другу. Клетки губчатой паренхимы незараженных растений имели преимущественно округлую форму, располагались рыхло и образовывали большие межклетники. Отличительной особенностью мезофилла при инфицировании вирусом М стало более плотное расположение клеток губчатой паренхимы и меньшее межклеточное пространство. Грибное заражение наблюдалось в основном в середине листа, где проходит проводящий пучок, при этом затрагивались близлежащие клетки губчатой паренхимы, которые также были плотнее сгруппированы, а в части из них отсутствовали хлоропласты. Вероятно, более плотное расположение клеток губчатой паренхимы облегчало распространение патогенов между клетками. Уменьшение межклеточного пространства могло приводить к снижению эффективности фотосинтеза, поскольку межклетники создают внутреннюю газовую среду и способствуют газообмену.
Показатель оводненности листьев не менялся при действии вируса, но снижался при заражении грибом с 81,4 до 70,0 % (p < 0,05) (рис. 1, А).
Число устьиц на единицу площади в незараженных листьях составляло в среднем 28 тыс. шт/см2. При вирусной инфекции их число не менялось, а при грибной — увеличивалось на 10 % (p < 0,05) (см. рис. 1, Б). При этом устьица инфицированных листьев в обоих случаях заражения имели меньшие линейные размеры в сравнении с контрольными вариантами (см. рис. 1, В). Полученные данные показывают, что устьичный аппарат принимает участие в ответе на инфекцию. При этом снижение размера устьиц можно рассматривать как проявление протекторных свойств для ограничения возможных путей проникновения патогенов (13), а увеличение их числа — как компенсацию снижения скорости газообмена, вызванного изменением структуры тканей.
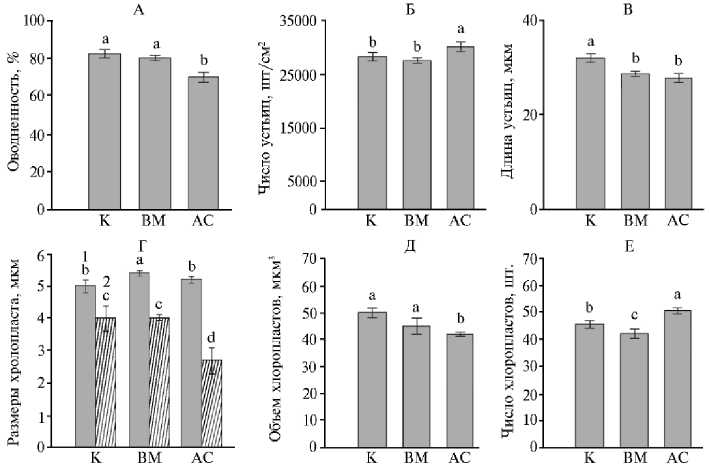
Рис. 1. Параметры структуры листа незараженных (К) и инфицированных вирусом М (ВМ) и грибом Alternaria solani (АС) растений картофеля ( Solanum tuberosum L.) сорта Тана: А — овод-ненность листа ( n = 3, N = 3), Б — число устьиц ( n = 30), В — длина устьиц ( n = 30), Г — длина (1) и ширина хлоропласта (2) ( n = 30), Д — объем хлоропласта ( n = 30), Е — число хлоропластов ( n = 30) ( M ±SEM; опытное поле Самарского НИИСХ им Н.М. Тулайкова, Самарская обл., 2022-2023 годы).
Разными латинскими буквами обозначены статистически значимые различия между средними значениями групп данных при p < 0,05.
При инфицировании существенно менялась структура хлоропластов: при грибной инфекции уменьшалась ширина хлоропласта, а при заражении вирусом М увеличивалась длина (см. рис. 1, Г). Объем хлоропластов уменьшался только при заражении грибом (см. рис. 1, Д). В этом же случае увеличивалось число хлоропластов в клетках палисадной паренхимы (рис. 1, Е). Такое изменение морфометрических параметров может свидетельствовать о появлении разного рода аномалий хлоропластов, зависящих от типа патогена (16).
-
1. Содержание фотосинтетических пигментов (мг/г сухой массы) в листьях не-зараженных (К) , инфицированных вирусом М (ВМ) и грибом Alternaria solani (АС) растений картофеля ( Solanum tuberosum L.) сорта Тана ( M ±SEM, n = 3, N = 3; опытное поле Самарского НИИСХ им Н.М. Тулайкова, Самарская обл., 2022-2023 годы)
|
Показатель |
К 1 |
ВМ |
АС |
|
Хлорофилл а |
6,8±0,3a |
5,5±0,2b |
3,5±0,2c |
|
Хлорофилл b |
2,3±0,2a |
1,7±0,1b |
1,3±0,1c |
|
Каротиноиды |
1,7±0,2a |
1,5±0,3a |
0,8±0,1b |
|
Сумма пигментов |
10,8±0,7a |
8,7±0,6b |
5,6±0,4c |
|
Хлорофилл а/хлорофилл b |
3,0 |
3,2 |
2,7 |
|
Хлорофиллы/каротиноиды |
5,3 |
4,8 |
6,0 |
Разными латинскими буквами обозначены достоверные различия между средними значениями групп дан- ных при p < 0,05.
Содержание пигментов служит одним из показателей функциональной активности фотосинтетического аппарата и устойчивости растений (14,
-
18). Общее количество фотосинтетических пигментов (хлорофиллы a, b и каротиноиды) в нашем опыте снижалось под действием обоих видов патогенов. При заражении вирусом М содержание хлорофиллов уменьшалось на 20-25 % (p < 0,05). При грибном заражении количество всех групп пигментов уменьшалось в 1,5-2,0 раза (p < 0,05) (табл. 1). Изменение соотношений хлорофилл а/хлорофилл b, хлорофиллы/каротиноиды свидетельствует о структурно-функциональной перестройке фотосинтетического аппарата у инфицированных растений (32).
Пигменты вместе с белками интегрированы в фотосинтетические мембраны тилакоидов и находятся в непосредственном контакте с глицеро-липидами (33). Основными структурными компонентами этих мембран служат галактолипиды — МГДГ и дигалактозилдиацилглицерин (ДГДГ), суль-фохиновозилдиацилглицерин (СХДГ) и фосфатидилглицерин (ФГ). Фосфолипиды входят в состав плазмалеммы, непластидных эндомембран и обо- лочки хлоропластов.
В листьях, зараженных обоими видами патоганов, более чем в 2 раза снижалась доля МГДГ по сравнению с контролем (рис. 2, А).
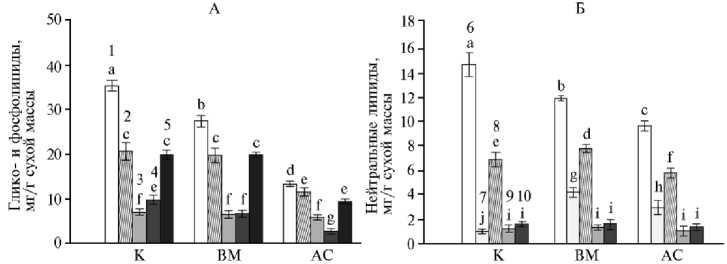
Рис. 2. Содержание липидов в листьях незараженных (К), инфицированных вирусом (ВМ) и грибом Alternaria solani (АС) растений картофеля ( Solanum tuberosum L.) сорта Тана: 1 — монога-лактозилдиацилглицерин, 2 — дигалактозилдиацилглицерин, 3 — сульфохиновозилдиацилг-лицерин, 4 — фосфатидилглицерол, 5 — другие фосфолипиды; 6 — эфиры стеринов, 7 — триацилглицерин, 8 — свободные жирные кислоты, 9 — стерины, 10 — диацилглицерин ( M ±SEM, n = 3, N = 3; опытное поле Самарского НИИСХ им Н.М. Тулайкова, Самарская обл., 2022-2023 годы).
Разными буквами обозначены статистически значимые различия между средними значениями групп данных при p < 0,05.
Вследствие этого изменилось соотношение между МГДГ и ДГДГ, которое в зеленых листьях растений обычно варьирует в пределах 1,5-2,0. При вирусном и грибном заражении показатель снизился до 1,1. Оба вида заражения приводили к снижению содержания ФГ — единственного фосфорсодержащего липида в составе мембран тилакоидов (см. рис. 2, А). При этом изменения в содержании СХДГ не превышали 10 % в сравнении с контролем.
Известно, что частичная недостаточность МГДГ повышает проводимость тилакоидных мембран при высокой интенсивности света, что приводит к большему фотоингибированию и может снизить эффективность использования света (34). ДГДГ, СХДГ и ФГ способствуют формированию гран и стабилизируют структурную организацию отдельных субъединиц фотосинтетического аппарата (35). Истощение таких классов липидов, как МГДГ и ФГ, вместе с изменением состава пигментов свидетельствует о существенной реорганизации биологических мембран, в которые встроены субъединицы фотосинтетического аппарата.
Стерины — еще одна группой соединений, входящих в состав мембран. Их содержание мало изменялось в зараженных листьях. Однако существенно менялось содержание других компонентов НЛ, обеспечивающих энергетический резерв клетки и принимающих участие в биосинтезе и формировании молекулярного разнообразия мембранных липидов, — эфиров стеринов (ЭС), триацилглицеринов (ТАГ), свободных ЖК (СЖК) и ди-ацилглицеринов (ДАГ) (25).
Установлено уменьшение количества ЭС при воздействии вируса и гриба соответственно в 1,2 и 1,5 раза (p < 0,05) (см. рис. 2, Б). На фоне снижения ЭС отмечено значительное повышение (в 3 раза и более) концентрации ТАГ. Снижение количества ЭС и увеличение ТАГ, по-видимому, связано с необходимостью создания энергетического резерва для фотосинтетического аппарата и может расцениваться как защитная реакция растений на действие патогенов.
В составе ЖК липидов, оказывающих влияние на текучесть и проницаемость мембран (36), были выявлены изменения только при грибном поражении. Значение ИНЖК в этом случае составило 1,5, в то время как в контроле и при вирусном поражении — 1,8 (табл. 2).
2. Состав жирных кислот (ЖК) в листьях незараженных (К) , инфицированных вирусом М (ВМ) и грибом Alternaria solani (АС) растений картофеля ( Solanum tuberosum L.) сорта Тана ( M ±SEM, n = 3, N = 3; опытное поле Самарского НИИСХ им Н.М. Тулайкова, Самарская обл., 2022-2023 годы)
|
ЖК, % суммы 1 |
К |
1 ВМ |
] АС |
|
С 12:0 |
0,1±0,0a |
0,2±0,1a |
- |
|
С 14:0 |
1,0±0,2а |
0,8±0,2а |
1,1±0,1а |
|
С 16:0 |
18,7±0,3a |
18,3±0,1a |
22,5±0,2b |
|
С 16:1 |
3,0±0,2a |
2,7±0,3a |
2,1±0,3b |
|
С 17:0 |
0,7±0,2a |
0,7±0,3a |
0,5±0,3a |
|
X |
5,0±0,4a |
4,4±0,5b |
3,0±0,4c |
|
С 18:0 |
2,2±0,1a |
2,3±0,2a |
4,2±0,2b |
|
С 18:1n9 |
2,2±0,2a |
2,0±0,1a |
2,3±0,1a |
|
С 18:2n6 |
20,2±0,1a |
20,0±0,1a |
19,8±0,2a |
|
С 18:3n3 |
44,4±0,3a |
45,5±0,2a |
37,0±0,1b |
|
С 20:0 |
1,4±0,2a |
1,5±0,2a |
3,4±0,3b |
|
С 22:0 |
0,3±0,1a |
0,6±0,2a |
1,3±0,1b |
|
С 22:2 |
0,0±0,0a |
0,1±0,0b |
0,3±0,1b |
|
С 24:0 |
0,5±0,1a |
0,6±0,2a |
1,0±0,1b |
|
ИНЖК |
1,8±0,2a |
1,8±0,1a |
1,5±0,3b |
Примечание. Х — не идентифицированные ЖК, ИНЖК — индекс ненасыщенности ЖК. Прочерк означает, что соответствующая жирная кислота отсутствовала.
Разными латинскими буквами обозначены достоверные различия между средними значениями групп данных при p < 0,05.
Ненасыщенность ЖК менялась за счет увеличения содержание пальмитиновой (С 16:0 ) и стеариновой (С 18:0 ), а также снижения содержания по-линенасыщенной линоленовой (С 18:3 ) ЖК. Кроме того, 2-кратно увеличивалось содержание компонентов с длиной цепи более 20 атомов углерода, что нетипично для листьев высших растений, но характерно для грибов (37). Увеличение доли С 22:0 , С 22:2 и С 24:0 свидетельствовало о специфическом проявлении патологии.
Одним из негативных процессов при патогенезе считается усиление ПОЛ в растительных тканях (38). В зараженных грибом листьях наблюдали 3-кратное увеличение содержания МДА — маркера окисления. При вирусной инфекции показатель МДА был сопоставим с контролем (см. рис. 3, А), но при этом содержание МБ снижалось на 35 % (p < 0,05) (см. рис. 3, Б). Причиной развития окислительного стресса становится интенсификация процессов образования активных форм кислорода (АФК) в результате снижения концентрации пигментов и нарушения структуры хлоропластов. АФК как реакционноспособные молекулы могут привести к нарушению целостности мембран за счет повреждения липидов и белков (39). Так, оба вида патогенов вызывали 1,5-2-кратное снижение концентрации некоторых классов ГЛ и ФЛ, способных подвергаться окислению, в (см. рис. 2).
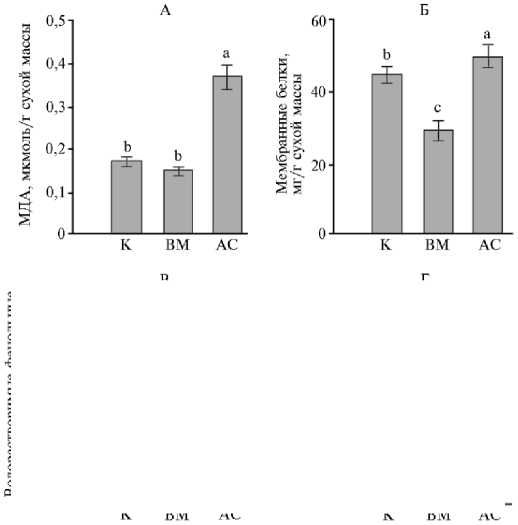
Рис. 3. Параметры редокс-гомостаза в листьях незараженных (К) , инфицированных вирусом М (ВМ) и грибом Alternaria solani (АС) растений картофеля ( Solanum tuberosum L.) сорта Тана: А — МДА, Б — мембранные белки, В — водорастворимые фенольные соединения, Г — свободный пролин ( M ±SEM, n = 3, N = 3; опытное поле Самарского НИИСХ им Н.М. Тулайкова, Самарская обл., 2022-2023 годы).
Разными латинскими буквами обозначены статистически значимые различия между средними значениями групп данных при p < 0,05.
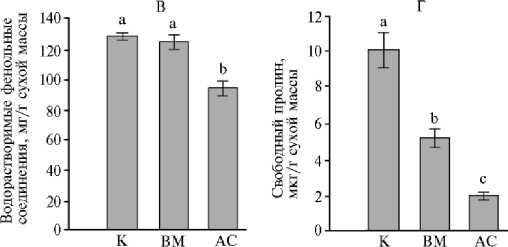
Однако однозначной связи между процессами окисления и снижением количества липидов и белков мы не обнаружили. Причиной подобного несоответствия, по-видимому, было то обстоятельство, что развитие болезни и защитная реакция происходят одновременно, а молекулы АФК принимают непосредственное участие в регуляции антиоксидантной защиты, в том числе с участием фенольных соединений и аминокислоты пролина (39-41). Содержание фенольных соединений, которые способствуют быстрому удалению поврежденных биомолекул, снижалось в 1,4 раза (p < 0,05) только в листьях картофеля, пораженных грибом (см. рис. 3, В). Содержание пролина снижалось в 2-5 раз (p < 0,05) при обоих видах инфицирования (см. рис. 3, Г). Известно, что патогены могут вызывать изменение активности фермента пролиндегидрогеназы, ответственного за деградацию пролина (41). Можно предположить, что снижение его содержания вызвано не только способностью обезвреживать АФК, но и усилением активности фермента.
Таким образом, патогенез при грибном и вирусном поражении растений картофеля захватывает все структурные уровни организации от органного до мембранного. При этом мы отмечали как сходства, так и различия в развитии заболеваний. Изменение оводненности тканей листа, снижение количества антиоксидантов и увеличение содержания МДА оказались более выражены при грибной инфекции, снижение количества мембранных белков — при вирусной инфекции. К общим проявлениям патогенеза следует отнести реорганизацию пространственного распределения клеток губчатой паренхимы, уменьшение объема пластид, снижение количества пигментов и липидов. Однако механизмы проявления патогенности различны. При заражении вирусом изменения связаны с тем, что хлоропласты становятся мишенью для его размножения. Вероятно, снижение количества пигментов и липидов фотосинтетических мембран связано с изменением активности ферментов, участвующих в синтезе этих компонентов de novo. В свою очередь, патогенность гриба сопряжена с выработкой фитотоксинов, вызывающих образование большого количества молекул АФК. Этим объясняется высокий уровень перекисного окисления липидов и снижение количества ненасыщенных жирных кислот. Следовательно, как сходства, так и различия структурно-функциональных изменений в листьях картофеля становятся следствием специфичности развития инфекционного процесса.


