Структурные изменения легочных артерий после транслюминальной баллонной ангиопластики у пациентов с хронической тромбоэмболической легочной гипертензией
Автор: Яровой С.Ю., Данилов Н.М., Матчин Ю.Г., Чазова И.Е.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Цель. Оценить влияние транслюминальной ангиопластики легочных артерий (ТЛА) на структурные изменения легочных артерий у неоперабельных пациентов с хронической тромбоэмболической легочной гипертензией (ХТЭЛГ).Материалы и методы. В исследование был включен 21 пациент с неоперабельной формой ХТЭЛГ. Проводилось определение клинических, гемодинамических параметров, измерение диаметра легочных артерий с помощью ангиографии, 11 пациентам - дополнительно измерение структурных показателей легочных артерий с помощью внутрисосудистого ультразвукового исследования (ВСУЗИ), исходно, сразу после ТЛА и после серии ТЛА.Результаты. Всего было выполнено 50 процедур ТЛА - серии из 2,3±1,5 этапов ТЛА на одного пациента. Продолжительность наблюдения - 165 (88;248) дней. После серии ТЛА отмечалась положительная динамика клинических и гемодинамических параметров, в том числе функционального класса, дистанции в тесте 6-минутной ходьбы, среднего давления в легочной артерии (срДЛА), легочного сосудистого сопротивления (ЛСС). По данным ангиографии продолжение дилятации артерий после первой ТЛА наблюдалось на уровне сегментарных артерий и ветвей 1-го порядка субсегментарных артерий. При ВСУЗИ наибольшие изменения определялись в ветвях 1-го и 2-го порядка субсегментарных легочных артерий - увеличение наружного и внутреннего диаметра, площади просвета сосуда, уменьшение площади сосудистой стенки. Была выявлена статистическая связь между диаметром ветвей 1-го порядка субсегментарных артерий после ТЛА и срДЛА (r=-0,74, p=0,006), сердечным выбросом (r=0,71, p=0,010), ЛСС(r=-0,78, p=0,003).Заключение. ТЛА у неоперабельных пациентов с ХТЭЛГ приводит к стойкому увеличению просвета баллонированных сосудов. В отдаленном периоде происходит положительное ремоделирование легочных артерий с наибольшим эффектом дистальнее уровня субсегментарных артерий. Диаметр сосудов на этом уровне имеет выраженную корреляционную связь с гемодинамическим результатом ТЛА.
Хроническая тромбоэмболическая легочная гипертензия, транслюминальная баллонная ангиопластика легочных артерий, внутрисосудистое ультразвуковое исследование, положительное ремоделирование
Короткий адрес: https://sciup.org/143173302
IDR: 143173302 | DOI: 10.38109/2225-1685-2020-4-12-20
Текст научной статьи Структурные изменения легочных артерий после транслюминальной баллонной ангиопластики у пациентов с хронической тромбоэмболической легочной гипертензией
*Автор, ответственный за связь с редакцией: Яровой Сергей Юрьевич – младший научный сотрудник отдела гипертонии Института клинической кардиологии им. А.Л. Мясникова, Федеральное государственное бюджетное учреждение «Национальный Медицинский Исследовательский Центр кардиологии» Министерства здравоохранения Российской Федерации, e-mail: , , адрес: 121552, г. Москва, улица 3-я Черепковская, 15А
Данилов Николай Михайлович – доктор медицинских наук, ведущий научный сотрудник отдела гипертонии Института клинической кардиологии им. А.Л. Мясникова, Федеральное государственное бюджетное учреждение «Национальный Медицинский Исследовательский Центр кардиологии» Министерства здравоохранения Российской Федерации, e-mail: ,
Матчин Юрий Георгиевич – доктор медицинских наук, заведующий отделением рентгенэндоваскулярных методов диагностики и лечения №2 Института клинической кардиологии им. А.Л. Мясникова, Федеральное государственное бюджетное учреждение «Национальный Медицинский Исследовательский Центр кардиологии» Министерства здравоохранения Российской Федерации, 8-495-414-68-53, e-mail: yumatchin@gmail. com,
Чазова Ирина Евгеньевна – академик РАН, доктор медицинских наук, профессор, заместитель генерального директора по научно-экспертной работе, руководитель отдела гипертонии Института клинической кардиологии им. А.Л. Мясникова, Федеральное государственное бюджетное учреждение «Национальный Медицинский Исследовательский Центр кардиологии» Министерства здравоохранения Российской Федерации, 8-495-414-61-33, e-mail: ,
*Author, responsible for communication with the editors: Sergey Y. Yarovoy – MD, junior researcher of Hypertension Department of Institute of Clinical Cardiology named after A.L. Myasnikov, Federal State Budgetary Institution National Medical Research Center of Cardiology of the Ministry of Healthcare of the Russian Federation, , , address: 3d Cherepkovskaya st., 15А, Moscow, Russian Federation, 121552
Nikolay M. Danilov – Dr. of Sci. (Med.), leading researcher of Hypertension department of Institute of Clinical Cardiology named after A.L. Myasnikov, Federal State Budgetary Institution National Medical Research Center of Cardiology of the Ministry of Healthcare of the Russian Federation, ndanilov1@ ,
Yuri G. Matchin – Dr. of Sci. (Med.), head of the Endovascular diagnosis and treatment department №2 of Institute of Clinical Cardiology named after A.L. Myasnikov, Federal State Budgetary Institution National Medical Research Center of Cardiology of the Ministry of Healthcare of the Russian Federation, , 8-495-414-68-53,
Irina E. Chazova – Academician of the Russian Academy of Science, Dr. of Sci. (Med.), Professor, Deputy Director General for research and expert work, head of Hypertension department of Institute of Clinical Cardiology named after A.L. Myasnikov, Federal State Budgetary Institution National Medical Research Center of Cardiology of the Ministry of Healthcare of the Russian Federation, , 8-495-414-61-33,
For quotation: Sergey Y. Yarovoy, Nikolay M. Danilov, Yuri G. Matchin, Irina E. Chazova. Structural changes of the pulmonary arteries after balloon pulmonary angioplasty in patients with chronic thromboembolic pulmonary hypertension. Eurasian heart journal. 2020;(4):12-20 (In Russ.)].
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) – прекапиллярная форма легочной гипертензии (ЛГ), обычно формирующаяся как осложнение перенесенной массивной тромбоэмболии легочной артерии. Два звена патогенеза – обструкция крупных и средних сосудов организованными тромбами и вторичные изменения микроциркуляторного русла – приводят к повышению легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА). При естественном течении заболевания исходом ХТЭЛГ, как и других групп ЛГ, является дисфункция правых отделов сердца, сердечная недостаточность и смерть [1-4].
Одним из методов лечения ХТЭЛГ является транслюминальная баллонная ангиопластика легочных артерий (ТЛА) [1-3]. В современных рекомендациях ТЛА имеет класс IIb, уровень доказательности С и может рассматриваться при неблагоприятном соотношении риск/польза от операции тромбэндартерэктомии и у неоперабельных пациентов [2]. Поскольку, несмотря на совершенствование хирургической техники, до 37% пациентов с ХТЭЛГ признаются неоперабельными (чаще всего вследствие дистального типа поражения легочных артерий или тяжелой сопутствующей патологии) [5,6], данный метод получает все большее распространение. В настоящее время также рассматривается применение ТЛА в сочетании с другими вариантами лечения ХТЭЛГ – с ЛАГ-специфической терапией и в комбинации с оперативным лечением [7,8].
В работах отечественных авторов ранее было показано, что в отдаленном периоде после ТЛА у пациентов продолжается постепенная дилатация прооперированных артерий, и указанные изменения имеют высокую силу корреляции с дистанцией в тесте 6-минутной ходьбы (Т6МХ) . К сожалению, данные о механизме обратного ремоделирования, то есть структурного изменения легочных артерий, после ТЛА ограничены небольшим объемом наблюдений и отсутствием данных об особенностях строения стенки таких артерий.
Цель настоящего исследования – оценить влияние ТЛА на структурные изменения легочных артерий у неоперабельных пациентов с ХТЭЛГ.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на базе отдела гипертонии и лаборатории рентгенэндоваскулярных методов диагностики и лечения в амбулаторных условиях при научно-диспансерном отделе Института клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» МЗ РФ. Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской декларации по правам человека, протокол исследования одобрен локальным этическим комитетом ФГБУ «НМИЦ кардиологии» МЗ РФ. Всеми пациентами до включения в исследование были подписаны информированные согласия на участие в исследовании и обработку персональных данных.
В проспективное исследование был включен 21 пациент с неоперабельной ХТЭЛГ. Диагноз был верифицирован по результатам предварительного обследования в ФГБУ «НМИЦ кардиологии» МЗ РФ в соответствии с действующими клиническими рекомендациями. Состояние каждого пациента обсуждалось мультидисциплинарной комиссией в составе кардиолога, рентге-нэндоваскулярного и сердечно-сосудистого хирурга, после чего принималось решение о возможности выполнения операции ТЭЭ.
Критерии включения в исследование:
-
• наличие хронических/ организованных тромбов/ эмболов в легочных артериях эластического типа по данным инвазивных/ неинвазивных визуализирующих методов исследования (ангиопульмонография, МСКТ ангиопуль-монография, перфузионная сцинтиграфия легких);
Таблица 1. Исходные клинические, гемодинамические и структурные параметры
Table 1. Baseline clinical, hemodynamic and structural parameters
|
Пол мужчины / женщины |
9 / 12 |
|
Возраст, лет |
60,1±13,9 |
|
Давность ТЭЛА, годы |
4,9±3,9 |
|
ФК: I : II : III : IV |
2,9±0,7 1(4,8%) : 5 (23,8%) : 13 (61,9%) : 2 (9,5%) |
|
Т6МХ, м |
350 (230;426) |
|
BNP, пг/мл |
452,5 (156,0;565,2) |
|
срДЛА, мм рт.ст. |
48 (43;52) |
|
СВ, л/мин |
3,75 (3,0;4,8) |
|
ЛСС, дин*сек/см5 |
910 (675;1076) |
|
Dдист, мм |
2,2 (2,0; 2,4) |
|
Dсред, мм |
3,9 (2,9;5,0) |
|
Dпрокс, мм |
8,4 (6,0;9,2) |
Примечание: ФК – функциональный класс по классификации Всемирной Организации Здравоохранения; Т6МХ – тест 6-минутной ходьбы; BNP – мозговой натрийуретический пептид; срДЛА – среднее давление в легочной артерии; СВ – сердечный выброс; ЛСС – легочное сосудистое сопротивление; Dдист – диаметр ветви легочной артерии в дистальном отделе по данным ангиопульмонографии; Dсред – диаметр ветви легочной артерии в среднем отделе по данным ангиопульмонографии; Dпрокс – диаметр ветви легочной артерии в проксимальном отделе по данным ангиопульмонографии.
Note: FC – functional class according to the classification of the World Health Organization; 6MWT – 6-minute walking test; BNP – brain natriuretic peptide; mPAP – mean pulmonary artery pressure; CO – cardiac output; PVR – pulmonary vascular resistance; Ddist – diameter of the branch of pulmonary artery in the distal section according to angiopulmonography; Dmid – diameter of the branch of pulmonary artery in the middle section according to angiopulmonography; Dprox – diameter of the branch of pulmonary artery in the proximal section according to angiopulmonography.
-
• среднее давление в легочной артерии (срДЛА) > 25 мм рт.ст., давление заклинивания в легочной артерии (ДЗЛА) ≤ 15 мм рт.ст., легочное сосудистое сопротивление (ЛСС) > 240 дин*сек/см5;
-
• неоперабельный статус пациента: дистальный тип поражения легочных артерий, ЛСС > 1100 дин*сек/см5, тяжелая дисфункция правого желудочка, тяжелые и средней степени тяжести заболевания легких, выраженная сопутствующая патология других органов и систем, кровотечение любой локализации или высокий риск кровотечения в послеоперационном периоде, невозможность проведения искусственного кровообращения с циркуляторным арестом.
Критерии исключения:
-
• пациенты с ЛГ любой другой этиологии, кроме ХТЭЛГ;
-
• хроническая болезнь почек IV и V стадии;
-
• жизнеугрожающие нарушения ритма;
-
• непереносимость/ аллергия на рентгеноконтрастные препараты в анамнезе;
-
• острая тромбоэмболия легочной артерии;
-
• нарушение мозгового кровообращения давностью менее
-
1 месяца;
-
• острый воспалительный процесс любого происхождения;
-
• индивидуальная непереносимость илопроста;
-
• необходимость значительной коррекции поддерживающей диуретической терапии в течение последних 3 месяцев;
-
• отсутствие эффективной антикоагулянтной терапии на протяжении последних 3 месяцев;
-
• крайне тяжелое состояние пациента, не позволяющее провести оперативное вмешательство.
Характеристика пациентов
Из 21 включенного в исследование пациента 9 – мужчины, 12 – женщины. Возраст пациентов в среднем составил 60,1±13,9 года. Период времени, прошедший после перенесенной тромбоэмболии легочной артерии – 4,9±3,9 года. Среди пациентов, включенных в исследование, были представлены все 4 функциональных класса (ФК) согласно классификации Всемирной Организации Здравоохранения (ВОЗ) – I : II : III : IV соответственно 1 пациент (4,8%) : 5 пациентов (23,8%) : 13 пациентов (61,9%) : 2 пациента (9,5%); среднее значение ФК 2,9±0,7. Пройденная дистанция в тесте 6-минутной ходьбы (Т6МХ) – 350 (230;426)
метров. Параметры гемодинамики по данным КПОС перед включением пациента в исследование: среднее давление в легочной артерии (срДЛА) – 48 (43;52) мм рт.ст., легочное сосудистое сопротивление (ЛСС) – 910 (675;1076) дин*сек/см5. Диаметр ветви легочной артерии, планируемой к ТЛА (условно в дистальном, среднем и проксимальном отделах) по данным ангиопульмо-нографии: Dдист 2,2 (2,0; 2,4), Dсред 3,9 (2,9;5,0), Dпрокс 8,4 (6,0;9,2). Более подробная характеристика пациентов представлена в таблице 1.
Причины неоперабельности пациентов: кровотечение любой локализации или высокий риск кровотечения в послеоперационном периоде – у 2 (9,5%) пациентов, сопутствующая выраженная патология других органов и систем – у 2 (9,5%) пациентов, ЛСС более 1100 дин*сек/см5 – у 5 (23,8%) пациентов, дистальный тип поражения легочных артерий – у 16 (76,1%) пациентов.
11 пациентам из 21 также проводилось внутрисосудистое ультразвуковое исследование (ВСУЗИ). В таблице 2 приведены некоторые характеристики сосудов на 3 уровнях измерения по данным ВСУЗИ.
Все пациенты в течение периода наблюдения получали адекватную антикоагулянтную и диуретическую терапию, при необходимости – другую симптоматическую терапию ХТЭЛГ. ЛАГ-специфические препараты в течение периода наблюдения не назначались.
МЕТОДЫ
Оценка клинических, гемодинамических параметров, структурных характеристик легочных артерий проводилась перед первой ТЛА и после серии ТЛА. Изучение структуры легочной артерии проводилось только на первой ветви, подвергшейся ТЛА.
У всех пациентов проводился сбора анамнеза для уточнения давности перенесенной ТЭЛА, оценивалось функциональное состояние (дистанция в Т6МХ, уровень мозгового натрийуретического пептида (BNP), ФК в соответствии с классификацией ВОЗ).
Всем пациентам, включенным в исследование, выполнялась КПОС согласно принятому стандартному протоколу. С использованием четырехканального катетера Свана-Ганца длиной 110 см диаметром 6F (Swan–Gantz CCO CEDV, Edwards Lifescience, Irvine, CA, США) путем прямой манометрии последовательно измерялись гемодинамические параметры малого
Таблица 2. Исходные структурные параметры легочных артерий по данным ВСУЗИ
Table 2. Baseline structural parameters of pulmonary arteries according to IVUS data
|
Dпром нар, мм |
2,1 (1,9;2,3) |
|
Dдист нар, мм |
3,9 (2,9;5,0) |
|
Dсред нар, мм |
4,9 (4,05;5,75) |
|
Dпром вн, мм |
1,8 (1,65;1,8) |
|
Dдист вн, мм |
2,58 (2,25;2,75) |
|
Dсред вн, мм |
3,33 (2,95;4,3) |
Примечание: Dпром нар – наружный диаметр ветви легочной артерии в промежуточном» отделе по данным ВСУЗИ; Dпром вн – внутренний диаметр ветви легочной артерии в промежуточном отделе по данным ВСУЗИ; Dдист нар – наружный диаметр ветви легочной артерии в дистальном отделе по данным ВСУЗИ; Dдист вн – внутренний диаметр ветви легочной артерии в дистальном отделе по данным ВСУЗИ; Dсред нар – наружный диаметр ветви легочной артерии в среднем отделе по данным ВСУЗИ; Dсред вн – внутренний диаметр ветви легочной артерии в среднем отделе по данным ВСУЗИ.
Note: Dint ex – the outer diameter of the branch of pulmonary artery in the intermediate section according to IVUS data; Dint in – inner diameter of the branch of pulmonary artery in the intermediate section according to IVUS data; Ddist ex – outer diameter of the branch of pulmonary artery in the distal section according to IVUS data; Ddist in – inner diameter of the branch of pulmonary artery in the distal section according to IVUS data; Dmid ex – outer diameter of the branch of pulmonary artery in the middle section according to IVUS data; Dmid in – inner diameter of the branch of pulmonary artery in the middle section according to IVUS data.
круга кровообращения. Сатурация смешанной венозной крови измерялась на портативном анализаторе i-STAT1 Analyzer (Abbott, США), сатурации артериальной крови – с помощью пульсоксиметра на пальце руки. Вычисление СВ проводилось с помощью непрямого метода Фика. Из полученных данных также рассчитывалось ЛСС.
Для уточнения характера поражения легочных артерий и определения целей для ТЛА, измерения диаметра легочных артерий выполнялась обзорная и селективная ангиопульмоно-графия. По диагностическому проводнику Amplatz Type Super Stiff J-Tip (Boston Scientific, США) диаметром 0,035 дюйма длиной 260 см в правую или левую легочную артерию доставлялся диагностический катетер диаметром 6 F длиной 110 см Pigtail 145 (Cordis, США), затем проводилась съемка в прямой и боковой проекции в режиме цифровой субтракции. Селективная съемка целевой ветви легочной артерии проводилась непосредственно перед ТЛА с помощью направляющего катетера. Все измерения выполнялись на программном обеспечении RadiAnt DICOM Viewer 2020.1.1. на кадре с максимальным заполнением артерии контрастным препаратом. Для калибровки использовался кончик направляющего катетера. Измерялся диаметр просвета сосуда в проксимальном (Dпрокс), среднем (Dсред) и дистальном (Dдист) отделах – на уровне ветвей легочной артерии 3-го, 4-го и 5-го порядка, т.е. сегментарных, субсегментарных артерий и ветвей субсегментарных артерий. Выбор идентичных точек при повторном измерении осуществлялся с помощью анатомических ориентиров (особенностей хода артерии, отхождения ветвей). Также определялся расчетный показатель – индекс ремоделирования (ИР), соответствующий относительному изменению диаметра артерии при контрольном обследовании после серии ТЛА по сравнению с диаметром сразу после ТЛА.
Для выполнения ВСУЗИ в дистальный отдел выбранной ветви легочной артерии устанавливался интракоронарный проводник, по нему проводился электронный ВСУЗИ-катетер Eagle
Dпрокс Dсред Dдист
Рисунок 2. Изменение диаметра ветви легочной артерии по данным ангиографии
Figure 2. Changes of the diameter of pulmonary artery branch according to angiography
Примечание: ТЛА – транслюминальная баллонная ангиопластика легочных артерий; Dдист – диаметр ветви легочной артерии в дистальном отделе по данным ангиопульмонографии; Dсред – диаметр ветви легочной артерии в среднем отделе по данным ангиопульмонографии; Dпрокс – диаметр ветви легочной артерии в проксимальном отделе по данным ангиопульмонографии.
Note: BPA – balloon pulmonary angioplasty; Ddist – diameter of the branch of pulmonary artery in the distal section according to angiopulmonography; Dmid – diameter of the branch of pulmonary artery in the middle section according to angiopulmonogra-phy; Dprox – diameter of the branch of pulmonary artery in the proximal section according to angiopulmonography.
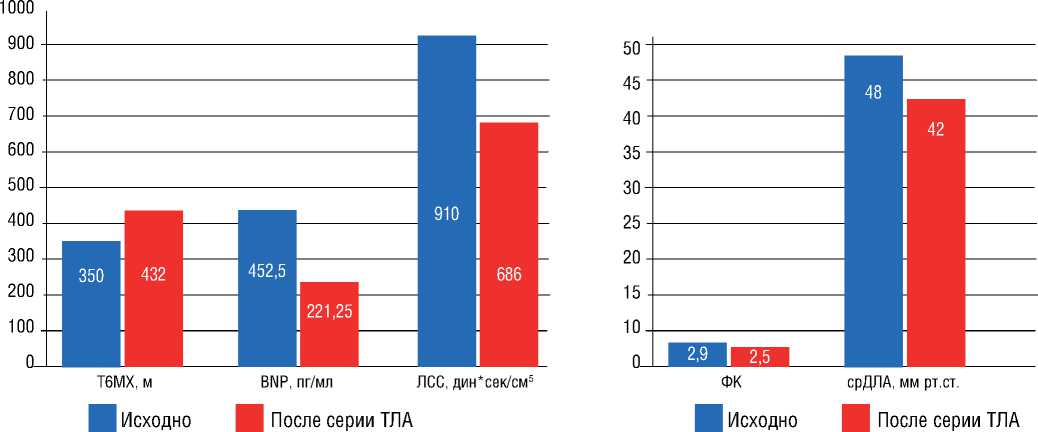
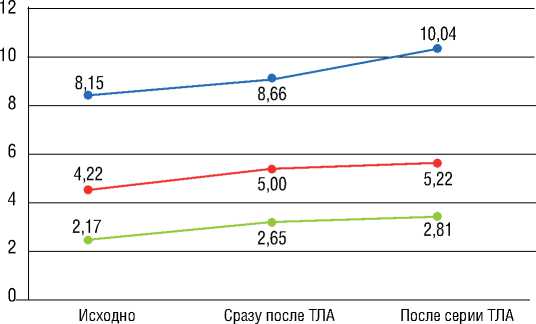
Рисунок 1. Сравнение клинических и гемодинамических параметров до и после ТЛА
Figure 1. Comparison of clinical and hemodynamic parameters before and after BPA
Примечание: ТЛА – транслюминальная баллонная ангиопластика легочных артерий; ФК – функциональный класс по классификации Всемирной Организации Здравоохранения; Т6МХ – тест 6-минутной ходьбы; BNP – мозговой натрийуретический пептид; срДЛА – среднее давление в легочной артерии; ЛСС – легочное сосудистое сопротивление.
Note: BPA – balloon pulmonary angioplasty; FC – functional class according to the classification of the World Health Organization; 6MWT – 6-minute walking test; BNP – brain natriuretic peptide; mPAP – mean pulmonary artery pressure; PVR – pulmonary vascular resistance.
16 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2020
Eye® Platinum (Volcano Therapeutics, Inc., США) с 64-мя пьезоэлементами, частотой 20 МГц (рис. 1). Измерения проводились на среднем (сред), дистальном (дист) и промежуточном (пром) уровне – ветви легочной артерии 4-го, 5-го и 6-го порядка, то есть субсегментарные легочные артерии и их ветви. При достижении ВСУЗИ-катетером дистального отдела выбранной ветви выполнялась обратная тракция в ручном режиме длиной 60-80 мм. Данные записи с датчика обрабатывались на консоли Volcano S5 (Volcano Therapeutics, Inc., США). Для измерения необходимых параметров были использованы поперечные серошкальные изображения. Выбор одних и тех же участков артерии при оценке параметров в динамике проводился, как и при ангиографии, по анатомическим ориентирам. Измерялись следующие параметры: диаметр сосуда, ограниченный наружной эластической мембраной (Dнар); диаметр просвета сосуда, ограниченный интимой сосуда (Dвн); минимальная, максимальная и средняя толщина стенки сосуда, соответствующая толщине комплекса интима-медиа (Тmin, Тmax, Тmean); площадь просвета сосуда, ограниченная интимой (LA); площадь стенки сосуда, соответствующая площади, занимаемой комплексом интима-медиа (Sст); площадь, ограниченная наружной эластической мембраной (EEM); относительная толщина стенки сосуда (RWT) – Tmean / Dвн; относительная площадь, занимаемая стенкой сосуда (%Sст) – Sст / EEM; индекс ремо- делирования по данным ВСУЗИ (ИР ВСУЗИ) – относительное изменение диаметра артерии при контрольном обследовании после серии ТЛА по сравнению с диаметром сразу после ТЛА по данным ВСУЗИ.
Для выполнения ТЛА использовался аппарат Allura Xper FD-10 (Philips, Нидерланды). По направляющему катетеру JR 4 или MPA 1 через пораженный участок проводился интракоронарный проводник. С помощью проводника доставлялись и позиционировались баллоны диаметром от 2 до 6 мм для поэтапной дилатации пораженного участка. Подходящий размер баллона определялся по данным количественной ангиографии и ВСУ-ЗИ. Для снижения риска реперфузионного отека вмешательство выполнялось с учетом значения индекса PEPSI (Pulmonary Edema Predictive Scoring Index), а после ТЛА всем пациентам проводилась активная диуретическая терапия фуросемидом и неинвазивная вентиляция легких в режиме Continuous positive airway pressure (СPAP) в течение нескольких часов.
Статистический анализ
Статистический анализ данных проводился при помощи программы STATISTICA 12,5 (StatSoft, Россия). Данные описательной статистики представлены в виде: медианы, 25% и 75% квартилей – Me (Q1;Q3); среднего значения и стандартного отклонения – M±s. При сравнении показателей двух зависимых групп был применен непараметрический тест Вилкоксона, при
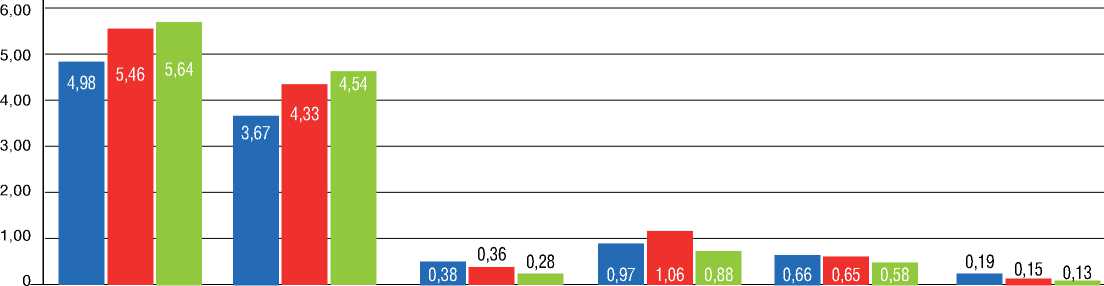
Тmean, мм
RWT
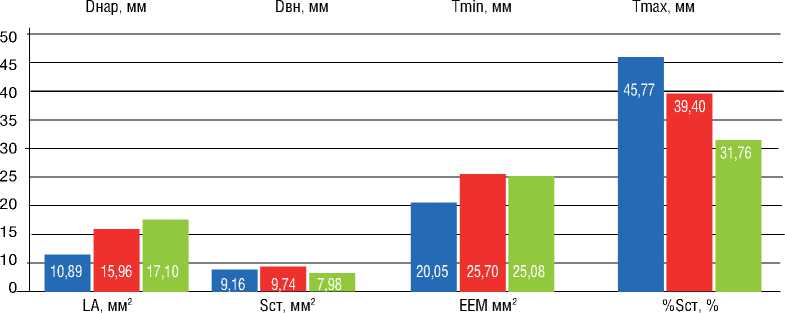
Рисунок 3. Динамика параметров ветви легочной артерии, подвергшейся ТЛА, в среднем отделе Figure 3. Dynamics of the parameters of pulmonary artery branch undergone BPA in the middle section
■ Исходно
Сразу после ТЛА
После серии ТЛА
Примечание: ТЛА – транслюминальная баллонная ангиопластика легочных артерий; Dнар – диаметр сосуда, ограниченный наружной эластической мембраной; Dвн – диаметр просвета сосуда, ограниченный интимой сосуда; Tmin, Tmax, Tmean – минимальная, максимальная и средняя толщина стенки сосуда, соответствующая толщине комплекса интима-медиа; LA – площадь просвета сосуда, ограниченная интимой; Sст – площадь стенки сосуда, соответствующая площади, занимаемой комплексом интима-медиа; EEM – площадь, ограниченная наружной эластической мембраной; RWT – относительная толщина стенки сосуда, Tmean / Dвн; Sст% – относительная площадь, занимаемая стенкой сосуда, Sст / EEM.
Note: BPA – balloon pulmonary angioplasty; Dex – the diameter of the vessel, limited by the external elastic membrane; Din – diameter of the vessel lumen, limited by the intima of the vessel; Tmin / Тmax / Tmean – maximum / minimum / mean vessel wall thickness corresponding to the thickness of the intima-media complex; LA – the lumen area of the vessel, limited by the intima; S – the area of the vessel wall corresponding to the area, occupied by the intima-media complex; EEM – the area, bounded by the external elastic membrane; RWT – relative vessel wall thickness, Tmean / Din; %S – the relative area, occupied by the vessel wall, S / EEM.
сравнении двух независимых групп – непараметрический тест Манна-Уитни. Оценка корреляционных связей проводилась при помощи непараметрического теста Спирмена. Статистически достоверными признавались различия при уровне значимости меньше 5% (p < 0,05).
РЕЗУЛЬТАТЫ
Включенному в исследование 21 пациенту было выполнено 50 процедур ТЛА – серии из 2,3±1,5 этапов ТЛА на одного пациента. Интервал между вмешательствами составил 4-8 недель. Клинически значимых осложнений вмешательства отмечено не было. Срок наблюдения составил 165 (88;248) дней с первой ТЛА, 72 (36;110) дней после последней ТЛА серии.
После серии ТЛА было выявлено статистически достоверное увеличение дистанции в Т6МХ (р=0,003). Также была отмечена положительная динамика других наблюдавшихся клинических и гемодинамических параметров (рис. 1). Значение СВ осталось на прежнем уровне – 3,85 л/мин исходно и 3,7 л/мин после серии ТЛА (p=0,850).
При анализе изменения размера артерий, подвергшихся ангиопластике, по данным ангиографии, были получены следующие данные: в проксимальном, среднем и дистальном отделах сразу после ТЛА наблюдалось статистически достоверное увеличение диаметра артерий (p<0,05); при сравнении диаметра артерий исходно и при контрольном визите – также увеличение диаметра в проксимальном (р=0,062), среднем (р=0,110) и дистальном (р=0,017) отделах; тенденция к изменению размера артерии при контрольном визите после серии ТЛА по сравнению с состоянием сразу после ТЛА была наиболее выражена определялась только в проксимальном (р=0,333) и дистальном (р=0,286) отделах (рис. 2). Индекс ремоделирования для проксимального отдела составил 11,9%, среднего – 3,5%, дистального – 4,7%.
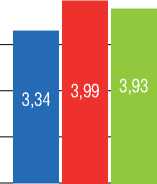
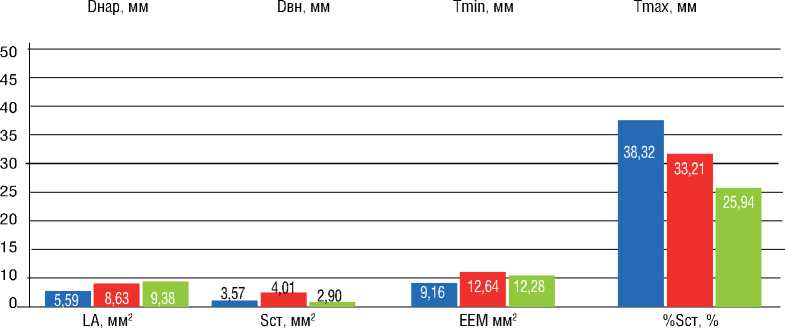
При сравнении результатов ВСУЗИ в среднем отделе исходно и после ТЛА наблюдалось увеличение наружного (Dнар) и внутреннего (Dвн) диаметра сосуда (р=0,074 и 0,093), площади просвета сосуда (LA) (р=0,093), площади, ограниченной наружной эластической мембраной (EEM) (р=0,047), небольшое увеличение площади стенки сосуда (Sст) (р=0,169) при уменьшении относительной площади стенки сосуда (Sст%) (р=0,241). Анализ результатов исходно и после серии ТЛА выявил следующие изменения: увеличение Dнар и Dвн (р=0,062 и р=0,076), LA (р=0,074), уменьшение Tmean (р=0,225), Sст% (р=0,138). При сравнении состояния ветви легочной артерии по данным ВСУЗИ сразу после ТЛА и при контроле после серии ТЛА: уменьшение Sст% (р=0,103). Четкой динамики других показателей ВСУЗИ зафиксировано не было (рис. 3).
6,00
5,00
0,40 0,41 0,40
0,31
0,16 0,14 0,10
0,18 0,24 0,20
0,66 0,57
Тmean, мм
Рисунок 4. Динамика параметров ветви легочной артерии, подвергшей ТЛА, в дистальном отделе Figure 4. Dynamics of the parameters of pulmonary artery branch undergone BPA in the distal section

RWT
Исходно
Сразу после ТЛА
После серии ТЛА
Примечание: ТЛА – транслюминальная баллонная ангиопластика легочных артерий; Dнар – диаметр сосуда, ограниченный наружной эластической мембраной; Dвн – диаметр просвета сосуда, ограниченный интимой сосуда; Tmin, Tmax, Tmean – минимальная, максимальная и средняя толщина стенки сосуда, соответствующая толщине комплекса интима-медиа; LA – площадь просвета сосуда, ограниченная интимой; Sст – площадь стенки сосуда, соответствующая площади, занимаемой комплексом интима-медиа; EEM – площадь, ограниченная наружной эластической мембраной; RWT – относительная толщина стенки сосуда, Tmean / Dвн; Sст% – относительная площадь, занимаемая стенкой сосуда, Sст / EEM.
Note: BPA – balloon pulmonary angioplasty; Dex – the diameter of the vessel, limited by the external elastic membrane; Din – diameter of the vessel lumen, limited by the intima of the vessel; Tmin / Тmax / Tmean – maximum / minimum / mean vessel wall thickness corresponding to the thickness of the intima-media complex; LA – the lumen area of the vessel, limited by the intima; S – the area of the vessel wall corresponding to the area, occupied by the intima-media complex; EEM – the area, bounded by the external elastic membrane; RWT – relative vessel wall thickness, Tmean / Din; %S – the relative area, occupied by the vessel wall, S / EEM.
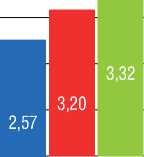
При попарном анализе данных ВСУЗИ в дистальном отделе были получены следующие результаты: сравнение показателей исходно и сразу после ТЛА – увеличение Dнар и Dвн (р=0,005 и 0,028), LA (р=0,028), EEM (р=0,005), уменьшение RWT (р=0,139) и Sст% (р=0,074); исходно и после серии ТЛА – увеличение Dнар и Dвн (р=0,023 и 0,025), LA (р=0,025), EEM (р=0,107), уменьшение Tmean (р=0,198), RWT (р=0,098), Sст (р=0,225), Sст% (р=0,061); сразу после ТЛА и при контрольном обследовании после серии ТЛА – уменьшение максимальной толщины стенки (Tmax) (р=0,068), Tmean (р=0,043), RWT (р=0,138), Sст (р=0,043), Sст% (р=0,138) (рис. 4).
При оценке 3 серий результатов показателей ВСУЗИ в промежуточном отделе наблюдались следующие закономерности: при сравнении исходно и сразу после ТЛА – увеличение Dнар и Dвн (р=0,008 и 0,011), Tmax (р=0,091), Tmean (р=0,051), LA (р=0,008), Sст (р=0,011), EEM (р=0,012), Sст% (0,314); исходно и после серии ТЛА – увеличение Dнар и Dвн (р=0,006 и 0,010), LA (р=0,006), EEM (р=0,010); сразу после ТЛА и при контрольном обследовании после серии ТЛА – увеличение Dнар и Dвн
(р=0,097 и 0,086), LA (р=0,097), уменьшение RWT (р=0,138), Sст (р=0,043), Sст% (р=0,138) (рис. 5).
Индексы ремоделирования легочной артерии по данным ВСУЗИ (ИР ВСУЗИ) составили: в среднем отделе – 9%, в дистальном отделе – 15%, в промежуточном отделе – 11%.
В настоящем исследовании также был проведен анализ ранговой корреляции Спирмена для определения взаимосвязи клинических и гемодинамических параметров со структурными характеристиками легочных артерий, полученными с помощью ангиографии. Были выявлены умеренные и сильные связи между следующими показателями: срДЛА после серии ТЛА и диаметром ветви легочной артерии (D ЛА) в дистальном отделе после серии ТЛА (r=-0,74, p=0,006); СВ после серии ТЛА и D ЛА в дистальном отделе после серии ТЛА (r=0,71, p=0,010); ЛСС после серии ТЛА и D ЛА в дистальном отделе после серии ТЛА (r=-0,78, p=0,003). Также отмечена корреляция между сроком наблюдения и ИР в проксимальном отделе (r=0,71, p=0,015). Статистический анализ корреляции с данными ВСУ-ЗИ не выполнялся в связи с малой выборкой пациентов.
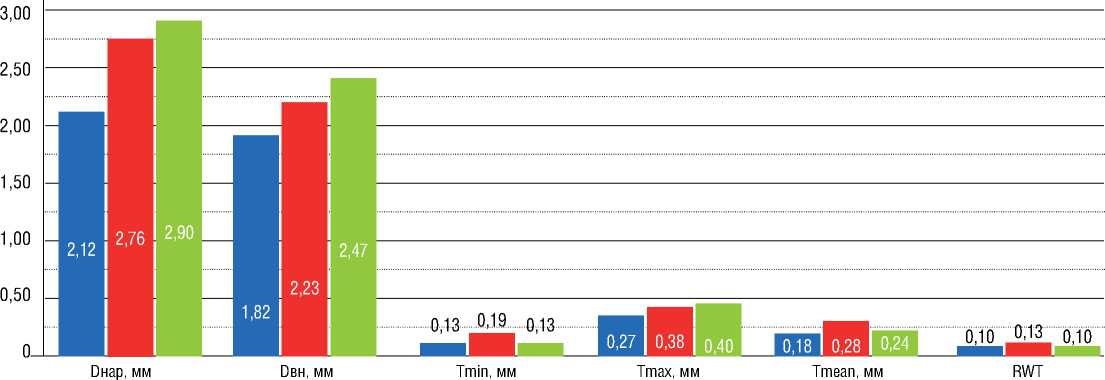
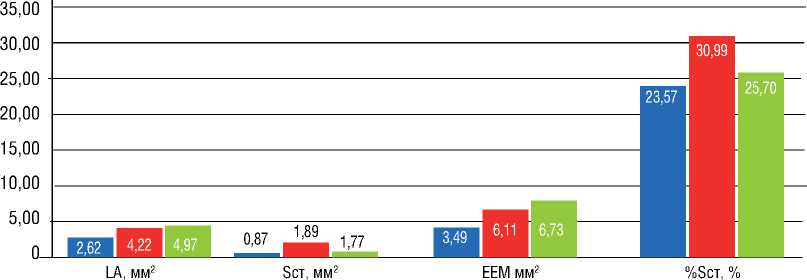
Рисунок 5. Динамика параметров ветви легочной артерии, подвергшей ТЛА, в промежуточном отделе
Figure 5. Dynamics of the parameters of pulmonary artery branch undergone BPA in the intermediate section
Исходно
Сразу после ТЛА
После серии ТЛА
Примечание: ТЛА – транслюминальная баллонная ангиопластика легочных артерий; Dнар – диаметр сосуда, ограниченный наружной эластической мембраной; Dвн – диаметр просвета сосуда, ограниченный интимой сосуда; Tmin, Tmax, Tmean – минимальная, максимальная и средняя толщина стенки сосуда, соответствующая толщине комплекса интима-медиа; LA – площадь просвета сосуда, ограниченная интимой; Sст – площадь стенки сосуда, соответствующая площади, занимаемой комплексом интима-медиа; EEM – площадь, ограниченная наружной эластической мембраной; RWT – относительная толщина стенки сосуда, Tmean / Dвн; Sст% – относительная площадь, занимаемая стенкой сосуда, Sст / EEM.
Note: BPA – balloon pulmonary angioplasty; Dex – the diameter of the vessel, limited by the external elastic membrane; Din – diameter of the vessel lumen, limited by the intima of the vessel; Tmin / Тmax / Tmean – maximum / minimum / mean vessel wall thickness corresponding to the thickness of the intima-media complex; LA – the lumen area of the vessel, limited by the intima; S – the area of the vessel wall corresponding to the area, occupied by the intima-media complex; EEM – the area, bounded by the external elastic membrane; RWT – relative vessel wall thickness, Tmean / Din; %S – the relative area, occupied by the vessel wall, S / EEM.
ОБСУЖДЕНИЕ
В настоящем исследовании количество выполненных ТЛА на одного пациента было ниже рекомендуемого рядом авторов для достижения целевого срДЛА [9,10]. Однако, достигнутая по нескольким клиническим и гемодинамическим параметрам положительная динамика позволяет говорить об уже развившемся эффекте ТЛА и предполагать наличие определенных структурных изменений в легочных артериях.
По данным ангиографии непосредственно после ТЛА происходит достоверное увеличение диаметра легочной артерии во всех исследуемых отделах – проксимальном, среднем и дистальном, что обусловлено непосредственным механическим воздействием во время ангиопластики и резким повышением давления ветви легочной артерии (в области с плохой перфузией до ТЛА). Продолжение изменения размеров легочной артерии в периоде наблюдения («положительное ремоделирование») может быть обусловлено непосредственно структурными изменениями ее стенки. Наибольший индекс ремоделирования наблюдался в проксимальном и дистальном отделе (т.е. на уровне сегментарных артерий и ветвей субсегментарных артерий), что позволяет предположить наличие структурных изменений у пациентов с ХТЭЛГ и на этом уровне – помимо уровня микроциркуляторного русла с диаметром сосудов менее 500 мкм [4]. Для уточнения конкретных патомор-фологических особенностей ветвей субсегментарных артерий может быть целесообразным проведение дополнительных гистологических исследований.
При проведении ВСУЗИ сразу после ТЛА у большинства пациентов наблюдалось увеличение абсолютной площади сосудистой стенки. Такие изменения, возникающие после бал-лонирования ветви легочной артерии и восстановления кровотока по ней, вероятно, следует рассматривать как явления локального отека сосудистой стенки на фоне механического повреждения эндотелия. В большей степени увеличение площади стенки наблюдалось в проксимальном отделе – область раздувания баллона и растяжения эндотелия, и в дистальном отделе – область воздействия высокого давления крови после резкого увеличения перфузии данного участка.
Также при ВСУЗИ во всех отделах отмечалось увеличение просвета, диаметра сосуда, уменьшение толщины и площади стенки сосуда сразу после ТЛА, а в дистальном и промежуточном отделах – также и в периоде наблюдения после серии ТЛА. При этом самая большая динамика изучаемых показателей была зафиксирована на уровне более мелких артерий (дистальном и промежуточном), что подтверждается расчетным показателем – индексом ремоделирования по ВСУЗИ. Полученные результаты согласуются с данными ангиографии и подтверждают наличие положительного ремоделирования легочных артерий на указанном уровне (ветви субсегментарных артерий 1-го и 2-го порядка). Пролонгированный эффект дилятации сосудов после ангиопластики также может быть рассмотрен и как негативный: при отсутствии в литературе в настоящее время данных гистологических исследований легочных артерий после ТЛА нельзя полностью исключить продолжение увеличения размера сосуда в периоде наблюдения в результате повреждающего действия высокого давления в легочной артерии. Однако клинические данные свидетельствует о дополнительном позитивном эффекте на функциональное состояние пациентов положительного ремоделирования легочных артерий после ТЛА . Также при оценке корреляционных связей была продемонстрирована умеренная и сильная корреляция гемодинамических параметров (среднего давления в легочной артерии, сердечного выброса, легочного сосудистого сопротивления) и диаметра легочной артерии в дистальном отделе по данным ангиографии. Кроме того, была выявлена положительная связь между сроком наблюдения пациента после первой ТЛА и индексом ремоделирования в проксимальном отделе, что подтверждает пролонгированный эффект от ТЛА и требует дальнейшего изучения.
Заключение
Транслюминальная баллонная ангиопластика легочных артерий у неоперабельных пациентов с хронической тромбоэмболической легочной гипертензией приводит к стойкому увеличению просвета баллонированных сосудов. В отдаленном периоде происходит положительное ремоделирование легочных артерий с наибольшим эффектом дистальнее уровня субсегментарных артерий. Диаметр сосудов на этом уровне имеет выраженную корреляционную связь с гемодинамическим результатом ангиопластики.
Список литературы Структурные изменения легочных артерий после транслюминальной баллонной ангиопластики у пациентов с хронической тромбоэмболической легочной гипертензией
- Чазова И.Е., Мартынюк Т.В. Клинические рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипертензии (I часть). Терапевтический архив. 2016;88(9):90-101. DOI: 10.17116/terarkh201688990-101
- Galiè N., Humbert M., Vachiery J. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J. 2015;37(1):67-119. DOI: 10.1093/eurheartj/ehv317
- Чазова И.Е., Мартынюк Т.В., Валиева З.С. и соавт. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии. Евразийский кардиологический журнал. 2020; (1): 78-122. DOI: 10.38109/2225-1685-2020-1-78-122
- Чазова И.Е., Мартынюк Т.В. (ред.), Авдеев С.Н. и соавт. Легочная гипертензия. М.: Практика, 2015. с. 81-102, 309-324, 563-604. 978-5-89816-138-5 ISBN: 978-5-89816-138-5
- D'Armini A., Morsolini M., Mattiucci G. et al. Pulmonary endarterectomy for distal chronic thromboembolic pulmonary hypertension. J Thorac Cardiovasc Surg. 2014;148(3):1005-1012.e2. DOI: 10.1016/j.jtcvs.2014.06.052
- Madani M., Auger W., Pretorius V. et al. Pulmonary Endarterectomy: Recent Changes in a Single Institution's Experience of More Than 2,700 Patients. Ann Am Thorac Soc. 2012;94(1):97-103. DOI: 10.1016/j.athoracsur.2012.04.004
- Yanaka K., Nakayama K., Shinke T. et al. Sequential Hybrid Therapy With Pulmonary Endarterectomy and Additional Balloon Pulmonary Angioplasty for Chronic Thromboembolic Pulmonary Hypertension. J Am Heart Assoc. 2018;7(13). DOI: 10.1161/jaha.118.008838
- Карабашева М.Б., Данилов Н.М., Сагайдак О.В. и соавт. Отдаленные результаты транслюминальной баллонной ангиопластики легочных артерий у пациентов с неоперабельной формой хронической тромбоэмболической легочной гипертензии. Системные гипертензии. 2019; 16(4): 27-32. DOI: 10.26442/2075082x.2019.4.190609
- Данилов Н.М., Матчин Ю.Г., Чазова И.Е. Баллонная ангиопластика легочных артерий при неоперабельной хронической тромбоэмболической легочной гипертензии. Consilium Medicum. 2016; 18 (5): 59-61. DOI: 10.26442/2075-1753_2016.5.59-61
- Lang I., Meyer B., Ogo T. et al. Balloon pulmonary angioplasty in chronic thromboembolic pulmonary hypertension. Eur Respir Rev 2017; 26:160119. DOI: 10.1183/16000617.5119-2016


