Структурные изменения плаценты на фоне гипертензивных расстройств во время беременности по данным магнитно-резонансной томографии и патоморфологического исследования: пилотное исследование
Автор: Кириллова Е.А., Мащенко И.А., Дурнова Е.Д., Дорохова Д.Д., Рощина Т.Ю., Маркина В.А., Рябоконь Н.Р., Осипова Н.А., Ишкараева В.В., Зазерская И.Е., Труфанов Г.Е.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Медицинская визуализация
Статья в выпуске: 5 т.15, 2025 года.
Бесплатный доступ
Актуальность. Гипертензивные расстройства осложняют до 10% беременностей, внося значительный вклад в статистику материнской и перинатальной заболеваемости и смертности. Ключевым звеном в патогенезе этих осложнений является плацентарная дисфункция. Ультразвуковое исследование (УЗИ) с допплерометрией, хотя и является стандартом оценки кровотока в системе мать–плацента–плод, ограничено в способности визуализировать структурные изменения плаценты. Магнитно-резонансная томография (МРТ), благодаря высокой тканевой контрастности и пространственному разрешению, рассматривается как перспективный неинвазивный метод, способный дополнить существующие подходы к оценке состояния плаценты при гипертензвиных расстройствах. Цель исследования: описать структурные изменения плаценты у беременных с гипертензивными расстройствами по данным МРТ и сопоставить полученные данные с результатами УЗИ и патоморфологического исследования. Материалы и методы. Проведено проспективное пилотное исследование по типу «случай–контроль» с участием 13 беременных с гипертензивными расстройствами во II и III триместрах. Выполнялись МРТ плаценты на томографе с индукцией магнитного поля 3 Тл с использованием стандартных импульсных последовательностей, УЗИ с допплерометрией и патоморфологическое исследование плацент после родоразрешения. Результаты. У 13 пациенток (средний возраст 33,7±6,1 года) МРТ выявила характерные изменения: диффузно-разлитые зоны пониженного МР-сигнала на Т2-ВИ (в 100% случаев), подчёркнутую дольчатость (54%), мелкозернистость долек (54%), а также нарушения кровообращения – инфаркты (69%) и гематомы (38%). Патоморфологические изменения были выявлены в 85% случаев. В 38% случаев МРТ обнаружила изменения, когда результаты допплерометрии были в пределах нормы. Выраженность изменений коррелировала с тяжестью гипертензивного расстройства и неблагоприятными исходами беременности. Заключение. МРТ позволяет выявить характерные структурные изменения плаценты при гипертензивных расстройствах, являющиеся прямым отражением сосудистых, иммунно-воспалительных и иных её поражений на микроскопическом уровне. Эти изменения могут быть выражены даже при нормальных показателях допплерометрии и связаны с неблагоприятными исходами беременности. МРТ предоставляет дополнительную информацию о состоянии плаценты при гипертензивных расстройствах, открывая перспективы для улучшения тактики ведения таких беременностей
Диагностическая визуализация [E01.370.350], состояние плаценты [A16.710], беременность [G08.686.784.769], гестационная гипертензия [C12.050.703.395], плацентарная недостаточность [C12.050.703.590.800], заболевания плаценты [C12.050.703.590], плацентарное кровообращение [G09.330.100.749], магнитно-резонансная томография [E01.370.350.825.500], ультразвуковое исследование [E01.370.350.850], гистологические методы [E01.370.225.750]
Короткий адрес: https://sciup.org/143185349
IDR: 143185349 | УДК: 618.36-073.756.8:618.3-06:616.12-008.331.1 | DOI: 10.20340/vmi-rvz.2025.5.MIM.2
Текст научной статьи Структурные изменения плаценты на фоне гипертензивных расстройств во время беременности по данным магнитно-резонансной томографии и патоморфологического исследования: пилотное исследование
Гипертензивные расстройства во время беременности представляют собой группу, объединяющую ряд заболеваний: хроническая артериальная гипертензия (ХАГ), гестационная артериальная гипертензия (ГАГ), преэклампсия (ПЭ) и эклампсия. Они осложняют до 10% беременностей во всём мире [1, 2], внося значительный вклад в структуру материнской и перинатальной заболеваемости и смертности. Патогенез этих состояний тесно связан с формированием и развитием плаценты, которая выступает центральным звеном в развитии заболевания [3]. Нарушение её функций приводит к различным осложнениям беременности, таким как преждевременные роды, преждевременная отслойка нормально расположенной плаценты, задержка внутриутробного развития плода и др. Отмечено также, что гипертензивные расстройства во время беременности увеличивают риск развития сердечно-сосудистых заболеваний и сахарного диабета у матери после завершения беременности, нарушений физического, психосоматического развития рождённых детей, что представляет собой значимую медицинскую и социальную проблему [2, 4].
«Золотым стандартом» в оценке состояния плаценты и кровотока в системе мать–плацента–плод является ультразвуковое исследование (УЗИ) с допплерометрией. Метод позволяет оценивать изменения резистивности сосудов, выражаемые в пульсационных индексах, в маточных артериях, артерии пуповины, средней мозговой артерии плода. Эти показатели позволяют судить о кровосонабжении плаценты и выраженности компенсаторных изменений в ответ на артериальную гипертензию [2, 5]. Однако данные имеют косвенный характер, а возможности УЗИ в выявлении структурных изменений ткани плаценты ограничены рядом факторов – низкими пространственным разрешением и тканевой контрастностью, небольшим полем обзора, зави- симостью результатов от оператора, а также от места прикрепления плаценты, положения плода в матке, индекса массы тела беременной [6, 7].
Широкие возможности в визуализации структурных изменений плаценты предоставляет метод магнитно-резонансной томографии (МРТ), который обладает техническими особенностями, позволяющими преодолевать указанные выше ограничения УЗИ, – крупное поле обзора, высокие пространственное разрешение и тканевой контраст, выбор различных импульсных последовательностей (ИП) [8, 9]. Так, стандартные Т2-взвешенные изображения (Т2-ВИ) позволяют одномоментно визуализировать форму, размеры, структуру плаценты, а также выявлять очаговые изменения, такие как инфаркты, гематомы и в комплексе с другими импульсными последовательностями дополнительно оценивать давность их возникновения [2, 7].
Хотя в настоящее время основным показанием к выполнению МР-исследования является патологическое прикрепление плаценты, перспективна роль МРТ в визуализации структурных и функциональных изменений плаценты при гипертензивных расстройствах с использованием таких методик, как BOLD-МРТ (Blood Oxygen Level Dependent – зависимая от уровня оксигенации крови), ASL-перфузия (Arterial Spin Labelling – метка артериального спина), IVIM-МРТ (Intravoxel Incoherent Motion – внутривоксельное некогерентное движение) и пр. [7, 10]. При этом структурная МР-визуализация является первым этапом при выполнении функциональных методик и может нести в себе существенную диагностическую информацию о состоянии плаценты.
Цель исследования: описать структурные изменения плаценты у беременных с гипертензивными расстройствами по данным магнитно-резонансной томографии и сопоставить полученные данные с результатами ультразвукового и патоморфологи-ческого исследований.
Материалы и методы
Проведено проспективное пилотное исследование типа «случай–контроль». МР-исследование плаценты было выполнено 13 пациенткам во II и III триместрах беременности с диагнозом гипертензивного расстройства во время беременности (гестационная артериальная гипертензия, хроническая артериальная гипертензия и преэклампсия) с одноплодной беременностью.
Распределение пациенток по типу гипертензивного расстройства во время беременности представлено в таблице 1. Диагнозы хронической артериальной гипертензии (ХАГ), умеренной преэк- лампсии (уПЭ), тяжёлой преэклампсии (тПЭ), а также преэклампсии, развившейся на фоне ХАГ (уПЭ/тПЭ+ХАГ), устанавливались на основании комплексной оценки жалоб, анамнеза, данных физикального, лабораторного и инструментального обследований в соответствии с действующими Клиническими рекомендациями Российского общества акушеров-гинекологов 2024 г. [2].
Критериями исключения являлись многоплодная беременность, наличие тяжёлой соматической патологии, абсолютные и относительные противопоказания к МРТ, отказ от участия. Исследование одобрено локальным этическим комитетом, от всех пациенток получено информированное согласие. У всех женщин магнитно-резонансное исследование плаценты выполнялось с научными целями, о чём они были проинформированы.
Магнитно-резонансное исследование плаценты выполнялось на высокопольном томографе с индукцией магнитного поля 3 Тл с использованием 18-канальной матричной катушки для тела, располагаемой над областью прикрепления плаценты в полости матки, и 32-канальной матричной катушки для позвоночника. Беременные укладывались на стол томографа головным концом вперёд на левый бок или левый полубок с использованием при необходимости валиков под правый бок и под ноги. Протокол включал получение Т2-ВИ с толщиной 4 мм (SSFSE single shot fast spin echo) в трёх стандартных плоскостях, Т2-ВИ с толщиной среза 3 мм в сагиттальной плоскости (TSE – turbo-spin echo) и Т1-взвешенных (3D-GRE gradient echo) изображений в сагиттальной плоскости с последующей реконструкцией в аксиальную и корональную, диффузионно-взвешенные изображения в аксиальной плоскости с использованием b-факторов со значениями 0, 50 и 600 с/мм2. МРТ плаценты оценивалось двумя независимыми врачами-рентгенологами с опытом в перинатальной визуализации не менее 3-х лет.
Общее время исследования не превышало 30 минут. По результатам МРТ плаценты проводили оценку её структурных изменений.
В день проведения МРТ выполнялось ультразвуковое исследование плаценты с допллерометрией кровотока с использованием конвексного датчика 31 Гц. Кровоток оценивался в маточных артериях (МА) и артерии пуповины (АП) с расчётом пульсационных индексов (ПИ) согласно референсным значениям для соответствующего гестационного возраста в соответствии с Клиническими рекомендациями Министерства здравоохранения Российской Федерации «Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода)» от 2022 г. [2].
Нарушения плодово-плацентарного кровотока (НППК) диагностировались при превышении 95-го процентиля ПИ.
После родоразрешения 13 плацент были направлены на патоморфологическое исследование для макро- и микроскопической оценки. Для микроскопического анализа забор материала производился из 10 точек с последующей фиксацией в 10% формалине, парафинизацией и окраской гематоксилином и эозином. При гистологическом исследовании плаценты патологические находки были разделены на три группы в соответствии с Международной классификацией поражений плаценты (Амстердам, 2015) [11]: сосудистые (инволюция, незрелость и диссоциированное развитие ворсин хориона, афункциональные гомогенные ворсины, синцитиальные узелки, хориоангиоз, инфаркт, псевдоинфаркт, гематома), иммунновоспалительные (продуктивные хориодецидуит и базальный децидуиты, очаговые гнойный хориоам-нионит и виллузит, интервиллузит) и другие (отложение фибриноида в межворсинчатом пространстве и ворсинах хориона, сужение межворсинчатого пространства).
Полученные данные анализировались с использованием описательных статистических методов с сопоставлением результатов МРТ плаценты, ультразвуковой допплерометрии системы мать– плацента–плод и патоморфологического исследования.
Результаты
В исследование вошло 13 пациенток в возрасте от 23 до 43 лет (средний возраст — 33,7±6,1 года). Средний гестационный возраст на момент исследования соответствовал 31,6±5,6 недель.
Диагнозы были распределены следующим образом: у 4 пациенток (31%) был установлен диагноз ХАГ, у 2 (15%) - уПЭ, у 4 (31%) - уПЭ+ХАГ, у 1 (8%) -тПЭ, у 2 (15%) - тПЭ+ХАГ.
У 8 (62%) из 13 беременных по данным ультразвуковой допплерометрии системы мать–плацента– плод определялось НППК, в т.ч. у 2 (25%) из 8 -изолированно в артерии пуповины, у 2 (25%) - в маточных артериях, у 4 (50%) - в АП и МА.
По данным МРТ плаценты, у 5 (38%) из 13 пациенток отмечались диффузно-разлитые зоны изоги-поинтенсивного МР-сигнала на Т2-ВИ по плодовой поверхности, у 7 (54%) из 13 - диффузно-разлитые зоны гипоинтенсивного МР-сигнала на Т2-ВИ по плодовой поверхности с формированием подчеркнутой дольчатости, в т.ч. у 3 (43%) из 7 - с распространением на материнскую поверхность. У 7 (54%) из 13 определялась мелкозернистая структу- ра долек плаценты. У 10 (77%) из 13 обследуемых отмечались признаки нарушения кровообращения различной степени давности: у 9 (69%) из 13 - инфаркты плаценты, у 5 (38%) из 13 - гематомы.
Патологически изменения плаценты по данным патоморфологического исследования определялись в 11 (85%) случаях из 13, при этом только сосудистые патологические находки определялись в 3 (27%) случаях из 11, патологические и иммунновоспалительные - в 1 (9%) случае из 11, сосудистые, иммунно-воспалительные и другие - в 7 (64%) случаях из 11.
Средний срок родоразрешения составил 35,1±3,9 н.г. В 4 (31%) случаях из 13 беременность завершилась срочными физиологическими родами, в 4 (31%) случаях из 13 - срочными родами путём операции кесарева сечения, в 5 (38%) случаях из 13 - преждевременными родами путём операции кесарева сечения. Средний балл по шкале Апгар на 1-й минуте составил - 7,2±0,7, на 5-й минуте - 8,3±0,6. На 1-й минуте балл по шкале Апгар у 2 (15%) пациенток из 13 составлял 6, у 7 (54%) - 7, у 4 (31%) - 8. На 5-й минуте балл по шкале Апгар у 1 (8%) пациентки составлял 7, у 7 (54%) - 8, у 5 (38%) - 9.
Обобщённые данные по каждой из 13 пациенток, включённых в исследование, представлены в таблицах 1 и 2.
Обсуждение
В основе гипертензивных расстройств во время беременности лежит нарушение процессов плацентации, в частности, поверхностная инвазия трофобласта и недостаточное ремоделирование спиральных артерий матки [12, 13]. Это приводит к децидуальной артериопатии, снижению маточноплацентарного кровотока, ишемии и хронической гипоксии плацентарной ткани [14]. Следствием этих процессов являются морфологические изменения в плаценте: формирование инфарктов, псевдоинфарктов и гематом, отложение фибриноида, увеличение количества синцитиальных узелков и другие признаки сосудистой мальперфузии, а также иммунно-воспалительные процессы [11]. Эти изменения на микроскопическом уровне имеют своё отражение на макроскопическом уровне и могут быть визуализированы с помощью магнитнорезонансной томографии.
Анализ представленных данных 13 пациенток с гипертензивными расстройствами во время беременности выявил ряд важных закономерностей в структурных изменениях плаценты, определяемых методом магнитно-резонансной томографии, и их корреляции с результатами допплерометрии и па-томорфологического исследования.
|
Таблица 1. Обобщённая таблица данных пациенток, включённых в исследование Table 1. Generalized data table of the patients included in the study |
||||||||||
|
№ пациентки |
Возраст |
ГВ (нед.)* |
Диагноз |
Допплерометрия |
МР-признаки |
Патологические изменения** |
||||
|
Изогипоинтенсивные зоны по плодовой поверхности |
Гипоинтенсивные зоны по плодовой (+), плодовой и материнской (++) поверхностям плаценты с подчеркнутой дольчатостью |
Мелкозернистость долек |
Нарушения |
|||||||
|
кровооб |
ращения |
|||||||||
|
Инфаркт |
Гематома |
|||||||||
|
1 |
34 |
39 |
ХАГ |
+ |
+ |
|||||
|
2 |
40 |
19 |
+ |
+ |
+ |
|||||
|
3 |
39 |
28 |
+ |
+ |
||||||
|
4 |
32 |
35 |
НППК (АП) |
+ |
+ |
|||||
|
5 |
23 |
37 |
уПЭ |
НППК (АП) |
+ |
+ |
+ |
++ |
||
|
6 |
29 |
33 |
НППК (МА) |
++ |
+ |
+ |
+ |
+++ |
||
|
7 |
26 |
32 |
уПЭ+ХАГ |
НППК (МА и АП) |
++ |
+ |
+ |
+++ |
||
|
8 |
32 |
39 |
+ |
|||||||
|
9 |
33 |
28 |
+ |
+ |
+++ |
|||||
|
10 |
41 |
34 |
НППК (МА и АП) |
+ |
+ |
+ |
+ |
+++ |
||
|
11 |
29 |
26 |
тПЭ |
НППК (МА и АП) |
+ |
+ |
+ |
+ |
+++ |
|
|
12 |
43 |
29 |
тПЭ+ХАГ |
НППК (МА) |
++ |
+ |
+ |
+++ |
||
|
13 |
37 |
32 |
НППК (МА и АП) |
+ |
+ |
+ |
+++ |
|||
Примечание: *Гестационный возраст на момент МР-исследования плаценты. **Патологические изменения плаценты по данным пато-морфологического микроскопического исследования: сосудистые поражения плаценты (+), сосудистые и иммунно-воспалительные поражения плаценты (++), сосудистые, иммунно-воспалительные и другие поражения плаценты (+++). АП – артерия пуповины; ГВ – гестационный возраст; МА – маточные артерии; НППК – нарушение плодово-плацентарного кровотока; тПЭ – тяжелая преэклампсия; тПЭ+ХАГ – тяжелая преэклампсия на фоне хронической артериальной гипертензии; уПЭ – умеренная преэклампсия; уПЭ+ХАГ – умеренная преэклампсия на фоне хронической артериальной гипертензии; ХАГ – хроническая артериальная гипертензия
Таблица 2. Исходы беременностей пациенток, включённых в исследование
Table 2. Pregnancy outcomes of the patients included in the study
|
№ пациентки |
ГВ (нед.)* |
Диагноз |
Тип родоразрешения |
Характер родоразрешения |
Срок родораз-решения (нед.) |
Шкала Апгар |
|
|
1 минута |
5 минута |
||||||
|
1 |
39 |
ХАГ |
Физиологическое |
Срочное |
39 |
8 |
9 |
|
2 |
19 |
Физиологическое |
Срочное |
37 |
8 |
9 |
|
|
3 |
28 |
Кесарево сечение |
Срочное |
38 |
7 |
9 |
|
|
4 |
35 |
Кесарево сечение |
Срочное |
37 |
8 |
9 |
|
|
5 |
37 |
уПЭ |
Физиологическое |
Срочное |
37 |
7 |
8 |
|
6 |
33 |
Кесарево сечение |
Срочное |
37 |
7 |
8 |
|
|
7 |
32 |
уПЭ+ХАГ |
Кесарево сечение |
Преждевременное |
32 |
6 |
7 |
|
8 |
39 |
Физиологическое |
Срочное |
39 |
8 |
9 |
|
|
9 |
28 |
Кесарево сечение |
Срочное |
37 |
7 |
8 |
|
|
10 |
34 |
Кесарево сечение |
Преждевременное |
35 |
7 |
8 |
|
|
11 |
26 |
тПЭ |
Кесарево сечение |
Преждевременное |
26 |
6 |
8 |
|
12 |
29 |
тПЭ+ХАГ |
Кесарево сечение |
Преждевременное |
30 |
7 |
8 |
|
13 |
32 |
Кесарево сечение |
Преждевременное |
33 |
7 |
8 |
|
Примечание: *Гестационный возраст на момент МР-исследования плаценты. ГВ – гестационный возраст; тПЭ – тяжелая преэклампсия; тПЭ+ХАГ – тяжелая преэклампсия на фоне хронической артериальной гипертензии; уПЭ – умеренная преэклампсия; уПЭ+ХАГ – умеренная преэклампсия на фоне хронической артериальной гипертензии; ХАГ – хроническая артериальная гипертензия.
Наиболее характерным МР-признаком в исследуемой группе стало формирование диффузноразлитых зон пониженной интенсивности МР-сигнала на Т2-ВИ по плодовой и/или материнской поверхностям плаценты: изогипоинтенсивных (рис. 1, А) и гипоинтенсивных (рис. 1, В, Д). Указанные зоны также имеют низкий МР-сигнал на ДВИ. При- знак определялся во всех 13 случаях (100%), и его появление может быть связано с формированием следующих изменений: диффузное отложение фибриноида в ворсинах хориона и межворсинчатом пространстве (рис. 1, Г), сужение последнего, в т.ч. на фоне неравномерного кровенаполнения ворсин и хориоангиоза (рис. 1, Б), а также развитие псевдоинфарктов (рис. 1, Е), инфарктов и кровоизлияний в структуре плаценты [9]. Фибриноид представляет собой эозинофильную субстанцию, состоящую из фибрина, фибриногена, плазменных белков и пр., и разделяется на фибриноподобный и матриксный. Первый возникает в результате активности материнских тромбоцитов и активации свертывающей системы крови, а также разрушения клеток трофобласта, второй является продуктом секреции вневорсинчатого трофобласта. Оба мо- гут обнаруживаться при нормально протекающей беременности, выполняя ряд важных функций в плаценте, включая опорную, защитную, транспортную и т.д. [15–17]. Однако увеличение площади отложения фибриноида представляет собой компенсаторную патологическую реакцию на мальперфу-зию и гипоксию плаценты, возникающую как следствие аномальных плацентации, инвазии и ремоделирования спиральных артерий на фоне гипертензивных расстройств [18, 19].
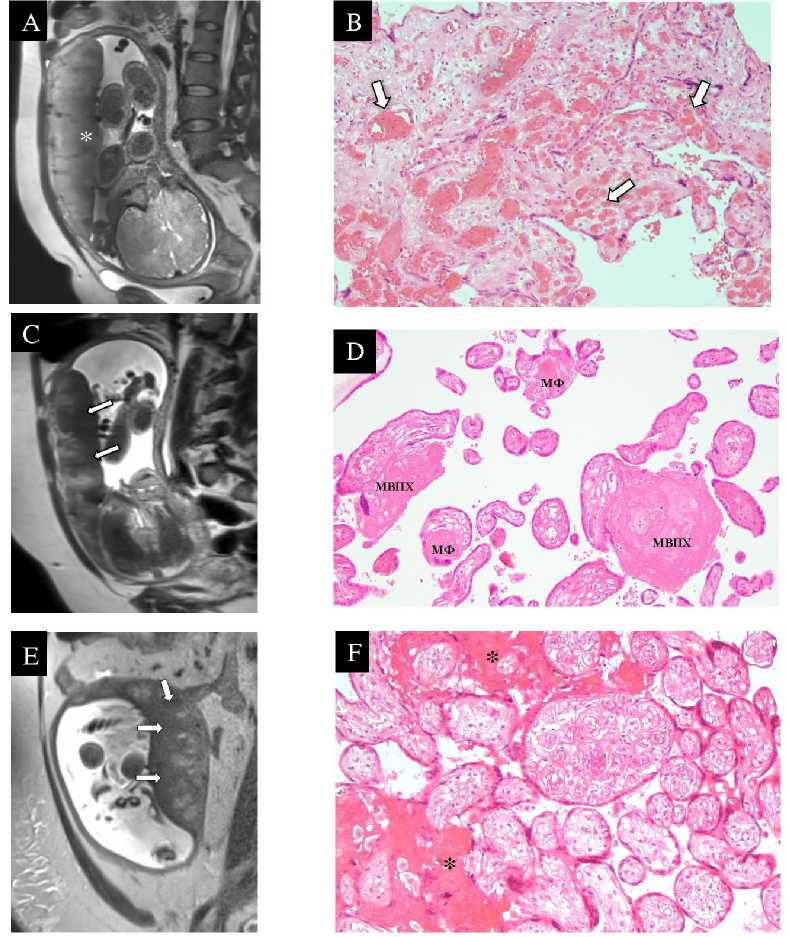
Рисунок 1. Зоны пониженного МР-сигнала в структуре плаценты у пациенток с гипертензивными расстройствами и соответствующие им патологические изменения по данным патоморфологического исследования. A. МРТ плаценты на 39 н.г., Т2-ВИ, аксиальная плоскость, диагноз - хроническая артериальная гипертензия (пациентка № 1). По плодовой поверхности плаценты определяется обширная зона изогипоинтенсивного МР-сигнала (*) с неровными нечеткими контурами. B. Плацента при хронической артериальной гипертензии, 39 н.г., световая микроскопия х200, окраска гематоксилин-эозин (пациентка № 1). Незрелая плацента с избыточно васкуляризованными и полнокровными ворсинами хориона (хориангиоз, черные стрелки) и выраженным сужением межворсинчатого пространства. C. МРТ плаценты на 32 н.г., Т2-ВИ, сагиттальная плоскость, диагноз - умеренная преэклампсия на фоне хронической артериальной гипертензии (пациентка № 7). По плодовой и материнской поверхностям плаценты определяются диффузно-разлитые зоны гипоинтенсивного МР-сигнала (стрелки). D. Плацента при умеренной преэклампсии на фоне хронической артериальной гипертензии, 32 н.г., световая
микроскопия х200, окраска гематоксилин-эозин (пациентка № 7). Фибриноидные отложения в строме ворсин хориона, матриксный фибриноид (МФ), и в межворсинчатом пространстве (МВПФ). E. МРТ плаценты на 29 н.г., Т2-ВИ, сагиттальная плоскость, диагноз – тяжелая преэклампсия на фоне хронической артериальной гипертензии (пациентка № 12). По плодовой и материнской поверхностям плаценты определяются диффузно-разлитые зоны гипоинтенсивного МР-сигнала (стрелки). F. Плацента при тяжелой преэклампсии на фоне хронической артериальной гипертензии, 30 н.г., световая микроскопия х200, окраска гематоксилин-эозин (пациентка № 12). Инволютивно-дистрофические изменения ворсинчатого хориона в виде псевдоинфарктов плаценты (*). Также отмечаются гиповаскуляризация ворсин хориона, склонность к их агглютинации и сужение межворсинчатого пространства
В нашем исследовании интенсивность МР-сигнала от плаценты снижалась с увеличением тяжести диагноза и выраженности патоморфологи-ческих изменений. Для плацент на фоне ХАГ были характерны изогипоинтенсивные зоны или нормальный сигнал от ткани плаценты, а в случаях преэклампсии, в т.ч. на фоне ХАГ, преобладали гипо-интенсивные зоны.
При наличии гипоинтенсивных зон характерной была подчёркнутая дольчатость плаценты (рис. 2), что не встречалось в группе изогипоинтенсивных зон: дольки плаценты визуализировались более отчётливо, были разделены толстыми септами ги-поинтенсивного МР-сигнала.
Дополнительно у 54% пациенток (7 наблюдений) отмечалась мелкозернистость долек (рис. 3). Этот признак отражает формирование мелкоочаговых инфарктов и кровоизлияний в структуре ворсин, участков отложения фибриноида в межворсинчатом пространстве и вдоль самих ворсин, а также диссоциированное созревание ворсин хориона [20].
Стоит отметить, что умеренно выраженные дольчатость и зернистость долек плаценты являются признаками физиологического «старения» плаценты при нормально протекающей беременности ближе к её завершению. Постепенно МР-сигнал от плаценты становится менее однородным к III триместру, когда плацента состоит из 15–25 долек диаметром примерно по 2–3 см и тонких междольковых перегородок, часть из них при этом в центре имеет небольшой участок гипоинтенсивного МР-сигнала на Т2-ВИ – более вероятно, соответствующий месту вхождения спиральной артерии [7, 21, 22]. В перечисленных нами случаях признаки «старения» либо были выражены в значительной мере сильнее, чем в норме, либо отмечались на ранних сроках, уже во II триместре.
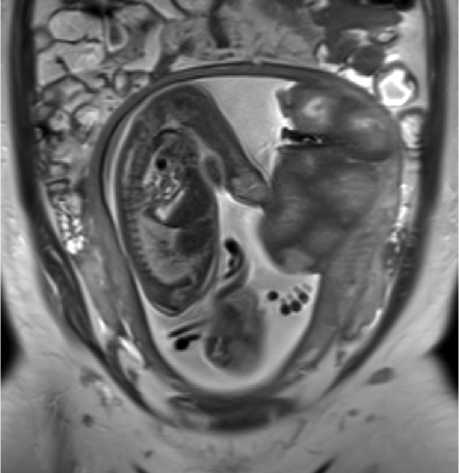
Рисунок 2. МРТ плаценты на 26 н.г., Т2-ВИ, корональная плоскость, диагноз – тяжёлая преэклампсия (пациентка № 11). По плодовой и материнской поверхностях плаценты определяются зоны гипоинтенсивного МР-сигнала с формированием широких междольковых перегородок и подчёркнутой дольчатости плаценты Figure 2. Placental MRI at 26 weeks of gestation, T2-WI, coronal plane, diagnosis – severe preeclampsia (patient 11). Zones of hypointense MR signal are observed along the fetal and maternal surfaces of the placenta, forming broad interlobular septa and pronounced lobulation
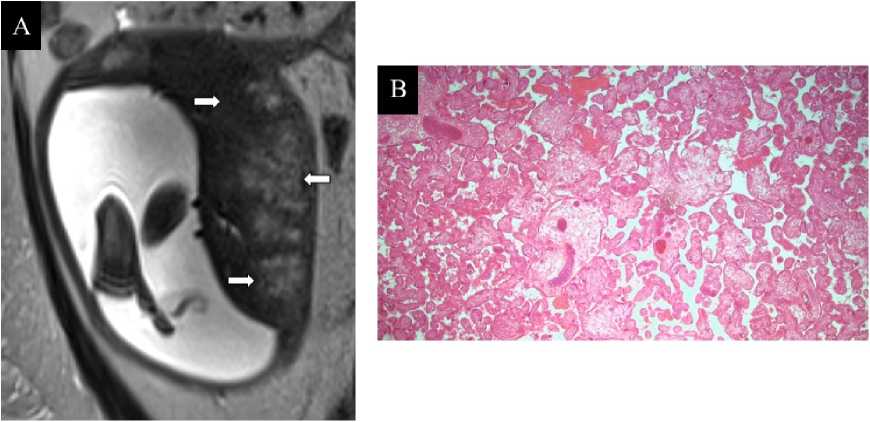
Рисунок 3. МР-симптом зернистости долек плаценты и диссоциированное созревание ворсин хориона по данным патоморфологиче-ского исследования. А. МРТ плаценты на 29 н.г., Т2-ВИ, корональная плоскость, диагноз – тяжёлая преэклампсия на фоне хронической артериальной гипертензии (пациентка № 12). Отмечается мелкозернистость долек плаценты (стрелки). B. Плацента при тяжёлой преэклампсии на фоне хронической артериальной гипертензии, 30 н.г., световая микроскопия ×50, окраска гематоксилин-эозин (пациентка № 12). Нарушение созревания ворсинчатого хориона диссоциированного типа с чередованием зрелых и незрелых ворсин вариабельного размера
Figure 3. MR feature of fine granularity of placental lobules and dissociated maturation of chorionic villi based on histopathological findings. A. Placental MRI at 29 weeks of gestation, T2-WI, coronal plane, diagnosis – severe preeclampsia on the background of chronic arterial hypertension (patient 12). Fine granularity of placental lobules is noted (arrows). B. Placenta in severe preeclampsia on the background of chronic arterial hypertension, 30 weeks of gestation, x50 light microscopy, hematoxylin-eosin staining (patient 12). Dissociated-type maturation disorder of the villous chorion is observed, with alternating mature and immature villi of variable size
Полученные нами данные имеют отчётливую корреляцию с результатами исследований других авторов. Например, в работах Ho A.E.P. и соавт. [4, 7, 23] выделялась схожая МР-семиотика: выраженная дольчатость плацент, не соответствующая сроку гестации, вариабельный размер долек и подчёркнутая их зернистость, значительное утолщение междольковых перегородок с формированием зон пониженного МР-сигнала. Последний признак оценивался также по данным BOLD-МРТ, отражающей уровень оксигенации тканей, и указанные зоны имели более низкий показатель Т2* в сравнении с дольками, причём изменения были более выражены при беременностях, осложнившихся ранней (до 34 нед. гестации) преэклампсией в сравнении с поздней (после 34 нед. гестации). Дополнительно авторы отмечали, что при хронической артериальной гипертензии МР-картина структурных изменений может сильно варьировать и в ряде случаев не отличаться от физиологически протекающей беременности.
В одной из публикаций Ho A.E.P. и соавт. [7] также обращали внимание, что изогипоинтенсивные зоны по плодовой поверхности могут возникать в случае её компрессии плодом. В наших случаях у всех ттрёх пациенток, у которых отмечались изоги- поинтенсивные зоны по плодовой поверхности, плоды не компримировали плаценту, а наличие этих зон на других импульсных последовательностях подтверждало, что указанные изменения не являлись артефактами. Aughwane R. и соавт. описывали схожие изменения структуры плаценты при беременностях, осложнившихся задержкой роста плода: диффузное снижение интенсивности МР-сигнала, подчеркнутая дольчатость [9].
У 10 (77%) из 13 пациенток наблюдались признаки нарушения внутриплацентарного кровообращения: инфаркты и гематомы.
Хотя возникновение инфарктов является нормальным этапом «старения» плаценты в III триместре, увеличение числа ишемических изменений в ней с тенденцией к центральному расположению в I и II триместрах при гипертензивных расстройствах можно считать одним из характерных признаков. Инфаркты возникают за счёт тромботической окклюзии артериол материнской части плаценты на фоне децидуальной артериопатии, что приводит к ишемическому некрозу ворсин и коллапсу межворсинчатого пространства (рис. 4, Д) [17, 22]. В нашем исследовании инфаркты плаценты отмечались в 69% случаев (9 наблюдений из 13).
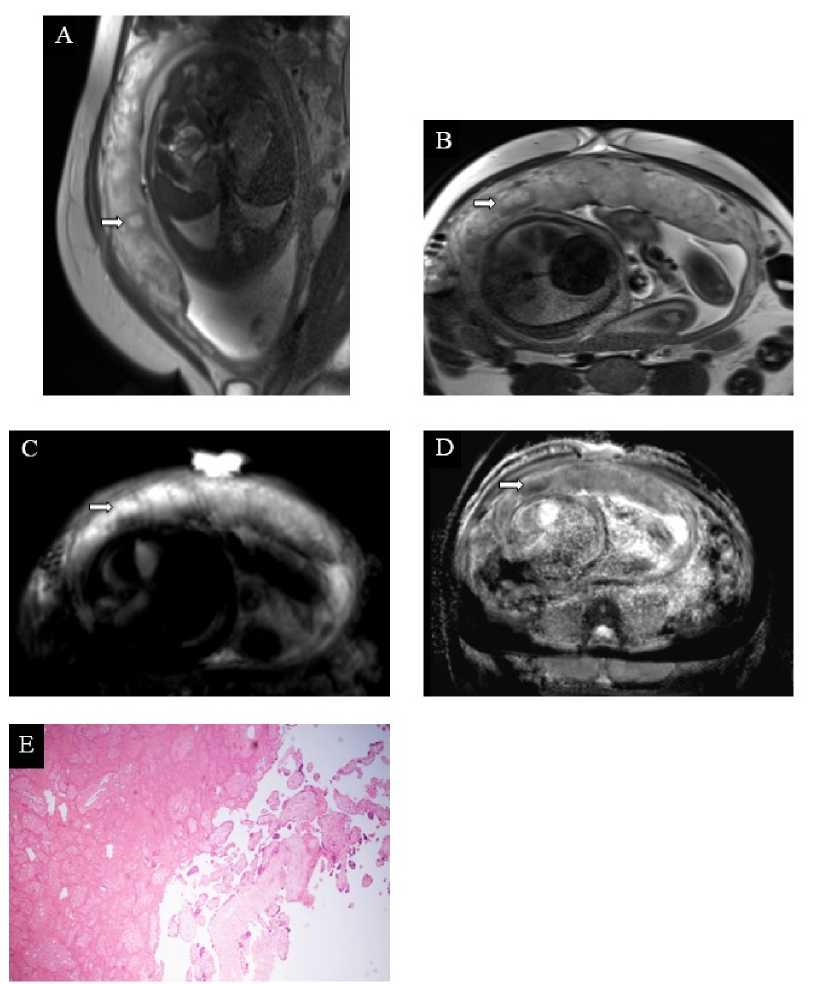
Рисунок 4. Инфаркт плаценты. А–D. МРТ плаценты на 37 н.г., Т2-ВИ (А и Б), ДВИ (В) и карты ИКД (Г), сагиттальная плоскость (А), аксиальная плоскость (Б-Г), диагноз – умеренная преэклампсия (пациентка № 5). В центральных отделах плаценты субхориально определяется инфаркт (стрелки), представленный отграниченным округлым участком гиперинтенсивного МР-сигнала на Т2-ВИ, окружённым гипоинтенсивным ободком, характеризующимся истинным ограничением МР-диффузии по данным ДВИ и карт ИКД. Е. Плацента при тяжёлой преэклампсии, 26 н.г., световая микроскопия х50, окраска гематоксилин-эозин (пациентка № 11). Инфаркт плаценты в хронической стадии
Figure 4 . Placental infarction. A–D. Placental MRI at 37 weeks of gestation, T2-WI (A and B), DWI (C) and ADC maps (D), sagittal plane (A), axial plane (B-D), diagnosis – moderate preeclampsia (patient 5). A subchorionic placental infarction is visualized in the central regions of the placenta (arrows), appearing as a well-defined, rounded hyperintense area on T2-WI, surrounded by a hypointense rim, consistent with true diffusion restriction on DWI and ADC maps. E. Placenta in severe preeclampsia, 26 weeks of gestation, x50 light microscopy, hematoxylin-eosin staining (patient 11). Chronic-stage placental infarction is observed
МР-семиотика инфарктов вариабельна, поскольку происходит последовательное их развитие от острейшей стадии к хронической, сопровождающееся отложением фибрина, солей кальция и пр., и, как следствие, сменой сигнальных характеристик. Присоединение геморрагического компонента также влияет на МР-сигнал, в результате чего зона ишемии может приобретать слабогипер- или гипертинтенсивный МР-сигнал на Т1-ВИ [24].
В связи с этим в научной литературе можно встретить различные подходы к описанию инфарктов по данным МРТ. Так, Oppenheimer D. и соавт. определяют инфаркты плаценты как участки гипо-интенсивного МР-сигнала на Т2-ВИ [22], другие же отмечают, что инфаркты будут иметь «классический» вид – гиперинтенсивный сигнал на Т2-ВИ и ДВИ, гипоинтенсивный – на картах измеряемого коэффициента диффузии – ИКД [24, 25].
В настоящем исследовании инфаркты плаценты мы определяли как округлой или неправильной формы участки нарушения архитектоники плаценты, отличные от её нормального дольчатого строения, визуализируемые в трёх плоскостях, характеризующиеся очаговым повышением интенсивности МР-сигнала на Т2-ВИ и ДВИ, в ряде случаев – сопровождающиеся снижением МР-сигнала на картах ИКД, при наличии геморрагического компонента – гиперинтенсивным МР-сигналом на Т1-ВИ (рис. 4, А–Г). Ещё одной формой нарушения кровообращения в ткани плаценты, свойственной гипертензивным расстройствам, является возникновение участков кровоизлияний в виде гематом [17, 25]. Как и инфаркты, гематомы могут возникать при нормально протекающей беременности, однако чаще это происходит на ранних сроках, причём большая часть из них подвергается спонтанному регрессу ко II триместру [26, 27]. Частота возникновения гематом широко варьирует – от 0,46% до 39,5% в зависимости от срока гестации, критериев диагностики, характеристик выборки и т.д. [28]. Мы отмечали наличие данной формы нарушения внут-риплацентарного кровообращения в 5 (38%) случаях из 13 (рис. 5). МР-семиотика гематом, как и инфарктов, зависит от давности их возникновения и, в частности, от типа присутствующего в них гемоглобина и значимо не отличается от гематом других локализаций [24, 25].
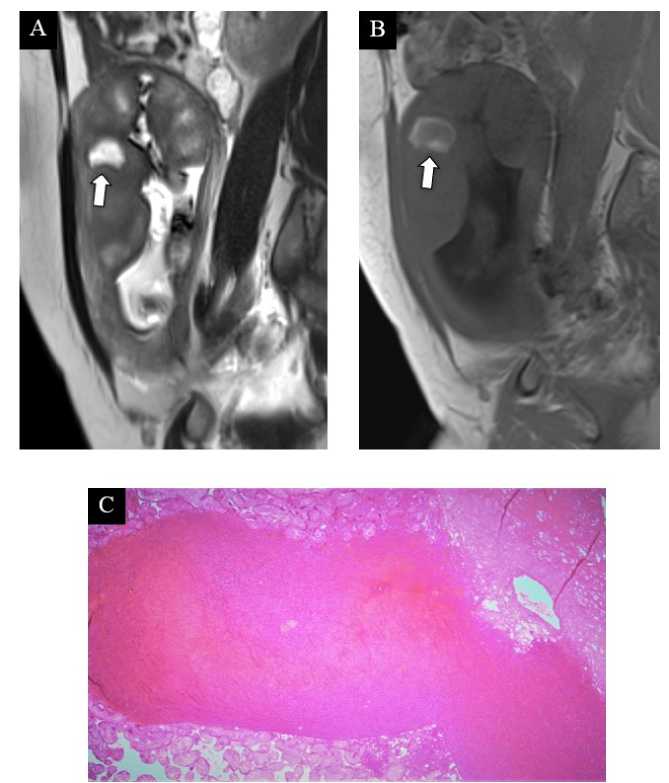
Рисунок 5. Гематома плаценты. А и B. МРТ плаценты на 26 н.г., Т2-ВИ (А) и Т1-ВИ (Б), сагиттальная плоскость, диагноз – тяжёлая преэклампсия (пациентка № 11). Субхориально определяется гематома в поздней подострой стадии (стрелка). C . Плацента при тяжёлой преэклампсии, 30 н.г., световая микроскопия х50, окраска гематоксилин-эозин (пациентка № 12). Межворсинчатая гематома плаценты
Figure 5. Placental hematoma. A and B. Placental MRI at 26 weeks of gestation, T2-WI (A) and T1-WI (B), sagittal plane, diagnosis – severe preeclampsia (patient 11). A subchorionic hematoma in the late subacute stage is observed (arrow). C. Placenta in severe preeclampsia, 30 weeks of gestation, x50 light microscopy, hematoxylin-eosin staining (patient 12). Intervillous hematoma of the placenta is observe
Анализ допплерометрических данных показал, что нарушения плодово-плацентарного кровотока были выявлены у 69% пациенток (10 наблюдений), причём в половине из этого числа случаев отмечались изолированные нарушения в маточных артериях или артерии пуповины, а в другой половине -комбинированные нарушения. Наиболее тяжёлые допплерометрические изменения наблюдались у пациенток с преэклампсией, что соответствует современным представлениям о роли нарушения маточно-плацентарного кровотока в патогенезе данного осложнения.
Примечательно, что в 5 случаях из нашей выборки МРТ выявляло структурные изменения, когда НППК по данным допплерометрии отсутствовало, что, вероятно, связано со следующими факторами: структурные изменения плаценты на микроструктурном уровне могут предвосхищать изменения на уровне крупных сосудов - маточных артерий и артерии пуповины; приём антигипертензивных препаратов может влиять на периферическое сосудистое сопротивление и приводить к нормальным показателям допплерометрии, в то время как признаки сосудистой мальперфузии, иммунновоспалительные и другие реакции носят необратимый или частично обратимый характер и остаются даже при эффективности терапии.
Гестационный возраст на момент исследования варьировал от 19 до 39 недель, при этом наиболее выраженные изменения наблюдались не только при беременностях, завершившихся преждевременным родоразрешением, но и при доношенных беременностях у пациенток с тяжёлыми формами гипертензивных расстройств. Это может указывать на то, что тяжесть патологических изменений в плаценте определяется не столько продолжительностью воздействия патологического фактора, сколько его интенсивностью.
Также следует отметить 8-е наблюдение (беременная 32 лет, 39 н.г., диагноз - уПЭ+ХАГ), в котором у пациентки, несмотря на установленный диагноз умеренной ранней преэклампсии, протекавшей на фоне хронической артериальной гипертензии, по данным МРТ обнаруживались лишь изоги-поинтенсивные зоны МР-сигнала на Т2-ВИ, при этом результаты допплерометрии и патоморфоло-гического исследования были в пределах нормы. Данный факт может подтверждать предположение, что изогипоинтенсивные зоны на Т2-ВИ наблюдаются при более благоприятном течении беременности.
Анализ исходов беременностей показал, что средний срок родоразрешения в группе из 13 пациенток был ниже нормы - 35,1±3,9 н.г., при нормальных сроках родоразрешения - 37 0/7 - 41 6/7 н.г. [29].
Большая часть беременностей, в 8 случаях, завершилась срочными родами, как физиологическими, так и путём операции кесарева сечения. В этой группе, состоящей из пациенток с диагнозами ХАГ, уПЭ и уПЭ+ХАГ, в 5 случаях изменения плаценты по данным МРТ характеризовались изо-гипоинтенсивными зонами МР-сигнала на Т2-ВИ по плодовой поверхности, в 2 случаях - гипоинтенсив-ными зонами, в 1 случае - нормальным МР-сигналом. Мелкозернистость определялась в 3 (38%) случаях из 8, инфаркты - в 5 (63%) случаях из 8, гематомы - в 1 (13%) случае из 8. По данным па-томорфологического исследования, у 2 (25%) из 8 пациенток не было обнаружено патологических изменений, у 3 (38%) - только признаки сосудистого поражения, у 1 (13%) - сосудистого и иммунновоспалительного, у 2 (25%) - сосудистого, имммуно-воспалительного поражения и другие признаки.
В группе из 5 пациенток с диагнозами уПЭ+ХАГ, тПЭ и тПЭ+ХАГ, чья беременность завершилась преждевременным родоразрешением путём операции кесарева сечения, у всех отмечались зоны гипоинтенсивного МР-сигнала на Т2-ВИ по плодовой поверхности, у 2 из них - с распространением на материнскую поверхность. Дополнительно у 4 (80%) из 5 определялись мелкозернистость долек, инфаркты и гематомы. При этом во всех случаях при патомор-фологическом исследовании плаценты наблюдались все три группы патологических изменений.
Таким образом, в этой серии из 13 случаев можно отметить взаимосвязь между патологическими изменениями плаценты по данным МРТ, патомор-фологического исследования, тяжестью гипертензивного расстройства и исходом беременности: более выраженные изменения наблюдались в той группе, где беременность завершилась неблагоприятно - преждевременным родоразрешением путём операции кесарева сечения.
Средние баллы по шкале Апгар на 1-й (7,2±0,7) и 5-й минутах (8,3±0,6) соответствовали нормальным показателям, равным 7–10 баллов [30], хотя и наблюдалась тенденция к более низким баллам с увеличением тяжести гипертензивного расстройства, выраженности патологических изменений по данным МРТ и патоморфологического исследования плаценты. При этом самые низкие показатели, равные 6 баллам на 1-й минуте, определялись в наблюдениях № 7 и № 11 у пациенток с диагнозами уПЭ+ХАГ и тПЭ соответственно, чьи беременности завершились преждевременно путём операции кесарева сечения, и у кого отмечались все три группы поражений плаценты при изучении гистологических препаратов плаценты, а также гипоин-тенсивные зоны МР-сигнала на Т2-ВИ, мелкозернистость долек, инфаркты и гематомы.
Ограничения
Настоящее исследование имело ряд ограничений. Так, оно носило пилотный характер с малым размером выборки, пациентки отбирались из одного лечебного учреждения, что, в совокупности, требует подтверждения результатов на большей когорте, включающей беременных женщин из других медицинских учреждения, не только с гипертензивными расстройствами, но и с физиологически протекающей беременностью в качестве группы контроля. Также для установления прогностической ценности метода необходимы слепой анализ МР-изображений, дальнейшие продольные исследования с оценкой корреляции МР-данных и результатов УЗ-исследования в В-режиме, перинатальных исходов.
Заключение
В рамках пилотного исследования магнитнорезонансная томография позволила выявить характерные структурные изменения плаценты при гипертензивных расстройствах беременности, такие как участки сниженного МР-сигнала на Т2-ВИ
(изогипо- и гипоинтенсивные), подчёркнутая дольчатость, мелкозернистость долек, нарушения внут-риплацентарного кровообращения в форме инфарктов и гематом, которые явились прямым отражением сосудистых, иммунно-воспалительных и иных поражений органа, которые наблюдались по данным патоморфологического исследования. При этом изменения отмечались даже в случаях, когда нарушения кровотока в системе мать–плацента– плод были в пределах нормальных значений для соответствующего срока гестации, и были более выражены при тяжёлых формах гипертензивных расстройств. Наблюдалась также взаимосвязь между неблагоприятными исходами беременности и выраженностью патологических изменений плаценты по данным МРТ. Таким образом, МР-исследование структурных изменений плаценты предоставляет дополнительную информацию о её состоянии, и в совокупности с другими методами диагностики, включая функциональные методики МРТ, может расширить роль медицинской визуализации при гипертензивных расстройствах во время беременности.


