Структурные изменения при моделировании внутрикостных дефектов верхней челюсти
Автор: Киреев Павел Владимирович, Снигур Григорий Леонидович, Фомичев Евгений Валентинович, Ефимова Елена Валерьевна, Ефимов Юрий Владимирович
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 4 (76), 2022 года.
Бесплатный доступ
В статье описаны патогистологические особенности репаративной регенерации костной ткани при моделировании внутрикостных дефектов челюстных костей у белых беспородных крыс
Морфометрия, костны/й дефект, регенерация кости
Короткий адрес: https://sciup.org/142236033
IDR: 142236033 | УДК: 616.314-089
Текст научной статьи Структурные изменения при моделировании внутрикостных дефектов верхней челюсти
Совершенствование хирургического лечения пациентов с околокорневыми кистами челюстей возможно не только при применении инновационных методов (тканевая инженерия, регенеративная медицина) но и при оптимизации традиционных методик лечения с применением современных остеопластических материалов [2, 4, 7, 8]. Однако патогистологические изменения костной ткани на разных этапах репаративной регенерации в области дефектов челюстных костей у экспериментальных животных изучены недостаточно, что и послужило поводом к проведению данного исследования.
Цель работы: выявить особенности морфологических изменений при моделировании внутрикостных дефектов верхней челюсти.
Материалы и методы: Экспериментальное исследование выполнено на нелинейных белых крысах. Формирование костного дефекта проводилось в области переднего отдела верхней челюсти. Животные были разделены на две группы: контрольную группу составили интактные крысы (n=8); вторую группу составили животные, у которых восстановление костного дефекта происходило под кровяным сгустком (n=8).
Вывод животных из эксперимента осуществлялся на 7, 14 и 21 сутки. Костно-мышечные фрагменты верхней челюсти фиксировали в 10% растворе нейтрального забуференного формалина (pH=7,4) в течение 24 часов, декальцинировали в растворе этилендиаминтетраацетата натрия. Изготовление и окраску гистологических срезов (гематоксилином и эозином, трихром по Массону) проводили по общепринятым гистоло- гическим методикам [1].
Морфометрически с помощью программного обеспечения (PhotoM 1.21, Россия) определяли удельную площадь костных балок, соединительной и хрящевой ткани (по отношению к общей площади ткани в поле зрения), оценивали интенсивность воспаления и резорбции костной ткани в зоне дефекта. Микрофотосъемку проводили в случайных полях зрения с помощью микроскопа «Axio Scope» (Carl Zeiss, Германия). Статистическую обработку результатов проводили с использованием программы Microsoft office Excel 2007 (Microsoft, США).
Результаты исследования и их обсуждение:
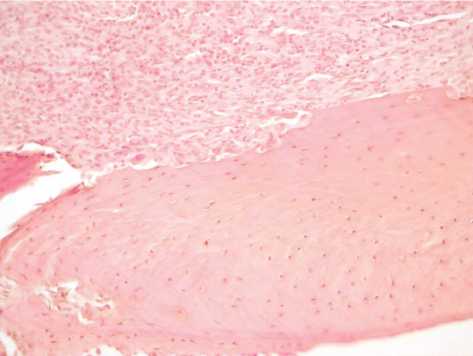
При гистологическом исследовании костной ткани в интактной группе животных во все сроки эксперимента (7, 14 и 21 сутки) отмечалось нормальное строение костной ткани, признаков воспаления не выявлялось, участки остео-кластической или пазушной резорбции костных балок не визуализировались (рис. 1). Удельная площадь костных балок составляла на 7, 14 и 21 сутки эксперимента - 48,3±1,2%, 46,9±2,1% и 43,2±1,8% соответственно, соединительной ткани - 38,4±2,3%, 41,1±1,4% и 36,5±2,7%, хрящевая ткань не определялась (табл. 1).
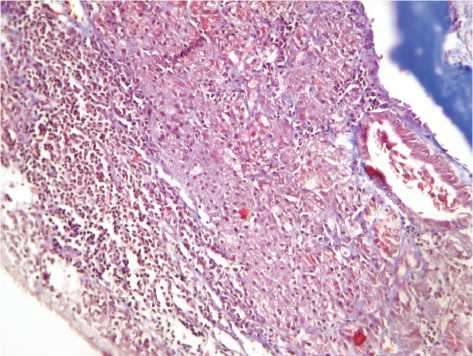
При изучении микропрепаратов во второй группе на 7 сутки в области костного дефекта отмечалась выраженная инфильтрация преимущественно сегментоядерными нейтрофильными гранулоцитами с примесью гистиоцитов, макрофагов и единичных лимфоцитов, неравномерный отёк. Данные изменения являются характерными для ранних сроков деструкции костной ткани [3]. На границе с дефектом в костных балках отмечались единичные гигантские многоядерные остеокласты с формированием лакун остеокластической резорбции, которые составляли 0,2±0,1%, что свидетельствовало о активации ремоделирования костной ткани [7]. Удельная площадь костных балок составляла
33,3±2,8%, соединительной ткани - 44,1±2,9%, хрящевая ткань не определялась (рис. 2. табл. 1). При окраске трихром по Массону на 7 сутки эксперимента определялись единичные тонкие хаотично ориентированные волокна коллагена (рис. 2, табл. 1).
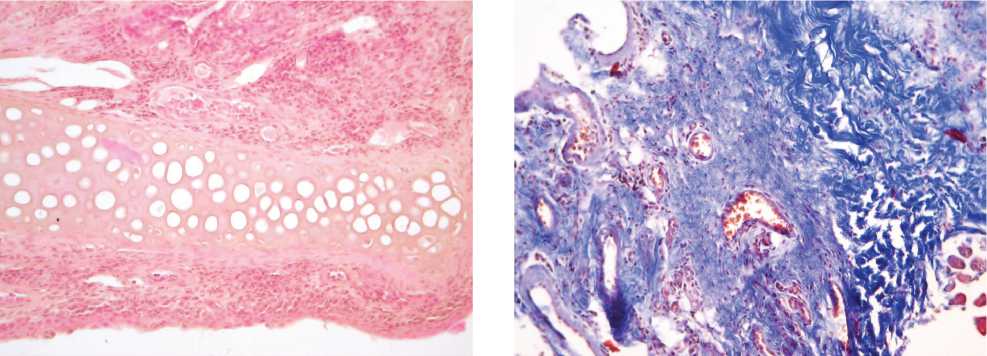
На 14 сутки эксперимента отмечалось уменьшение отека, снижалась интенсивность воспалительной инфильтрации. Количество сегментоядерных нейтрофильных гранулоцитов уменьшалось, в составе экссудате начинали преобладать гистиоциты, макрофаги, лимфоциты и фибробласты. Определялись участки формирования хрящевой ткани. В костных балках признаков формирования остеолиза не визуа-лизирвалось. Удельная площадь костных балок составляла 32,4±3,5%, соединительной ткани -45,8±31%, хрящевой ткани - 32,2±2,7%. В зоне дефекта костной ткани при окраске трихром по Массону на 14 сутки эксперимента определялись структурированные пучки коллагеновых волокон (рис. 2, табл. 1). Данные структурные изменения могут свидетельствовать о недостаточных остеоиндуктивных и остеокондуктивных свойствах кровяного сгустка ввиду отсутствия жесткого каркаса для остеогенных клеток [5, 6].
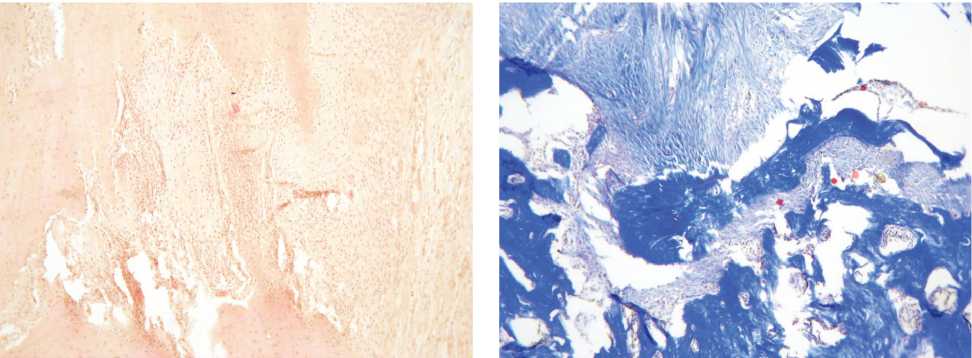
К 21 суткам эксперимента на обзорной окраске сохранялись признаки активной реструктуризации костной ткани в виде незначительной лимфо-гистоицитарной инфильтрации в зоне дефекта, формирования остеоидных и минерализованных костных балок с замещением зоны хрящевой ткани на соединительную ткань (рис. 2). Гистологических признаков остеолиза не выявлялось. Удельная площадь костных балок составляла 28,8±2,4%, соединительной ткани -47,9±5,1%, хрящевой ткани - 9,1±1,3% (табл. 1). При окраске по Массону выявлялась новообразованная костная и соединительная ткани с хаотичным расположением костных балок и разнонаправленными пучками коллагеновых волокон (рис. 2, табл. 1).
Таблица 1.
Морфометрические параметры костного дефекта верхней челюсти (M±m).
|
Морфометрический параметр |
Экспериментальные группы |
Время эксперимента |
||
|
7 сутки |
14 сутки |
21 сутки |
||
|
Удельная площадь костных балок, % |
Интактная |
48,3±1,2 |
46,9±2,1 |
43,2±1,8 |
|
Костный дефект+кровяной сгусток |
33,3±2,8* |
32,4±3,5* |
28,8±2,4* |
|
|
Удельная площадь плотноволокнистой соединительной ткани, % |
Интактная |
38,4±2,3 |
41,1±1,4 |
36,5±2,7 |
|
Костный дефект+кровяной сгусток |
44,1±2,9 |
45,8±31 |
47,9±5,1 |
|
|
Удельная площадь хрящевой ткани, % |
Интактная |
- |
- |
- |
|
Костный дефект+кровяной сгусток |
- |
32,2±2,7 |
9,1±1,3 |
|
* - достоверно по отношению к группе интактного контроля.
Заключение
Результаты гистологического исследования свидетельствуют о развитии острого воспаления в зоне костного дефекта на ранних сроках остеорепарации, которое сменилось признаками репаративной регенерации кости с 14 суток эксперимента. Однако формирование плотноволокнистой соединительной и хрящевой тканей в зоне дефекта не привело к статистически достоверному замещению зоны дефекта полноценной костной тканью даже к 21 суткам исследования. Таким образом, результаты проведенного исследования свидетельствуют о воспроизведении адекватной экспериментальной модели формирования дефектов костной ткани при использовании кровяного сгустка. В силу недостаточных остеоиндуктивных и остеокондуктивных свойств кровяного сгустка во все сроки наблюдения не происходило замещение дефекта новообразованной костной тканью.
АБ
Рис. 1. Костная ткань верхней челюсти интактной группы. А - окраска гематоксилином и эозином, начальное увеличение х400. Б - окраска трихром по Массону, начальное увеличение х100.
А
Б
В
Г
ДЕ
Рис. 2. Костный дефект верхней челюсти, группа сравнения. А - 7 сутки эксперимента. Окраска гематоксилином и эозином, начальное увеличение х400. Б - 7 сутки эксперимента. Окраска трихром по Массону, начальное увеличение х400. В - 14 сутки эксперимента. Окраска гематоксилином и эозином, начальное увеличение х100. Г - 14 сутки эксперимента. Окраска трихром по Массону, начальное увеличение х100. Д - 21 сутки эксперимента. Окраска гематоксилином и эозином, начальное увеличение х100.
Е - 21 сутки эксперимента. Окраска трихром по Массону, начальное увеличение х100.
Список литературы Структурные изменения при моделировании внутрикостных дефектов верхней челюсти
- Основы гистологической техники. Коржевский Д. Э. Гиляров А.В. - Санкт-Петербург, 2010. - 95 c.
- Рахимов З.К., Чиргалиев М.Ж., Пулатова Ш.К. Совершенствование методов лечения радикулярных кист челюстей // Биология и интегративная медицина. - 2019. - № 2. - С. 5-15.
- Bone injury, healing and grafting. In Basic Orthopaedic Sciences. The Stanmore Guide. Bates P., Ramachandran M. Edited by: Ramachandran M. London, 2007. - Р.123-134.
- Chiapasco M., Rossi A., Motta J.J., Crescentini M. Spontaneous bone regeneration after enucleation of large mandibular cysts: a radiographic computed analysis of 27 consecutive cases. - J. Oral Maxillofac Surg. 2000;58(9):942-8.
- Faour O., Dimitriou R., Cousins C.A., Giannoudis P.V. The use of bone graft substitutes in large cancellous voids: any specific needs? - Injury. 2011;42(2):87-90.
- Giannoudis P.V., Dinopoulos H., Tsiridis E. Bone substitutes: an update. - Injury. 2005;36(3):20-7.
- Ho-Shui-Ling A., Bolander J., Rustom L.E., Johnson A.W., Luyten F.P., Picart C. Bone regeneration strategies: Engineered scaffolds, bioactive molecules and stem cells current stage and future perspectives. - Biomaterials. 2018;180:143-162.
- Maumus M., Pers Y.M., Ruiz M., Jorgensen C., Noël D. Cellules souches mesenchymateuses et medecine regeneratrice - Quel avenir pour l'arthrose? [Mesenchymal stem cells and regenerative medicine: future perspectives in osteoarthritis]. - 2018;34(12):1092-1099. French.


