Структурные изменения сосудов микроциркуляторного русла и их окружения в первичной зрительной коре 3- и 18-месячных крыс при фотоповреждении сетчатки, их коррекция
Автор: Бахарева Юлия Олеговна, Варакута Елена Юрьевна, Логвинов Сергей Валентинович, Потапов Алексей Валерьевич, Жданкина Анна Александровна, Плотников Марк Борисович, Солонский Анатолий Владимирович, Герасимов Александр Владимирович, Сагнаева Малика Айтгабуловна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 2, 2020 года.
Бесплатный доступ
Морфофункциональные изменения микроциркуляторного русла играют важную роль в пластичности нервных клеток, их способности менять свое функциональное состояние при воздействии различных факторов. Целью исследования являлось изучение морфологии сосудов микроциркуляторного русла и окружающих их нейронов и глиоцитов в первичной зрительной коре 3- и 18-месячных крыс в норме и при стрессе, вызванном высокоинтенсивным круглосуточным световым воздействием, а также в условиях коррекции. Материалы и методы. Эксперименты выполнены на 60 крысах-самцах линии «Вистар». Возраст -3 и 18 мес. Методами световой и электронной микроскопии, морфометрии оценивали удельную площадь и численную плотность капилляров, удельную площадь измененных (со стазом, сладжем форменных элементов и тромбозом) и неизмененных сосудов, а также морфологию клеток, их окружающих. Для множественных сравнений внутри возрастных групп использовали критерий Крускала-Уоллиса, для парных - Манна-Уитни. Результаты. У 3- и 18-месячных крыс обнаружена различная реакция капилляров на световое воздействие, что выражалось в увеличении численной плотности капилляров у 3-месячных крыс и снижении - у 18-месячных (р
Микроциркуляция, п-тирозол, стресс, первичная зрительная кора
Короткий адрес: https://sciup.org/14117602
IDR: 14117602 | УДК: 611.813.1/.814.4:611.13/.14.08]:616-001.15-08-092.9:599 | DOI: 10.34014/2227-1848-2020-2-123-133
Текст научной статьи Структурные изменения сосудов микроциркуляторного русла и их окружения в первичной зрительной коре 3- и 18-месячных крыс при фотоповреждении сетчатки, их коррекция
Введение. Высокоинтенсивное длительное световое воздействие вызывает фотоповреждение нейронов и глиоцитов сетчатки, что приводит к дефициту афферентных импульсов и морфологическим изменениям клеток в центральном отделе зрительного анализатора [1]. Также в условиях круглосуточного светового воздействия наблюдается рассогласование околосуточных биоритмов, которое является мощным стрессирующим фактором для всех систем организма [2]. Известно, что чрезмерные стимулы и различные эндогенные факторы, в т.ч. и старение, могут сопровождаться дезадаптивными реакциями в органах и тканях, что приводит к стрессиндуцированным патологическим состояниям или заболеваниям [3]. На данный момент имеется множество исследований, рассматривающих стрессиндуци-рованные изменения головного мозга, их связь со стрессом, старением и нейродегенератив-ными заболеваниями [4–7]. При этом данных о морфологических изменениях сосудистого русла в зрительной коре при стрессе и повреждении сетчатки недостаточно.
Цель исследования. Изучение морфологии сосудов микроциркуляторного русла и окружающих их нейронов и глиоцитов в первичной зрительной коре 3- и 18-месячных крыс в норме и при стрессе, вызванном высокоинтенсивным круглосуточным световым воздействием, а также в условиях коррекции.
Материалы и методы. Эксперименты выполнены на 3- и 18-месячных крысах-самцах Вистар (n=60). Всех животных содержали на стандартном пищевом рационе с неограниченным доступом к воде. Крыс разделили на 2 группы (табл. 1).
Таблица 1
Table 1
Assignment of animals to experimental groups
|
Возраст Age |
Контрольная группа (n=30) Control group (n=30) |
Экспериментальная группа (n=30) (световое воздействие) Experimental group (n=30) (light exposure) |
||||
|
Интактные Intact |
Коррекция Correction |
Вода Water |
Опыт Test |
Коррекция Correction |
Вода Water |
|
|
3 месяца 3-month-old |
5 |
5 |
5 |
5 |
5 |
5 |
|
18 месяцев 18-month-old |
5 |
5 |
5 |
5 |
5 |
5 |
Разделение животных по экспериментальным группам
Крыс контрольной группы (n=30) содержали в стандартных условиях вивария с дневной освещенностью 25 лк, ночной – 4 лк. Крыс экспериментальной группы (n=30) помещали в специальную установку из пяти прямоугольных рефлекторов с вмонтированными в них люминесцентными лампами, уровень освещенности составил 3500 лк круглосуточно в течение 7 сут.
Для коррекции использовали активный компонент лекарственного растения Rhodiola rosea n-тирозол, обладающий гемореологическими и антиоксидантными свойствами, показавший нейропротективный эффект при тран-зиторной глобальной ишемии головного мозга [8–10]. Дозу 50 мг/кг массы разводили дистиллированной водой и вводили внутри-желудочно через зонд 1 раз в сутки в течение 7 сут. По 5 крыс каждой возрастной и экспериментальной группы получали эквиобъем-ное количество дистиллированной воды 1 раз в сутки в течение недели.
На 8-е сут эксперимента производили декапитацию под легким эфирным наркозом, выделяли затылочную область коры, для све- товой микроскопии фиксировали в 10 % формалине и заливали в парафин. Срезы окрашивали гематоксилин-эозином по стандартной методике, дифференцировали первичную зрительную кору, подсчитывали удельную площадь неизмененных сосудов (венул и артериол), удельную площадь измененных сосудов (венул и артериол со сладжем, стазом и тромбозом), численную плотность и удельную площадь капилляров (расчеты производили на 56 600 мкм2), количество глиоцитов и капилляров на 1 нейрон в срезе (программное обеспечение ImageJ). Для электронной микроскопии (JEN-100 CX, Япония) материал фиксировали в 2,5 % растворе глутаральдегида на какодилатном буфере (рН=7,4), далее производили постфиксацию в 2 % растворе четы-рехоксида осмия и заливали в смесь эпона и аралдита М. Полутонкие срезы окрашивали азуром II. Ультратонкие срезы контрастировали ацетатом уранила и цитратом свинца.
Статистическую обработку проводили в программе SPSS Statistics, использовали непараметрический критерий Крускала–Уоллиса для множественных сравнений внутри воз- растных групп и критерий Манна–Уитни для парного сравнения показателей между 3- и 18-месячными животными. Различия считали статистически значимыми при р≤0,05. На работу получено одобрение регионального этического комитета (№ 4972 от 31.10.2016). Работа выполнена с соблюдением международных принципов Хельсинкской декларации и в соответствии с директивой Европейского сообщества (2010/63/ЕU).
Результаты и обсуждение. При световом воздействии в просвете капилляров 3-месячных крыс встречались явления сладжа и стаза эритроцитов, вокруг гемокапилляров обнаруживались отечные отростки астроцитов (рис. 1).
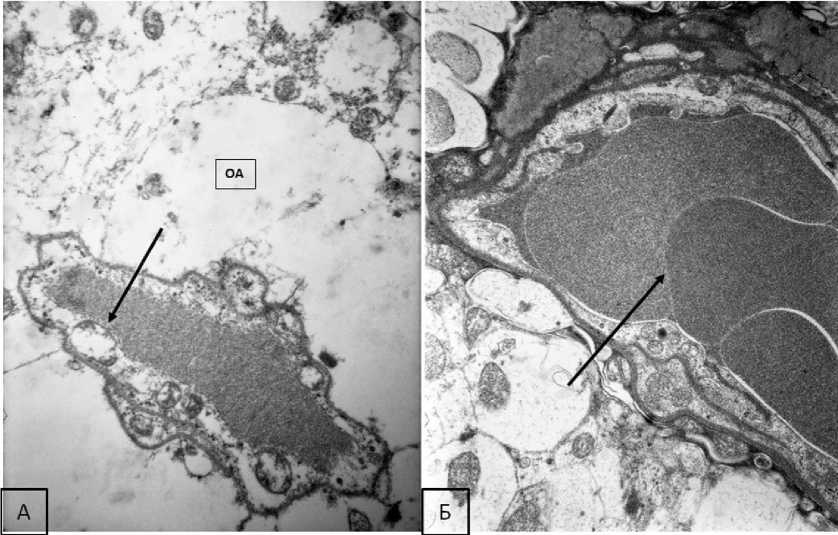
Рис. 1. Электронные микрофотографии первичной зрительной коры 3-месячных крыс со световым воздействием. Контраст ацетатом уранила, цитратом свинца.
А) Разрушение органелл в цитоплазме эндотелиоцита (стрелка), вокруг капилляра отечные отростки астроцитов (ОА). Ув. 5000.
Б) Сладж эритроцитов в просвете капилляра (стрелка). Ув. 6000
Fig. 1. Electron micrographs of the primary visual cortex of 3-month-old rats under light exposure. Contrast with uranyl acetate and lead citrate.
-
A) Destruction of organelles in the cytoplasm of endothelial cells (arrow), edematous astrocyte branching around the capillary, ×5000.
-
B) Erythrocyte sludge in the capillary lumen (arrow), ×6000
На ультраструктурном уровне в цитоплазме эндотелиоцитов и перицитов встречались набухшие митохондрии с частичной или полной деструкцией крист. Нередко цитоплазма эндотелиоцитов выбухала в просвет сосуда, сужая его. Морфологический анализ показал отсутствие значимых различий между подгруппами 3-месячных крыс по показателям удельной площади измененных и неизмененных сосудов. У крыс со световым воздей- ствием выявлено увеличение численной плотности капилляров до 33 (29; 35) по сравнению с показателями интактных 3-месячных крыс – 29 (27; 31), что, вероятно, связано с их открытием, переходом в функционально активное состояние (р=0,04 по критерию Крускала– Уоллиса).
При коррекции n-тирозолом у крыс 3-месячного возраста со световым воздействием обнаружено достоверное увеличение числен- ной плотности капилляров до 40 (38; 43) и удельной площади капиллярного русла до 1,9 (1,4; 2) по сравнению с показателями крыс 3-месячного возраста со световым воздействием без коррекции – 33 (29; 35) и 0,9 (0,75; 0,9) соответственно, что, вероятно, отражало улучшение микроциркуляции в связи с повышением метаболического запроса нервных клеток при стрессе, вызванным световым воздействием (р=0,04; р=0,00 соответственно по критерию Крускала–Уоллиса). По- хожие результаты обнаружены в экспериментах на спонтанно гипертензивных крысах, где n-тирозол также показал достоверное увеличение численной плотности капилляров [9].
При световом воздействии у 18-месячных крыс гемодинамические изменения были более выражены и, наряду с явлением сладжа и стаза форменных элементов в капиллярах, характеризовались появлением периваскулярного отека венул, стазом форменных элементов в их просвете (рис. 2).
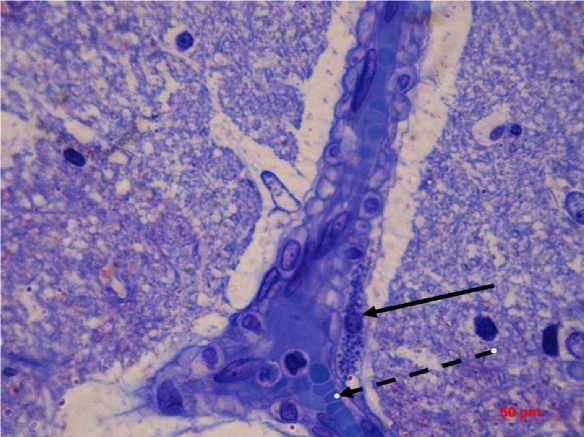
Рис. 2. Микрофотография венулы первичной зрительной коры 18-месячной крысы при световом воздействии с периваскулярным отеком, стазом форменных элементов (пунктирная стрелка). Вдоль стенки сосуда – тучная клетка (стрелка). Полутонкий срез. Окраска азуром II. Ув. 1000
Fig. 2. Microphotograph of a venule in the primary visual cortex of an 18-month-old rat under light exposure with perivascular edema, and stasis of blood elements (dotted arrow). A mast cell (arrow) is along the vessel wall. Azure II staining, ×1000
Морфометрический анализ показал отсутствие различий в группах 18-месячных крыс по показателям удельной площади измененных и неизмененных сосудов. Световое воздействие приводило к значимому снижению удельной площади до 0,6 % (0,5; 0,7) и численной плотности капилляров до 23 (20; 26) у 18-месячных крыс по сравнению с показателями интактных 18-месячных крыс – 0,9 % (0,8; 1,2); 30 (28; 32) соответственно, что могло быть связано с перикапиллярным отеком отростков астроцитов и механической компрессией сосудов извне, а также со спазмом капилляров (р=0,00 по критерию Кру- скала–Уоллиса). При сравнении численной плотности капилляров у молодых (33 (29; 35)) и 18-месячных (23 (20; 26)) крыс при световом воздействии также выявлены значимые различия, что отражает возрастные особенности реактивности микроциркуляторного русла (р=0,00 по критерию Манна–Уитни). В экспериментах показано, что на фоне старения снижается способность сосудов головного мозга адекватно реагировать на изменение метаболической потребности нейронов. В итоге это приводит к их дисфункции и гипоксии [11]. При коррекции у 18-месячных крыс со световым воздействием выявлено достоверное уве- личение численной плотности капилляров до 27 (26; 29) по сравнению с 18-месячными крысами без коррекции – 23 (20; 26), что, вероятно, улучшало микроциркуляцию (р=0,02 по критерию Крускала–Уоллиса).
Люминарная поверхность эндотелия некоторых капилляров у 3- и 18-месячных крыс при световом воздействии на фоне введения n-тирозола образовывала микроворсинки, увеличивающие контактную поверхность эндоте-лиоцитов (рис. 3А). Также в группах со световым воздействием наблюдались множественные пиноцитозные пузырьки, что нетипично для эндотелиоцитов головного мозга (рис. 3Б).
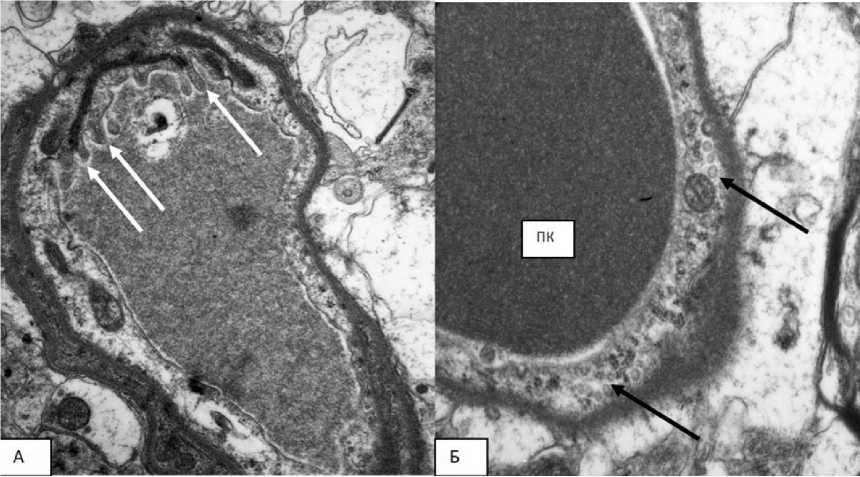
Рис. 3. Электронные микрофотографии капилляров первичной зрительной коры 18-месячных крыс со световым воздействием. Контраст ацетатом уранила, цитратом свинца.
А) Микроворсинки эндотелиоцита капилляра (стрелки). Ув. 6000.
Б) Скопление пиноцитозных пузырьков в цитоплазме эндотелиоцита (стрелки).
ПК – просвет капилляра. Ув. 10 000
Fig. 3. Electron micrographs of the capillaries in the primary visual cortex of 18-month-old rats under light exposure. Contrast with uranyl acetate and lead citrate.
-
A) Microvilli of capillary endothelial cells (arrows), ×6000.
-
B) Accumulation of pinocytotic vesicles in the endothelial cell cytoplasm (arrows).
ПК – capillary lumen, ×10 000
Похожие изменения в эндотелиоцитах головного мозга наблюдали при воздействии микроволнового излучения [12], ишемии головного мозга [13], на модели распространенной деполяризации [14]. Считается, что низкий уровень трансцитоза играет существенную роль в поддержании гомеостаза межклеточной среды головного мозга [15, 16]. Изменение барьерных свойств эндотелия, вероятно, связано с повышением уровня провоспа-лительных цитокинов и хемокинов в центральной нервной системе при стрессе [17], что наряду с окислительным стрессом потенцирует повреждение нервных клеток.
При морфологическом исследовании нейронов 3- и 18-месячных крыс при световом воздействии обнаружены потенциально обратимые изменения в виде очагового хроматолиза и гиперхромных нейронов без сморщивания и деструктивные, необратимые: тотальный хроматолиз и пикноморфные сморщенные клетки. Нейроны с деструктивными изменениями встречались редко, в основном в группе 18-месячных крыс. Ультраструктур-ный анализ показал наличие фрагментов разрушенных органелл, мультивезикулярные, слоистые, миелиноподобные тельца в цитоплазме таких клеток. В нормохромных и обра- тимо измененных нейронах преобладали реактивные изменения: набухание митохондрий и расширение цистерн эндоплазматической сети (ЭПС), свидетельствующие, вероятно, о повышенной метаболической активности клеток (рис. 4А).
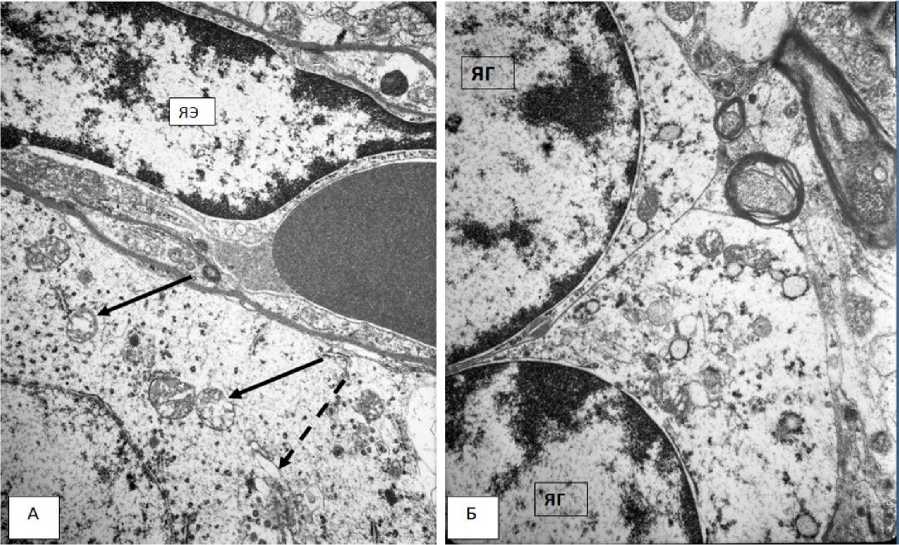
Рис. 4. Электронные микрофотографии первичной зрительной коры 3-месячных крыс со световым воздействием. Контраст ацетатом уранила, цитратом свинца.
А) В цитоплазме нейрона – набухшие митохондрии с частичной деструкцией крист (стрелка), расщирение цистерн эндоплазматической сети (пунктирная стрелка);
ЯЭ – ядро эндотелиоцита. Ув 8000.
Б) Попарно расположенные глиоциты; ЯГ – ядро глиоцита. Ув. 5000
Fig. 4. Electron micrographs of the primary visual cortex of 3-month-old rats under light exposure. Contrast with uranium acetate and lead citrate.
-
A) Swollen mitochondria with partial cristae destruction (arrow), and expansion of cisterns in the endoplasmic reticulum (dotted arrow) are observed in the neuron cytoplasm.
ЯЭ – endothelial cell nucleus, ×8000.
-
B) Paired glia cells, ЯГ – glia cel nucleus, ×5000
Другим важным компонентом нейро-глио-сосудистого ансамбля являются глиоциты, не только обеспечивающие структурную поддержку нейронов, но и регулирующие процессы восстановления нервной ткани после повреждения [18]. Глиоциты 3- и 18-месячных крыс при световом воздействии характеризовались набуханием, увеличением объема цитоплазмы и ядра. В цитоплазме таких глиоцитов обнаруживались реактивные изменения – набухшие митохондрии и цистерны ЭПС. Нередко наблюдались глиоциты, расположенные парами или группами, что, возможно, свидетельствовало об их пролифера- ции и/или миграции (рис. 4Б). В группе 18-месячных крыс при световом воздействии встречались и деструктивно измененные гиперх-ромные сморщенные глиоциты.
Для оценки взаимоотношений между нейронами, глией и капиллярами использовали соотношение количества глии и капилляров на 1 нейрон в срезе. У 3-месячных крыс при световом воздействии на фоне введения n-тирозола значимо повышалось количество глиоцитов на 1 нейрон – до 1,3 (0,9; 1,8) и количество капилляров – до 0,5 (0,4; 0,88), что значимо отличалось от показателей 3-месячных крыс со световым воздействием без кор- рекции (0,8 (0,7; 1) и 0,29 (0,2; 0,46) соответственно) и, вероятно, способствовало лучшей адаптации нервных клеток при высокоинтенсивном световом воздействии (p=0,01; p=0,03 соответственно по критерию Крускала–Уоллиса).
Заключение. Таким образом, изменения сосудов первичной зрительной коры у 3-месячных крыс носили адаптивный характер, что выражалось в увеличении численной плотности капилляров в первичной зритель- ной коре и реактивных изменениях нейронов и глиоцитов. У 18-месячных крыс световое воздействие, вероятно, приводило к срыву адаптации, о чем свидетельствовали снижение числа капилляров и деструктивные изменения нейронов и глиоцитов. N-тирозол был более эффективен у 18-месячных крыс при световом воздействии, препарат способствовал увеличению численной плотности капилляров первичной зрительной коры, что, вероятно, улучшало микроваскуляризацию.
Список литературы Структурные изменения сосудов микроциркуляторного русла и их окружения в первичной зрительной коре 3- и 18-месячных крыс при фотоповреждении сетчатки, их коррекция
- Sverdeva Y.O., Varakuta E.Ju., Zhdankina A.A. Age-related structural changes in the cells of the primary visual cortex of rats under high-intensity light exposure. Advances in gerontology. 2018; 31 (3): 352-355.
- Степанова С.И., Галичий В.А. Космическая биоритмология. Хронобиология и хрономедицина. М.: Триада-Х; 2000. 239.
- McEwen S. Stress, adaptation, and disease: Allostasis and allostatic load. Annals of the New York academy of sciences. 1998; 840 (1): 33-44.
- Смирнов А.В., Григорьева Н.В. Морфофункциональные изменения дорсального и вентрального отделов гиппокампа крыс при моделировании комбинированного стресса с учетом экспрессии CASPASE-3 и GFAP. Вестник Волгоградского государственного медицинского университета. 2018; 1 (65). URL: https://cyberlemnka.ru/article/n/morfofunktsionalnye-izmeneniya-dorsalnogo-i-ventralnogo-otdelov-gippokampa-krys-pri-modelirovami-kom-binirovannogo-stressa-s-uchetom (дата обращения: 24.02.2020).
- Belleau E.L., Treadway M.T., Pizzagalli D.A. The impact of stress and major depressive disorder on hippocampal and medial prefrontal cortex morphology. Biological psychiatry. 2019; 85 (6): 443-453.
- Волобуев А.Н., Романчук П.И. Биофизика кровообращения при сосудистой деменции и болезни Альцгеймера. Бюллетень науки и практики. 2019; 5 (4). URL: https://cyberleninka.ru/article/n/bio-fizika-krovoobrascheniya-pri-sosudistoy-dementsii-i-bolezni-altsgeymera (дата обращения: 24.02.2020).
- Sàntha P. Restraint stress-induced morphological changes at the blood-brain barrier in adult rats. Frontiers in molecular neuroscience. 2016; 8: 88.
- Khanna K., Mishra K.P. Golden root: A wholesome treat of immunity. Biomedicine. Pharmacotherapy. 2017; 87: 496-502.
- Plotnikov M.B., Aliev O.I. Effect of p-tyrosol on hemorheological parameters and cerebral capillary network in young spontaneously hypertensive rats. Microvascular research. 2018; 119: 91-97.
- Khodanovich M.Y. P-Tyrosol Enhances the Production of New Neurons in the Hippocampal CA1 Field after Transient Global Cerebral Ischemia in Rats. Bulletin of experimental biology and medicine. 2019; 168 (2): 224-228.
- Riddle D.R., Sonntag W.E., Lichtenwalner R.J. Microvascular plasticity in aging. Ageing research reviews. 2003; 2 (2): 149-168.
- Логвинов С.В., Зуев В.Г., Ушаков И.Б. Очерки неионизирующей радиобиологии: структурно-функциональный анализ. Томск; 1994. 208.
- Haley M.J., Lawrence C.B. The blood-brain barrier after stroke: structural studies and the role of transcytotic vesicles. Journal of Cerebral Blood Flow & Metabolism. 2017; 37 (2): 456-470.
- Sadeghian H. Spreading depolarizations trigger caveolin 1-dependent endothelial transcytosis. Annals of neurology. 2018; 84 (3): 409-423.
- Ben-Zvi A., Lacoste B., Kur E. Mfsd2a is critical for the formation and function of the blood-brain barrier. Nature. 2014; 509 (7501): 507-511.
- Knowland D. Stepwise recruitment of transcellular and paracellular pathways underlies blood-brain barrier breakdown in stroke. Neuron. 2014; 82 (3): 603-617.
- Marsland A.L., Walsh C. The effects of acute psychological stress on circulating and stimulated inflammatory markers: a systematic review and meta-analysis. Brain, behavior, and immunity. 2017; 64: 208-219.
- Greenhalgh A.D., David S., Bennett F.C. Immune cell regulation of glia during CNS injury and disease. Nature Reviews Neuroscience. 2020; 1-14. URL: https://www.ncbi.nlm.nih.gov/pubmed/32042145 (дата обращения: 10.02.2020).
- DOI: 10.1038/s41583-020-0263-9


