Структурные механизмы становления симметрии у микроспориальных эмбриоидов пшеницы: данные сканирующей электронной микроскопии
Автор: Сельдимирова Оксана Александровна, Титова Галина Евгеньевна, Галин Ильшат Рафкатович, Круглова Наталья Николаевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Методом сканирующей электронной микроскопии проанализированы фенотипы эмбриоидов, формирующихся в культуре in vitro пыльников яровой мягкой пшеницы. Выявлены структурные механизмы формирования эмбриоидов и рассмотрена роль синтетического ауксина 2,4-Д в индукции их образования.
Культура пыльников in vitro, эмбриоиды, полиэмбриоиды, 4-д, симметрия
Короткий адрес: https://sciup.org/148202071
IDR: 148202071 | УДК: 633.111.1:581.143.6
Текст научной статьи Структурные механизмы становления симметрии у микроспориальных эмбриоидов пшеницы: данные сканирующей электронной микроскопии
Морфогенез, как совокупность протекающих в развивающемся организме процессов дифференциации клеток с образованием специализированных тканей и органов [1], остается одной из сложнейших проблем биологии развития растений.
При морфогенезе определяющее значение принадлежит процессам становления полярности и симметрии растительного организма, так как осевая организация тела в пространстве – существенный элемент целостности растительного организма [2, 3].
Однако реальные процессы, в том числе и структурные механизмы, лежащие в формирования осевой симметрии у высших растений, изучены недостаточно [2]. Основная причина этого – недоступность зародышей растений на самых ранних этапах их развития [4].
Удобной модельной системой для исследований в области морфогенеза растений может служить соматический эмбриогенез – формирование биполярных зародышеподобных структур – эмбриоидов в строго контролируемых условиях in vitro [5], в том числе при культивировании in vitro изолированных пыльников пшеницы [6].
При анализе структурных механизмов становления полярности и симметрии эмбриоидов in vitro большую помощь оказывает метод сканирующей электронной микроскопии (СЭМ), позволяющий получить точное представление о пространственной организации изучаемого объекта и тонких деталях его строения, а также точно идентифицировать конкретный путь морфогенеза in vitro , реализующийся при культивировании изолированных пыльников.
Цель работы состояла в изучении микроспори-альных эмбриоидов пшеницы методом СЭМ и анализе структурных механизмов становления их симметрии.
Объектом исследования послужили микроспо-риальные эмбриоиды, полученные при культивировании in vitro пыльников яровой мягкой пшеницы сорта Жница.
Донорные растения выращивались в полевых условиях на экспериментальных участках научного стационара Института биологии УНЦ РАН (Уфимский р-н).
Микроспориальные эмбриоиды получали с использованием метода культуры in vitro изолированных пыльников яровой мягкой пшеницы [7]. Образцы для сканирующей электронной микроскопии готовили согласно[8], высушивали с помощью прибора «Critical point» (Hitachi, Japan), электронопроводящее покрытие создавали термическим напылением золота в вакууме с применением вакуумного универсального поста (ВУП). Объекты анализировали с помощью сканирующего электронного микроскопа JSM-6390 (Jeol, Japan; на базе БИН РАН, г. Санкт-Петербург).
В культуре in vitro изолированных пыльников при использовании низких концентраций 2,4-Д образуются эмбриоиды (рис. 1 а ), сходные по строению с зиготическим зародышем пшеницы (рис. 1 б ). Такие эмбриоиды характеризуются дорзовентраль-ной симметрией и наличием всех органов, присущих зиготическому зародышу. Разнообразные формы эмбриоидов можно объяснить их развитием в отсутствии жесткой тканевой детерминации, имеющей место у зиготического зародыша in vivo.
При повышении концентрации 2,4-Д образуются эмбриоиды, представляющие собой сложные структуры – полиэмбриоиды – с измененным типом полярности и симметрии, что выражается в образовании в их апикальной части множественных щитков и апикальных меристем побега (от 2 до 5, рис. 2), объединенных общим корневым полюсом (иногда отмечается дифференциация двух независимых или поверхностно сросшихся апикальных меристем первичного корня).
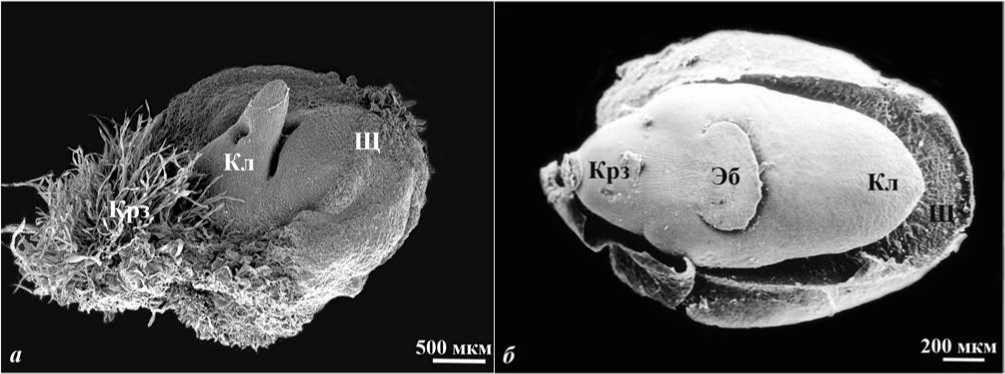
Рис. 1. Микроспориальный эмбриоид ( а ), сходный по строению с зиготическим зародышем ( б). СЭМ. Условные обозначения : Кл - колеоптиль, Крз - колеориза, Щ - щиток, Эб - эпибласт
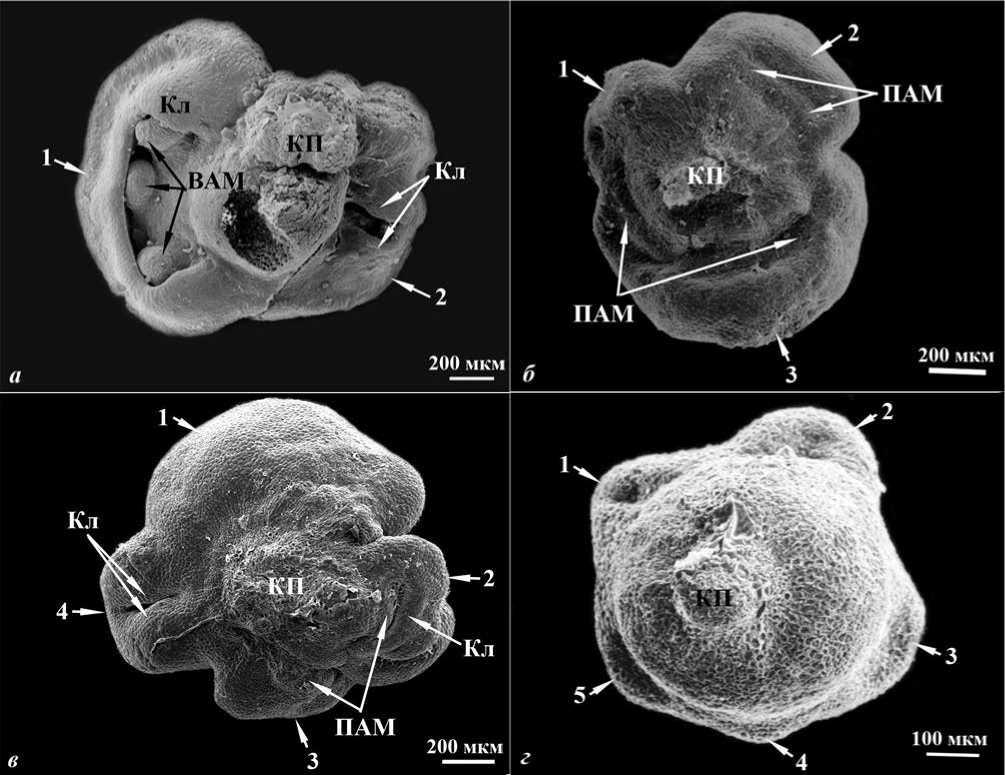
Рис. 2. Микроспориальные полиэмбриоиды с множественными щитками и апикальными меристемами побега: а - с двумя, б - тремя, в - четырьмя, г - пятью щитками, соответственно. СЭМ. Условные обозначения : ВАМ -вторичная апикальная меристема побега, Кл - колеоптиль, КП - корневой полюс, ПАМ - первичная апикальная меристема побега. Прим. Цифрами обозначены отдельные щитки
Анализ полученных результатов позволяет выделить два типа полиэмбриоидов с различным типом симметрии: 1) полиэмбриоиды с щитками, обращенными друг к другу дорзальной стороной и расположенными, в целом, терминально по отношению к соответствующим апикальным меристе мам побега (преобладающий тип) (рис. 2) и 2) полиэмбриоиды с щитками, обращенными друг к другу вентральной стороной и расположенными латерально по отношению к соответствующим апикальным меристемам побега (единичные случаи) (рис. 3).
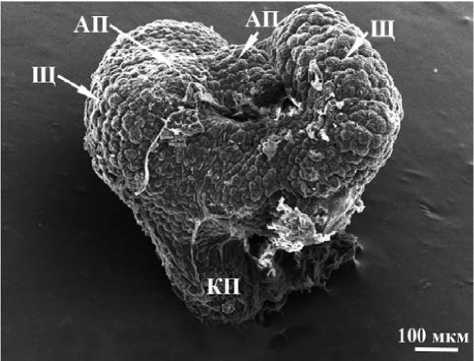
Рис. 3. Микроспориальный полиэмбриоид с щитками, обращенными друг к другу вентральной стороной. СЭМ. Условные обозначения : АП – апекс побега, КП – корневой полюс, Щ – щиток
Возможный механизм формирования таких полиэмбриоидов – кливажная полиэмбриония, состоящая в возникновении нескольких зародышей из зиготы или зародышей различного происхождения вследствие их расщепления [9].
При определенных условиях клетки зародышей и эмбриоидов могут освобождаться от организменного контроля, становиться тотипотентными, а затем детерминированными к формированию «нового» зародыша.
У голосеменных растений кливажная полиэмбриония – явление спонтанное и регулярное как в условиях in vivo , так и in vitro [11].
У покрытосеменных растений процесс кливажной полиэмбриоинии in vivo происходит довольно редко [9], но может быть индуцирован с использованием различных обработок, как правило, применением синтетических ауксинов [12–15] или ингибиторов полярного транспорта ауксинов [16] на ранних стадях развития зародышей.
Оба типа полиэмбриоидов, полученных нами в культуре in vitro пыльников пшеницы, в целом идентичны фенотипам, индуцированных воздействием in vitro ингибиторов полярного транспорта ауксинов (N-1-нафтилфталамовая кислота, кверти-цин) на изолированные зиготические зародыши Triticum aestivum L. в глобулярной стадии и раннего перехода к органогенезу [16].
В проанализированных нами литературных источниках [12-16] не прослежен генезис таких полимерных структур. Изучение генезиса полиэмбриоидов 1-го типа с использованием метода СЭМ позволило выявить структурный механизм кливажной полиэмбрионии лежащий в основе их образования.
Такой механизм заключается в следующем: за счет увеличения размеров апикальной части первичного эмбриоида (по крайней мере, с глобулярной стадии развития) на ней вместо одной возникают множественные точки роста, часто неравноценные по объему, что приводит к различиям в размерах образующихся множественных щитков и соответствующих им апикальных меристем побега (рис. 2 а – в ).
Аномальное увеличение размеров первичных апикальных меристем побега (рис. 2 б , в ) приводит к возникновению множественных вторичных апикальных меристем (рис. 2 а ), образующих в дальнейшем систему фасциированных побегов.
Известно, что главную роль в становлении симметрии зародыша растений играет негомогенное распределение ауксина (градиенты ауксина); потоки ауксина, создавая позиционную информацию, действуют как мощнейший морфогенетический фактор и определяют дифференциацию органов зародыша [2, 16].
Анализ полученных результатов позволяет сделать вывод об общности механизма гормональной регуляции образования полимерных структур на основе процесса кливажной полиэмбрионии как зиготических зародышей [16], так и микроспориаль-ных эмбриоидов пшеницы. Данный механизм состоит в нарушении полярного транспорта ауксинов в зародыше/эмбриоиде на глобулярной стадии развития, приводящей к изменению их симметрии и полярности: в зародыше – под действием ингибиторов полярного транспорта ауксинов, в эмбриоидах – вследствие создания в них избытка ауксинов при повышении концентрации 2,4-Д в индукционной среде.
C.Fischer и G.Neuhaus [17] установили, что в недифференцированном зиготическом зародыше пшеницы вокруг апикальной части существует кольцо клеток, компетентных к формированию меристемы побега. В условиях in vivo ауксин из базальной части зародыша транспортируется полярно в двух направлениях – к месту дифференциации апекса побега и к месту дифференциации щитка – и недоступен для других групп клеток зародыша. Однако при нарушении транспорта ауксин может накапливаться в клетках, в которых обычно его содержание низко. Авторы предположили, что эти клетки могут быть уже морфогенетически компетентными к дифференциации органов, либо же им для этого требуется импульс в виде потока ауксина. В результате формируются дополнительные меристемы побега и формируются полиэмбрионы.
По мнению B.Haccius [13], недифференцированный зародыш уже обладает «апикальным доминированием». Возможно, что при действии ростовыми веществами повреждается группа клеток, из которой позднее возникнет апекс побега и которая подавляет формирование других апексов. При этом действие клеток будущего апекса прекращается, а клетки, которые в норме должны давать начало семядолям, дают начало новым апексам побегав.
Дальнейшая детализация данных по генезису микроспориальных полиэмбриоидов позволит внести вклад в понимание процессов морфогенеза зародыша и кливажной полиэмбрионии, а также внести уточнения в гипотезу о механизме гормональной регуляции становления полярности и симметрии в эмбриогенезе злаков и подойти к управлению этими процессами в условиях in vitro .
-
1. Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М.: ФБК-ПРЕСС, 1999. 160 с.
-
2. Медведев С.С. Механизмы формирования и физиологическая роль полярности в растениях // Физиол. раст. 2012. Т. 59. № 4. С. 543-556.
-
3. Theißen G ., Saedler H. Molecular architects of plant body plans // Progress in botany. V. 59 / eds H.-D.Behnke, K. Esser, J.W. Kadereit, U. Lüttge, M. Runge. Berlin, Heidelberg: Springer-Verlag, 1998. P. 227-256.
-
4. Raghavan V . Embryogenesis in angiosperms: a developmental and experimental study. New York: Cambridge Univer. Press, 1986. 316 p.
-
5. Zimmerman J.L . Somatic embryogenesis: a model for early development in higher plants // Plant Cell. 1993. V. 5. N 10. P. 1411-1423.
-
6. Круглова Н.Н . Микроспора злаков как модельная система для изучения путей морфогенеза: Автореф. дис. … д-ра биол. наук. СПб., 2002. 48 с.
-
7. Круглова Н.Н., Батыгина Т.Б. Методические рекомендации по использованию морфогенетического потен-
циала пыльника в биотехнологических исследованиях яровой мягкой пшеницы. Уфа, 2002. 39 с.
-
8. Миронов A.A., Комиссарчик Я.Ю., Миронов В.А . Методы электронной микроскопии в биологии и медицине. СПб.: Наука, 1994. 399 с.
-
9. Батыгина Т.Б. Воспроизведение, размножение и возобновление растений // Эмбриология цветковых растений. Терминология и концепции. Т. 3: Системы репродукции / Под ред. Т.Б. Батыгиной. СПб.: Мир и семья, 2000. С. 35-39.
-
10. Sharp W.R., Sondahl M.R., Caldas L.S., Maraffa S.B. The physiology of in vitro asexual embryogenesis // Hort. Rev. V. 2 / eds F.G. Dennis, D.N. Maynard, M.N. Rogers. Westport, Connecticut: The AVI Publishing company, 1980. P. 268-310.
-
11. Gupta P.K., Durzan D.J. Somatic polyembryogenesis from callus of mature sugar pine embryos // Nat. Biotechnol. 1986. V. 4. N 7. P. 643-645.
-
12. Яковлев М.С., Снегирев Д.П. Влияние ростовых веществ на образование многозародышевых зерновок у пшеницы // Ботан. журн. 1954. Т. 39. № 2. C. 187-194.
-
13. Haccius B. Experimentally induced twinning in plants // Nature. 1955. V. 176. N 4477. P. 355-356.
-
14. Ferguson J.D., Mc Ewan J.M., Card K.A. Hormonally induced polyembryos in wheat // Physiol. Plant. 1979. V. 45. N 4. P. 470-474.
-
15. Erdelska O., Vidovencova Z. Cleavage polyembryony in vivo and in vitro // Biol. Plant. 1994. V. 36. N 3. P. 329-334.
-
16. Fischer C ., Speth V., Fleig-Eberenz S., Neuhaus G . Induc- tion of zygotic polyembryos in wheat: influence of auxin po
lar transport // The Plant Cell. 1997. V. 9. N 10. P. 17671780.
-
17. Fischer C., Neuhaus G. Influence of auxin on the establishment of bilateral symmetry in monocots // Plant J. 1996. V. 9. N 5. P. 659-669.
STRUCTURAL MECHANISMS OF SYMMETRY ESTABLISHMENT IN MICROSPORE DERIVED EMBRYOIDS OF WHEAT: THE DATA OF SCANNING ELECTRON MICROSCOPY
Список литературы Структурные механизмы становления симметрии у микроспориальных эмбриоидов пшеницы: данные сканирующей электронной микроскопии
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М.: ФБК-ПРЕСС, 1999. 160 с.
- Медведев С.С. Механизмы формирования и физиологическая роль полярности в растениях//Физиол. раст. 2012. Т. 59. № 4. С. 543-556.
- Theißen G., Saedler H. Molecular architects of plant body plans//Progress in botany. V. 59/eds H.-D.Behnke, K. Esser, J.W. Kadereit, U. Lüttge, M. Runge. Berlin, Heidelberg: Springer-Verlag, 1998. P. 227-256.
- Raghavan V. Embryogenesis in angiosperms: a developmental and experimental study. New York: Cambridge Univer. Press, 1986. 316 p.
- Zimmerman J.L. Somatic embryogenesis: a model for early development in higher plants//Plant Cell. 1993. V. 5. N 10. P. 1411-1423.
- Круглова Н.Н. Микроспора злаков как модельная система для изучения путей морфогенеза: Автореф. дис. … дра биол. наук. СПб., 2002. 48 с.
- Круглова Н.Н., Батыгина Т.Б. Методические рекомендации по использованию морфогенетического потенциала пыльника в биотехнологических исследованиях яровой мягкой пшеницы. Уфа, 2002. 39 с.
- Миронов A.A., Комиссарчик Я.Ю., Миронов В.А. Методы электронной микроскопии в биологии и медицине. СПб.: Наука, 1994. 399 с.
- Батыгина Т.Б. Воспроизведение, размножение и возобновление растений//Эмбриология цветковых растений. Терминология и концепции. Т. 3: Системы репродукции/Под ред. Т.Б. Батыгиной. СПб.: Мир и семья, 2000. С. 35-39.
- Sharp W.R., Sondahl M.R., Caldas L.S., Maraffa S.B. The physiology of in vitro asexual embryogenesis//Hort. Rev. V. 2/eds F.G. Dennis, D.N. Maynard, M.N. Rogers. Westport, Connecticut: The AVI Publishing company, 1980. P. 268-310.
- Gupta P.K., Durzan D.J. Somatic polyembryogenesis from callus of mature sugar pine embryos//Nat. Biotechnol. 1986. V. 4. N 7. P. 643-645.
- Яковлев М.С., Снегирев Д.П. Влияние ростовых веществ на образование многозародышевых зерновок у пшеницы//Ботан. журн. 1954. Т. 39. № 2. C. 187-194.
- Haccius B. Experimentally induced twinning in plants//Nature. 1955. V. 176. N 4477. P. 355-356.
- Ferguson J.D., Mc Ewan J.M., Card K.A. Hormonally induced polyembryos in wheat//Physiol. Plant. 1979. V. 45. N 4. P. 470-474.
- Erdelska O., Vidovencova Z. Cleavage polyembryony in vivo and in vitro//Biol. Plant. 1994. V. 36. N 3. P. 329-334.
- Fischer C., Speth V., Fleig-Eberenz S., Neuhaus G. Induction of zygotic polyembryos in wheat: influence of auxin polar transport//The Plant Cell. 1997. V. 9. N 10. P. 1767-1780.
- Fischer C., Neuhaus G. Influence of auxin on the establishment of bilateral symmetry in monocots//Plant J. 1996. V. 9. N 5. P. 659-669.


