Структурные преобразования среднего мозга крыс при экспериментальном моделировании дефицита магния
Автор: Смирнов А.В., Евсюков О.Ю., Спасов А.А., Харитонова М.В., Желтова А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Морфология
Статья в выпуске: 1 (33), 2012 года.
Бесплатный доступ
В работе представлены результаты качественного и количественного анализа структурных изменений различных отделов среднего мозга крыс при экспериментальном моделировании алиментарного дефицита магния. Отмечены различия в характере и выраженности структурных преобразований нейронов и нейропиля различных отделов среднего мозга крыс в условиях экспериментальной гипомагнезиемии и при пищевой коррекции последней магния L-аспарагинатом.
Средний мозг, магний, дефицит
Короткий адрес: https://sciup.org/142148942
IDR: 142148942 | УДК: 616.132.2-092.9:546
Текст научной статьи Структурные преобразования среднего мозга крыс при экспериментальном моделировании дефицита магния
В биологических системах магний является одним из важнейших макроэлементов, являющимся кофактором более трехсот ферментов, контролирующих, прежде всего, обмен аденозинтрифосфата, его участие в ионном транспорте, передаче внутриклеточных сигналов и осуществлении активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала в возбудимых тканях [1, 2, 6, 7]. Магниевая недостаточность создает неблагоприятный преморбидный фон для большого круга форм патологии нервной системы (экстрапирамидных расстройств, депрессии, мигрени и других цефалгий, сосудистых и нейродегенеративных поражений) [1, 6]. Магний важен для регуляции обмена нейромедиаторов и модулирования функции рецепторов в центральной нервной системе, в том числе ответственных за формирование депрессивно-подобного и тревожного поведения у животных [5]. В соответствии с современными представлениями о нейрохимической организации головного мозга основная масса катехол- и индоламинергических нейронов локализуется в различных отделах среднего мозга. Алиментарная коррекция магниевой недостаточности L-аспарагинатом магния способствует нормализации холинергической, норадренергической, серотонинергической нейротрансмиссии в центральной нервной системе, повышает порог коразоловых судорог [3]. Учитывая важную роль магния в патологии нейромедиаторного обмена представляется целесообразным оценить структурные изменения среднего мозга экспериментальных животных в условиях алиментарной магниевой недостаточности, а также при ее коррекции магний L-аспарагинатом.
ЦЕЛЬ РАБОТЫ
Определение влияния алиментарной недостаточности магния и ее коррекции на структурные изменения красных ядер среднего мозга крыс.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследования были выполнены на 30 половозрелых нелинейных белых крысах-самцах массой 220—240 г. В ходе эксперимента выделены группы животных: первая — контрольная интактная (10 животных), вторая — с моделированием алиментарного дефицита магния в течение 8 недель (10 животных), третья — животные, находившиеся на магний-дефицитной диете в течение 8 недель с последующим применением магния L-аспарагината в таблетированной форме в течение 4 недель (10 животных). Животные содержались в условиях вивария, согласно правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ Р 50258-92, ГОСТ З 51000.3-96 и 51000.4-96) с соблюдением «Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях», (1997). Эксперименты были одобрены Комитетом по этической экспертизе исследований Волгоградского государственного медицинского университета (протокол № 35-2006 от 27.03.2006). Интактные животные (1-я группа) получали полноценную магний-сбалансированную диету, содержащую 0,84 г MgO (0,5 г элементарного магния) на 1 кг диеты и отстоянную воду (содержание магния 20 мг/л). Животные, у которых моделировали гипомагнезиемию, получали специальную магний-дефицитную диету фирмы «ICN Biomedicals Inc.» (Aurora, Ohio, США), которая включала 20 % казеина, 70 % крахмала, 0,3 % DL-метионина, 0,2 % холина битартрата, 5 % кукурузного масла, 1 % поливитаминной смеси, 3,5 % диеты составляла полиминеральная смесь AIN-76, не содержащая магния. Для питья использовалась дистиллированная вода. Скорость и глубину развития гипомагнезиемии контролировали, определяя концентрацию магния в плазме и эритроцитах крови спектрофотометрическим методом по цветной реакции с титановым желтым (Sigma, США) с измерением на спектрофотометре «СФ-26» (ЛОМО, Россия) в кювете с длиной оптического пути 1 см при длине волны 550 нм. При снижении концентрации магния ниже 1,4 ммоль/л в эритроцитах и ниже 0,7 ммоль/л в плазме считалось, что у животных развилась гипомагнезиемия средней тяжести, свидетельствующая об адекватности используемой экспериментальной модели. Животным, находящимся на магний-дефицитной диете, в течение 8 недель перорально через зонд вводили исследуемую соль магния. Доза магния L-аспарагината рассчитывалась исходя из 50 мг элементарного магния на 1 кг веса животного. Усредненное время компенсации дефицита магния составляло около 4 недель. Забой животных проводился согласно требованиям, изложенным в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1989). Образцы головного мозга фиксировались в течение 24 часов в нейтральном забуференном 10%-м формалине с дальнейшим обезвоживанием в батарее спиртов и изготовлением парафиновых срезов толщиной 4—6 мкм, которые окрашивали по стандартным методикам гематоксилином и эозином, тионином по Нисслю. При морфологическом исследовании оценивали такие морфометрические параметры, как средняя площадь перикарионов нейронов, средняя площадь ядра нейрона, средняя площадь цитоплазмы перикарионов нейронов, ядерно-цитоплазматическое отношение, удельное количество нейронов с «темной» цитоплазмой. Полученные данные обрабатывались методами базисного статистического анализа в программе STATISTICA/6.0 фирмы StatSoft Inc. (США) для Windows.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В группе животных с дефицитом магния (в течение 8 недель) наблюдается уменьшение массы тела животных по сравнению с контролем на 18 % (p < 0,05), уменьшение массы головного мозга по сравнению с контролем — на 4 % (p < 0,05), уменьшение относительной массы головного мозга на 2 % (p < 0,05). При микроскопическом исследовании различных отделов среднего мозга наиболее выраженные изменения отмечаются в красных ядрах, центральном сером веществе, черной субстанции, в верхнем центральном и дорсальном ядрах шва. Наибольший интерес представляют изменения со стороны красных ядер, обеспечивающих интеграцию эфферентных сигналов экстрапирамидной системы [8], а также ядер шва, составляющие морфологическую основу серотонин-опосредованных депрессивно-подобных и тревожных поведенческих расстройств у изучаемых животных [1]. Отмеченные регионы среднего мозга представлены преимущественно крупными мультиполярными нейронами с треугольной и веретеновидной формой перикарионов, также встречаются мелкие и средние нейроны с округлой и полигональной формой перикарионов. Ядра многих крупных и мелких нейронов при дефиците магния сморщены, резко ба-зофильны, с мозаичной конденсацией гетерохроматина. В кариоплазме отдельных нейронов становятся трудно различимыми эктопированные ядрышки, отмечается появление глыбчатых пик-нотически измененных гомогенных ядерных фрагментов, напоминающих апоптозные тельца, отме- чается очаговая вакуолизация ядер и цитоплазмы перикарионов нейронов. В большинстве нейронов обнаруживается мозаичный гиперхроматоз цитоплазмы, в некоторых — просветление перинуклеарной области цитоплазмы перикариона. В нейропиле ядер центрального серого вещества, ядер шва при дефиците магния выявлялись набухшие глиоциты, явления периваскулярной ней-рофагии. В указанных регионах выявлены выраженное полнокровие сосудов микроциркулятор-ного русла, стаз эритроцитов в капиллярах, отек и набухание эндотелиоцитов капилляров и мелких артериол, ядра эндотелиоцитов артериол иногда располагаются перпендикулярно базальной мембране, что является одним из признаков вазоспазма.
В красных ядрах среднего мозга магний-де-фицитных животных при морфометрическом исследовании наблюдается увеличение средней площади перикарионов нейронов — на 2,5 %, а при алиментарной коррекции магниевой недостаточности — на 1,62 % по сравнению с контролем (табл.). Отмечается увеличение средней площади цитоплазмы перикарионов нейронов у магний-дефицитных крыс — на 6,4 %, а при коррекции магния L-аспарагинатом — на 4,2 % по сравнению с контролем. Средняя площадь ядер нейронов при дефиците магния уменьшается — на 4,5 %, а при пищевой коррекции — на 2,6 % по сравнению с контролем.
В группе животных с дефицитом магния отмечается достоверное (при р < 0,05) увеличение удельного количества темных нейронов на 23,4 % по сравнению с контрольной группой (рис. 1).
Таким образом, достоверное увеличение количества темных нейронов красных ядер среднего мозга (рис. 2) в группе с моделируемым в течение 8 недель магниевым дефицитом может свидетельствовать как о роли изучаемого макроэлемента в регуляции функций экстрапирамидной системы, так и о магний-индуцированных механизмах повреждения высокоспециализированных клеток центральной нервной системы [6, 8]. При этом диссоциированные изменения ядер и цито-плазмы перикарионов нейронов среднего мозга могут отражать различные механизмы морфологических преобразований при нарушении магниевого гомеостаза.
Изменение некоторых морфометрических параметров нейронов красных ядер среднего мозга крыс при алиментарном дефиците магния ( М ± m ) и его коррекции
|
Показатель |
Группы |
||
|
контрольная |
дефицит магния (8 недель) |
солевая коррекция магниевой недостаточности (магния L-аспарагинат) |
|
|
Масса тела, г |
225,78 ± 11,41 |
185,16 ± 6,91* |
193,43 ± 7,88* |
|
Масса головного мозга, г |
1,90 ± 0,05 |
1,83 ± 0,04 |
1,86 ± 0,07 |
|
Средняя площадь перикарионов нейронов, мкм2 |
202,16 ± 6,20 |
207,15 ± 3,26 |
205,45 ± 4,14 |
|
Средняя площадь ядра нейрона, мкм2 |
67,12 ± 5,08 |
63,34 ± 4,11 |
64,61 ± 3,15 |
|
Средняя площадь цитоплазмы перикарионов нейронов, мкм2 |
135,04 ± 5,12 |
143,67 ± 4,39 |
140,80 ± 4,12 |
|
Ядерно-цитоплазматическое отношение, число |
0,49 ± 0,03 |
0,44 ± 0,02 |
0,46 ± 0,03 |
|
Удельное количество нейронов с «темной» цитоплазмой, % |
9,12 ± 1,02 |
12,78 ± 1,06* |
11,56 ± 1,84 |
* p < 0,05 при сравнении с контролем.

Рис. 1. Увеличение количества темных нейронов в красном ядре среднего мозга при дефиците магния.
Окр. тионином по Нисслю, ув. х 100
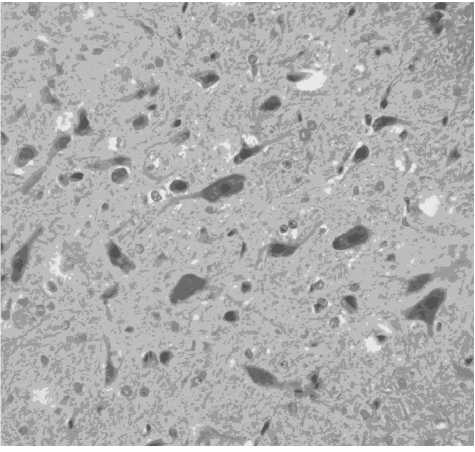
Рис. 2. Красное ядро среднего мозга при моделировании алиментарного дефицита магния. Окр. гематоксилином и эозином, ув. х 400
ЗАКЛЮЧЕНИЕ
Проведенное морфологическое исследование выявило ряд структурных изменений в нейронах и нейропиле различных отделов среднего мозга (красных ядрах, центральном сером веще- стве, черной субстанции, ядрах шва) крыс при экспериментальном моделировании алиментарного дефицита магния, что согласуется с литературными данными [8] о роли магниевой недостаточности в развитии экстрапирамидных расстройств, а также нейромедиаторного дисбаланса в центральной нервной системе [5]. Обнаруженные морфологические изменения в головном мозге крыс с алиментарной коррекцией дефицита магния L-аспарагинатом свидетельствуют о модулирующем влиянии этого вещества на состояние мик-роциркуляторного русла, нейронов и нейропиля ядер среднего мозга.


