Структурные реакции сердца и печени мышей CD-1 на однократное введение боркаптата натрия
Автор: Каныгин В.В., Колдышева Е.В., Завьялов Е.Л., Разумов И.А., Соловьева О.И., Кичигин А.И., Бутикова Е.А., Капустина В.И.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.31, 2023 года.
Бесплатный доступ
Бор-нейтронозахватная терапия рассматривается как перспективный метод лечения злокачественных опухолей головы и шеи. Считается, что для повышения эффективности этого вида терапии требуется использование больших доз препарата бора, что может повлечь за собой нежелательное воздействие на здоровые ткани. Одним из веществ, применяемых в клинической практике бор-нейтронозахватной терапии, является обогащенный изотопом бора 10В боркаптат натрия Na2B12H11SH (BSH). Цель исследования - изучение структурных реакций миокарда и печени мышей линии CD-1 после введения BSH. Проведено светооптическое и поляризационно-микроскопическое исследование миокарда и печени мышей-самцов линии CD-1 (n=56) после введения борсодержащего вещества в дозах 100 и 1000 мг/кг, однократно, внутрибрюшинно. Оценка структурных изменений в миокарде и печени проводилась через 1, 3 и 7 сутки после введения BSH. Однократное введение BSH в дозе 100 мг/кг не приводило к гибели животных, тогда как через 3 часа после введения BSH в дозе 1000 мг/кг погибло 1 животное. Масса тела животных в течение эксперимента менялась незначительно. Анализ массы сердца показал снижение этого показателя к 3 и 7 суткам по сравнению с показателями в тех же группах на 1 сутки эксперимента. При анализе динамики изменений массы печени достоверные ее изменения на протяжении эксперимента не выявлены. К основным структурным изменениям миокарда относились литические и контрактурные повреждения кардиомиоцитов, гемодинамические нарушения в виде выраженного венозного и капиллярного полнокровия. Повреждения печени проявлялись в дистрофических изменениях гепатоцитов, появлении через 3 суток моноцеллюлярных некрозов гепатоцитов и перицентральных мононуклеарных инфильтратов. Полученные данные свидетельствуют о том, что использованные дозы BSH 100 и 1000 мг/кг при однократном введении вызывают структурные изменения миокарда и печени различной степени выраженности, которые сохраняются в течение 7 суток наблюдения.
Миокард, печень, радиотерапия опухолей, боркаптат натрия, мыши cd-1
Короткий адрес: https://sciup.org/143181183
IDR: 143181183 | DOI: 10.20340/mv-mn.2023.31(3).812
Текст научной статьи Структурные реакции сердца и печени мышей CD-1 на однократное введение боркаптата натрия
Kanygin VV, Koldysheva EV, Zav’yalov EL, Razumov IA, Solovyova OI, Kichigin AI, Butikova EA, Kapustina VI. Structural reactions of CD-1 mice heart and liver to a single injection of borocaptate sodium. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(3):812. (3).812
Введение. Важнейшей медикобиологической задачей остается разработка новых подходов к лечению особо агрессивных злокачественных новообразований, к которым относятся опухоли мозга с высокой пролиферативной активностью, выраженным метастатическим потенциалом, коротким периодом ремиссии и низким уровнем выживаемости пациентов. Одним из таких подходов является бор-нейтронозахватная терапия (далее - БНЗТ), которая относится к разряду лучевой терапии злокачественных опухолей [13]. Считается, что эта технология позволяет объединить принцип органа-мишени, используемый в химиотерапии и принцип анатомической локализации традиционной радиотерапии [4]. Принцип БНЗТ основан на реакции захвата изотопом 10B теплового нейтрона и образованием нестабильного изотопа 11B, который распадается на альфа-частицу и ион лития, что обеспечивает повреждение ДНК и гибель опухолевой клетки, в которой селективно накапливается 10B [5]. Для проведения БНЗТ необходим малотоксичный агент, обогащенный 10B. Одним из таких соединений является боркаптат натрия Na2B12H11SH (BSH). Хотя BSH был впервые использован в клинической практике БНЗТ еще в 1975 году, использование его до сих пор актуально как в экспериментальных исследованиях, так и в клинической практике [6-8]. Однако кардио- и гепатотоксичность этого вещества и его роль в структурных перестройках жизненно важных органов, уровень цитотоксичности для опухолевых и неопухолевых клеток изучена до сих пор недостаточно. Есть данные, свидетельствующие о низкой токсичности BSH применяемом в терапевтической дозе 100 мг/кг [9-11], но, как известно, для подавления опухолевого роста лимитирующим фактором нередко является доза препарата, как, например, это происходит с широко применяемыми антрациклиновыми антибиотиками [12]. В экспериментальных исследованиях использовались дозы препарата до 1000 мг/кг, которые показали LD50 исследуемых лабораторных мышей [13]. Однако такая высокая летальность была связана с недостаточной чистотой синтезированного препарата, а дополнительные морфологические исследования не проводились. В связи с этим актуальность приобретает вопрос дозировки и способа доставки применяемого ве- щества, а также понимание путей взаимодействия борсодержащих препаратов с опухолевой клеткой и организмом в целом. Особое значение имеет исследование возможной структурной реорганизации здоровых тканей в ответ на введение этого вещества [14-15].
Цель исследования: изучение структурных реакций миокарда и печени мышей CD-1 после введения боркаптата натрия, обогащенного изотопом 10В.
Материалы и методы исследования. В эксперименте использованы мыши-самцы линии CD-1 в возрасте 12 недель, массой 38-45 г (n=56), которых содержали в Центре генетических ресурсов лабораторных животных на базе ЦКП «SPF-виварий» Института цитологии и генетики СО РАН в клетках Tecniplast в контролируемых условиях. Животные были разделены на 3 группы. Группа 1 (n=27) получала 0,9% раствор NaCl, который вводили в том же объеме, что и борсодержащее вещество. Группы 2 (n=15) и 3 (n=14) получали боркаптат натрия (BSH) в дозе 100 и 1000 мг/кг, соответственно. Был использован BSH производства Katchem spol. s. r. o. (Чехия) [CAS 12448-24-7], обогащенный изотопом 10В (>99.5%), который растворяли в 0,9% растворе NaCl с учетом максимально допустимого объема для инъекции. Инъекции проводили однократно, внутрибрюшинно. Все манипуляции проводили с соблюдением принципов гуманного отношения к животным (Директивой Европейского сообщества 86/609/ЕЕС).
Из эксперимента животных выводили декапитацией через 1, 3 и 7 суток после введения BSH. После вскрытия животного визуально оценивали состояние внутренних органов, проводили взвешивание внутренних органов. Сердце помещали в холодовую камеру до полной остановки, извлекали печень. Образцы стенки левого желудочка сердца и фрагменты печени фиксировали в 10% растворе нейтрального формалина (Biovitrum, Россия). Проводку осуществляли в аппарате STP120 (Microm GmbH, Walldorf, Germany). Парафиновые срезы толщиной 2-3 мкм получали на ротационном микротоме НМ325 (Thermo Fisher Scientific, Runcorn, UK). После стандартной процедуры депарафинации окрашивали ге- матоксилином и эозином с постановкой реакции Перльса. Светооптическое и поляризационно-микроскопическое исследование препаратов проводили с использованием универсального микроскопа Leica DM 4000B. Для получения снимков с препаратов применяли цифровую фотокамеру Leica DFC230 и компьютерную программу Leica QWin3 (Leica Microsystem, Cambidge, UK). При статистической обработке результатов определяли средние значения параметров, вычисляли дисперсию и стандартную ошибку среднего. Для сравнения нормально распределенных количественных данных использовали непарный t-критерий Стьюдента. Отличия считали статистически значимыми при p<0,05.
Результаты исследования и обсуждение. Однократное введение BSH в дозе 100 мг/кг не приводило к гибели животных, тогда как через 3 часа после вве-
Таблица 1
Масса тела, сердца и печени мышей CD-1 при введении BSH в дозах 100 и 1000 мг/кг, (М±т)
|
Показатель |
1 группа (контроль) |
2 группа |
3 группа |
||||
|
Время после введения BSH |
|||||||
|
1 сутки |
3 сутки |
7 сутки |
1 сутки |
3 сутки |
7 сутки |
||
|
Масса тела, г |
41,30±0,96 |
40,7±0,8 |
39,3±0,5 |
41,1±0,6 |
39,2±2,2 |
38,3±0,9 |
45,0±0,4 |
|
Масса сердца, г |
0,17±0,02 |
0,22±0,0 |
0,12±0,0 # |
0,10±0,0 # |
0,20±0,0 |
0,14±0,0 |
0,16±0,0 |
|
Относительная масса сердца, мг/г |
4,19±0,43 |
5,37±0,4 |
3,06±0,5 |
2,43±0,0 * # |
5,15±0,4 |
3,66±0,7 |
3,55±0,5 |
|
Масса печени, г |
2,08±0,08 |
2,04±0,1 |
1,86±0,0 |
2,10±0,0 |
2,13±0,1 |
2,0±0,1 |
2,4±0,1 |
|
Относительная масса печени, мг/г |
50,18±1,24 |
50,0±1,5 |
47,3±0,8 |
51,1±0,8 |
54,4±1,8 |
52,2±1,9 |
53,3±1,7 |
Примечание: # - p<0,05 по сравнению с показателем той же группы на 1 сутки; * - p<0,05 по сравнению с контрольной группой
Светооптическое исследование печени выявило, что общее строение органа во всех группах было сохранено. У контрольных животных цитоплазма гепатоцитов равномерно окрашивалась эозином. Ядра содержали преимущественно эухро-матин, гетерохроматин располагался некрупными глыбками в околоядрышковой зоне или по периметру кариолеммы. Центральные и портальные вены и синусоидные капилляры иногда были расширены, полнокровны.
Через 1 сутки после введения BSH во 2-й и 3-й группах отмечались сходные изменения строения печени. Одно и двуядерные гепатоциты существенно варьировали по размеру, их цитоплазма окра- дения BSH в дозе 1000 мг/кг погибло 1 животное (7%). Масса тела животных в течение эксперимента менялась незначительно. Анализ массы сердца показал снижение этого показателя к 3 и 7 суткам: у животных 2-й группы на 45 и 55% (p<0,05), а у животных 3 группы на 30 и 20% по сравнению с показателями в тех же группах на 1 сутки. Относительная масса сердца у животных 2 группы к 7 суткам эксперимента снижалась по сравнению с контролем (на 42%; p<0,05) и показателем той же группы на 1 сутки эксперимента (на 55%; p<0,05). В 3 группе к 7 суткам наблюдалась сходная тенденция, снижение составляло 12% по сравнению с контролем и 31% по сравнению с показателями той же группы на 1 сутки эксперимента. При анализе динамики массы печени достоверные изменения не выявлены (табл. 1).
шивалась преимущественно равномерно. В то же время следует отметить, что у животных 3-й группы отмечался выраженный полиморфизм ядер и дистрофические изменения, проявляющиеся в вакуолизации цитоплазмы гепатоцитов (рис. 1-Б). В обеих группах гемодинамические изменения выражались в более выраженном расширении центральных и портальных вен и синусоидных капилляров по сравнению с 1-й группой (рис. 1-А).
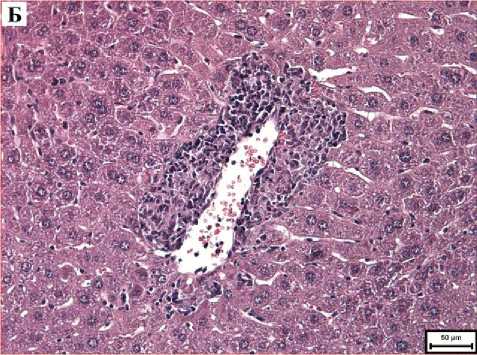
Через 3 суток после введения BSH у животных 2-й группы цитоплазма гепатоцитов окрашивалась в основном равномерно, но одновременно встречались небольшие участки дольки, в которых гепатоциты были более эозинофильными. Такие участ- ки располагались чаще всего перипорталь-но (рис. 1-А). Наблюдались очаги некроза гепатоцитов из 2-3 клеток, инфильтрированные мононуклеарами. У мышей 3-й группы отмечались более выраженные, чем в предыдущий срок, дистрофические изменения гепатоцитов, заключавшиеся в выраженных просветлениях цитоплазмы, ее очаговом лизисе. У мышей этой группы наблюдалось формирование массивных муфтообразных перицентральных моно-нуклеарных инфильтратов (рис. 2-Б). В обеих группах центральные и портальные вены и синусоидные капилляры были расширены, полнокровны; во многих венах наблюдалось эозинофильное пенистое содержимое (плазмостаз, см. рис. 2-А).
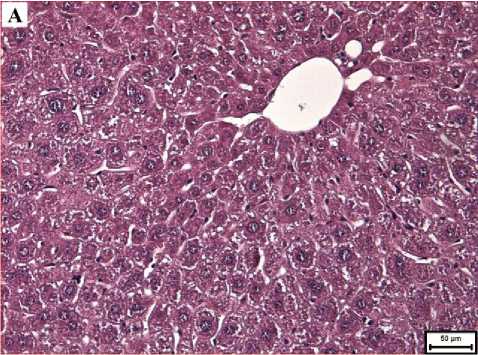
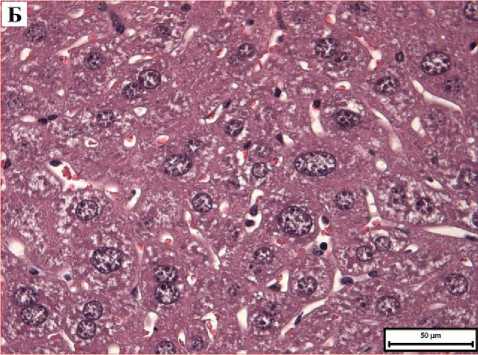
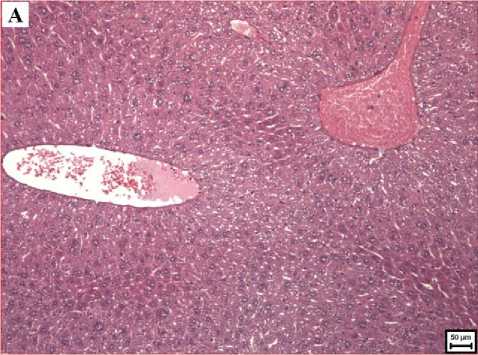
Рис. 2. Микрофото гистологического препарата печени мышей CD-1 через 3 суток после введения BSH. Окр.: гематоксилином и эозином. А - доза препарата 100 мг/кг, ув.: х100. Б -доза препарата 1000 мг/кг, ув.: х200
Рис. 1. Микрофото гистологического препарата печени мышей CD-1 через 1 сутки после введения BSH. Окр.: гематоксилином и эозином. А - доза препарата 100 мг/кг, ув.: х200. Б -доза препарата 1000 мг/кг, ув.: х400
Через 7 суток выраженность структурных изменений печени в каждой группе существенно не менялась по сравнению с предыдущим сроком. Однако следует отметить появление моноцеллюлярных некрозов гепатоцитов (рис. 3-А) в печени мышей обеих групп. У мышей 3-й группы сохранялись более выраженные дистро- фические изменения гепатоцитов по сравнению с мышами 2-й группы (рис. 3, Б). В обеих группах манифестировали выраженные нарушения гемодинамики в виде венозного и синусоидного полнокровия.
Миокард животных контрольной группы не претерпевал заметных изменений. Через сутки после введения BSH в кардиомиоцитах животных 2-й и 3-й групп наблюдались умеренные литические изменения, венозное и капиллярное полнокровие, в остальном миокард этих животных не отличался от контрольного. Следует отметить, что в 3-й группе изменения были более выраженными (рис. 4А-Б).
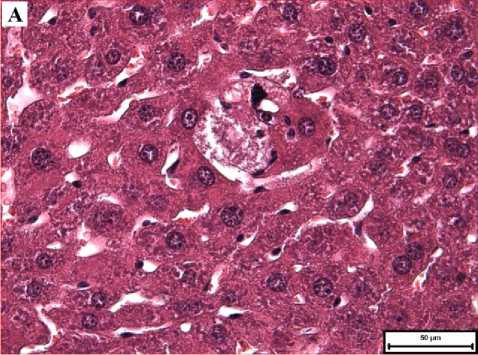
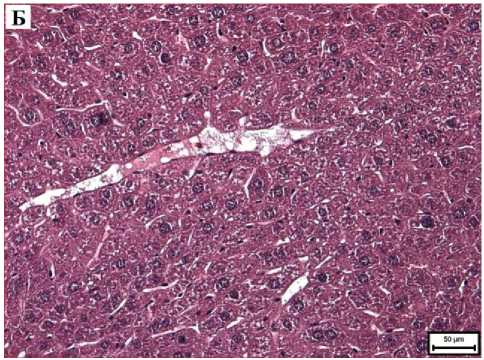
Рис. 3. Микрофото гистологического препарата печени мышей CD-1 через 7 суток после введения BSH. Окр.: гематоксилином и эозином. А - доза препарата 100 мг/кг, ув.: х400. Б -доза препарата 1000 мг/кг, ув.: х200
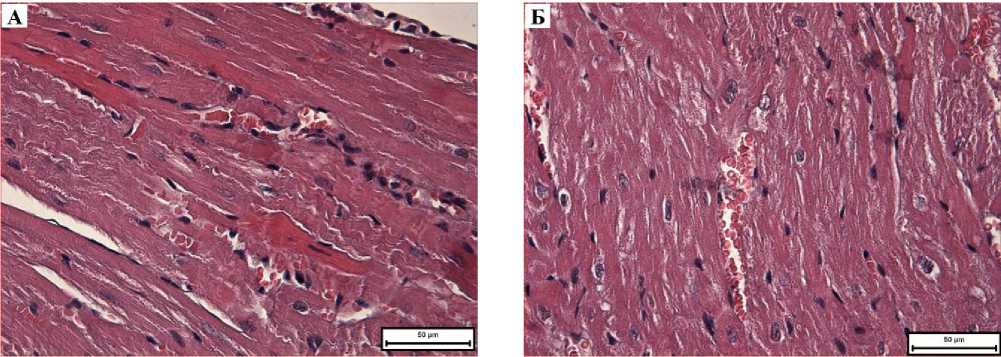
Рис. 4. Микрофото гистологического препарата сердца мышей CD-1 через 1 сутки после введения BSH. Окр.: гематоксилином и эозином. А - доза препарата 100 мг/кг, ув.: х400. Б -доза препарата 1000 мг/кг, ув.: х400
Через 3 суток после введения BSH литические изменения в кардиомиоцитах усиливались по сравнению с 1 сутками, иногда появлялись околоядерные «опустошения». К этому сроку у исследованных мышей были выявлены контрактурные изменения миофибрилл. Гемодинамические нарушения выражались в неравномерном венозном полнокровии. В некоторых сосудах наблюдалось «пенистое» содержимое фибриноидной природы (рис. 5-А). Сосудистая стенка у животных 3-й группы выглядела более рыхлой и утолщенной (рис. 5-Б). Содержимое крупных сосудов часто разделялось на плазму и форменные элементы. При исследовании образцов миокарда с помощью поляризационной микроскопии выяснилось, что в обеих группах появлялись миофибриллы подверженные контрактурным изменениям. Следует отметить, что все вышеуказанные изменения миокарда были более выраженными у животных 3-й группы по сравнению со 2-й.
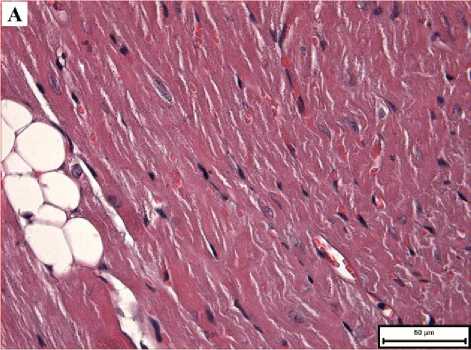
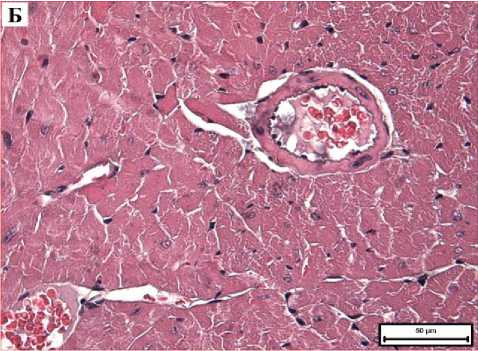
Рис. 5. Микрофото гистологического препарата сердца мышей CD-1 через 3 суток после введения BSH. Окр.: гематоксилином и эозином. А - доза препарата 100 мг/кг, ув.: х200. Б -доза препарата 1000 мг/кг, ув.: х400
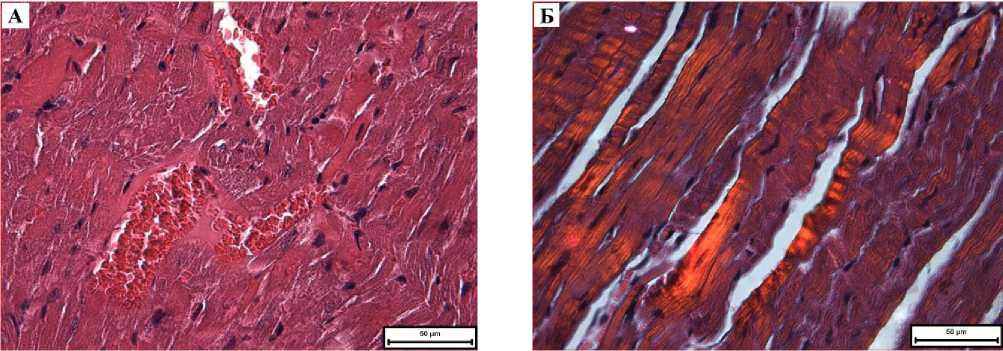
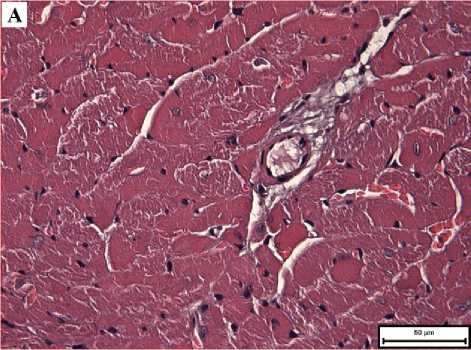
Рис. 7. Микрофото гистологического препарата сердца мышей CD-1 через 7 суток после введения BSH в дозе 1000 мг/кг. А – световая микрсокопия, Б – поляризационная микроскопия. Окр.: гематоксилином и эозином. Ув. х400
Рис. 6. Микрофото гистологического препарата сердца мышей CD-1 через 7 суток после введения BSH в дозе 100 мг/кг. А – световая микрсокопия, Б – поляризационная микроскопия. Окр.: гематоксилином и эозином. Ув. х400

Через 7 суток после инъекции BSH сохранялись литические и контрактурные изменения кардиомиоцитов, при этом миокард животных, получавших различные дозы вещества в этот срок эксперимента, незначительно различался по степени выраженности повреждений. Вне зависимости от дозы полученного вещества манифестировали гемодинамические нарушения в виде венозного и капиллярного полнокровия, нередко со сладжированием эритроцитов и диапедезными явлениями (рис. 6-7).
Результаты проведенного исследования свидетельствуют о сходных структурных реакциях миокарда и печени экспериментальных животных на BSH с реакциями на противоопухолевые препараты таких групп как антрациклиновые антибиотики, алкилирующие агенты, ингибиторы топоизомеразы и некоторые другие. Механизмы, лежащие в основе цитотоксического действия этих агентов, продолжают изучаться, несмотря на длительный период исследования [16-20]. Что касается степени токсичности BSH для неопухолевых клеток этот вопрос остается недостаточно изученным, особенно в аспекте воздействия вещества в виде моно
Список литературы Структурные реакции сердца и печени мышей CD-1 на однократное введение боркаптата натрия
- Hatanaka H. Boron-neutron capture therapy for tumors. Glioma. 1986;1-28. DOI:10.1007/978-3-642-84127-9_18
- Wang S, Zhang Z, Miao L, Li Y. Boron Neutron Capture Therapy: Status and Challenges. Front Oncol. 2022;12:788770. DOI: 10.3389/fonc.2022.788770
- Miyatake SI, Wanibuchi M, Hu N, Ono K. Boron neutron capture therapy for malignant brain tumors. J Neurooncol. 2020;149:1-11. DOI: 10.1007/s11060-020-03586-6
- Farhood B, Samadian H, Ghorbani M, et al. Physical, dosimetric and clinical aspects and delivery systems in neutron capture therapy. Reports of Practical Oncology&Radiotherapy. 2018;23(5):462-473. DOI:10.1016/j.rpor.2018.07.002
- Locher GL. Biological effects and therapeutic possibilities of neutrons. Am J Roentgenol Radium Ther. 1936;36:1-13
- Barth RF, Mi P, Yang W. Boron delivery agents for neutron capture therapy of cancer. Cancer Commun (London). 2018;38(1):35. DOI:10.1186/s40880-018-0299-7
- Fukuda H, Sauerwein W, Masutani M, Hopewell J. Response of Normal Tissues to Boron Neutron Capture Therapy (BNCT) with 10B-Borocaptate Sodium (BSH) and 10B-Paraboronophenylalanine (BPA). Cells. 2021;10(11):2883. DOI:10.3390/cells10112883
- Suzuki M, Masunaga S, Kinashi Y, et al. Intra-arterial administration of sodium borocaptate bsh/lipiodol emulsion delivers B-10 to liver tumors highly selectively for boron neutron capture therapy: experimental studies in the rat liver model. Int J Radiation oncology biol Phys. 2004;59(1):260-266. DOI:10.1016/j.ijrobp.2003.12.018
- Capala J, Stenstam BH, Sköld K, et al. Boron neutron capture therapy for glioblastoma multiforme: clinical studies in Sweden. J Neuro-Oncol. 2003;62:135-144. DOI: 10.1007/BF02699940
- Wittig A, Moss RLM, Sauerwein WAG. Glioblastoma, brain metastases and soft tissue sarcoma of extremities: Candidate tumors for BNCT. Applied Radiation and Isotopes. 2014;88:46-49. DOI:10.1016/j.apradiso.2013.11.038
- Bendel P, Wittig A, Basilico F, et al. Metabolism of bo-rono-phenylalanine-fructose complex (BPA-fr) and borocaptate sodium (BSH) in cancer patients--results from EORTC trial 11001. J Pharm Biomed Anal. 2010;51(1):284-287. DOI:10.1016/j.jpba.2009.08.018
- Wittig A, Stecher-Rasmussen F, Hilger RA, et al. Sodium mercaptoundecahydro-closo-dodecaborate (BSH), a boron carrier that merits more attention. Applied Radiation and Isotopes. 2011;69(12):1760-1764. DOI:10.1016/j.jpba.2009.08.018
- Lushnikova EL, Klinnikova MG, Molodykh OP, Nepomnyashchikh LM. Morfologicheskie proyavleniya remodelirovaniya serdtsa pri di-lyatatsionnoy kardiomiopatii antratsiklinovogo geneza. Byull Eksper Biol. 2004;138(12): 684-689 In Russian
- Larionova VB, Snegovoy AV. Correction possibilities of drug-induced liver toxicity in the treatment of patients with blood system tumors. On-cohematology. 2020;15(4):65-81. DOI:10.17650/1818-8346-2020-15-4-65-81
- Tan W. Cardiotoxicity. Drug Induced Cardiotoxicity: Mechanism, Prevention and Management. 2018:7. DOI:10.5772/intechopen.79611
- Lushnikova EL, Nepomnyashchikh LM, Tolstikova TG. Patomorfologiya myshechnykh kletok serdtsa pri deystvii tsiklofosfamida i triterpenoidov. Moskva: Izd-vo RAMN, 2009.- 272 s. In Russian
- Lushnikova EL, Molodykh OP, Nikityuk DB, et al. Strukturny analiz miokarda pri eksperimental'noy antratsiklinovoy kardiomiopatii i adrenali-novykh vozdeystviyakh. Bull Expr Biol i Med. 2018;166(11)\641-647. In Russian
- Nepomnyashchikh LM, Molodykh OP, Lushnikova EL, Sorokina YUA. Morfogenez i gistostereologichesky analiz gepatopatii, indutsirovannoy tsiklofosfomidom. Bull Exp Biol i Med. 2010;149(1):113-119. In Russian
- Vatutin NT, Sklyannaya EV, El'-Hatib MA i dr. Gepatotoksichnost' protivoopukholevykh preparatov: sovremennoe sostoyanie problemy. Ros-siysky szurnal oncologii. 2016;21(6):325-333. D01:10.18821/1028-9984-2016-21-6-325-333 In Russian
- Hung Y-H, Lin Y-C, Lin Y-T, et al. Therapeutic Efficacy and Radiobiological Effects of Boric Acid-mediated BNCT in a VX2 Multifocal Liver Tumor-bearing Rabbit Model. Anticancer research. 2019;39:5495-5504. D0I:10.21873/anticanres.13742


