Study of the effect of lomustin on HER2-positive breast cancer in FVB/N her-2 transgenic mice
Автор: Stukov Alexander N., Vershinina Sofia F., Koziavin Nikita A., Semiglazova Tatiana Yu., Filatova Larisa V., Latipova Dilorom Kh., Ivantsov Alexander O., Bespalov Vladimir G., Semenov Alexander L., Belyaeva Olesya A., Kireeva Galina S., Alexandrov Valery A., Tochilnikov Grigoriy V., Vasilyeva Irina N., Maydin Mikhail A., Tyndyk Margarita L., Kruglov Stepan S., Yanus Grigory A., Yurova Maria N.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.18, 2019 года.
Бесплатный доступ
Because of the high risk of brain metastases from HER2-positive breast cancer, the study of the anticancer activity of drugs used to treat brain tumors, in particular lomustine, is of great importance. In the FVB/N Her-2 transgenic mice bearing HER2-positive breast cancer (BC HER2+), a single oral administration of lomustine at a dose of 50 mg/kg resulted in a significant tumor growth inhibition (up to 96 %, p
HER2-positive breast cancer, HER2 transgenic FVB/N mice, lomustine, intracranial tumor, tumor growth index
Короткий адрес: https://sciup.org/140254287
IDR: 140254287 | УДК: 618.19-006.6-08:615.28]-092.9 | DOI: 10.21294/1814-4861-2019-18-5-54-60
Текст научной статьи Study of the effect of lomustin on HER2-positive breast cancer in FVB/N her-2 transgenic mice
У больных раком молочной железы с гиперэкспрессией HER2 очень высока частота метастазов в ЦНС, достигающая 30–55 % [4], тогда как в общей популяции больных с метастатическим РМЖ этот показатель составляет 5–15 % [5]. Возможности эффективной терапии таких метастазов ограничены. Лечение трастузумаб эмтанзином способствовало увеличению общей продолжительности жизни больных HER2-положительным раком молочной железы с метастазами в ЦНС до 26,8 мес по сравнению с 12,9 мес у больных, получавших комбинацию лапатиниба с капецитабином, однако выживаемость без прогрессирования была одинаково невысокой – 5,9 и 5,7 мес соответственно [6]. К числу химиотерапевтических препаратов, применяемых в лечении метастатического поражения головного мозга, относится ломустин. В связи с высоким риском метастазирования HER2-положительного РМЖ в головной мозг целесообразно исследование собственной активности ломустина при HER2-положительной опухоли.
Материал и методы
В работе использованы мыши линии FVB/N, трансгенные по гену рецептора эпидермального фактора роста 2-го типа (HER2), и мыши BALB/c. Мыши FVB/N, несущие онкоген HER2, первоначально были получены из Национального института старения (Анкона, Италия) и поддерживаются в виде разводки в виварии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. Эти мыши отличаются значительной частотой развития спонтанных опухолей молочных желез у самок, иногда они возникают и у самцов [7, 8].
В течение эксперимента все животные находились в стандартных условиях содержания (12:12 часовой искусственный режим освещения, проточно-вытяжная вентиляция и температура 20– 25 ºС), получали стандартный комбинированный корм (ООО «Лабораторкорм») и питьевую воду ad libitum. Все экспериментальные исследования проводились в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986), под контролем этического комитета ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Для получения экспериментальной терапевтической модели перевиваемого HER2-положительного рака молочной железы опухоль молочной железы, спонтанно возникшая у мыши-самца линии FVB/N, трансгенной по онкогену HER2, была трансплантирована 9 другим здоровым самцам этой же линии. Перевивка осуществлялась внутримышечно путём введения в бедренную мышцу 0,2 мл 20 % взвеси опухолевой ткани в 0,9 % растворе натрия хлорида. У всех 9 мышей перевивка оказалась положительной. К 31 дню после перевивки масса опухолевых узлов в среднем составила 2463 ± 153 мг. При гистологическом исследовании опухоль характеризовалась как инвазивный рак молочной железы (рис. 1). Исследование мРНК реакцией ПЦР в режиме реального времени по методу delta Ct выявило выраженную экспрессию транскрипта HER2. В криоконсервированном виде опухоль сохраняется в опухолевом банке ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Влияние ломустина (Ломустин медак, ГмбХ Германия) на рост данной опухоли, обозначенной как РМЖ HER2+, изучалось как при её экстра- , так и при интракраниальной трансплантации. Экстракраниальная трансплантация РМЖ HER2+ производилась внутримышечно путем инъекции в бедренную мышцу 0,2 мл 20 % взвеси опухоли в 0,9 % растворе натрия хлорида 28 интактным мышам-самцам линии FVB/N, трансгенной по HER2. Из них 14 мышам на 6-й день после перевивки опухоли был введен ломустин в дозе 50 мг/кг внутрь однократно в виде взвеси в 2,5 % растворе крахмала в объёме 0,2 мл на 10 г массы тела мыши, 14 мышей составили контрольную группу и получили 2,5 % раствор крахмала по 0,2 мл на 10 г массы тела.
Действие ломустина на РМЖ HER2+ у мышей FVB/N сравнивалось с его действием на солидную опухоль Эрлиха у мышей BALB/c. Опухоль Эрлиха была трансплантирована внутримышечно 20 мышам-самцам BALB/c путём инъекции в бедренную мышцу 0,2 мл 0,9 % раствора натрия хлорида, содержащих 5×106 опухолевых клеток из асцита от мыши с асцитной формой опухоли Эрлиха. На 6-й день после перевивки опухоли Эрлиха 10 мышам был введен ломустин однократно перорально в дозе 50 мг/кг в 2,5 % растворе крахмала, 10 мышей служили контролем и получили 2,5 % раствор крахмала.
Интракраниальная трансплантация РМЖ HER2+ производилась путём введения в головной мозг 0,025 мл 20 % опухолевой взвеси по методике, являющейся модификацией метода внутримозгового заражения мышей вирусом бешенства [9]. При гистологическом исследовании в головном мозге выявлялся очаг опухолевого роста (рис. 2). Исследование проводилось на 22 мышах-самцах трансгенной по HER2 линии FVB/N. Через 24 ч после перевивки 10 мышам был введён ломустин в дозе 50 мг/кг однократно перорально в 2,5 % растворе крахмала, 12 мышам контрольной группы был введен перорально раствор крахмала.
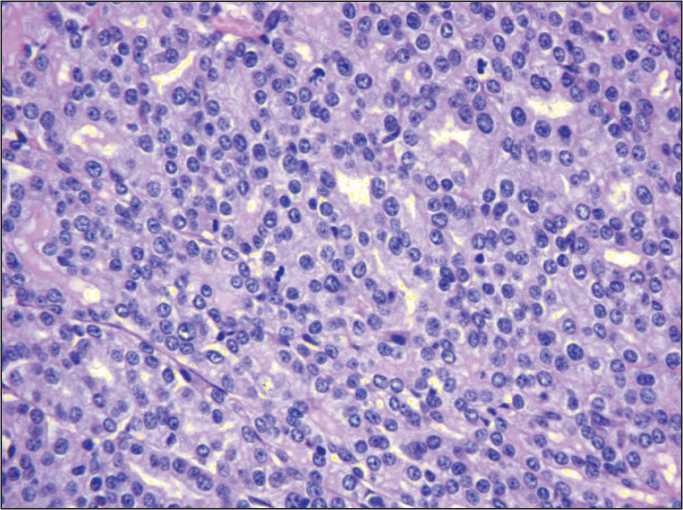
Рис. 1. Микрофото. Внутримышечно трансплантированный HER2-положительный инвазивный рак молочной железы у мыши FVB/N. Окраска гематоксилином и эозином, ×400
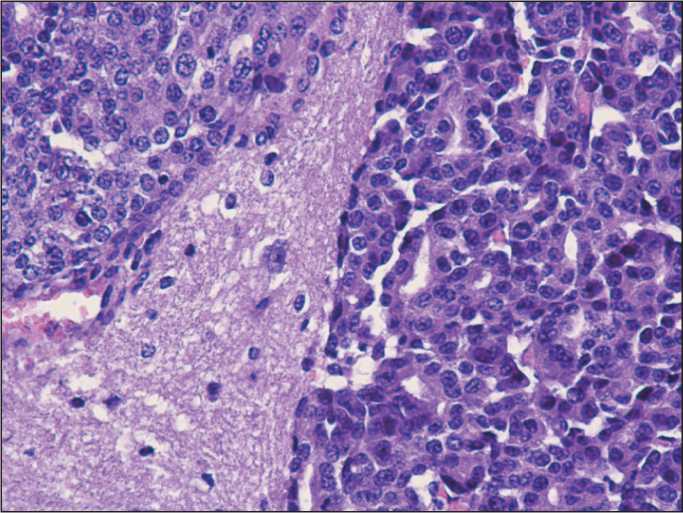
Рис. 2. Микрофото. Головной мозг мыши FVB/N с трансплантированным интракраниально HER2-положительным инвазивным раком молочной железы. Окраска гематоксилином и эозином, ×400
Противоопухолевая активность при опухолях, трансплантированных внутримышечно, оценивалась по торможению роста опухоли (ТРО), по площади под кинетической кривой роста опухоли (S) и индексу роста опухоли (ИРО), представляющему собой отношение S в исследуемой группе к S в контроле, выраженное в процентах) [10].
Торможение роста опухоли (ТРО) определялось в процентах по формуле
TGI = x 100, vc где TРО – торможение роста опухоли (%); VК – средний объём опухоли в контрольной группе, мм3; V – средний объём опухоли в экспериментальной Э группе, мм3.
Индекс роста опухоли (ИРО) определялся в процентах по формуле
TGI = — x 100,
Sc где ИРО – индекс роста опухоли (%), SЭ – площадь под кинетической кривой роста опухоли в экспериментальной группе, а SK – площадь под кинетической кривой роста опухоли в контрольной группе.
У мышей с РМЖ HER2+, трансплантированной интракраниально, терапевтический эффект оценивался по медиане продолжительности жизни (МПЖ) и по увеличению продолжительности жизни (УПЖ):
1ST = MSTt MSTc x 100, MSTC где МПЖК – медиана продолжительности жизни в контрольной группе; МПЖЭ – медиана продолжительности жизни в экспериментальной группе.
При статистической обработке результатов опытов использовали методы вариационной статистики с использованием пакетов статистических программ SPSS Statistics 17.0 и GraphPad Prism 6.0. Достоверность различий оценивали с
Таблица 1
влияние ломустина на рост перевитого внутримышечно HER2-положительного инвазивного рака молочной железы (рМЖ HER2+)
|
Группа |
Объем опухоли мм3 (M±m), ТРО (%), р к контролю Дни после перевивки S ИРО 12 16 20 24 28 |
|
I .Контроль (n=14) II. Ломустин 50 мг/кг (n=14) |
495 ± 91 1375 ± 198 2251 ± 262 3612 ± 381 6339 ± 455 50286 ± 4456 100 % 19 ± 7 291 ± 80 795 ± 156 1499 ± 250 3055 ± 358 96 % 75 % 67 % 58 % 52 % 16488 ± 2607 33 % p=0,0004 p<0,0001 p<0,0001 p<0,0001 p<0,0001 p<0,001 p<0,001 |
Таблица 2
|
Группа |
Объем опухоли мм3 (M±m), ТРО (%), р к контролю Дни после перевивки S ИРО 10 12 15 17 20 |
|
I .Контроль (n=12) II. Ломустин 50 мг/кг (n=12) |
495 ± 91 1375 ± 198 2251 ± 262 3612 ± 381 6339 ± 455 50286 ± 4456 100 % 19 ± 7 291 ± 80 795 ± 156 1499 ± 250 3055 ± 358 96 % 75 % 67 % 58 % 52 % 16488 ± 2607 33 % p=0,0004 p<0,0001 p<0,0001 p<0.0001 p<0.0001 p<0.001 p<0.001 |
Таблица 3
влияние ломустина на продолжительность жизни мышей FVB/N с перевитой интракраниально HER2+ опухолью молочной железы
|
Группа |
Число мышей/живы к МПЖ 95% ДИ УПЖ, % 27 дню |
|
12/0 21 14,2–27,8 10/7 30 27,0–33,0 43% (р=0,0007) (р<0,001) |
Примечание: МПЖ – медиана продолжительности жизни, УПЖ – увеличение продолжительности жизни; 95 % ДИ – 95% доверительный интервал.
влияние ломустина на рост перевитой внутримышечно опухоли Эрлиха
использованием критерия t Стъюдента, Fisher’s LSD теста для one-way ANOVA, лог-ранк теста Ментеля-Хензеля.
Результаты и обсуждение
Однократное пероральное введение ломустина в дозе 50 мг/кг обусловило значительное торможение роста перевитого внутримышечно HER2-положительного рака молочной железы (РМЖ HER2+). На 12-й день после перевивки (6-й день после введения ломустина) торможение роста опухоли достигло 96 % (p=0,0004) и в дальнейшем оставалось на достаточно высоком уровне (табл. 1), составив 52 % к концу периода наблюдения на 28 день (p<0,0001). Площадь под кинетической кривой роста опухоли у мышей, получивших ломустин, оказалась почти в 3 раза меньше, чем в контроле, соответственно, индекс роста опухоли (ИРО) составил 33 % (табл. 1).
На рост трасплантированной внутримышечно опухоли Эрлиха у мышей BALB/c ломустин не проявил столь выраженного влияния (табл. 2). При введении ломустина в такой же дозе 50 мг/кг торможение роста опухоли Эрлиха было статистически значимым, но не превышало 39 %. Индекс роста опухоли, достигавший 68 %, не свидетельствовал о заметной активности ломустина при опухоли Эрлиха (табл. 2).
У мышей FVB/N с трансплантированным интракраниально РМЖ HER2+ (табл. 3) медиана
Список литературы Study of the effect of lomustin on HER2-positive breast cancer in FVB/N her-2 transgenic mice
- Tan M., Yu D. Molecular mechanisms of erbB2-mediated breast cancer chemoresistance. Adv Exp Med Biol. 2007; 608: 119-129. DOI: 10.1007/978-0-387-74039-3_9
- Трякин А.А. Таргетная терапия колоректального рака, рака желудка и поджелудочной железы. Практическая онкология. 2010; 11(3): 143-150.
- Santin A.D., Bellone S., Roman J.J., McKenney J.K., Pecorelli S. Trastuzumab treatment in patients with advanced or recurrent endometrial carcinoma overexpressing HER2/neu. Int J Gynaecol Obstet. 2008 Aug; 102(2): 128-31. DOI: 10.1016/j.ijgo.2008.04.008
- Pestalozzi B.C., Holmes E., de Azambuja E., Metzger-Filho O., Hogge L., Scullion M., Láng I., Wardley A., Lichinitser M., Sanchez R.I., Müller V., Dodwell D., Gelber R.D., Piccart-Gebhart M.J., Cameron D. CNS relapses in patients with HER2-positive early breast cancer who have and have not received adjuvant trastuzumab: a retrospective substudy of the HERA trial (BIG 1-01). Lancet Oncol. 2013 Mar; 14(3): 244-8. DOI: 10.1016/S1470-2045(13)70017-2
- Barnholtz-Sloan J.S., Sloan A.E., Davis F.G., Vigneau F.D., Lai P., Sawaya R.E. Incidence proportions of brain metastases in patients diagnosed (1973 to 2001) in the Metropolitan Detroit Cancer Surveillance System. J Clin Oncol. 2004; 22(14): 2865-2872. DOI: 10.1200/JCO.2004.12.149
- Krop I.E., Lin N.U., Blackwell K., Guardino E., Huober J., Lu M., Miles D., Samant M., Welslau M., Diéras V. Trastuzumab emtansine (T-DM1) versus lapatinib plus capecitabine in patients with HER2-positive metastatic breast cancer and central nervous system metastases: a retrospective, exploratory analysis in EMILIA. Ann Oncol. 2015 Jan; 26(1): 113-9. DOI: 10.1093/annonc/mdu486
- Тындык М.Л., Попович И.Г., Аникин И.В., Егормин П.А., Юрова М.Н., Забежинский М.А., Анисимов В.Н. Влияние препарата SSH&H на продолжительность жизни и развитие спонтанных опухолей у трансгенных мышей HER2/neu. Вопросы онкологии. 2012; 58 (2): 243-247.
- Panchenko A.V., Popovich I.G., Trashkov A.P., Egormin P.A., Yurova M.N., Tyndyk M.L., Gubareva E.A., Artyukin I.N., Vasiliev A.G., Khaitsev N.V., Zabezhinski M.A., Anisimov V.N. Biomarkers of aging, life span and spontaneous carcinogenesis in the wild type and HER-2 transgenic FVB/N female mice. Biogerontology. 2016 Apr; 17(2): 317-24. DOI: 10.1007/s10522-015-9611-y
- Стуков А.Н., Филатова Л.В., Латипова Д.Х., Беспалов В.Г., Беляева О.А., Киреева Г.С., Васильева И.Н., Александров В.А., Майдин М.А., Семенов А.Л., Вершинина С.Ф., Маркочев А.Б., Абдулоева Н.Х., Чубенко В.А., Семиглазова Т.Ю. Терапевтическая активность гемцитабина при интракраниальных опухолях. Вопросы онкологии. 2015; 61(2): 274-279.
- Стуков А.Н., Иванова М.А., Никитин А.К., Сорокин Г.М., Коньков С.А. Индекс роста опухоли как интегральный критерий эффективности противоопухолевой терапии в эксперименте. Вопросы онкологии. 2001; 47(5): 616-618.


