Studying of import mechanisms for different length and structure DNA into plant mitochondria
Автор: Klimenko E.S., Koulintchenko M.V., Grebnev P.A., Dietrich A., Konstantinov Yu.M.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
We investigated import of DNA of various length (109 bp, 269 bp, 717 bp, 1540 bp, 2732 bp, 9000 bp and 11600 bp) into the isolated mitochondria from potato tubers ( Solanum tuberosum ) and turnip root crops ( Brassica rapa ). The results imply existence of multiple pathways of DNA transfer into plant mitochondria. It was established that the transport of short length DNA (100-300 bp) is apparently carried out with the participation of several protein carriers which nature is currently unknown. We identified factors that influence the process of DNA transfer into mitochondria. These factors include the length of nucleic acid molecule and the presence of terminal inverted repeats that are specific to linear mitochondrial plasmids of plants.
Mitochondria, dna import, solanum tuberosum, linear mitochondrial plasmids, plant mitochondria genome
Короткий адрес: https://sciup.org/14323913
IDR: 14323913
Текст научной статьи Studying of import mechanisms for different length and structure DNA into plant mitochondria
Общеизвестно, что горизонтальный перенос генов играет важную роль в эволюции геномов бактерий. Однако позднее установлено, что горизонтальный перенос генов достаточно активно происходит и в растительных митохондриях
(частота этого процесса намного выше по сравнению с митохондриями других представителей эукариот) (Mower et al., 2012).
Сравнительный анализ митохондриальных нуклеотидных последовательностей дает основания предполагать, что предки высших растений обладали компактным митохондриальным геномом (Turmel et al., 2002). Митохондриальный геном высших растений имеет значительно больший размер (200 кб -11 Мб), чем у животных и грибов (16–100 кб). Лишь 11–18% митохондриальной ДНК составляют гены, кодирующие белки или рибосомальные и транспортные РНК, более 5% имеют хлоропластное, ядерное или вирусное происхождение, а для половины и более последовательностей мтДНК остаются неизвестны функции и происхождение. Вполне вероятно, что «избыточное» количество ДНК в митохондриях связано со способностью этих органелл к поглощению и встраиванию в свой геном чужеродной ДНК. Нами предположено, что в горизонтальном переносе генов в митохондрии активную роль играет обнаруженный нами природный механизм активного поглощения ДНК митохондриями (“импорт ДНК”), который распространен не только у растений, но также у млекопитающих и дрожжей (Koulintchenko et al., 2003; Koulintchenko et al., 2006; Weber-Lotfi et al., 2009). Важно подчеркнуть, что импортируемая в митохондрии ДНК может транскрибироваться, подвергаться репарации и интегрировать в геном, т.е. активно включается в генетические процессы в этих органеллах (Boesch et al., 2009, 2010; Mileshina et al., 2011). В отличие от импорта белков и тРНК биологическая роль и молекулярный механизм импорта ДНК в митохондрии растений остаются малоизученными. Наличие феномена
«природной компетентности митохондрий к поглощению чужеродной ДНК» у высших организмов в случае детального выяснения его молекулярно-биологических механизмов открывает широкие перспективы его использования не только в фундаментальных исследованиях по выяснению функций митохондриального генома у организмов разных видов, но также (что не менее важно) в исследованиях по биотехнологии (клонирование целевых генов в митохондриях) и биомедицине (генотерапия митохондриальных болезней и болезней пожилого возраста). Реализации этих планов мешает отсутствие эффективных подходов для целенаправленной доставки ДНК в митохондрии организмов разных видов в условиях in vivo .
MATERIALS AND METHODS
Выделение митохондрий из картофельных клубней
Митохондрии изолировали из клубней картофеля согласно стандартному протоколу (Neuburger et al ., 1982). Концентрацию митохондриального белка определяли методом Бредфорда. Оценку дыхательной активности митохондрий и определение их дыхательного контроля проводили с использованием кислородного электрода и ячейки производства фирмы «Hansatech».
Импорт ДНК в митохондрии
Импорт ДНК в митохондрии (200 мкг белка), проводили в буфере, содержащем 0,4 M сахарозу и 40 мM фосфат калия, pH 7.0 (буфер импорта), в течение 40 мин при 25°С и постоянном помешивании. По окончании инкубации, неимпортированную ДНК удаляли посредством отмывки 1 мл среды, содержащей 10 мM фосфат калия, 0,3 M сахарозу,0.1 % БСА, 5 мM глицин, pH 7.5 (СП). Далее осадок митохондрий ресупендировали и проводили обработку митохондрий ДНКазой (Fermentas, 1ед. активности фермента на пробу) в течение 20 мин в присутствии 10 mM MgCl2. Двухкратную отмывку от ДНКазы проводили в 1 мл СП, содержащей дополнительно 10 мM ЭДТА+10 мM ЭГТА.
Экстракция ДНК из митохондрий
Экстракцию ДНК проводили, с использованием одного объёма буфера, содержащего 10 мM Трис-HCl, 1 мM ЭДТА, 1 % (в/о) ДСН, pH 7.5, и одного объёма фенола. Нуклеиновые кислоты, содержавшиеся после центрифугирования в водной фазе, осаждали этанолом и разделяли электрофоретически в 1 % (в/о) агарозном геле, с последующим переносом в щелочных условиях (в 0,4 М NaOH) на нейлоновую мембрану (Hybond N+, Amersham Biosciences). Перед переносом нуклеиновых кислот на мембрану гель инкубировали последовательно в 0,25 М HCl, с целью апуринизации ДНК, в течение 20 мин, затем в 0,4 М NaOH, 30 мин. По окончании переноса нейлоновую мембрану использовали для радиоавтографии, экспонируя ее с рентгеновской пленкой (Fuji X-Ray Film, "Super RX").
Экстракцию ДНК из митохондрий для анализа с помощью ПЦР-РВ проводили с использованием метода термообработки. Полученные осадки митохондрий ресуспендировали в 50 мкл раствора, содержащего 0,5% NP-40, 2,5 мкМ EDТА, затем прогревали при 98°С 12 минут. После этого проводили осаждение центрифугированием и отбирали супернатант для ПЦР-РВ. Нуклеотидные последовательности праймеров и флуоресцентных зондов представлены в таблице 1.
Реакцию проводили в объеме 15 мкл. Реакционная смесь содержала: 1 ед.акт. Taq-полимеразы (Fermentas), буфер для Taq-полимеразы (650 мМ трис-HCl, pH 8.8, 160 мМ (NH 4 ) 2 SO 4 , 0.5% Tween 20), 1 мМ dNTP, 8 мМ MgCl 2 , праймеры 0.6 mМ, зонды 0.3 mМ, 2,5 мкл образца ДНК. Амплификацию проводили в следующем режиме: 4.5 мин – 95°С, 1 цикл; 15 с – 95°С, 15 с – 60°С, 40 циклов на CFX96 (Bio-Rad). Данные анализировали при помощи программного обеспечения CFX96 (Bio-Rad). Для дизайна праймеров и зондов использовали программное обеспечение PrimerExpress (Applied Biosystems).. Для построения калибровочной кривой использовали рекомбинантные плазмиды, содержащие ампликоны gfp и cox2 . Концентрацию ДНК измеряли спектрофотометрически (SmartSpec Plus, Bio-Rad). Чистоту препарата оценивали по соотношению А260/А280.
RESULTS AND DISCUSSION
Исследования эффективности импорта ДНК разной длины и структуры в различных условиях были проведены с использованием митохондрий из клубней картофеля (Solanum tuberosum) и корнеплодов репы (Brassica rapa). Анализ импорта ДНК малой (100 - 300 п.н.) средней (700 - 2700 п.н.) и большой (от 9000 п.н.) длины проводили с использованием двух методов детекции: ПЦР в реальном времени (Klimenko et al., 2011) и радиоактивно меченой ДНК (Koulintchenko et al., 2003).
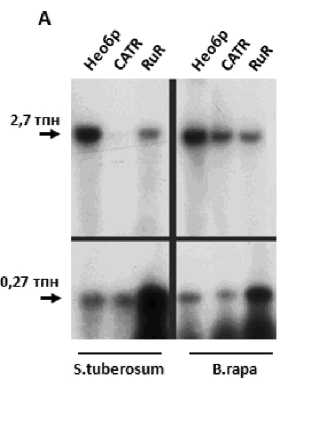
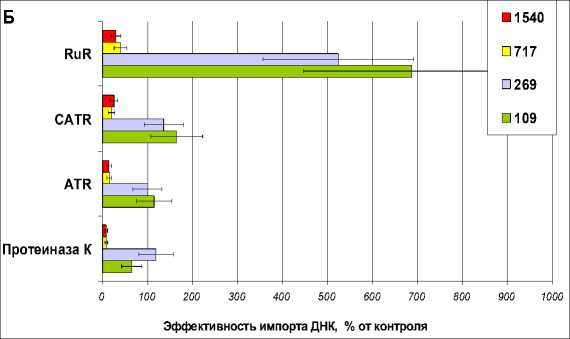
Как было показано ранее (Koulintchenko et al., 2003) в транспорте нуклеиновых кислот через митохондриальные мембраны у растений участвуют порин (VDAC) и адениннуклеотидтранслоказа (АНТ). В наших экспериментах использовали изолированные митохондрии картофеля и репы, обработанные ингибитором порина рутением красным и ингибиторами адениннуклеотидтранслоказы (АНТ) атрактилозидом и карбоксиатрактилозидом, а также обработку протеазами. Такая обработка позволяет судить об участии экспонированных на внешней поверхности мембраны белков в импорте ДНК. Так, предобработка изолированных митохондрий картофеля протеиназой К не оказывает существенного влияния на транспорт ДНК малой (109-269 п.н.) длины, но ингибирует транспорт ДНК средней (717-1540 п.н.), примерно, на 90%. Такие ингибиторы АНТ как атрактилозид и карбоксиатрактилозид не влияли на транспорт ДНК малой длины, но для ДНК средней (717-2700 п.н.) длины наблюдалось снижение эффективности импорта ДНК. На основании этих данных можно предположить, что для ДНК малой (109-269 п.н.) длины АНТ не является единственным белковым переносчиком на уровне внутренней мембраны митохондрий. Рутений красный, согласно литературным данным, является агентом, модулирующим транспортную активность порина (VDAC)- основного многофункционального белка внешней мембраны митохондрий. Рутений не оказывал на транспорт ДНК малой (109-269 п.н.) длины ингибирующего действия, более того, был выявлен стимулирующий эффект этого агента на транспорт ДНК в митохондрии, примерно в 5-7 раз. Для ДНК средней (717-2700 п.н.) длины обработка рутением приводила к торможению импорта ДНК по сравнению с контрольными необработанными митохондриями.
Таким образом, нами получены данные в поддержку гипотезы о существовании множественных путей переноса ДНК разной длины в митохондрии растительного происхождения. Один из этих путей трансмембранного переноса проявляет сходство с таковым, показанным ранее для импорта ДНК длиной от 1 до 3 т.п.н., и происходит c участием классических митохондриальных переносчиков: (1) зависимого от напряжения анионного канала (VDAC, от “voltage dependent anion channel”) наружной мембраны и (2) переносчика адениновых нуклеотидов (АНТ) внутренней мембраны митохондрий (Рис 1, А и Б). ДНК малой и средней длины импортируется в митохондрии частично перекрывающимися, но не совпадающими полностью путями. Транспорт в митохондрии малых ДНК может эффективно осуществляться с участием ряда альтернативных белковых переносчиков и/или мембранных каналов, природа которых остается пока неизвестной.
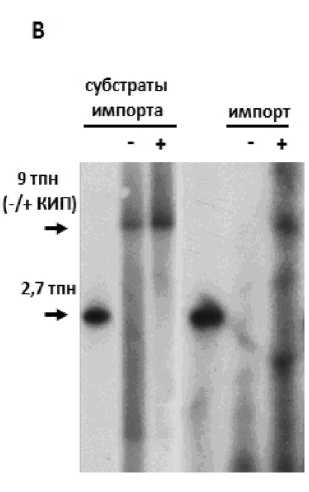
Установлено, что растительные митохондрии обладают специфичным транспортным механизмом в отношении длинных молекул ДНК (от 9 т.п.н. и больше), обладающих такими структурными особенностями как наличие концевых инвертированных повторов (327 п.н.) плазмиды 11,6 т.п.н. из B. napus (Handa, 2008). Митохондрии B. rapa импортируют длинные молекулы (порядка 9 т.п.н.), различающиеся в своей структуре наличием или отсутствием концевых инвертированных повторов, с большей эффективностью по сравнению с митохондриями S. tuberosum. При этом импорт молекул большой длины в митохондрии обоих растительных видов имеет сходную специфичность: наличие на концах молекул концевых инвертированных повторов обусловливает большую эффективность импорта
ДНК (Рис 1, В и Г).
Полученные в настоящей работе результаты свидетельствуют в пользу существования нескольких путей переноса ДНК в растительные митохондрии. Обнаружено, что транспорт ДНК малой (100-300 п.н.) длины осуществляется, по-видимому, с участием нескольких белковых переносчиков, природа которых пока остается неустановленной. Установлены факторы, влияющие на перенос ДНК в митохондрии. К таким факторам следует отнести длину молекулы нуклеиновой кислоты, а также наличие концевых инвертированных повторов, характерных для линейной плазмиды 11,6 т.п.н митохондрий Brassica napus .
Таблица 1. Нуклеотидные последовательности праймеров и флуоресцентных зондов
|
Олигонуклеотид |
Нуклеотидная последовательность |
|
|
gfp |
Rev |
5’- CGGGGCATGGCACTCTTGA-3’ |
|
For |
5’- CTGTTCCTTGGCCACACT-3’ |
|
|
Зонд |
Cy5~5`-TGTTCAATGCTTTTCAAGATACCCAGA -3’~BHQ2 |
|
|
cox2 |
Rev |
5’-AGCCTGCAATGTCCGATAAC -3’ |
|
For |
5’- CCCATTCCGAAAGGTTACTG-3’ |
|
|
Зонд |
R6G~5`-TGGTATACAACTTTGGACCTAACAGCC -3’~BHQ2 |
|
Г Эффективность импорта разноразмерных молекул ДНК в
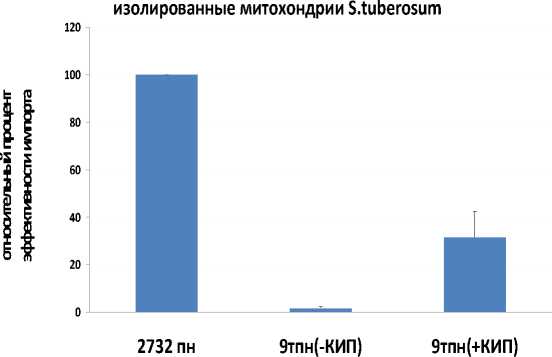
Рисунок 1. А и Б . Импорт ДНК разной длины в изолированные митохондрии S. tuberosum (А и Б) и B. rapa (А) имеет различную чувствительность к влиянию ингибиторов митохондриальных мембранных переносчиков (VDAC и АНТ). В качестве субстратов ДНК использовали фрагменты ДНК длиной 109 (Б), 269 (А и Б), 717 (Б), 1589 (Б) и 2732 (А) п.н. Анализ эффективности импорта проводили с использованием радиоактивно меченых субстратов (А) или методом ПЦР в реальном времени (Б). Использованные ингибиторы: для АНТ - карбоксиатрактилозид, 10 μМ (CATR), атрактилозид, 100 μМ (ATR), для VDAC - рутений красный, 5 μМ (RuR); Необр – необработанные митохондрии. В и Г . Митохондрии, изолированные из клубней картофеля, импортируют ДНК длиной 9 т.п.н., имеющую в структуре своей последовательности концевые инвертированные повторы (КИП) линейной митохондриальнйо плазмиды 11,6 т.п.н из B. napus . Анализ эффективности импорта проводили с использованием радиоактивно меченых субстратов.
ACKNOWLEDGMENT
Работа выполнена при финансовой поддержке грантов РФФИ 12-04-01400, 12-04-01027 и междисциплинарного интеграционного проекта СО РАН №59.
Список литературы Studying of import mechanisms for different length and structure DNA into plant mitochondria
- Boesch P., Ibrahim N., Dietrich A., Lightowlers R.N. (2010) Membrane association of mitochondrial DNA facilitates base excision repair in mammalian mitochondria. Nucleic Acids Res., 38(5), 1478-1488
- Boesch P., Ibrahim N., Paulus F., Cosset A., Tarasenko V., Dietrich A. (2009) Plant mitochondria possess a short-patch base excision DNA repair pathway. Nucleic Acids Res., 37(17), 5690-5700
- Handa H. (2008) Linear plasmids in plant mitochondria: Peaceful coexistence or malicious invasions? Mitochondrion, 8, 15-25
- Klimenko E.S., Mileiko V.A., Morozkin E.S., Laktionov P.P., Konstantinov Yu.M. (2011) Study of DNA Import and Export in Potato (Solanum tuberosum) Mitochondria Using Quantitative PCR. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology, 5(2), 170-176
- Koulintchenko M., Konstantinov Y., Dietrich A. (2003) Plant mitochondria actively import DNA via the permeability transition pore complex. EMBO J., 22(6), 1245-1254
- Koulintchenko M., Temperley R.J., Mason P.A., Dietrich A., Lightowlers R.N. (2006) Natural competence of mammalian mitochondria allows the molecular investigation of mitochondrial gene expression. Human Mol. Genetics, 15(1), 143-154
- Mileshina D., Koulintchenko M., Konstantinov Yu., Dietrich A. (2011) Transfection of plant mitochondria and in organello gene integration. Nucleic Acid Res., 39(17), e115
- Mower J.P., Jain K., Hepburn N.J. (2012) The role of horizontal transfer in shaping the plant mitochondrial genome. Advances in Botanical Res., 63. 41-64
- Turmel M., Otis C., Lemieux C. (2002). The complete mitochondrial DNA sequence of Mesostigma viride identifies this green alga as the earliest green plant divergence and predicts a highly compact mitochondrial genome in the ancestor of all green plants. Mol. Biol. Evol. 19, 24-38
- Weber-Lotfi F., Ibrahim N., Boesch P., Paulus F., Cosset A., Konstantinov Y., Lightowlers R.N., Dietrich A. (2009) Developing a genetic approach to investigate the mechanism of mitochondrial competence for DNA import. Biochim. Biophys. Acta, 1787, 320-327


