Субпопуляционный состав PD-l1-позитивных лимфоцитов в первичной опухоли у больных люминальными формами рака молочной железы
Автор: Таширева Л.А., Калинчук А.Ю., Алифанов В.В., Григорьева Е.С., Андрюхова Е.С., Крахмаль Н.В., Попова Н.О., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.23, 2024 года.
Бесплатный доступ
Взаимосвязь между опухолью и ее микроокружением представляет большой интерес, поскольку может определять эффективность новых агентов лекарственного лечения РМЖ, нацеленных на модуляцию противоопухолевых иммунных реакций, например ингибиторов иммунных контрольных точек (ИИКТ). При назначении ИИКТ при раке молочной железы оценка PD-L1-статуса должна проводиться в иммунных клетках. Это подчеркивает важность изучения особенностей опухолевого микроокружения, основным подходом к которому является раскрытие его гетерогенности. Цель исследования - изучение субпопуляционного состава PD-L1-положительных лимфоцитов опухолевого микроокружения отдельно в каждом из подтипов люминальных форм РМЖ и его сравнение в зависимости от PD-L1-статуса опухоли. материал и методы. Были получены 52 образца опухоли из первичного очага от пациенток с инвазивной карциномой молочной железы люминального А, люминального В HER2- и люминального В HER2+ подтипов (Т1-2N0-1M0). Ни одна пациентка не получала лекарственную терапию до операции. Оценка содержания цитотоксических лимфоцитов (ЦТЛ), В-лимфоцитов, Т-хелперных лимфоцитов, Т-регуляторных лимфоцитов и экспрессия ими PD-L1 в образцах опухолевой ткани была выполнена с помощью проточной цитофлуориметрии, а статус PD-L1 в опухоли был определен с помощью иммуногистохимического теста Ventana SP142.
Рак молочной железы, микроокружение, лимфоциты, pd-l1-статус
Короткий адрес: https://sciup.org/140305928
IDR: 140305928 | УДК: 618.19-006.6+616.155.32 | DOI: 10.21294/1814-4861-2024-23-3-64-72
Текст научной статьи Субпопуляционный состав PD-l1-позитивных лимфоцитов в первичной опухоли у больных люминальными формами рака молочной железы
В микроокружении опухоли лимфоциты преобладают среди мононуклеарных клеток и считаются проявлением местного иммунного ответа. Наиболее многочисленной популяцией опухолеинфильтрирующих лимфоцитов (ОИЛ) являются Т-клетки, которые включают множество субпопуляций, различающихся по своим функциям. Среди них Tbet+ T-хелперные (Th) клетки 1 типа и CD8+ цитотоксические Т-лимфоциты (ЦТЛ), которые характеризуются своей цитолитической активностью, в том числе против опухолевых клеток. Напротив, GATA3+ Th2 клетки и FOXP3+ T-регуляторные лимфоциты (Tregs) модифицируют противоопухолевый иммунный ответ, нарушая презентацию антигена, активность и цитотоксичность других иммунных клеток, что способствует росту опухоли и иммунной толерантности [1].
С момента открытия молекулярно-биологических подтипов, различающихся по генетическим сигнатурам и агрессивности течения, утвердилось представление, что инвазивный рак молочной железы (РМЖ) является гетерогенным заболеванием [2]. В определенной степени взаимодействие между злокачественными клетками и ОИЛ зависит от генетики и биологии опухоли [3]. Более того, появляется все больше доказательств того, что прогностическая и предсказательная значимость ОИЛ варьирует при РМЖ различных молекулярно-биологических подтипов. Высокий уровень ОИЛ связан с благоприятным исходом у больных тройным негативным и HER2+ подтипами и с неблагоприятным исходом у больных люминальными подтипами РМЖ [4]. Взаимосвязь между опухолью и ее микроокружением представляет большой интерес, поскольку в практику лекарственного лечения РМЖ вошли новые агенты, нацеленные на модуляцию противоопухолевых иммунных реакций, например ингибиторы иммунных контрольных точек (ИИКТ) [5]. В России данная группа препаратов зарегистрирована для терапии метастатического тройного негативного РМЖ, а главным показанием является положительный PD-L1- статус, который имеет неопределенное прогностическое значение при РМЖ и определяется по иммунным клеткам [6]. Однако в настоящее время нет универсальности в оценке PD-L1-статуса. Для его определения существует четыре валидированных теста, различающиеся алгоритмами подсчета (в иммунных или опухолевых клетках) и пороговыми значениями при разных локализациях рака, а также адаптированные для соответствующих анти-PD-L1/PD-1-препаратов и полученные путем эмпирических наблюдений [6]. Это указывает на неравнозначность вовлеченности иммунных клеток в формирование резистентности к ИИКТ и подчеркивает ценность изучения популяций иммунных клеток, несущих PD-L1 при РМЖ.
Целью исследования явилось изучение субпопуляционного состава PD-L1-положительных лимфоцитов опухолевого микроокружения отдельно в каждом из подтипов люминальных форм РМЖ и его сравнение в зависимости от PD-L1-статуса опухоли.
Материал и методы
Пятьдесят два образца опухоли из первичного очага было получено от пациенток с инвазивной карциномой молочной железы люминального А, люминального В HER2- и люминального В HER2+ подтипов. Ни одна пациентка в этом исследовании не получала лекарственную терапию до операции. Клинико-патологические данные, включая менопаузальный статус, гистологический тип, молекулярно-биологический подтип, стадию, были собраны при изучении историй болезни.
Экспрессию PD-L1 оценивали методом иммуногистохимии с использованием кроличьего моноклонального анти-PD-L1 клона SP142 (Spring Bioscience, Pleasanton, CA, США) и автоматического иммуностейнера Ventana Benchmark ULTRA. Опухоли с ≥ 1 % иммунных клеток с цитоплазматическим и/или мембранным окрашиванием PD-L1 от площади всей опухоли считались PD-L1-позитивными.
Оценка содержания субпопуляций лимфоцитов в образцах опухолевой ткани больных была выполнена с помощью проточной цитофлуориметрии, как описано ранее [7]. Использовались следующие антитела: BV570-анти-CD45 (клон HI30, мышиные IgG1, Sony Biotechnology), PerCP/Cy5.5-анти-CD3 (клон UCHT1, Mouse IgG1, Sony Biotechnology), BV650-анти-CD8 (клон SK1, Mouse IgG1, Sony Biotechnology), APC/Cy7-анти-CD20 (клон 2H7, Mouse IgG2b, Sony Biotechnology), BV421-анти-CD274 (PD-L1) (клон MIH3, Mouse IgG1, Sony Biotechnology), AF647-анти-CD326 (EpCAM) (клон 9C4, Mouse IgG2b, Sony Biotechnology), PE/Cy7-анти-T-bet (клон 4B10, Mouse IgG1, Sony Biotechnology), PE-анти-FOXP3 (клон 259D, Mouse IgG1, Sony Biotechnology), AF488-анти-GATA3 (клон 16E10A23, Mouse IgG2b, κ, Sony), AF647-анти-pan-Cytokeratin (клон AE-1/AE-3, Mouse IgG1, Novus). Количество лимфоцитов различных субпопуляций в общей популяции лейкоцитов выражалось в % от общего количества CD45+EpCAM-pan-Cytokeratin-клеток.
Статистический анализ проводился с использованием программного обеспечения GraphPad Prism ver. 9.1.0. Значения изучаемых параметров представлены в виде медианы и межквартильного размаха (Me (Q1-Q3)). Для сравнения двух непарных групп использовался U-тест Манна–Уитни, для множества непарных групп – критерий Крускелла–Уоллиса. Значение р<0,05 считалось статистически значимым.
Результаты
Состав лимфоцитарного инфильтрата при различных молекулярных подтипах рака молочной железы.
Использование проточной цитометрии для анализа гомогенатов свежих тканей позволяет иметь информацию, которую трудно получить из архивных тканей. Этот подход был использован для определения частоты встречаемости субпопуляций лимфоцитов в общей популяции лейкоцитов и расчета относительного количества отдельных PD-L1-позитивных субпопуляций, чтобы полностью отразить композицию иммунного инфильтрата опухоли. Все определяемые нами основные популяции лимфоцитов, инфильтрирующих ткань первичной опухоли, обнаруживались у большинства пациенток (рис. 1А). Отмечается, что доли PD-L1-положительных клеток каждой изучаемой субпопуляции не различаются и составляют от 80 до 100 % как в люминальных А (p=0,2343), так и в люминальных В HER2- (p=0,0948) и HER2+ (p>0,9999) опухолях (рис. 1Б).
Оценка соотношения PD-L1-положительных клеток различных субпопуляций лимфоцитов в образцах опухолей различных молекулярных подтипов
Мы наблюдали значимые различия количества PD-L1-положительных Th2-лимфоцитов в зависимости от молекулярно-биологического подтипа опухоли. Так, количество PD-L1-положительных Th2-лимфоцитов в образцах люминального А (6,90 (1,62–10,38) %) и люминального В HER2- (6,74 (2,61–11,40) %) РМЖ было значимо большим по сравнению с люминальными В HER2+ случаями (0,75 (0,02–1,78) %, р=0,0240 и р=0,0092, соответственно) (рис. 2А). Значимых различий количества цитотоксических лимфоцитов (ЦТЛ), В-лимфоцитов, Тh1-лимфоцитов и Т-регуляторных лимфоцитов в микроокружении опухоли в зависимости от молекулярно-биологического подтипа рака молочной железы не обнаружено (рис. 2А). При расчете доли PD-L1-положительных Th2-лимфоцитов от общего количества Th2-лимфоцитов оказалось, что доля PD-L1-положительных Th2-лимфоцитов значимо меньше у больных люминальным В HER2- по сравнению с люминальным
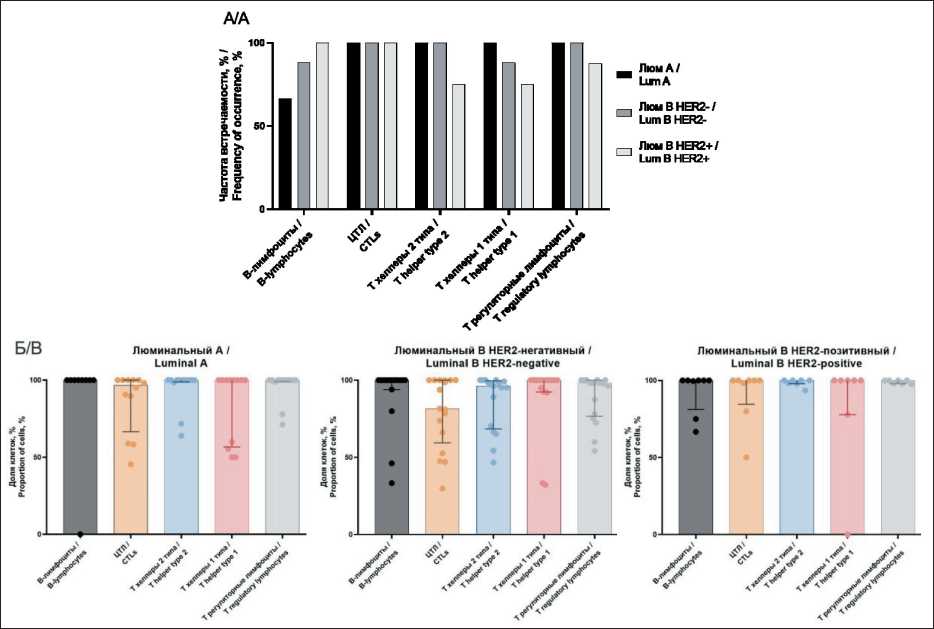
Рис. 1. Представленность изучаемых субпопуляций клеток в микроокружении РМЖ с учетом молекулярно-биологического подтипа: А – частота встречаемости цитотоксических лимфоцитов (ЦТЛ), В-лимфоцитов, Т-хелперных лимфоцитов и Т-регуляторных лимфоцитов в микроокружении РМЖ люминальных подтипов; Б – доля PD-L1-положительных клеток от количества всех клеток изучаемой субпопуляции в микроокружении РМЖ люминальных подтипов.
Примечание: рисунок выполнен авторами
Fig. 1. Representation of the studied cell subpopulations in the microenvironment of breast cancer taking into account the molecular biological subtype: A – the frequency of occurrence of cytotoxic lymphocytes (CTLs), B-lymphocytes, T-helper lymphocytes and T-regulatory lymphocytes in the microenvironment of luminal breast cancer; B – the proportion of PD-L1-positive cells in the number of all cells of the studied subpopulation in the microenvironment of luminal breast cancer. Note: created by the authors
А РМЖ (рис. 2Б). Кроме того, аналогичная закономерность существует и относительно доли Т-регуляторных лимфоцитов.
Оценка соотношения PD-L1-положительных клеток различных субпопуляций лимфоцитов в образцах опухолей с различным
PD-L1-статусом
В нашем исследовании 62,2 % (23/37) опухолей имели PD-L1+ статус. Далее все больные РМЖ были разделены на 2 подгруппы на основании их различного статуса экспрессии PD-L1. Мы оценили вариабельность экспрессирующих PD-L1 лимфоцитов в опухолях с положительным PD-L1-статусом. Цитотоксические лимфоциты, Тh2-лимфоциты и Т-регуляторные лимфоциты составляли большую часть PD-L1-положительных иммунных клеток в микроокружении рака молочной железы, и их количество в PD-L1-положительных опухолях люминального В HER2- значимо превышало соответствующие показатели в PD-L1-отрицательных опухолях. Прочих существенных различий в составе иммунных субпопуляций между PD-L1-позитивными и PD-L1-негативными опухолями других люминальных подтипов не выявлено (рис. 3).
Обсуждение
Разработка подходов к терапии РМЖ, основанных на модуляции иммунной системы, началась более 25 лет назад. Однако резкое увеличение количества клинических исследований, в которых бы тестировались иммунотерапевтические стратегии, связано с открытием ИИКТ [8]. К январю 2022 г. зарегистрировано 450 исследований, включающих проведение терапии ИИКТ, посвященных РМЖ.
При люминальном РМЖ первые попытки сочетания ИИКТ и химиотерапии у больных с метастатическим раком были неутешительными [9]. Однако при ранних формах люминального РМЖ терапия пембролизумабом приводила к увеличению частоты полного морфологического ответа с 13 до 30 % [10]. При тройном негативном подтипе РМЖ частота полного морфологического ответа при терапии пембролизумабом составила 60 %, при стандартной химиотерапии – 20 % [10]. Таким образом, несмотря на скромную эффективность, активность пембролизумаба при
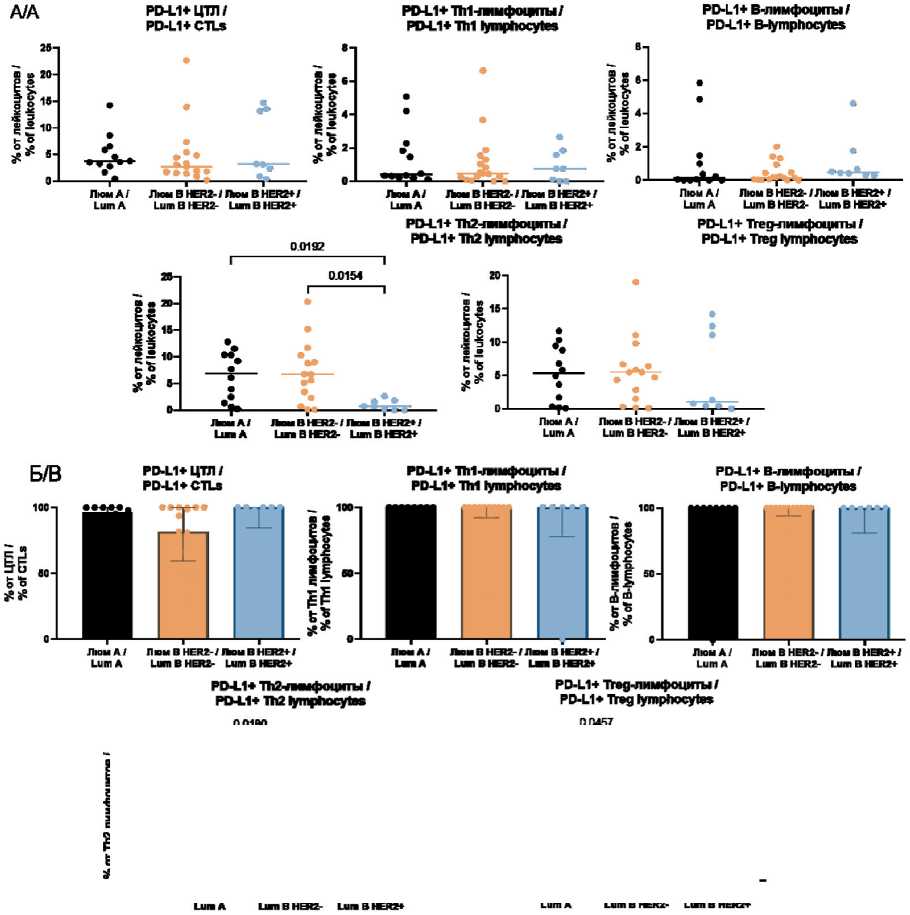
Рис. 2. Количество PD-L1-положительных клеток изучаемых субпопуляций в микроокружении РМЖ различных люминальных подтипов в расчете на общее количество лейкоцитов (А) и на количество клеток данной популяции (Б).
Примечание: рисунок выполнен авторами
Fig. 2. The number of PD-L1-positive cells of the studied subpopulations in the microenvironment of luminal breast cancer among the total number of leukocytes (A) and the number of cells in this population (B). Note: created by the authors
PD-L1-положительных люминальных РМЖ обнаруживается, клинические исследования в этом направлении продолжаются.
Экспрессия PD-L1 при РМЖ может обнаруживаться как в опухолевых, так и в иммунных клетках. Однако при назначении ИИКТ у больных РМЖ оценка PD-L1-статуса должна проводиться в иммунных клетках. Это подчеркивает важность изучения особенностей опухолевого микроокружения, основным подходом к которому является раскрытие его гетерогенности [11], в частности субпопуляций PD-L1-положительных лимфоцитов. В нашем исследовании мы выявили существенное разнообразие субпопуляционного состава лимфоцитов опухолевого микроокружения в образцах всех изучаемых нами молекулярно-биологических подтипов РМЖ. Действительно, все изучаемые нами клетки встречались в микроокружении опухоли в подавляющем большинстве случаев, и среди клеток каждой субпопуляции преимущественно встречались PD-L1-положительные (рис. 1). PD-L1 обычно не экспрессируется в нормальной ткани молочной железы ни в эпителиальных, ни в иммунных клетках [12]. Иными словами, появление PD-L1-положительных лимфоцитов в опухолевой ткани вызвано протекающим патологическим процессом. Считается, что главным аутокринным индуктором экспрессии PD-L1 является IFN-γ, главными продуцентами которого называют CD8+ Т-клетки и CD4+Th1-клетки [13]. Однако
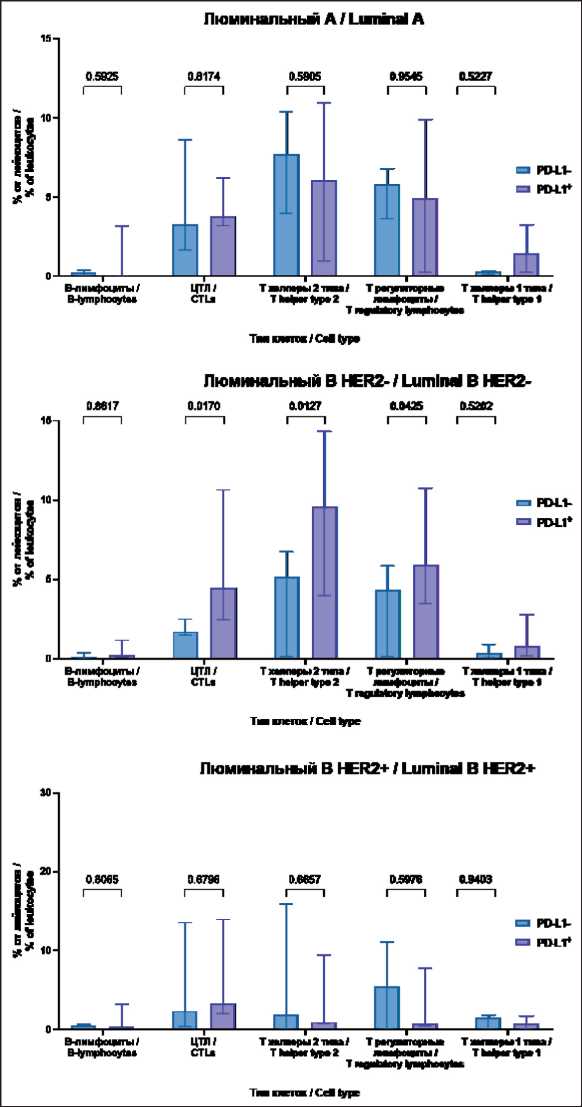
Рис. 3. Количество PD-L1-положительных клеток различных субпопуляций лимфоцитов в образцах опухолей с различным PD-L1-статусом у больных люминальными формами РМЖ. Примечание: рисунок выполнен авторами
Fig. 3. The number of PD-L1-positive cells of various subpopulations of lymphocytes in tumor samples with different PD-L1 status in patients with luminal breast cancer. Note: created by the authors исследования показывают, что опухоли с высоким содержанием клеток Th2-подобной иммуновоспа-лительной реакции имеют высокий уровень IFN-γ [14]. В нашем исследовании наличие в микроокружении опухоли PD-L1-положительных Th2-клеток, В-лимфоцитов и Т-регуляторных лимфоцитов согласуется с наблюдениями авторов, поскольку доля PD-L1-положительных клеток среди всех перечисленных популяций преобладала.
По нашим данным, в опухоли соседствовали иммунные клетки, формирующие различные типы иммуновоспалительных реакций: Th1-лимфоциты и цитотоксические лимфоциты, Th2-лимфоциты и В-лимфоциты (рис. 1). Возможность такого события обсуждалась и ранее [15]. Однако наше исследование дополняет эти данные, указывая на то, что гетерогенным является и состав PD-L1-положительных лимфоцитов.
По нашим данным, клеточный состав PD-L1-положительных лимфоцитов различается между люминальными подтипами РМЖ только по количеству Th2-лимфоцитов – значимо меньшее их количество определяется в люминальном В HER2+ подтипе (рис. 2). Возможно, этим отчасти объясняется противоречивая прогностическая и предиктивная значимость микроокружения при люминальных формах РМЖ, когда их рассматривают как один молекулярный подтип [4]. Насколько нам известно, ранее экспрессия PD-L1 на Th2-лимфоцитах, инфильтрирующих опухоль, отдельно от общей популяции CD4+ лимфоцитов в ткани РМЖ не оценивалась. В классическом понимании Th2-лимфоциты связаны с неблагоприятным исходом при РМЖ, но последние работы все же содержат некоторые противоречия. В исследовании L. Le et al. люминальные опухоли с высоким уровнем Th2 демонстрировали большую частоту полного патологического ответа [14]. В другой работе показаны критическая положительная роль CD4+ Th2-лимфоцитов в иммунном ответе против рака молочной железы, которая опосредуется переходом клеток опухоли в терминальное состояние эпителиально-мезенхимального перехода (ЭМП), и подавление пролиферативной активности под действием IL-3, IL-5, и GM-CSF [16]. Экспрессия PD-L1 на лимфоцитах защищает последние от гибели, в том числе и от снижения способности синтезировать цитокины. Показано, что применение ИИКТ не приводит к восстановлению дисбаланса Th1/Th2 и Th17/Treg лимфоцитов, которое могло иметься перед началом терапии, а также не приводит к снижению уровня таких цитокинов, как IL-4, TGF-β и IL-17 [17]. Th2-подобная «противовоспалительная» фаза воспаления является «пререгенераторным» процессом, для которого характерны не столько эффекторные иммунные реакции, сколько стимуляция фибробластов/миофибробластов к продукции компонентов межклеточного матрикса и эпителия к регенерации. Эпителий, включая клетки карцином, под влиянием цитокинов иммуновоспалительных реакций Th2-типа, прежде всего TGFβ, претерпевает ЭМП, при этом пролиферативная способность ингибируется. В нашем исследовании уровень PD-L1-положительных Th2-лимфоцитов был значимо ниже при люминальном В HER2+ подтипе, по сравнению с более благоприятными люминальным А и люминальным В HER2- подтипами. Интересно, что при пересчете не на абсолютное количество лимфоцитов, а на количество лимфоцитов изучаемой популяции мы наблюдали другие закономерности – сниженную долю PD-L1-положительных
Th2-лимфоцитов и Т-регуляторных лимфоцитов у больных люминальным В HER2-подтипом по сравнению с люминальным А. Каждая из исследуемых нами популяций лимфоцитов может быть в опухоли в двух состояниях – с экспрессией PD-L1 и без. Что касается функционального состояния, то на данный момент нет убедительных данных, говорящих о том, сопряжена ли экспрессия PD-L1 с большей функциональной активностью клетки. Вероятнее, активность клеток будет в большей степени зависеть от микроокружения. Конечно, представляет интерес более тщательная оценка различной функциональной активности каждой популяции и не только в модельных системах, но и на клиническом материале.
Мы наблюдали сопоставимое количество различных субпопуляций PD-L1-положительных лимфоцитов в опухолях с различным PD-L1-статусом люминального А и люминального В HER2+ подтипов РМЖ (рис. 3). В свою очередь, только в люминальных В HER2- опухолях разного PD-L1-статуса количество PD-L1-положительных лимфоцитов значимо различалось. В PD-L1-положительных опухолях было большее количество цитотоксических лимфоцитов, Th2-лимфоцитов и Т-регуляторных лимфоцитов. Интересно, но существуют данные о том, что высокий уровень Th2-лимфоцитов связан с высокой мутационной нагрузкой, а также с
Список литературы Субпопуляционный состав PD-l1-позитивных лимфоцитов в первичной опухоли у больных люминальными формами рака молочной железы
- Mezheyeuski A., Backman M., Mattsson J., Martín-Bernabé A., Larsson C., Hrynchyk I., Hammarström K., Ström S., Ekström J., Mauchanski S., Khelashvili S., Lindberg A., Agnarsdóttir M., Edqvist P.H., Huvila J., Segersten U., Malmström P.U., Botling J., Nodin B., Hedner C., Borg D., Brändstedt J., Sartor H., Leandersson K., Glimelius B., Portyanko A., Ponten F., Jirström K., Micke P., Sjöblom T. An immune score reflecting pro- and anti-tumoural balance of tumour microenvironment has major prognostic impact and predicts immunotherapy response in solid cancers. EBioMedicine. 2023; 88. https://doi.org/10.1016/j.ebiom.2023.104452.
- Lüönd F., Tiede S., Christofori G. Breast cancer as an example of tumour heterogeneity and tumour cell plasticity during malignant progression. Br J Cancer. 2021; 125(2): 164-75. https://doi.org/10.1038/s41416-021-01328-7.
- Archetti M., Pienta K.J. Cooperation among cancer cells: applying game theory to cancer. Nat Rev Cancer. 2019; 19(2): 110-7. https://doi.org/10.1038/s41568-018-0083-7.
- Gao Z.H., Li C.X., Liu M., Jiang J.Y. Predictive and prognostic role of tumour-infiltrating lymphocytes in breast cancer patients with different molecular subtypes: a meta-analysis. BMC Cancer. 2020; 20(1): 1150. https://doi.org/10.1186/s12885-020-07654-y.
- Debien V., De Caluwé A., Wang X., Piccart-Gebhart M., Tuohy V.K., Romano E., Buisseret L. Immunotherapy in breast cancer: an overview of current strategies and perspectives. NPJ Breast Cancer. 2023; 9(1): 7. https://doi.org/10.1038/s41523-023-00508-3.
- Badve S.S., Penault-Llorca F., Reis-Filho J.S., Deurloo R., Siziopikou K.P., D’Arrigo C., Viale G. Determining PD-L1 Status in Patients With Triple-Negative Breast Cancer: Lessons Learned From IMpassion130. J Natl Cancer Inst. 2022; 114(5): 664-75. https://doi.org/10.1093/jnci/djab121.
- Tashireva L.A., Kalinchuk A.Yu., Gerashchenko T.S., Savel'eva O.E., Perel'muter V.M. Subpopulyatsii V-limfotsitov u bol'nykh rakom molochnoi zhelezy v zavisimosti ot statusa PD-L1. Byulleten' sibirskoi meditsiny. 2023; 22(1): 88-95. https://doi.org/10.20538/1682-0363-2023-1-88-95.
- Esteva F.J., Hubbard-Lucey V.M., Tang J., Pusztai L. Immunotherapy and targeted therapy combinations in metastatic breast cancer. Lancet Oncol. 2019; 20(3): 175-86. https://doi.org/10.1016/S1470-2045(19)30026-9.
- Tolaney S.M., Barroso-Sousa R., Keenan T., Li T., Trippa L., Vaz-Luis I., Wulf G., Spring L., Sinclair N.F., Andrews C., Pittenger J., Richardson E.T., Dillon D., Lin N.U., Overmoyer B., Partridge A.H., Van Allen E., Mittendorf E.A., Winer E.P., Krop I.E. Effect of Eribulin With or Without Pembrolizumab on Progression-Free Survival for Patients With Hormone Receptor-Positive, ERBB2-Negative Metastatic Breast Cancer: A Randomized Clinical Trial. JAMA Oncol. 2020; 6(10): 1598-605. https://doi.org/10.1001/jamaoncol.2020.3524.
- Nanda R., Liu M.C., Yau C., Shatsky R., Pusztai L., Wallace A., Chien A.J., Forero-Torres A., Ellis E., Han H., Clark A., Albain K., Boughey J.C., Jaskowiak N.T., Elias A., Isaacs C., Kemmer K., Helsten T., Majure M., Stringer-Reasor E., Parker C., Lee M.C., Haddad T., Cohen R.N., Asare S., Wilson A., Hirst G.L., Singhrao R., Steeg K., Asare A., Matthews J.B., Berry S., Sanil A., Schwab R., Symmans W.F., van ‘t Veer L., Yee D., DeMichele A., Hylton N.M., Melisko M., Perlmutter J., Rugo H.S., Berry D.A., Esserman L.J. Effect of Pembrolizumab Plus Neoadjuvant Chemotherapy on Pathologic Complete Response in Women With EarlyStage Breast Cancer: An Analysis of the Ongoing Phase 2 Adaptively Randomized I-SPY2 Trial. JAMA Oncol. 2020; 6(5): 676-84. https://doi.org/10.1001/jamaoncol.2019.6650.
- Bareche Y., Buisseret L., Gruosso T., Girard E., Venet D., Dupont F., Desmedt C., Larsimont D., Park M., Rothé F., Stagg J., Sotiriou C. Unraveling Triple-Negative Breast Cancer Tumor Microenvironment Heterogeneity: Towards an Optimized Treatment Approach. J Natl Cancer Inst. 2020; 112(7): 708-19. https://doi.org/10.1093/jnci/djz208.
- Núñez Abad M., Calabuig-Fariñas S., Lobo de Mena M., TorresMartínez S., García González C., García García J.Á., Iranzo GonzálezCruz V., Camps Herrero C. Programmed Death-Ligand 1 (PD-L1) as Immunotherapy Biomarker in Breast Cancer. Cancers (Basel). 2022; 14(2): 307. https://doi.org/10.3390/cancers14020307.
- Chen S., Crabill G.A., Pritchard T.S., McMiller T.L., Wei P., Pardoll D.M., Pan F., Topalian S.L. Mechanisms regulating PD-L1 expression on tumor and immune cells. J Immunother Cancer. 2019; 7(1): 305. https://doi.org/10.1186/s40425-019-0770-2.
- Le L., Tokumaru Y., Oshi M., Asaoka M., Yan L., Endo I., Ishikawa T., Futamura M., Yoshida K., Takabe K. Th2 cell infiltrations predict neoadjuvant chemotherapy response of estrogen receptor-positive breast cancer. Gland Surg. 2021; 10(1): 154-65. https://doi.org/10.21037/gs-20-571.
- Perelmuter V.M., Tashireva L.A., Manskikh V.N., Savelieva O.E., Kaygorodova E.V., Zavyalova M.V. Heterogeneity and Plasticity of Immune Inflammatory Responses in the Tumor Microenvironment: Their Role in the Antitumor Effect and Tumor Aggressiveness. Biol Bull Rev. 2018; 8: 431-48. https://doi.org/10.1134/S2079086418050055.
- Boieri M., Malishkevich A., Guennoun R., Marchese E., Kroon S., Trerice K.E., Awad M., Park J.H., Iyer S., Kreuzer J., Haas W., Rivera M.N., Demehri S. CD4+ T helper 2 cells suppress breast cancer by inducing terminal differentiation. J Exp Med. 2022; 219(7). https://doi.org/10.1084/jem.20201963.
- Wu D., Liu Y., Pang N., Sun M., Wang X., Haridia Y., Zhao F., Qin Y., Fan W., Guo X., Ding J. PD-1/PD-L1 pathway activation restores the imbalance of Th1/Th2 and treg/Th17 cells subtypes in immune thrombocytopenic purpura patients. Medicine (Baltimore). 2019; 98(43). https://doi.org/10.1097/MD.0000000000017608.


