Сверхмедленные колебания потенциалов нейромодуляторных центров головного мозга и корковых отделов сенсорных систем
Автор: Пугачев К.С., Кребс А.А., Филиппов И.В., Зюзин Е.В.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 1 (17), 2014 года.
Бесплатный доступ
Выявлена и проанализирована динамика сверхмедленных колебаний потенциалов нейромодуляторных центров головного мозга крыс (голубого пятна, дорсального ядра шва и базального крупноклеточного ядра). В этих структурах установлено присутствие сверхмедленной активности секундного и обнаружены средние значения (0,45≤r≤0,65) коэффициентов линейной корреляции многосекундных волн, что указывает на их участие в модулирующих влияниях указанных структур на процессы переработки сенсорной информации в первичной зрительной слуховой и вкусовой коре головного мозга.
Сверхмедленные колебания потенциалов, голубое пятно, дорсальное ядро шва, базальное крупноклеточное ядро, первичная зритель- ная, слуховая и вкусовая кора
Короткий адрес: https://sciup.org/14992662
IDR: 14992662 | УДК: 612.826.5:612.826.8:612.825.1
Текст научной статьи Сверхмедленные колебания потенциалов нейромодуляторных центров головного мозга и корковых отделов сенсорных систем
Известно, что различные биоэлектрические процессы головного мозга являются коррелятами его функциональной активности [1].Тем не менее в клинических и фундаментальных дисциплинах не отводится должного внимания сверхмедленным биоэлектрическим процессам, протекающим в ЦНС. В связи с этим все большую актуальность приобретают исследования, направленные на понимание роли сверхмедленных колебаний потенциалов (СМКП) в функционировании головного мозга [2 – 4]. В соответствии с общепринятыми взглядами, СМКП представляют собой совокупность сложноорганизованной квазипериодической динамики биопотенциалов головного мозга человека и животных с частотами менее 0,5 Гц [5]. Исходя из существующей классификации [1], СМКП подразделяются на следующие частотные диапазоны: секундные (период от 2 до 10 с), многосекундные (от 10 до 60 с) и минутные (более 1 мин) волны. Ранее было доказано присутствие СМКП в различных сенсорных представительствах головного мозга: в первичной зрительной коре (ПЗК), первичной слуховой коре (ПСК), во вкусовой коре (ВК), а также в латеральном коленчатом теле, медиальном коленчатом те- ле и в вентральном задне-срединном ядре таламуса [2–4]. Также установлено участие СМКП в процессах переработки сенсорной информации в этих структурах и во взаимодействиях перечисленных отделов ЦНС при переработке сенсорной информации различных модальностей. На основании полученных в наших исследованиях данных была выдвинута гипотеза о возможной обусловленности динамики СМКП в первичных корковых представительствах сенсорных систем с динамикой аналогичных процессов на уровне различных нейромо-дуляторных центров. Это представляется возможным в контексте существующих сведений о присутствии норадренергических (от голубого пятна), серотонинергических (от дорсального ядра шва) и ацетилхолинергических (от базального крупноклеточного ядра) волокон в различных отделах коры больших полушарий, в том числе в сенсорных представительствах неокортекса [6, 7]. Однако до настоящего времени данные о наличии СМКП и об их сравнительном анализе в различных нейромо-дуляторных центрах отсутствовали, в частности голубом пятне (ГП), дорсальном ядре шва (ДЯШ) и базальном крупноклеточном ядре (БКЯ), а также в высших корковых представительствах зрительной, слуховой и вкусовой сенсорных систем. Все эти вопросы представляют существенный интерес, поскольку позволяют более детально понять вклад (норадреналина, серотонина и ацетилхолина) в модуляцию как функциональных состояний различных отделов неокортекса, так и переработку афферентной информации на уровне высших сенсорных представительств ЦНС.
Учитывая актуальность проблемы, цель настоящей работы: выявить в условиях отсутствия действия сенсорных стимулов сверхмедленные колебания потенциалов в голубом пятне, дорсальном ядре шва и базальном крупноклеточном ядре и сопоставить у анестезированных крыс в условиях хронического эксперимента динамику СМКП в указанных нейромодуляторных центрах с аналогичными процессами на уровне первичной зрительной, слуховой и вкусовой коры.
Основные задачи исследования:
-
1. Выявить и проанализировать динамику сверхмедленных колебаний потенциалов в голубом пятне, дорсальном ядре шва и базальном крупноклеточном ядре головного мозга крыс при отсутствии действия зрительных, слуховых и вкусовых раздражителей.
-
2. Сопоставить временные и амплитудночастотные характеристики сверхмедленной активности голубого пятна, дорсального ядра шва и базального крупноклеточного ядра с аналогичными процессами в области первичной зрительной, слуховой и вкусовой коры в тех же условиях.
Материалы и методы
Работа проведена на 30 самцах взрослых нелинейных крыс альбиносов с массой тела 230– 280 г (n=150 повторных экспериментальных наблюдений). Все опыты выполнены согласно основным положениям Европейской конвенции об обращении с животными при проведении биомедицинских исследований (2010/63/EU). Первоначально, руководствуясь атласом головного мозга крыс [8], каждому экспериментальному животному под нембуталовым наркозом производилась стереотаксическая имплантация золотых долгосрочных интрацеребральных электродов (золото 98 %, площадь активной поверхности 0,2 мм2) в ГП, ДЯШ, БКЯ, а также в ПЗК, ПСК и ВК. Использование золотых электродов объясняется современными представлениями о том, что металлические электроды оптимальны для изучения очень медленных форм биоэлектрической активности ЦНС в условиях хронического эксперимента [9]. До начала проведения стереотаксической операции каждая электродная пара была предварительно протестирована в физиологическом растворе, а для имплантации использовались лишь те электродные пары, которые имели стабильный межэлектродный потенциал. После операции крысы помещались на 14 суток в стандартные условия вивария с целью завершения репаративных процессов в исследуемых структурах ЦНС.
Затем осуществляли многократную монопо-лярную синхронную регистрацию СМКП в голубом пятне, дорсальном ядре шва и базальном крупноклеточном ядре, а также в ПЗК, ПСК и ВК. Для этого животные помещались в звуко-свето-непроницаемый индивидуальный контейнер, который располагался в экранированной камере. Эксперименты проводились в темноте (0 люкс) и тишине (0 дБ). Крысы во время исследований находились под легким уретановым наркозом (0,2–0,3 г/кг, интраперитонеально). Использование уретана объясняется тем, что, по данным литературы, он практически не искажает нативную динамику СМКП головного мозга [10]. Для усиления, записи и анализа СМКП применялся компьютерный электрофизиологический комплекс с высокоимпен-дансным многоканальным усилителем биопотенциалов (модель УУ-93, ЭПМ НИИЭМ РАМН), аналогоцифровым преобразователем (модель Е-154, Л-Кард) и персональным компьютером с набором соответствующего программного обеспечения.
Изучение динамики СМКП предусматривало амплитудно-временной анализ различных диапазонов СМКП, основанный на применении алгоритма быстрого прямого преобразования Фурье, а также корреляционный анализ. Статистическую значимость отличий оценивали с использованием однофакторного дисперсионного анализа. Отличия с p<0,05 рассматривались как статистически значимые. После завершения экспериментальных исследований осуществлялся забой крыс (уретан, 2-2,5 г/кг, интраперитонеально) и производилась морфологическая верификация расположения активной части электродов в исследуемых структурах головного мозга.
Результаты и обсуждение
Анализ и обобщение полученных в ходе настоящего исследования данных позволили установить, что для основных структур норадренергической (ГП), серотонинергической (ДЯШ) и холинергической (БКЯ) системы характерно наличие фоновых спонтанных сверхмедленных колебаний потенциалов различных частотных диапазонов. Это были регулярные синусоидальные секундные волны с преобладанием частот в диапазоне от 0,1 до 0,32 Гц и амплитудой до 0,3 мВ в голубом пятне (рис. 1а; 2а). В дорсальном ядре шва доминировали секундные СМКП с частотами от 0,1 до 0,33 Гц и амплитудой до 0,15 мВ (рис. 3а, 4а). Схожие по частотно-амплитудным характеристикам колебания потенциалов секундного диапазона зарегистрированы и в базальном крупноклеточном ядре – преобладающие частоты находились в пределах от 0,1 до 0,2 Гц и с амплитудой до 0,25 мВ (рис. 5а, 6а).
Помимо секундных СМКП были обнаружены регулярные синусоидальные многосекундные волны во всех изученных структурах в диапазонах частот 0,0167–0,04 Гц и амплитудой до 0,27 мВ в голубом пятне (рис. 1б, 2б), 0,0167–0,035 Гц и амплитудой до 0,15 мВ в дорсальном ядре шва (рис. 3б, 4б), 0,0167–0,047 Гц и амплитудой до 0,2 мВ в базальном крупноклеточном ядре (рис. 5б, 6б).
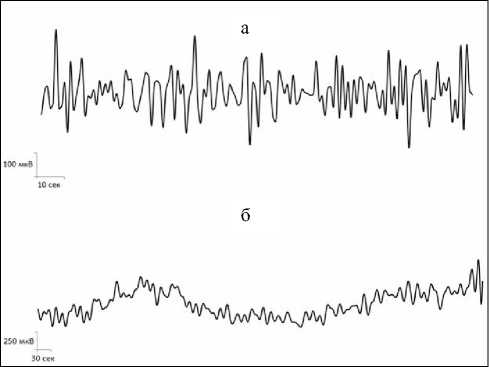
Рис. 1. Примеры нативных записей сверхмедленных колебаний потенциалов различных диапазонов в голубом пятне головного мозга крысы: (а) волны секундного диапазона, (б) волны многосекундного и минутного диапазонов.
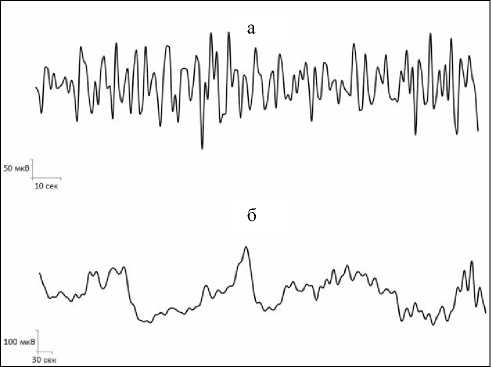
Рис. 3. Примеры нативных записей сверхмедленных колебаний потенциалов различных диапазонов в дорсальном ядре шва головного мозга крысы: (а) волны секундного диапазона, (б) волны многосекундного и минутного диапазонов.
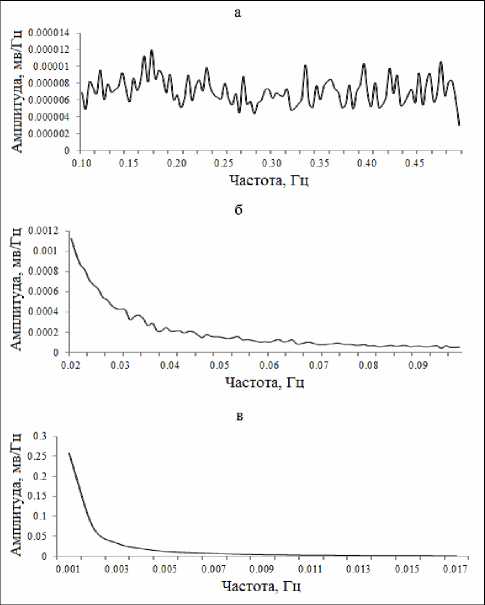
Рис. 2. Суммарные арифметически усредненные спектрограммы (по данным n=50 экспериментов) СМКП различных диапазонов в голубом пятне головного мозга крыс: (а) секундные, (б) многосекундные и (в) минутные волны.
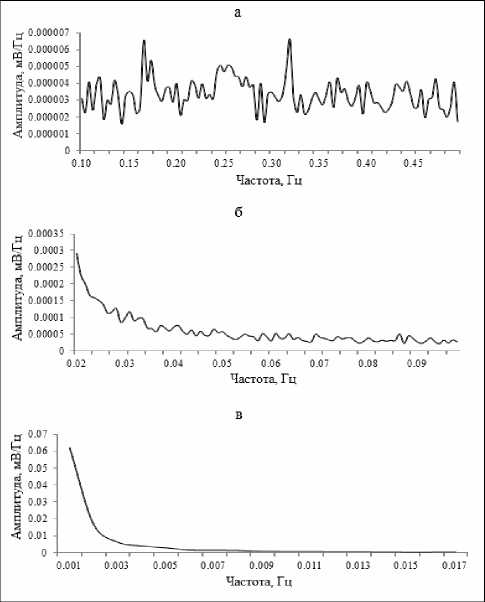
Рис. 4. Суммарные арифметически усредненные спектрограммы (по данным n=50 экспериментов) СМКП различных диапазонов в дорсальном ядре шва головного мозга крыс: (а) секундные, (б) многосекундные и (в) минутные волны.
В голубом пятне, дорсальном ядре шва и базальном крупноклеточном ядре также обнаружены спонтанные одиночные минутные волны синусоидальной формы с частотой менее 0,006 Гц (рис. 1б, 2в; 3б, 4в; 5б, 6в). Подобные результаты позволяют сделать заключение о том, что для каждого из изученных нейромодуляторных центров характерно явление спонтанной фоновой сверхмедленной ритмической биоэлектрической активности.
Кроме того, нами зарегистрированы и проанализированы фоновые сверхмедленные колебания потенциалов в первичных корковых представительствах сенсорных систем головного мозга крыс – в первичной зрительной, первичной слуховой и вкусовой коре. Данные о динамике СМКП первичной зрительной коры, первичной слуховой коры и вкусовой коры головного мозга крыс описаны и ранее [2–4]. Несмотря на это, они проанали-
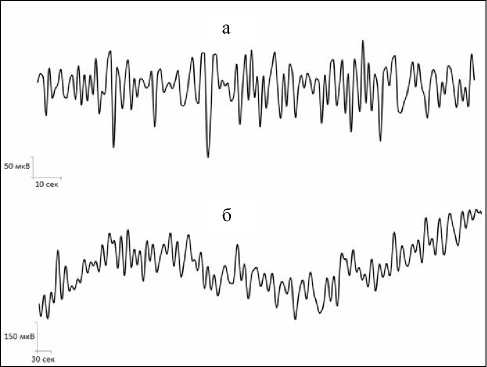
Рис. 5. Примеры нативных записей сверхмедленных колебаний потенциалов различных диапазонов в базальном крупноклеточном ядре головного мозга крысы: (а) волны секундного диапазона, (б) волны многосекундного и минутного диапазонов.
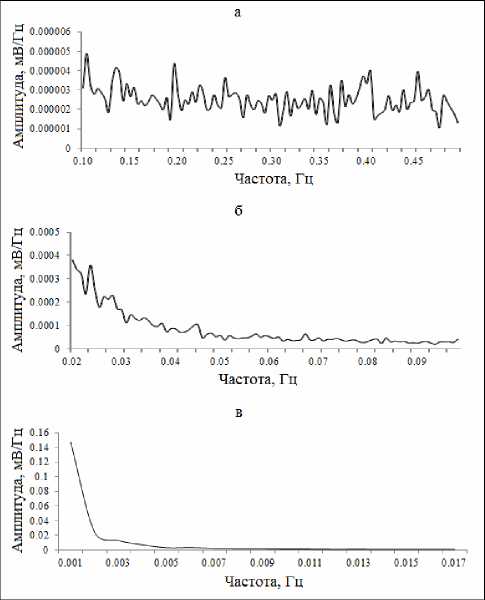
Рис. 6. Суммарные арифметически усредненные спектрограммы (по данным n=50 экспериментов) СМКП различных диапазонов в базальном крупноклеточном ядре головного мозга крыс: (а) секундные, (б) многосекундные и (в) минутные волны.
зированы нами в контексте взаимосвязи динамики СМКП изученных нейромодуляторных центров и первичных корковых сенсорных представительств. Это связано с необходимостью сопоставить фоновые взаимосвязи СМКП в интрацеребральных функциональных системах нейромодуляторный центр – первичные корковые сенсорные представительства (т.е. ГП-ПЗК, ГП-ПСК, ГП-ВК; ДЯШ-ПЗК,
ДЯШ-ПСК, ДЯШ-ВК; БКЯ-ПЗК, БКЯ-ПСК и БКЯ-ВК) в условиях отсутствия действия зрительных, слуховых и вкусовых раздражителей. С этой целью проведена линейная корреляция фоновых СМКП различных диапазонов в парах ГП-ПЗК, ГП-ПСК, ГП-ВК; ДЯШ-ПЗК, ДЯШ-ПСК, ДЯШ-ВК; БКЯ-ПЗК, БКЯ-ПСК и БКЯ-ВК.
В результате анализа указанных данных установлены слабые положительные корреляционные связи в диапазоне секундных волн во всех изученных парах (таблица). Коэффициенты линейной корреляции, отражающие взаимосвязь СМКП в многосекундном и минутных диапазонах (т.е. в едином объединенном диапазоне частот 0,0167–0,1 Гц) можно охарактеризовать как положительные средние.
Коэффициенты линейной корреляции фоновых нативных записей (по данным n=150 экспериментов) различных диапазонов СМКП
|
Пары сравнения |
Коэффициент линейной корреляции (r) секундных СМКП |
Коэффициент линейной корреляции (r) многосекундных и минутных СМКП |
|
ГП-ПЗК |
0,24 |
0,64 |
|
ГП-ПСК |
0,22 |
0,63 |
|
ГП-ВК |
0,14 |
0,61 |
|
ДЯШ-ПЗК |
0,28 |
0,63 |
|
ДЯШ-ПСК |
0,24 |
0,65 |
|
ДЯШ-ВК |
0,14 |
0,60 |
|
БКЯ-ПЗК |
0,25 |
0,64 |
|
БКЯ-ПСК |
0,20 |
0,57 |
|
БКЯ-ВК |
0,17 |
0,45 |
Примечание: пары сравнения – голубое пятно – первичная зрительная, слуховая и вкусовая кора; дорсальное ядро шва – первичная зрительная, слуховая и вкусовая кора; базальное крупноклеточное ядро – первичная зрительная, слуховая и вкусовая кора.
При этом следует обратить внимание на положительные средние значения коэффициентов линейной корреляции, которые указывают на фоновую спонтанную взаимосвязь СМКП многосекундного и минутного диапазонов во всех проанализированных парах сравнения (ГП-ПЗК, ПСК, ВК; ДЯШ-ПЗК, ПСК, ВК; БКЯ-ПЗК, ПСК, ВК). Эти данные сопоставимы с результатами исследований связей нейромодуля-торных центров с различными отделами неокортек-са (норадренергические, серотонинергические и холинергические проекции), в том числе с высшими корковыми представительствами зрительной, слуховой и вкусовой сенсорных систем [11 – 13]. Они указывают на тесные нейроанатомические моноси-наптические связи ГП, ДЯШ и БКЯ с ПЗК, ПСК и ВК, что предположительно является структурной основой подобных функциональных взаимодействий в системах ГП-ПЗК, ПСК, ВК; ДЯШ-ПЗК, ПСК, ВК; БКЯ-ПЗК, ПСК, ВК.
Трудность анализа полученных данных сопряжена с отсутствием в литературе сведений о динамике СМКП в ГП, ДЯШ и БКЯ. Для интерпретации в парах изученных структур корреляционных связей многосекундных СМКП, а следовательно и характера взаимодействий нейромодуляторных, можно привлечь существующие нейрофизиологические и нейрохимические работы. Например, показано, что активация ГП при действии сенсорных стимулов (как и его электростимуляция) вызывает увеличение выделения норадреналина и его производных метаболитов в коре больших полушарий [14, 15]. Установлено также, что различные ритмы ЭЭГ (низкоамплитудная высокочастотная активность и/или высокоамплитудные медленные волны) в коре, по-видимому, связаны с импульсной активностью ГП, которое оказывает регулирующее влияние на уровень возбудимости корковых нейронов [16].
Изучение особенностей тета-ритма у крыс выявило участие ДЯШ и серотонина в этих процессах, и существенный вклад серотонинергической системы ДЯШ в регуляцию уровня бодрствования. Продемонстрированы непосредственные влияния ДЯШ на процессы поддержания уровня активности популяций нейронов неокортекса [17, 18].
Существуют данные об участии БКЯ в модуляции функциональных состояний коры и уровня ответных реакций «настораживания» при действии краткосрочных сенсорных стимулов [19]. Также предполагается, что БКЯ изменяет эндогенную ос-цилляторную активность нейронов пейсмейкеров неокортекса, что указывает на важнейшую роль холинергических нейронов БКЯ в модуляции биоэлектрической активности коры и ее функциональных состояний [20].
Приведенные работы (косвенно) сопоставимы с полученными нами данными о средней степени обусловленности наиболее медленных диапазонов СМКП, протекающих в ПЗК, ПСК и ВК, c динамикой аналогичных биоэлектрических процессов на уровне рассмотренных нейромодуляторных центров. Однако следует обратить внимание и на то, что в секундном диапазоне СМКП наблюдались слабые значения корреляционных связей в системах ГП-ПЗК, ПСК, ВК; ДЯШ-ПЗК, ПСК, ВК; БКЯ-ПЗК, ПСК, ВК. Эти результаты соответствуют нашим предыдущим результатам о вовлеченности СМКП секундного диапазона в специфические процессы переработки сенсорной информации, тогда как потенциалы многосекундного диапазона отражали глобальные колебания уровня общей возбудимости нейронов неокортекса [2 – 4]. Поскольку в настоящей работе записи СМКП в нейромодуляторных центрах и в высших корковых представительствах изученных сенсорных систем проводились в условиях отсутствия действия соответствующих по своей модальности сенсорных раздражителей, можно обоснованно предположить, что в этих условиях переработка сенсорной информации в ПЗК, ПСК и ВК отсутствовала. Это и объясняет слабые корреляционные связи динамики секундного диапазона в системах ГП-ПЗК, ПСК, ВК; ДЯШ-ПЗК, ПСК, ВК; БКЯ-ПЗК, ПСК, ВК. В то же самое время, по-видимому, даже в этих условиях со стороны ГП, ДЯШ и БКЯ существуют постоянные фоновые спонтанные сверхмедленные регуляторные влияния на общий уровень возбудимости нейронов ПЗК,
ПСК и ВК, что и объясняет выраженные корреляционные связи динамики многосекундных СМКП между этими структурами в состоянии покоя.
Выводы
-
1. В голубом пятне, дорсальном ядре шва и базальном крупноклеточном ядре продемонстрировано наличие фоновых эндогенных спонтанных сложноорганизованных сверхмедленных колебаний потенциалов секундного (0,1–0,5 Гц), многосекундного (0,0167–0,1 Гц) и минутного (менее 0,0167 Гц) диапазонов.
-
2. Голубое пятно, дорсальное ядро шва и базальное крупноклеточное ядро оказывают постоянные регуляторные влияния на глобальный уровень возбудимости нейронов первичной зрительной, слуховой и вкусовой коры, что преимущественно отражается в средних значениях коэффициентов линейной корреляции многосекундных (0,0167–0,1 Гц) волн сверхмедленных колебаний потенциалов между этими структурами.
Данная поисковая научно-исследовательская работа выполнена в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России на 2009–2013 гг.», а также при частичной поддержке гранта РФФИ (проект 1404-00028).
Список литературы Сверхмедленные колебания потенциалов нейромодуляторных центров головного мозга и корковых отделов сенсорных систем
- Илюхина В.А. Мозг человека в механизмах информационно-управляющих взаимодействий организма и среды обитания. СПб.: Институт мозга человека РАН, 2004. 321 c.
- Филиппов И.В., Кребс А.А., Пугачев К.С. Сверхмедленная биоэлектрическая активность структур слуховой системы головного мозга//Сенсорные системы. 2006. Т. 20. №3. С. 238-244.
- Филиппов И.В. Сверхмедленные колебания потенциалов латерального коленчатого тела и первичной зрительной коры как корреляты процессов переработки зрительной информации//Сенсорные системы. 2007. Т. 21. № 3. С. 165-173.
- Филиппов И.В., Кребс А.А., Пугачев К.С. Сверхмедленные колебания потенциалов центральных представительств вкусовой системы головного мозга крыс при действии различных вкусовых стимулов//Сенсорные системы. 2008. Т. 22. № 2. С. 162-174.
- Аладжалова Н.А. Медленные электрические процессы в головном мозге. М., 1962. 240 с.
- Nakamura K., Yamamoto M., Takahashi K., et al. State-dependency of neuronal slow dynamics during sleep observed in cat lateral geniculate nucleus//Sleep Res. Online. 2000. Vol. 3. P. 147-157.
- Novak P., Lepicovska V. Slow modulation of EEG//Neuroreport. 1992. Vol. 3. P. 189-192.
- Swanson L.W. Brain Maps: Structure of the Rat Brain//Second revised edition. Elsevier.: Amsterdam, 1998. 267 p.
- Ikeda A., Nagamine T., Yarita M. et al. Reappraisal of the effect of electrode property on recording slow potentials//Electroencephalogr. Clin. Neurophysiol. 1998. Vol. 107. P. 59-63.
- Ebenezer I.S. The generation of cortical slow potentials in the rat anaesthetized with urethane and their modification by nicotine//Neuropharmacol. 1986. Vol. 25. № 6. P. 639-643.
- Waterhouse B.D., Border B., Wahl L. et al. Topographic organization of rat locus coeruleus and dorsal raphe nuclei: distribution of cells projecting to visual system structures//J. Comp. Neurol. 1993. Vol. 336. № 3. P. 345-361.
- Blasiak T., Lewandowski M.H. Dorsal raphe nucleus modulates neuronal activity in rat intergeniculate leaflet//Behav. Brain Res. 2003. Vol. 138. № 2. P. 179-185.
- Robbins T.W., Everitt B.J., Ryan C.N., et al. Comparative effects of quisqualic and ibotenic acidinduced lesions of the substantia innominata and globus pallidus on the acquisition of a conditional visual discrimination: differential effects on cholinergic mechanisms//Neuroscience. 1989. Vol. 28. № 2. P. 337-352.
- Salgado H., Garcia-Oscos F., Patel A., et al. Layer-specific noradrenergic modulation of inhibition in cortical layer II/III//Cereb. Cortex. 2011. Vol. 21. № 1. P. 212-221.
- Anlezark G.M., Walter D.S., Arbuthnott G.W. et al. The relationship between noradrenaline turnover in cerebral cortex and electrical self-stimulation through electrodes in the region of locus coeruleus//J. Neurochemistry. 1975. Vol. 24. № 4. P. 677-681.
- Eschenko O., Magri C., Panzeri S. et al. Noradrenergic Neurons of the Locus Coeruleus Are Phase Locked to Cortical Up-Down States during Sleep//Cereb. Cortex. 2012. Vol. 22. № 2. P. 426-435.
- Follett K.A., Gebhart G.F. Modulation of cortical evoked potentials by stimulation of nucleus raphe magnus in rats//J. Neurophysiol. 1992. Vol. 67. № 4. P. 820-828.
- Juckel G., Hegerl U., Giegling I. et al. Association of 5-HT1B receptor polymorphisms with the loudness dependence of auditoryevoked potentials in a community-based sample of healthy volunteers//Am. J. Med. Gene.t B. Neuropsychiatr. Genet. 2008. Vol. 147B. № 4. P. 454-458.
- Wenk G.L. The nucleus basalis magnocellularis cholinergic system: one hundred years of progress//Neurobiol. Learn. Mem. 1997. Vol. 67. № 2. P. 85-95.
- Metherate R., Cox C.L., Ashe J.H. Cellular bases of neocortical activation: modulation of neural oscillations by the nucleus basalisand endogenous acetylcholine//J. Neurosci. 1992. Vol. 12. № 12. P. 4701-411.


