Светокультура растений в современных сооружениях искусственного климата (обзор)
Автор: Синявина Н.Г., Панова Г.Г., Кулешова Т.Э., Чесноков Ю.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Крайний Север, Арктика, Антарктика: новые агротехнологии
Статья в выпуске: 5 т.59, 2024 года.
Бесплатный доступ
Светокультура растений как процесс выращивания под искусственным светом возникла в XIX веке (F.H. Besthorn, 2013; J. Kleszcz с соавт., 2020). В России научные исследования в области светокультуры начали активно развиваться в первой половине ХХ века (В.М. Леман, 1976; А.М. Глобус, 2007; Е.И. Ермаков, 2009; I.G. Tarakanov с соавт., 2022). В настоящее время изучение различных аспектов выращивания растений в контролируемых условиях среды проводится в ряде ведущих научных учреждений Российской Федерации и Республики Беларусь, а также коллективами исследователей из стран Европы, Азии, США, Канады и Австралии. Значительный интерес к этой области растениеводства подтверждается резко увеличившимся в последние годы количеством публикаций по указанной тематике (A. Dsouza с соавт., 2023). Светокультура реализована в современных сооружениях искусственного климата (controlled environment agriculturee, СЕА), оборудованных, как правило, многоярусными стеллажными системами для выращивания растений и осветительным оборудованием и служащих альтернативой традиционному аграрному производству (T. Kozai с соавт., 2020). Такие сооружения (растительные фабрики, вертикальные фермы, сити-фермы, фитотехкомплексы) применяются для производства растительной продукции в густонаселенных городских районах и регионах с экстремальными погодными условиями, то есть там, где они имеют ряд преимуществ по сравнению с традиционным сельским хозяйством (N. Didenko с соавт., 2021; D.L. Friedrich, 2021; G.G. Panova с соавт., 2023). К основным достоинствам сооружений искусственного климата относятся возможность круглогодичного производства вне зависимости от сезона и погодных условий, высокое качество продукции, ее близость к потребителю. Многие исследователи отмечают также более высокий выход товарной продукции с 1 м2 за счет применения многоуровневых систем выращивания, а также экономию ресурсов благодаря использованию современных гидропонных и аэропонных технологий выращивания и замкнутых циклов (C.E. Wong с соавт., 2020; N. Engler с соавт., 2021; K. Al-Kodmany, 2024). Выбор растений для производства в СЕА определяется прежде всего рентабельностью, поэтому в настоящее время выращивают в основном быстрорастущие культуры с компактным габитусом - листовые овощи, пряно-ароматические растения, микрозелень. При этом сообщается о необходимости расширения ассортимента продукции и селекции новых сортов, предназначенных для контролируемых условий выращивания (K.M. Folta, 2019; M. SharathKumar, 2020; С.Е. Wong с соавт., 2020; A. Dsouza с соавт., 2023). Основным объектом исследований в СЕА в настоящее время служит световая среда, поскольку от ее состава зависят фотосинтез, рост и морфогенез растений, их биохимический состав, накопление ценных метаболитов и в конечном итоге оптимизация технологий выращивания, эффективность использования ресурсов и рентабельность производства (A. Dsouza с соавт., 2023). В настоящей статье рассмотрена роль спектрального состава света, интенсивности и равномерности излучения, фотопериода в формировании растений, оценено влияние каждой из этих составляющих световой среды на урожай и качественный состав растительной продукции. Показано, что при помощи варьирования спектрального состава света можно управлять архитектоникой растений, регулировать накопление первичных и вторичных метаболитов (G.C. Modarelli с соавт., 2022; K. Zhang с соавт., 2023; K. Rosniza с соавт., 2023). Отражены генетически обусловленные различия в требованиях ряда культур к составу световой среды, в том числе обсуждается возможность существования сортовой специфичности в реакции образцов внутри культуры на формируемые условия выращивания. Также идет речь о применяемых в СЕА технологиях и используемых культурах, кратко отражены последние результаты в области селекции для светокультуры и указаны перспективы дальнейших исследований.
Светокультура, агропроизводство в контролируемых условиях, сеа, световая среда, светодиодные светильники, растения, урожай, качество, селекция
Короткий адрес: https://sciup.org/142243774
IDR: 142243774 | УДК: 631.95:631.544.4 | DOI: 10.15389/agrobiology.2024.5.869rus
Текст обзорной статьи Светокультура растений в современных сооружениях искусственного климата (обзор)
Рост численности населения на фоне глобальных климатических изменений в XXI веке — это основной фактор, определивший необходимость развития и совершенствования современных агротехнологий защищенного грунта. Одним из перспективных направлений в сфере устойчивого производства растительной продукции в настоящее время служит агропроизводство в контролируемых условиях среды с применением светокультуры (controlled environment agriculture, CEA), в которых растения полностью изолированы от внешнего влияния (1-3).
В XXI веке светокультура все более активно применяется в аграрном производстве, о чем свидетельствует объем инвестиций, увеличивающийся с каждым годом. Ожидается, что к 2030 году объем мирового рынка сельского хозяйства с применением светокультуры достигнет 122,3 млрд долларов, а среднегодовой темп роста составит 13,5 % (4). Также значительно повысился исследовательский интерес к этой тематике. Авторы многих научных публикаций подчеркивают важную роль CEA в обеспечении устойчивого будущего сельского хозяйства. Сооружения искусственного климата способны удовлетворить потребность в высококачественной растительной продукции местного производства как в густонаселенных городских районах, так и в зонах рискованного земледелия, включая приполярные регионы, Арктику и Антарктиду (3, 5-7). К основным преимуществам CEA по сравнению с традиционным сельским хозяйством относятся более высокая производительность и качество продукции, ее экологическая безопасность, приближенность производства к конечному потребителю (8-10).
Для производства растительной продукции используются различные типы CEA: от стационарных зданий и помещений большой площади до мобильных контейнеров, а также ростовых камер и гроубоксов (10-13). Ассортимент культур, выращиваемых в CEA, преимущественно включает быстрорастущие листовые овощные культуры, цветы, лекарственные растения и микрозелень (3). В настоящее время еще окончательно не решен ряд вопросов, связанных с рентабельностью и устойчивостью производства в этих условиях (10, 14). Поэтому значительная часть научных исследований и разработок в области светокультуры растений направлена на повышение рентабельности и экономической эффективности CEА. В этом вопросе одна из ведущих ролей отводится поискам способов оптимизации световой среды с учетом генетических и физиологических особенностей различных культур в целях повышения продуктивности и качества растительной продукции, а также селекционно-генетическим исследованиям, задачей которых становятся поиск и создание сортов, максимально адаптированных к искусственному свету и технологиям, применяемым в СЕА.
Цель настоящего обзора — обобщение и анализ данных о современной светокультуре растений и основных направлениях научных исследований в этой области.
Светокультура растений: исторический аспект. Понятие «светокультура растений» (СР) претерпело существенные изменения за последние полвека и дополнялось с учетом современных достижений в сельскохозяйственном производстве и текущих направлений его развития. Так, в 1970-е годы было сформулировано определение светокультуры как дисциплины, изучающей теоретические основы и методы выращивания растений с помощью искусственной радиации (15), а также существовало более расширенное определение СР как способа выращивания растений при искусственном освещении, применяемого для раннего выращивания рассады овощных культур, их зимней культуры (особенно в условиях Крайнего Севера), для выгонки цветов, круглогодичной селекции и семеноводства при оптимальном световом режиме, в научных целях (16). Современное определение характеризует светокультуру как макротехнологический процесс выращивания растений при сочетании естественного и искусственного освещения либо при полностью искусственном освещении; к сооружениям, в которых она применяется, относятся промышленные теплицы, городские фермы и фитотроны (17). Таким образом, существуют два основных направления применения светокультуры — научное и практическое, при этом они тесно взаимосвязаны, поскольку основная часть экспериментальных исследований направлена на решение практических вопросов, относящихся к аграрному производству. В настоящей статье мы подробно остановимся на полной светокультуре, то есть на CEA.
Идея светокультуры растений возникла в 1960-х годах. В то время в качестве источников искусственного света использовали керосиновые лампы, газовые горелки, угольные дуги и впоследствии небольшие лампы накаливания. В этот период началось изучение отдельных физиологических процессов у растений, которые выращивали в небольших экспериментальных установках (15).
В ХХ веке с появлением и усовершенствованием различных типов оборудования для выращивания растений под искусственным светом и накоплением данных об их реакции на формируемую световую среду, температурно-влажностный режим, режим питания, состав субстрата, технологические приемы и способы выращивания светокультура стала применяться в теплицах в качестве дополнения к естественному освещению, а с начала XXI века — в сооружениях искусственного климата, полностью изолированных от окружающей среды.
Сама идея промышленного выращивания культурных растений на ярусных установках с использованием искусственного освещения возникла в начале ХХ века. В 1915 году американский геолог G.E. Bailey впервые предложил термин «вертикальные фермы» для обозначения нового способа производства растительной продукции на многоуровневых стеллажных системах. По его утверждению, такие фермы, где растения выращивают в контролируемой среде с применением гидропонных методов, способны приносить пользу как экономике, так и экологии (18).
В начале 1930-х годов продолжателем этой идеи стал W.F. Gericke, основоположник гидропоники, работавший в университете г. Беркли (Калифорния) (19). В 1960-е годы австрийский инженер O. Ruthner впервые создал несколько многоуровневых тепличных комплексов — башен, где для выращивания растений применялись стеллажные системы и гидропонные технологии (20). В конце ХХ века архитектор K. Yeang частично реализовал идеи G.E. Bailey в архитектурном проекте «Биоклиматический небоскреб» (Menara Mesiniaga), построенном в 1992 году в г. Субанг-Джая (Селангор, Малайзия) (21). С 1990-х годов с развитием сложных гидропонных и аэро-понных систем сельскохозяйственное производство в контролируемых условиях среды превратилось в коммерчески жизнеспособную стратегию крупномасштабного выращивания самых разных культур (22, 23).
В нашей стране научные исследования в области светокультуры растений начали активно развиваться в первой половине ХХ века. В 1932 году А.Ф. Иоффе и Н.И. Вавиловым был основан Физико-агрономический институт, ныне ФГБНУ Агрофизический научно-исследовательский институт (ФГБНУ АФИ), в котором одной из первых была создана лаборатория светокультуры растений. Под руководством профессора В.П. Мальчевского и при деятельном участии академика Н.А. Максимова была сформулирована и реализована программа изучения действия спектрального состава света, интенсивности лучистого потока на онтогенез и продуктивность растительных объектов (зерновые, овощные, древесные, декоративные и другие растения) с целью разработки приемов ускорения селекции сельскохозяйственных культур и круглогодичного получения полноценной растительной продукции (24).
В последующие годы под руководством члена-корреспондента РАСХН Б.С. Мошкова велись работы, посвященные выяснению природы фотопе- риодической реакции растений, значению спектрального состава света для онтогенеза растений, движению листьев при фотопериодических воздействиях, возникновению и сохранению околосуточных эндогенных осцилляций, развитию методов интенсивной светокультуры, оценке эффективности различных источников оптического излучения, последействию света от разных источников на плодообразование и многому другому (24, 25).
Под руководством академика Е.И. Ермакова заложены фундаментальные основы многомерной оптимизации среды обитания растений, включая световую, корнеобитаемую, воздушную; разработаны светотехнические и светофизиологические методы управления продукционным процессом. Были исследованы спектральный состав света, интенсивность светового потока и коэффициенты равномерности его распределения по полезной площади, занятой растениями, необходимые для формирования высоких показателей продуктивности и скорости развития у различных культур (24, 26). Физически смоделированы, изучены и охарактеризованы регулируемые агроэкосистемы первого и второго поколения. Показаны пути создания «идеальных» агроэксистем, характеризующихся высокой степенью управляемости потоками вещества и энергии между окружающей средой и растениями с сопутствующей биотой, в которых становится возможным в максимальной степени раскрыть генетически обусловленный потенциал той или иной сельскохозяйственной культуры и создать оптимизированные высокоэффективные комплексы «микроклимат—сорт (гибрид)—техноло-гия» для получения стабильно высоких урожаев качественной растительной продукции (24, 27).
Наряду с АФИ, исследования влияния световой среды на растения проводились и продолжаются в настоящее время в Институте физиологии растений РАН (28), РГАУ-МСХА им. К.А. Тимирязева (15, 29, 30), Институте биофизики СО РАН (31), Институте цитологии и генетики Сибирского отделения РАН (32), Институте медико-биологических проблем (ИМБП) РАН (33-35), Институте фундаментальных проблем биологии РАН (36), Институте биохимической физики им. Н.М. Эмануэля РАН и Всероссийском НИИ сельскохозяйственной биотехнологии (37), в Дальневосточном федеральном университете (38), Всесоюзном научно-исследовательском светотехническом институте им. С.И. Вавилова (ВНИСИ) (39), Институте агроинженерных и экологических проблем сельскохозяйственного производства (40), Институте экспериментальной ботаники им. В.Ф. Купревича НАН Беларуси (41).
Научно обоснованным формированием световой среды, включающей источники света со спектральным составом, специально подобранным для стимуляции роста, повышения продуктивности и качества выращиваемых культур, а также технико-технологические элементы, которые обеспечивают заданную продолжительность светового периода, равномерность распределения светового потока и регуляцию его интенсивности, в настоящее время занимаются только в нескольких научных учреждениях, среди которых ФГБНУ АФИ, ИМБП РАН, ВНИСИ. При этом в АФИ в последние годы активно развиваются фундаментальные основы многомерной оптимизации параметров среды обитания растений, направленные на создание системы сорт—технология в светокультуре.
Сооружения искусственного климата в XXI веке: актуальность, распространенность, характеристика. В настоящее время сооружения CEA, предназначенные для промышленного выращивания растений, широко распространены по всему миру. Как правило, они располагаются в больших городах, в непосредственной близости к конечному потребителю, а также в регионах, где традиционное сельское хозяй-872
ство имеет низкую эффективность или требует высоких экономических затрат вследствие неблагоприятных природно-климатических условий (приполярные и полярные регионы, зоны с аридным климатом). В США, Австралии, странах Европы они носят название сити-ферм, или вертикальных ферм (10), в Японии и странах Азии — растительных фабрик (14).
Идея сити-фермерства была реализована и в нашей стране: на сегодняшний день в России работают четыре крупные производственные компании с объемом инвестиций до 4 млрд долларов США, специализирующиеся в этой области, и значительное количество более мелких (42). В ФБГНУ АФИ разработаны уникальные отечественные фитотехкомплексы различных типов для круглогодичного получения высококачественной растительной продукции с оригинальным устройством световой и корнеобитаемой среды, позволяющим выращивать основные сельскохозяйственные культуры на тонкослойных и малообъемных аналогах почв с циркулирующим питательным раствором методом панопоники (43, 44).
Одной из главных причин увеличения объема инвестиций в сферу производства растительной продукции в СЕА стали глобальные изменения климата, которые приводят к существенным потерям урожая и ухудшению его качества в условиях открытого грунта. Климатические риски, представляющие серьезную опасность для населения, существенно возросли в большинстве регионов мира, в том числе в нашей стране (45-47). В этой связи сооружения искусственного климата, в которых растения выращиваются в полностью контролируемой и стандартизируемой среде и не зависят от внешних условий, могут выступать в качестве мощного инструмента создания устойчивого аграрного производства для большинства культур, традиционно возделываемых в защищенном грунте, — листовых и плодовых овощей, ягодных и лекарственных культур, цветочной продукции.
Приполярные и в особенности полярные области Земли вследствие суровых природно-климатических условий стали одними из регионов с наиболее высокой степенью востребованности сооружений искусственного климата для производства растительной продукции. Сообщается, что во многих полярных регионах инфраструктура недостаточно развита, а доставка населению свежих, полезных для здоровья продуктов питания часто ограничена и занимает много времени; логистические цепочки сложны и не всегда ненадежны. В результате стоимость продукции очень высока, что в целом снижает доступность здоровой пищи (48, 49).
Использование СЕА в регионах с экстремальными погодными условиями способствует решению проблемы доступности свежих овощей. Полученная продукция имеет высокое качество и питательную ценность, что в целом способствует улучшению здоровья местного населения и повышению продовольственной безопасности (48). Н.И. Диденко с соавт. (50) показали, что строительство вертикальных ферм в условиях Арктики — это экономически обоснованная стратегия обеспечения населения региона качественными овощами (50).
Примером успешной реализации концепции CEA в регионах с экстремальными погодными условиями служат результаты испытаний созданных в ФГБНУ АФИ фитотехкомплексов разного типа с технологией тонкослойной панопоники, которые с 2020 года функционируют на Российской антарктической станции «Восток». В них участники эксперимента получают стабильно высокие урожаи огурца, томата, перца, листовых и листостебельных овощных культур, а также арбуза; свежая и качественная продукция используется в пищу полярниками (5). Важным преимуществом технологии тонкослойной панопоники служит отсутствие необходимости утилизации отработанного субстрата, которая была структурным элементом классических гидропонных и аэропонных технологий и практически неосуществима в полярных областях.
В последние годы светокультура, реализованная в сооружениях искусственного климата, все более активно используется для промышленного возделывания растений. Так, в 2018 году сектор CEA во всем мире оценивался в 26,8 млрд долларов США, при этом анализ рынка прогнозировал темпы роста на 9,19 % с 2020 по 2025 год (11). Согласно последнему отчету исследовательской и консалтинговой компании «Grand View Research, Inc.» (США), к 2030 году объем мирового рынка сельского хозяйства с применением светокультуры достигнет 122,3 млрд долларов США при среднегодовом темпе роста с 2022 по 2030 год 13,5 % (4).
Сооружения искусственного климата для выращивания растений (рис. 1) представляют собой изолированные от окружающей среды жилые и нежилые здания, их части (в том числе подвальные и мансардные помещения) либо мобильные комплексы на основе промышленных модулей.
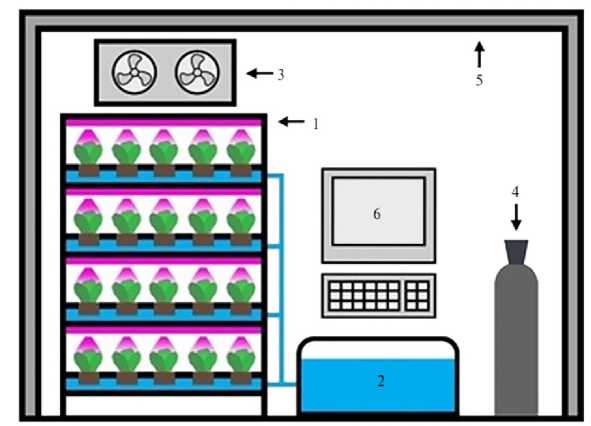
Рис. 1. Схема СЕА (controlled environment agriculture): 1 — многоуровневая система со светодиодными (LED) осветительными элементами, 2 — гидропонная система, 3 — система отопления, вентиляции и кондиционирования воздуха, 4 — система подачи CO 2 , 5 — теплоизолированные и воздухонепроницаемые стены, 6 — блок управления окружающей средой (регулировка света, температуры, влажности, содержания CO 2 , скорости воздушного потока) и питательным раствором (регулировка электропроводности EC, pH, содержания O 2 , температуры корневой зоны) (цит. по 53).
Как правило, они оборудованы многоярусными светоустановками, обеспечивающими существенную экономию пространства, и системами регуляции параметров окружающей среды и контроля (10, 11). Также используются конструкции меньшего размера — ростовые камеры и гроубоксы, которые часто применяются при проведении научных исследований (12, 13). Некоторые типы СЕА могут быть успешно интегрированы с действующими промышленными или жилыми объектами, что способствует существенному сокращению вредных выбросов в окружающую среду и экономии энергетических и водных ресурсов в пределах целого объекта (51, 52).
Основы формирования световой среды в CEA. Световая среда — поле оптического излучения в занятой растениями части пространства, определяемое естественным или искусственным освещением в культивационном помещении и фитоценозом (53). Она служит одним из основных факторов, от которых зависят рост и урожай растений, а также качественный состав растительной продукции. Фотосинтетическая активная радиация (ФАР), обусловливающая работу фотосинтетического аппарата и особенности протекания физиологических процессов, может быть охарактеризована совокупностью следующих факторов: интенсивностью излучения в области ультрафиолетовой (200-400 нм), видимой (400-700 нм), инфракрасной (или тепловой, 700-40000 нм) радиации, спектральным составом света, фотопериодом, пространственной структурой (распределением) потока, динамичностью освещения (изменение облученности, спектральных характеристик, пространственной структуры в течение вегетации или фотопериода) (54). Подбор оптимальных для каждой производимой в СЕА культуры значений интенсивности освещения, продолжительности светового дня, спектральных характеристик применяемых светильников — приоритетная задача исследований, направленных на создание рентабельных и устойчивых технологий производства в сооружениях искусственного климата.
В настоящее время в системах освещения в светокультуре используются дуговые натриевые трубчатые (ДНаТ) и зеркальные (ДНаЗ) лампы высокого давления, люминесцентные лампы и светодиоды (14). Натриевые лампы в большей степени применяются в сфере тепличного овощеводства и цветоводства. Они имеют более высокий показатель теплового излучения по сравнению с остальными светильниками, что ограничивает их использование в ярусных стеллажных системах (табл.). Люминесцентные лампы не сильно нагреваются в процессе работы и могут применяться в многоярусных светоустановках, однако они характеризуются более низкой светоотдачей и ограниченным сроком службы. В последнее десятилетие в СЕА наиболее популярны светодиодные светильники (55, 56).
По сравнению с другими источниками света светодиоды обладают такими преимуществами, как меньшее тепловое излучение, наиболее длительный срок службы, низкое энергопотребление, а также возможность формировать практически любой спектральный состав излучаемого света в соответствии с физиологическими потребностями растений и задачами эксперимента (3).
A. Dsouza с соавт. (3) на основе анализа большого числа научных статей показали, что термин «светодиоды» (LED) был одним из наиболее часто встречающихся в публикациях, посвященных выращиванию растений в CEA, вслед за терминами «растительные фабрики» и «вертикальное фермерство». При этом значительная часть исследований за последние 5 лет была посвящена изучению реакции растений на интенсивность света, его спектральный состав и длину светового дня: более 70 % из порядка 350 проанализированных работ относились к категории фотобиологических (3). Такой интерес обусловлен тем, что условия освещения влияют не только на фотосинтез, но и на морфогенез растений, поглощение ими элементов питания, содержание ценных вторичных метаболитов, экспрессию генов. В конечном счете они определяют эффективность использования ресурсов и рентабельность выращивания культур в условиях CEA.
Применение светодиодов позволяет формировать равномерный поток излучения разной степени интенсивности по всей облучаемой поверхности, а также создавать практически любой спектр в видимой области. Это имеет важное значение для оптимизации условий выращивания с учетом генетических особенностей культур и повышения рентабельности их возделывания, а также оказывает существенное влияние на накопление вторичных метаболитов и содержание биологически активных соединений в растительной продукции.
Параметры источников света, используемых в CEA (controlled environment agriculture)
Источник света
Характеристика
Спектр излучения
Газоразрядные лампы Основаны на введении электриче-высокого давления: ской дуги в элементарную газовую
дуговые натриевые трубчатые (ДНаТ) и зеркальные (ДНаЗ)
смесь, источником света служит газовый разряд в парах натрия, поэтому в спектре преобладает резонансное излучение натрия — яркий оранжево-желтый свет
Газоразрядные лампы Производят свет от возбуждения па-низкого давления (лю-ров ртути низкого давления в смеси минесцентные) инертных газов
Светодиоды Полупроводниковые при боры с электронно-дырочным переходом, создающие оптическое излучение при пропускании через него электрического тока в прямом направлении
Преимущества Недостатки
Свет обладает очень высокой интенсивно- Высокое тепловое излуче-стью; дают световой поток, достаточный для ние; низкое качество спек-светолюбивых растений; остаются самым тральной эмиссия, преиму- распространенным источником света в защи-щественно желто-красная щенном грунте и инфракрасная составля ющие; срок службы около 25000 ч
Могут быть использованы в многоярусных установках в непосредственной близости к растительному покрову, поскольку не сильно нагреваются при работе; спектр близок к естественному солнечному свету
Низкий световой поток; низкая светоотдача; срок службы около 10000 ч
Высокая энергоэффективность; хорошая све- Неопределенность эффек-тоотдача; можно создать практически любой тивного спектрального со-спектр; возможность диммирования; хорошее става пространственное распределение; эффективное использование площадей за счет возможности близкого к растениям размещения;
срок службы до 100000 ч
Роль спектрального состава света в процессах роста и морфогенеза растений в СЕА. Свет разных длин волн определяет рост и обмен веществ у растений, в том числе структурно-функциональное состояние важнейшего процесса в растительной клетке — фотосинтеза (рис. 2). Для фотосинтеза, фотоморфогенеза и регуляции обмена веществ наиболее важны синий (400-500 нм), красный (600-700 нм) и дальний красный (700-800 нм) диапазоны длин волн, поглощаемых фоточув-ствительными пигментами, поскольку в этих областях спектра находится максимум поглощения хлорофиллов и чувствительности фоторецепторов (57). Зеленая же (500-600 нм) часть спектра способствует повышению эффективности их действия (58). Регуляция фотосинтеза включает в себя управление движением устьиц, ростом листьев, строением хлоропластов, содержанием фотосинтетических пигментов, белков и т.д. У большинства растений наибольшая скорость фотосинтеза наблюдается при оранжевом и красном свете. Тем не менее другие составляющие спектра (инфракрасная, синяя, зеленая и др.) также влияют на фотосинтетический аппарат и метаболические процессы в растительных клетках.
Эффекты различного качества света могут быть неодинаковы для разных растений (59-61). Поэтому значительный объем работ в области светокультуры в последние годы посвящен изучению влияния интенсивности освещения и спектрального состава световой среды на рост растений и накопление биологически ценных первичных и вторичных метаболитов. Подчеркивается, что предварительное изучение роста растений, продуктивности и качественных характеристик растительной продукции при различных световых режимах необходимо для оптимизации реакции видов и сортов на искусственное освещение, поиска и подбора наиболее перспективных для выращивания образцов (62).
Высокая
Регуля-
торная
Фотосинтез,
регуляция фотопериодической
пр сникающая способность,
полезен для
Фотосинтетические
реакции, фотоморфогенез,
Поглощается
Вредное воздей-
стене
роль
(в небольших
реакции,
поглощается фототропинами и
оптически плотных
листьев, нижних
ярусов,
дозах)
регуляция
процессов,
Регуляторное действие (в небольших Дозах),
внутри- и межклеточной
водой, увеличивает
криптохромами
густых посевов
поглощение фитохрома Р^
поглощение фитохрома Р,м
скорость тейповых биохимических
реакций
1600 нм
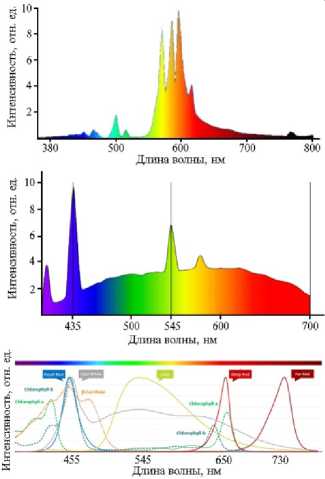
Рис. 2. Влияние диапазонов спектра излучения на физиологические процессы в растениях (цит. по 31) .
Влияние синего диапазона спектра. Показано, что синий свет регулирует рост растений в целом, контролирует открытие устьиц и транспирацию, вызывает увеличение размеров листьев у некоторых культур, повышает содержание пигментов, а также может стимулировать синтез фенолов и флавоноидов (63-65). При этом эффект от его воздействия существенно варьируется в зависимости от объекта исследования и методики проведения эксперимента.
Результаты многих исследований свидетельствуют о положительном влиянии синего света на урожай и качество листовых овощей — основной на сегодняшний момент категории культур, производимых в СЕА. Так, Y. Qian с соавт. (66) показали, что в условиях CEA площадь листовой поверхности и биомасса, а также общее содержание глюкозинолатов у кресс-салата (Lepidium sativum L.) повышались с увеличением доли синего света по сравнению с растениями, выращенными в полевых условиях. Авторы рассматривают накопление глюкозинолатов и расширение их компонентного состава под влиянием синего света как способ повышения качества продукции кресс-салата за счет улучшения его питательных характеристик.
В другой работе (67) было выявлено, что синий свет оказывал комплексный положительный эффект на растения пекинской капусты ( Brassica rapa L. ssp. pekinensis ), выразившийся в накоплении фенолов и флавоноидов, активации ферментов антиоксидантной системы, повышении содержания глюкозинолатов, β -каротина и других ценных соединений, повышении устойчивости к стрессовым воздействиям. Однако у томата ( Solanum lyco-persicum L.) значительное увеличение доли синего света в спектре светильника достоверно снижало сухую массу растений, длину стебля и площадь листьев (68). У кориандра ( Coriandrum sativum L.) существенное увеличение доли синего света способствовало уменьшению содержание хлорофилла и водорастворимых сахаров, оптимальное соотношение красного и синего света составляло 3:1 (69).
Влияние зеленого диапазона спектра. Зеленый свет в меньшей степени поглощается растениями, однако он может глубже проникать в ткани листа и возбуждать хлорофилл в нижних слоях растительных клеток. Поэтому наряду с красным и синим светом он также играет важную роль в физиологических процессах: влияет на анатомическую структуру листьев, ориентацию роста, устьичную проводимость и фотосинтез, участвует в метаболизме азота, повышает антиоксидантный потенциал, способствует дозреванию плодов (70-72).
М. Trojak с соавт. (73) показали, что добавление зеленого света к красному и синему снижало сухую массу надземной части томата ( Solanum lycopersicum L.), но повышало длину и биомассу корней, при этом уменьшались устьичная проводимость, транспирация и изменялись характеристики устьиц, что привело к повышению эффективности использования воды. У земляники ( Fragaria ½ ananassa Duch.) добавление зеленого света (20 % от общей плотности фотонного фотосинтетического потока) повышало общую массу растений, урожай ягод, положительно влияло на интенсивность фотосинтеза (74). На проростках огурца ( Cucumis sativus L.) была показана роль зеленого света в защите растений от стресса: в условиях засухи при освещении зеленым светом значительно повышалась сырая и сухая масса побегов, их высота, диаметр стебля и площадь листьев, объем корневой системы, а также улучшался водный статус (75).
В то же время присутствие зеленого света в спектре светильника не всегда оправдано. Так, К. Rosniza с соавт. (76) показали, что добавление зеленого света не оказывало прямого влияния на рост, содержание хлорофилла и антоцианов у пурпурно-красного сорта капусты пак-чой ( Brassica rapa L. ssp. chinensis ). Существенно лучшие показатели продуктивности и содержания пигментов были получены при использовании только красного и синего света (76). Т. Zhang с соавт. (65) выявили, что зеленый свет подавлял рост салата ( Lactuca sativa L.) и способствовал накоплению нитратов и аммония в растительных тканях, в отличие от фиолетового, синего и красного света. N.B. Claypool с соавт. (77) также показали отсутствие стимулирующего влияния зеленого света на рост и показатели фотосинтетической активности у растений огурца.
Очевидно, что причина различий в полученных результатах состоит в разной генетически обусловленной реакции изучаемых культур на воздействие зеленого света, а также в неодинаковых условиях проведения экспериментов.
Влияние красного и дальнего красного диапазонов спектра. Красный свет характеризуется самой высокой относительной квантовой эффективностью фотосинтеза, регулирует работу фотосинтетического аппарата и оказывает комплексный эффект на растения: вызывает общее повышение биомассы, увеличение объема корневой системы, удлинение стеблей, рост площади листовой поверхности. Он также влияет на переход к генеративной стадии развития, регулирует продолжительность цветения (78, 79).
I.G. Tarakanov с соавт. (80) исследовали влияние красного (640, 660 и 730 нм) и синего (460 нм) света на накопление биомассы и фотосинтетическую активность салата сорта Афицион и показали, что монохроматический синий свет замедлял рост растений, а монохроматический красный, напротив, ускорял его. Также красный свет повышал фотодыхание, а синий — карбоксилирование, при этом синий свет снижал эффективность использования воды (80). В то же время монохроматический синий свет, напротив, стимулировал рост рассады огурца по сравнению с монохроматическим красным и зеленым светом: при его использовании достоверно повышались высота растений, диаметр стебля и сухая масса побегов (77).
Для капусты пак-чой ( Brassica rapa L. ssp. chinensis ) оптимальное соотношение красного и синего света составило 0,9 в условиях эксперимента, проведенного Y.N. Li с соавт. (81). Биомасса растений существенно повышалась по сравнению с вариантами с более высоким содержанием красного света (81). Освещение капусты пак-чой ( B. rapa L. ssp. chinensis ) синим светом в течение 2 нед перед уборкой способствовало получению более высокой биомассы и повышению содержания хлорофилла по сравнению с красным и пурпурным светом (82).
Дальний красный свет (700-800 нм) также играет важную роль в процессах роста и развития растений, участвуя в регуляции прорастания семян, циркадных ритмов, устьичной проводимости и процессов дыхания, в подавлении роста гипокотилей, индукции цветения и накоплении антоцианов (83, 84). Сообщается о влиянии дальнего красного света при исследованиях в СЕА на процессы фотосинтеза и морфогенеза у растений посредством активации фитохрома, а также на ускорение фотосинтетического переноса электронов и повышение эффективности использования света у салата. При этом показано, что излишне высокая интенсивность дальнего красного света может вызвать стресс у растений (85, 86).
Добавление красного и дальнего красного света на разных стадиях роста повышало сырую массу салата и содержание в нем сахаров и витамина Е при одновременном снижении количества нитратов, а также улучшало архитектонику растений (87). В другом эксперименте выявлена специфичность сортовой реакции и различия в отклике трех сортов салата на воздействие дальним красным светом, хотя общая тенденция, состоящая в увеличении показателей продуктивности и снижении содержания хлорофилла и антоцианов при увеличении плотности фотосинтетического фотонного потока дальнего красного света, была одинакова для всех исследуемых сортов (88).
Влияние УФ-области спектра. О роли УФ-области спектра в регуляции роста и метаболизма растений в CEA в настоящее время имеется ограниченное число публикаций. Показано, что кратковременное воздействие УФ-Б радиацией хоть и имело негативный эффект на накопление биомассы растений базилика ( Ocimum basilicum L.), но также способствовало значительному обогащению растительной продукции ценными метаболитами — антоцианами, фенолами и флавоноидами. В этой работе также были выявлены генетически обусловленные сортовые различия в реакции двух образцов базилика на применяемые воздействия (89).
У проростков листовой капусты кейл (Brassica olearacea ssp. acephala) УФ-Б радиация достоверно повышала общее содержание фенолов, индуци- руя аккумуляцию 9 из 11 идентифицированных соединений, а также стимулировала синтез и накопление глюкозинолатов (90). О стимулирующем влиянии УФ-С радиации (в определенных дозах) на рост и развитие растений томата в вегетативный период известно из публикаций Е.И. Ермакова с со-авт. (91).
Влияние полноспектрального излучения . Механизмы влияния спектральных характеристик освещения на физиологические процессы растений в настоящее время до конца не изучены из-за большого количества возможных спектральных комбинаций и специфических реакций разных растительных организмов на их воздействие. Возможность формирования узкополосного излучения от светодиодов позволяет оценить влияние конкретных длин волн на морфологию, биохимический состав и фотосинтетическую активность растений, однако все большее количество исследований показывает, что растениям для реализации продукционного потенциала требуется полный спектр излучения в видимой области. Причем разные культуры и даже сорта неодинаково реагируют на преобладание в спектре светильника определенных диапазонов длин волн.
Например, добавление красного света к базовому белому в соотношении 1:2 существенно повышало массу корней и надземной части капусты пак-чой, а также содержание сахаров, белка, витамина С, флавоноидов и антиоксидантную активность, при этом содержание нитратов было минимальным (92). В то же время В. Frqszczak с соавт. (93) выявили неодинаковую реакцию сортотипов салата, различающихся плотностью и цветом листьев, на спектральный состав света. Наблюдался рост сырой массы и увеличение содержания хлорофилла у дуболистного красного салата при добавлении к белому спектру красного света, в то время как у маслянолистных сортов аналогичный эффект достигался при добавлении синего света. Светло-зеленые тонколистные образцы оказались не чувствительны к изменению спектра (93).
Принцип получения белого света с использованием светодиодных технологий заключается либо в комбинировании RGB (красных, зеленых, синих) светодиодов, либо в частичном преобразовании синего света с помощью люминофора в красный и желтый свет. Недостатком обоих способов оказывается получение неоптимального спектра: в первом случае в связи со сложностью подбора нужного спектра из-за огромного количества сочетаний, во втором — с неравномерностью получаемого спектра и выраженным синим пиком.
Длина волны, нм
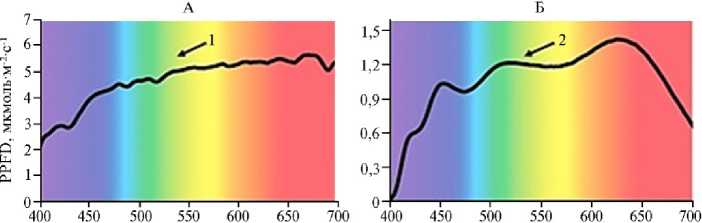
Рис. 3. Спектр излучения солнца в безоблачное время (25.08.2019 в 1100, г. Санкт-Петербург) (А, 1) и светодиодного источника света AFI-5000 (ФГБНУ АФИ) (Б, 2) (цит. по 94).
Смоделировать и реализовать фотосинтетически активный и физиологически значимый спектр излучения для растений можно при использовании в качестве эталона солнечного спектра излучения в видимой области, 880
содержащего все функциональные длины волн (рис. 3, А) — как для работы фотосинтетического аппарата с максимумами поглощения света в синей и красной областях спектра, так и для реализации вторичных процессов, от аккумулирования энергии до активации защитных механизмов в растениях. На основе инновационных кристаллов — светодиодов, покрытых высокоэффективным люминофором, Т.Э. Кулешова с соавт. (94) создали источники света, моделирующие естественное освещение в разное время суток. Например, спектр излучения светодиодного светильника AFI-5000 близок к спектру излучения солнца в полуденное время (см. рис. 3, Б).
В более ранней работе (95) эти же авторы выявили, что в условиях интенсивной светокультуры показатели продуктивности салата и томата при выращивании на тонкослойном аналоге почвы под светодиодным источником света со спектром, близким к солнечному, превышали таковые под эталонной натриевой лампой соответственно на 10 и 24 %, что до этого не удавалось получить ни для одного светодиодного светильника (включая красно-бело-синий, варианты белого, а также светильник, моделирующий спектр натриевой лампы).
Преимущество использования в описанной серии экспериментов спектра излучения, приближенного к солнечному свету, свидетельствует о решающей роли всего диапазона длин волн в видимой области спектра в осуществлении фотосинтетических реакций: аккумуляции и преобразовании энергии света, а также в регуляции вторичных процессов — синтезе метаболитов, защитных соединений и др.
В настоящее время проводятся исследования влияния спектрального состава света от светодиодных светильников, моделирующего солнечное излучение в разное время суток, на процессы фотосинтеза, роста и морфогенеза у различных культур, в частности редиса. Показано, что у редиса ( Raphanus sativus L.) для формирования урожая корнеплодов наиболее оптимален спектр с повышенным содержанием синего света, в то время как более высокая масса листьев формировалась при повышенном содержании красного и зеленого света (94).
Влияние интенсивности излучения на морфофизиологические и биохимические показатели растений. С использованием полноспектральных светодиодных светильников было установлено, что две популярные в СЕА быстрорастущие культуры, японская капуста форма мизуна ( Brassica rapa L. ssp. nipposinica (Bailey) Hanelt.) и салат дуболистный ( Lactuca sativa L.) существенно различались как по эффективности использования света, так и по степени накопления хлорофилла и антоцианов в зависимости от освещенности. У японской капусты все исследуемые показатели были существенно выше по сравнению с салатом. При этом у обеих культур с ростом плотности фотонного фотосинтетического потока (ПФФП) от 50 до 425 мкмоль•м - 2•с - 1 наблюдалось увеличение площади листовой поверхности и проективного покрытия кроны, повышалось содержание пигментов, а также существенно увеличивалась масса растений (96).
Выращивание салата при плотности фотонного фотосинтетического потока от 130 до 389 мкмоль•м-2•с-1 показало, что увеличение интенсивности света активизировало процесс фотосинтеза, поддерживало скорость транспорта электронов и стимулировало синтез антоцианов и каротиноидов, что в целом оказало положительный эффект на системы фотозащиты, способствовало повышению сырой и сухой массы, а также росту содержания сухого вещества (97). Сходные результаты были получены другими исследователями (98). Однако в экспериментах G. Pennisi с соавт. (99) прирост биомассы салата и базилика наблюдался при повышении плотности фотонного потока от 100 до 250 мкмоль•м-2•с-1, а при более высоком значении ПФФП — 300 мкмоль•м-2•с-1 масса обеих культур снижалась.
Эксперименты на карликовом сорте томата в условиях ростовой камеры позволили установить, что увеличение плотности фотонного фотосинтетического потока от 300 до 700 мкмоль•м - 2•с - 1 привело к снижению сырой и сухой массы, а также площади листьев у растений, находящихся на вегетативной стадии развития. Также наблюдали уменьшение содержания хлорофилла в листьях по мере роста интенсивности освещения. Авторы сделали вывод, что высокая освещенность — 700 мкмоль•м - 2•с - 1 в условиях проведения эксперимента — избыточна для томата и снижает его фотосинтетическую способность (68).
Действие фотопериода на урожай и качество растительной продукции. Другое важное направление научных исследований, связанных со световой средой, — изучение влияния фотопериода и интеграла дневного освещения (ИДО — количество ФАР, которое растение получает в течение дня) на урожай и качество растений. Поиск оптимальной продолжительности освещения для различных культур и сортов, обеспечивающей высокие показатели продуктивности и улучшенный биохимический состав, имеет важное значение для создания сортовых технологий выращивания в условиях вертикальных ферм и растительных фабрик.
Так, К.Р. Gavhane с соавт. (100) в экспериментах на салате сортотипа Айсберг при 12-, 16- и 20-часовом фотопериоде показали, что оптимальная длина светового дня для этого сорта составляла 16 ч. При ее увеличении до 20 ч наряду с существенным ростом энергетических затрат на освещение наблюдалось снижение сырой и сухой массы растений, числа листьев и площади листовой поверхности. Кроме того, при 16-часовом фотопериоде авторы получили максимальные значения содержания фенольных соединений и антиоксидантной активности в листьях салата, в то время как количество аскорбиновой кислоты положительно коррелировало с продолжительностью освещения (100).
В другом исследовании (101) авторы изучали влияние на рост салата интенсивности освещения (120-270 мкмоль•м - 2•с - 1) и фотопериода (1624 ч). Было показано, что удлинение фотопериода может компенсировать более низкую освещенность. Правда, такой результат был получен только при высоких значениях ИДО (101). S. Palmer с соавт. (102) наблюдали увеличении биомассы салата и японской капусты формы мизуна, а также более высокие значения для большинства показателей фотосинтетической активности при снижении интенсивности освещения и увеличении фотопериода с 10 до 20 ч (при этом интеграл дневного освещения был одинаков) (102). У растений карликового томата урожай плодов был сходным при равном ИДО, но разных значениях фотопериода и плотности фотосинтетического потока (103). У кресс-салата более низкая освещенность и длительный фотопериод (20 ч) способствовали большему накоплению глюкозинолатов и повышению массы растений по сравнению с высокой интенсивностью освещения и коротким фотопериодом (104).
Однако показано, что даже представители одного семейства (Bras-sicaceae) — горчица листовая (Brassica juncea (L.) Czern.), горчица красная (Brassica juncea L.) и листовая капуста кейл (Brassica oleracea L. var. acephala (DC.) Alef.) могут по-разному реагировать на формируемые в экспериментах фотопериод и освещенность (105). Это подчеркивает важность изучения влияния световой среды для каждого вида и сорта выращиваемой в СЕА культуры при создании оптимизированных сортовых технологий производ- ства растительной продукции. Также необходимо учитывать особенности влияния фотопериода и ИДО на скорость перехода в репродуктивную фазу (и, соответственно, длительность вегетационного периода, продуктивность и биохимический состав) у длиннодневных, короткодневных и нейтральных к длине дня растений.
К настоящему времени в публикациях отечественных и зарубежных авторов накоплен значительный объем экспериментальных данных о реакции на продолжительность освещения у фотопериодически чувствительных и нейтральных культур в светокультуре, чему будет посвящена отдельная статья.
Равномерность распределения светового потока в зоне роста растений и обеспечение снижения светопотерь также служат одними из существенных факторов, влияющих на растения (26, 44). Это достигается не только определенным расположением светильников относительно растений, но и использованием отражателей светового потока, обеспечивающих его локализацию в зоне роста растений и равномерное распределение по ее площади.
Технологии выращивания растений . Современные сооружения искусственного климата, кроме систем регуляции параметров жизнеобеспечения растений, могут быть оснащены высокотехнологичными инструментами мониторинга, интеллектуальными платформами управления, роботами для высадки рассады и сбора растительной продукции, системами IoT, существенно облегчающими проведение научных исследований. Число публикаций по этой тематике существенно возросло в последние годы (106-109).
В сооружениях СЕА используются преимущественно ресурсосберегающие гидропонные и аэропонные технологии выращивания. С.Е. Wong с соавт. (9) сообщают, что в 2019 году более 50 % всех растительных фабрик в мире применяли гидропонику, на втором месте была аэропоника (20 %). Оставшиеся предприятия использовали почву в качестве субстрата для растений (13 %), а также применяли аквапонные (9 %) и другие технологии (6 %) (9).
При разработке в ФГБНУ АФИ фитотехкомплексов различного типа, уже более четырех лет функционирующих на Антарктической станции «Восток», использована уникальная технология тонкослойной панопоники, не требующая утилизации отработанного субстрата (43). При этом урожай растений не уступает или даже превосходит таковой, получаемый в тех же условиях другими исследователями при использовании аэропонных и гидропонных технологий (5).
В качестве основных преимуществ растительных фабрик, вертикальных ферм и других сооружений СЕА специалисты отмечают высокое качество и экологическую безопасность растительной продукции, ее близость к потребителю, более высокую по сравнению с полевыми и тепличными условиями урожайность культур на единицу площади за счет использования многоярусных систем выращивания, возможность круглогодичного производства и отсутствие зависимости от погодных и климатических условий, существенное снижение вредных выбросов и уменьшение загрязнения окружающей среды (10, 14, 51). Лучшее по сравнению с традиционным производством качество продукции достигается за счет использования экологически безопасных гидропонных инертных субстратов и очищенной воды для полива, отсутствия необходимости применения пестицидов, а также существенного уменьшения длины логистических цепочек поставок продукции, которая практически сразу попадает в места реализации, минуя склады и не подвергаясь длительной транспортировке при низких температурах и специальной обработке, что определяет ее высокую биологическую и потребительскую ценность (10, 110, 111). К. Specht с соавт. (112) также отмечают экономические и экологические преимущества сооружений искусственного климата, заключающиеся в существенном снижении водопотреб-ления, локальной переработке органических отходов и уменьшении выбросов CO2 при транспортировке вследствие сокращения логистических цепей поставок продукции потребителю.
Используемые растительные культуры. Выбор культур для выращивания в полностью контролируемых условиях определяется прежде всего их рентабельностью, поскольку сооружения СЕА требуют значительно более высоких капитальных и эксплуатационных расходов по сравнению с традиционными промышленными теплицами (10, 14). Так, по данным С.Е. Wong с соавт. (9), в 2017 году основными видами культур, выращиваемых на вертикальных фермах США и Канады, были листовые овощи (57 %), томаты (16 %), лекарственные травы (11 %), цветочная продукция (10 %) и микрозелень (6 %). Авторы подчеркивают, что вследствие более высоких по сравнению с теплицами и открытым грунтом эксплуатационных расходов в сооружениях искусственного климата важно учитывать длительность цикла выращивания и выбирать культуры, пользующиеся большим спросом, либо нишевые культуры с высокой рентабельностью (9).
-
А. Dsouza с соавт. (3), авторы комплексного исследования 2023 года, включающего анализ 244 публикаций последних лет о производимых в CEA культурах, пришли к сходным выводам. Салат ( Lactuca sativa L.) оказался основным объектом исследований. Реже использовали базилик и томаты, еще реже — другие культуры (листовая капуста кейл, земляника, женьшень, огурец и др.) (3).
-
T. Kozai, автор серии книг и статей по проблемам производства растительной продукции в условиях растительных фабрик, сформулировал следующие основные требования для листовых овощных культур — основного объекта производства в СЕА: небольшая высота (около 30 см или меньше), определяющая пригодность для выращивания на многоярусных стеллажах с расстоянием между ярусами 40-50 см; высокая скорость роста (получение урожая через 10-30 сут после посадки); устойчивость к низкой интенсивности освещения и высокой плотности посадки; высокое качество растительной продукции и ценный биохимический состав; отзывчивость на формируемые внешние условия, возможность управления качеством продукции (интенсивностью окраски, содержанием ценных биохимических соединений и др.) за счет регуляции свето-температурных факторов среды; хозяйственно полезная часть урожая должна составлять не менее 85 % от сырой массы растения; простота высадки рассады и ухода за растениями (14). Допустимое содержание нитратов в растительной продукции в странах Европы, США и Азии существенно выше, чем в Российской Федерации (113), что позволяет использовать для ряда культур свет низкой интенсивности, при котором в растениях могут накапливаться нитраты в количествах, превышающих нормы ПДК в России.
Как отмечалось выше, на долю быстрорастущих листовых овощей и микрозелени в СЕА приходится более 60 % всей производимой продукции. Тем не менее очевидно, что для качественного и сбалансированного питания населения необходимо выращивать большее разнообразие культур. Сообщается, что значительная часть существующих в настоящее время сортов не полностью подходит для выращивания в контролируемых условиях светокультуры, поскольку они создавались для других условий — открытого или традиционного защищенного грунта. Регулируемые условия СЕА требуют иных подходов к селекции: новые сорта для растительных фабрик, кроме скороспелости и компактного габитуса, должны характеризоваться высокой адаптацией к искусственному свету, улучшенным товарным видом и высокими вкусовыми характеристиками, повышенной питательной ценностью и увеличенным содержанием полезных для здоровья нутриентов (114-119). В настоящее время проводится в основном изучение и оценка коллекций различных культур (томат, салат, базилик, шпинат, кресс-салат, листовые капустные культуры и др.) в условиях СЕА, идентификация ценных образцов — доноров и источников селекционно ценных признаков (114, 120-123).
Примером завершенных селекционно-генетических исследований служит созданный в ФГБНУ АФИ высокопродуктивный скороспелый сорт редиса для светокультуры Петербургский фиолетовый, а также линии редиса и редьки, адаптированные к условиям искусственного освещения (124). Очевидно, что в ближайшие годы появятся новые сорта растений, предназначенные для светокультуры, адаптированные к искусственному освещению и применяемым технологиям выращивания, что еще более укрепит позиции СЕА на рынке производства сельскохозяйственной продукции.
Итак, анализ данных, полученных авторами и приведенных в источниках литературы, свидетельствует о высокой актуальности исследований, связанных со светокультурой растений. Сооружения искусственного климата (controlled environment agriculturee, СЕА) представляют собой перспективное направление развития современного аграрного производства. Они служат прежде всего для обеспечения потребностей населения мегаполисов, а также регионов с экстремальными погодными условиями свежей и качественной овощной продукцией. Сложность в разработке однозначных рекомендаций по микроклимату и световой среде с учетом применяемых технологий культивирования конкретных образцов растений связана с крайне неоднородной информацией от разных исследователей, что, в свою очередь, обусловлено сортовой, видовой спецификой растений и различными условиями выращивания одних и тех же культур. В этой связи подбор культур по принципу эффективности их производства в СЕА, разработка оптимальных режимов и ресурсосберегающих технологий выращивания (в том числе технологий замкнутого цикла) в соответствии с требованиями каждой культуры (сорта), поиск возможностей для дальнейшего совершенствования световой среды при реализации методологии многомерной оптимизации условий культивирования растений, а также селекция новых образцов для СEA служат перспективными направлениями исследований с целью дальнейшего повышения устойчивости и производительности растениеводства в CEA.
Список литературы Светокультура растений в современных сооружениях искусственного климата (обзор)
- Van Gerrewey T., Boon N., Geelen D. Vertical farming: the only way is up? Agronomy, 2021, 12(1): 2 (doi: 10.3390/agronomy12010002).
- Vatistas C., Avgoustaki D.D., Bartzanas T. A systematic literature review on controlled-environ-ment agriculture: how vertical farms and greenhouses can influence the sustainability and footprint of urban microclimate with local food production. Atmosphere, 2022, 13(8): 1258 (doi: 10.3390/at-mos13081258).
- Dsouza A., Newman L., Graham T., Fraser E.D.G. Exploring the landscape of controlled envi-ronment agriculture research: a systematic scoping review of trends and topics. Agricultural Sys-tems, 2023, 209: 103673 (doi: 10.1016/j.agsy.2023.103673).
- Indoor farming market size, share & trends analysis report by facility type (greenhouses, vertical farms), by component (hardware, software), by crop category, by region, and segment forecasts, 2022-2030. Режим доступа: https://www.marketresearch.com/Grand-View-Research-v4060/In-door-Farming-Size-Share-Trends-31516510. Без даты.
- Panova G.G., Teplyakov A.V., Novak A.B., Levinskikh M.A., Udalova O.R., Mirskaya G.V., Khomyakov Y.V., Shved D.M., Ilyin E.A., Kuleshova T.E., Kanash E.V., Chesnokov Yu.V. Growth and development of leaf vegetable crops under conditions of the phytotechnical complex in Antarctica. Agronomy, 2023, 13(12): 3038 (doi: 10.3390/agronomy13123038).
- Zacharaki A.K., Monaghan J.M., Bromley J.R., Vickers L.H. Opportunities and challenges for strawberry cultivation in urban food production systems. Plants, People, Planet, 2024, 6(3): 611-621 (doi: 10.1002/ppp3.10475).
- Talbot M.H., Monfet D. Development of a crop growth model for the energy analysis of con-trolled agriculture environment spaces. Biosystems Engineering, 2024, 238: 38-50 (doi: 10.1016/j.biosystemseng.2023.12.012).
- SharathKumar M., Heuvelink E., Marcelis L.F. Vertical farming: moving from genetic to environmental modification. Trends in Plant Science, 2020, 25(8): 724-727 (doi: 10.1016/j.tplants.2020.05.012).
- Wong C.E., Teo Z.W.N., Shen L., Yu H. Seeing the lights for leafy greens in indoor vertical farming. Trends in Food Science & Technology, 2020, 106: 48-63 (doi: 10.1016/j.tifs.2020.09.031).
- Al-Kodmany K. Vertical farms for future cities. In: Digital agriculture /P.M. Priyadarshan, S.M. Jain, S. Penna, J.M. Al-Khayri (eds.). Springer, Cham, 2024: 179-197 (doi: 10.1007/978-3-031-43548-5_6).
- Engler N., Krarti M. Review of energy efficiency in controlled environment agriculture. Renewable and Sustainable Energy Reviews, 2021, 141: 110786 (doi: 10.1016/j.rser.2021.110786).
- Rajendran R., Jagmohan S., Jayaraj P., Ali O., Ramsubhag A., Jayaraman J. Effects of Ascophyl-lum nodosum extract on sweet pepper plants as an organic biostimulant in grow box home garden conditions. Journal of Applied Phycology, 2022, 34: 647-657 (doi: 10.1007/s10811-021-02611-z).
- Lee T.S., Jung D.-H., Kim J.Y., Lee J.Y., Park J.-E., Kim H.S., Park S.H. Development of a low-cost plant growth chamber for improved phenotyping research. Journal of Biosystems Engi-neering, 2023, 48(3): 355-363 (doi: 10.1007/s42853-023-00197-7).
- Kozai T., Niu G. Chapter 2 - Role of the plant factory with artificial lighting (PFAL) in urban areas. In: Plant factory (second edition) /T. Kozai, G. Niu, M. Takagaki (eds.). Academic Press, Burlington, 2020: 7-34 (doi: 10.1016/B978-0-12-816691-8.00002-9).
- Леман В.М. Курс светокультуры растений. М., 1976.
- Большая Советская Энциклопедия, 3-е изд., т. 23. Режим доступа: http://bse.uaio.ru/BSE/2301.htm?ysclid=luieli99ai249503070. Без даты.
- ГОСТ Р 58461-2019. Освещение растений в сооружениях защищенного грунта. Термины и определения. М., 2019.
- Besthorn F.H. Vertical farming: social work and sustainable urban agriculture in an age of global food crises. Aust. Soc. Work, 2013, 66(2): 187-203 (doi: 10.1080/0312407X.2012.716448).
- Gericke W.F. Hydroponics — crop production in liquid culture media. Science, 1937, 85(2198): 177-178 (doi: 10.1126/science.85.2198.177).
- Kleszcz J., Kmiecik P., Świerzawski J. Vegetable and gardening tower of Othmar Ruthner in the Voivodeship park of culture and recreation in Chorzów — the first example of vertical farming in Poland. Sustainability, 2020, 12(13): 5378 (doi: 10.3390/su12135378).
- Zaręba A., Krzemińska A., Kozik R. Urban vertical farming as an example of nature-based solu-tions supporting a healthy society living in the urban environment. Resources, 2021, 10(11): 109 (doi: 10.3390/resources10110109).
- Despommier D. The vertical farm: feeding the world in the 21st century. New York, 2010.
- Shon D., Lee E., Lee Y., Lee J., Byun N. Characteristics of smart farms for architectural planning and design. Buildings, 2022, 13(1): 93 (doi: 10.3390/buildings13010093).
- Ермаков Е.И. Избранные труды. СПб, 2009.
- Глобус А.М. Агрофизический институт: 75 лет на пути к точному земледелию. СПб, 2007.
- Черноусов И.Н. Физическое моделирование световой среды растений в регулируемой агроэкосистеме. В сб.: Регулируемая система в растениеводстве и экофизиологии. СПб, 2007: 43-53.
- Ермаков Е.И., Мухоморов В.К. Продукционный процесс растений и многообразие взаимодействий эдафических факторов в регулируемой агроэкосистеме. Доклады РАСХН, 2002, 3: 14-17.
- Клешнин А.Ф. Растение и свет: теория и практика светокультуры растений. М., 1954.
- Протасова Н.Н. Светокультура как способ выявления потенциальной продуктивности растений. Физиология растений, 1987, 34(4): 812-822.
- Прикупец Л.Б., Боос Г.В., Терехов В.Г., Тараканов И.Г. Исследование влияния излучения в различных диапазонах области ФАР на продуктивность и биохимический состав биомассы салатно-зеленных культур. Светотехника, 2018, 5: 6-12.
- Тихомиров А.А., Шарупич В.П., Лисовский Т.М. Светокультура растений: биофизические и биотехнологические основы. Новосибирск, 2000.
- Лях П.А., Колошина К.А., Попова К.И., Лях А.А. Влияние спектрального состава светодиодного излучения на рост и развитие растений. Инновации и продовольственная безопасность, 2022, 1(35): 108-120 (doi: 10.31677/2311-0651-2022-35-1-108-120).
- Аверчева О.В., Беркович Ю.А., Ерохин А.Н., Жигалова Т.В., Погосян С.И., Смолянина С.О. Особенности роста и фотосинтеза растений китайской капусты при выращивании под светодиодными светильниками. Физиология растений, 2009, 56(1): 17-26.
- Коновалова И.О., Беркович Ю.А., Ерохин А.Н., Смолянина С.О., Яковлева О.С., Знаменский А.И., Тараканов И.Г., Радченко С.Г., Лапач С.Н., Трофимов Ю.В., Цвирко В.И. Оптимизация светодиодной системы освещения витаминной космической оранжереи. Авиакосмическая и экологическая медицина, 2016, 50(3): 17-22.
- Беркович Ю.А., Буряк А.А., Очков О.А., Смолянина С.О., Переведенцев О.В., Лапач С.Н. Некоторые пути оптимизации светодиодного освещения в светокультуре растений. Светотехника, 2019, S: 37-42.
- Kreslavski V., Khudyakova A., Kosobryukhov A., Pashkovskiy P., Vereshchagin M., Balakh-nina T., Alharby H.F., Allakhverdiev S.I. Impact of additional green light and deficit in crypto-chrome 1 on photosynthetic activity and pro-/antioxidant balance in Arabidopsis thaliana. Photo-synthetica, 2023, 61(SI): 215-224 (doi: 10.32615/ps.2023.009).
- Мартиросян Л.Ю., Мартиросян Ю.Ц., Кособрюхов А.А., Гольдберг В.М., Гачок И.В., Мартиросян В.В., Гладченко М.А., Гайдамака С.Н., Америк А.Ю., Миних А.А., Варфо-ломеев С.Д. Биосинтез каучука и инулина в зависимости от спектрального состава света и активности фотосинтетического аппарата при аэропонном культивировании Taraxa-cum kok-saghys E. Rodin. Сельскохозяйственная биология, 2023, 58(1): 100-113 (doi: 10.15389/agrobiology.2023.1.100rus).
- Косьянов Д.Ю., Ворновских А.А., Шичалин О.О., Завьялов А.П. Композитные керамиче-ские люминофоры для сверхъярких светодиодов. Мат. Межд. науч.-техн. молод. конф. «Перспективные материалы конструкционного и функционального назначения». Томск, 2022: 194-196.
- Прикупец Л.Б. Светодиоды в тепличном освещении: возможности и реальность. Светотехника, 2019, S: 8-12.
- Мишанов А.П., Ракутько Е.Н., Ракутько С.А. Цифровой светодиодный светильник с регулируемым спектром. Известия Санкт-Петербургского государственного аграрного университета, 2022, 1(66): 125-134 (doi: 10.24412/2078-1318-2022-1-125-134).
- Молчан О.В., Обуховская Л.В., Куделина Т.Н., Астасенко Н.И., Баркун М.И., Трофимов Ю.В. Активация LED-освещением фотосинтетических и ростовых процессов растений томата в условиях опытно-производственного участка. Известия Национальной академии наук Беларуси. Серия биологических наук, 2023, 68(4): 282-292 (doi: 10.29235/1029-8940-2023-68-4-282-292).
- Подольская Т.В., Васюта Е.А., Плаксина А.Ю. Вертикальные фермы как ключевое направление интенсификации сельского хозяйства в условиях урбанизации. Экономика: вчера, сегодня, завтра, 2023, 13(5-1): 294-304.
- Черноусов И.Н., Панова Г.Г., Удалова О.Р., Александров А.В. Фитотехкомплекс для выращивания растений. Патент на полезную модель. МПК A 01 G 9/14. ФГБНУ «Агрофизический научно-исследовательский институт (ФГБНУ АФИ) (РФ), Общество с ограниченной ответственностью «Фитосфера» (РФ). № 189309 U1. Заявл. 10.09.2018. Опубл. 21.05.2019. Бюл. № 15.
- Панова Г.Г., Удалова О.Р., Канаш Е.В., Галушко А.С., Кочетов А.А., Прияткин Н.С., Архипов М.В., Черноусов И.Н. Основы физического моделирования «идеальных» агроэкосистем. Журнал технической физики, 2020, 90(10): 1633-1639 (doi: 10.21883/JTF.2020.10.49792.429-19).
- Vermeulen S.J., Dinesh D., Howden S.M., Cramer L., Thornton P.K. Transformation in practice: a review of empirical cases of transformational adaptation in agriculture under climate change. Frontiers in Sustainable Food Systems, 2018, 2: 65 (doi: 10.3389/fsufs.2018.00065).
- Hansen J., Hellin J., Rosenstock T., Fisher E., Cairns J., Stirling C., Lamanna A., van Etten J., Rose A., Campbell B. Climate risk management and rural poverty reduction. Agricultural Systems, 2019, 172: 28-46 (doi: 10.1016/j.agsy.2018.01.019).
- Ксенофонтов М.Ю., Ползиков Д.А. К вопросу о влиянии климатических изменений на развитие сельского хозяйства России в долгосрочной перспективе. Проблемы прогнозирования, 2020, 3: 82-92.
- McCartney L., Lefsrud M. Protected agriculture in extreme environments: a review of controlled environment agriculture in tropical, arid, polar, and urban locations. Applied Engineering in Agri-culture, 2018, 34(2): 455-473 (doi: 10.13031/aea.12590).
- Friedrich D.L. Vegetable farming, climate change, and food security in the Arctic. In: Justice and food security in a changing climate /H. Schübel, I. Wallimann-Helmer (eds.). Wageningen Aca-demic Publishers, The Netherlands, 2021: 51-57 (doi: 10.3920/978-90-8686-915-2_5).
- Didenko N., Skripnuk D., Ilin I., Cherenkov V., Tanichev A., Kulik S.V. An economic model of sustainable development in the Russian arctic: the idea of building vertical farms. Agronomy, 2021, 11(9): 1863 (doi: 10.3390/agronomy11091863).
- Martin M., Weidner T., Gullström C. Estimating the potential of building integration and regional synergies to improve the environmental performance of urban vertical farming. Frontiers in Sus-tainable Food Systems, 2022, 6: 849304 (doi: 10.3389/fsufs.2022.849304).
- Parkes M.G., Cubillos Tovar J.P., Dourado F., Domingos T., Teixeira R.F. Life cycle assessment of a prospective technology for building-integrated production of broccoli microgreens. Atmos-phere, 2022, 13(8): 1317 (doi: 10.3390/atmos13081317).
- Физико-агрономический словарь /Под ред. А.Г. Бондарева, Н.Ф. Бондаренко, Е.И. Ерма-кова, Е.Н. Романовой, В.А. Семенова., И.Б. Ускова, В.П. Якушева. СПб, 2000.
- Ермаков Е.И., Казимирчук А.А., Сизов Г.М., Желтов Ю.И., Черноусов И.Н. Устройство для освещения растений. Патент на изобретение МПК A 01 G 9/26, F 21 K 7/00, F 21 V 13/08. Акционерное общество "Транс РЭС" (РФ). № 2057423 C1. Заявл. 23.09.1993. Опубл. 10.04.1996.
- Trivellini A., Toscano S., Romano D., Ferrante A. LED lighting to produce high-quality orna-mental plants. Plants, 2023, 12(8): 1667 (doi: 10.3390/plants12081667).
- Cavallaro V., Muleo R. The effects of LED light spectra and intensities on plant growth. Plants, 2022, 11(15): 1911 (doi: 10.3390/plants11151911).
- Borbély P., Gasperl A., Pálmai T., Ahres M., Asghar M.A., Galiba G., Müller M., Kocsy G. Light intensity- and spectrum-dependent redox regulation of plant metabolism. Antioxidants, 2022, 11(7): 1311 (doi: 10.3390/antiox11071311).
- Kim H.H., Goins G.D., Wheeler R.M., Sager J.C. Green-light supplementation for enhanced lettuce growth under red-and blue-light-emitting diodes. HortScience, 2004, 39(7): 1617-1622 (doi: 10.21273/HORTSCI.39.7.1617).
- Kami C., Lorrain S., Hornitschek P., Fankhauser C. Light-regulated plant growth and develop-ment. Current Topics in Developmental Biology, 2010, 91: 29-66 (doi: 10.1016/S0070-2153(10)91002-8).
- Kochetova G.V., Avercheva O.V., Bassarskaya E.M., Zhigalova T.V. Light quality as a driver of photosynthetic apparatus development. Biophys. Rev., 2022, 14: 779-803 (doi: 10.1007/s12551-022-00985-z).
- Kabacheuskaya E.M., Sukhoveeva S.V., Trofimov Y.V., Barkun M.I. Effect of the spectral com-position of LED artificial lighting sources on the functional activity of the photosynthetic appa-ratus of basil leaves. J. Appl. Spectrosc., 2024, 90: 1267-1272 (doi: 10.1007/s10812-024-01663-6).
- Modarelli G.C., Paradiso R., Arena C., De Pascale S., Van Labeke M.C. High light intensity from blue-red leds enhance photosynthetic performance, plant growth, and optical properties of red lettuce in controlled environment. Horticulturae, 2022, 8(2): 114 (doi: 10.3390/horticul-turae8020114).
- Assmann S.M., Shimazaki K.I. The multisensory guard cell. Stomatal responses to blue light and abscisic acid. Plant Physiology, 1999, 119(3): 809-816 (doi: 10.1104/pp.119.3.809).
- Kim E.-Y., Park S-A., Park B.-J., Lee Y., Oh M.-M. Growth and antioxidant phenolic com-pounds in cherry tomato seedlings grown under monochromatic light-emitting diodes. Hortic. Environ. Biotechnol., 2014, 55: 506-513 (doi: 10.1007/s13580-014-0121-7).
- Zhang T., Shi Y., Piao F., Z. Sun Z. Effects of different LED sources on the growth and nitrogen metabolism of lettuce. Plant Cell Tiss. Organ. Cult., 2018, 134: 231-240 (doi: 10.1007/s11240-018-1415-8).
- Qian Y., Hibbert L.E., Milner S., Katz E., Kliebenstein D.J., Taylor G. Improved yield and health benefits of watercress grown in an indoor vertical farm. Scientia Horticulturae, 2022, 300: 111068 (doi: 10.1016/j.scienta.2022.111068).
- Zhang R., Yang W., Pan Q., Zeng Q., Yan C., Bai X., Liu Y., Zhang L., Li B. Effects of long-term blue light irradiation on carotenoid biosynthesis and antioxidant activities in Chinese cabbage (Brassica rapa L. ssp. pekinensis). Food Research International, 2023, 174(2): 113661 (doi 10.1016/j.foodres.2023.113661).
- Ke X., Yoshida H., Hikosaka S., Goto E. Optimization of photosynthetic photon flux density and light quality for increasing radiation-use efficiency in dwarf tomato under LED light at the vege-tative growth stage. Plants, 2021, 11(1): 121 (doi: 10.3390/plants11010121).
- Gao Q., Liao Q., Li Q., Yang Q., Wang F., Li J. Effects of LED red and blue light component on growth and photosynthetic characteristics of coriander in plant factory. Horticulturae, 2022, 8(12): 1165 (doi: 10.3390/horticulturae8121165).
- Kokalj D., Hribar J., Cigić B., Zlatić E., Demšar L., Sinkovič L., Šircelj H., Bizjak G., Vidrih R. Influence of yellow light-emitting diodes at 590 nm on storage of apple, tomato and bell pepper fruit. Food Technology and Biotechnology, 2016, 54(2): 228 (doi: 10.17113/ftb.54.02.16.4096).
- Liu J., van Iersel M.W. Photosynthetic physiology of blue, green, and red light: light intensity effects and underlying mechanisms. Front. Plant Sci., 2021, 12: 619987 (doi: 10.3389/fpls.2021.619987).
- Sheikhi H., Delshad M., Aliniaeifard S., Haghbeen K., Bababalar M., Nasiri R. Enhancing growth and nutritional quality in greenhouse-grown ‘little gem’lettuce using LED supplemental lighting. International Journal of Horticultural Science and Technology, 2024, 11(3): 353-368 (doi: 10.22059/ijhst.2023.364300.690).
- Trojak M., Skowron E., Sobala T., Kocurek M., Pałyga J. Effects of partial replacement of red by green light in the growth spectrum on photomorphogenesis and photosynthesis in tomato plants. Photosynth. Res., 2022, 151: 295-312 (doi: 10.1007/s11120-021-00879-3).
- Avendaño-Abarca V.H., Alvarado-Camarillo D., Valdez-Aguilar L.A., Sánchez-Ortíz E.A., Gon-zález-Fuentes J.A., Cartmill A.D. Response of strawberry to the substitution of blue light by green light in an indoor vertical farming system. Agronomy, 2023, 13(1): 99 (doi: 10.3390/agron-omy13010099).
- Ma Y., Hu L., Wu Y., Tang Z., Xiao X., Lyu J., Xie J., Yu J. Green light partial replacement of red and blue light improved drought tolerance by regulating water use efficiency in cucumber seedlings. Front. Plant Sci., 2022, 13: 878932 (doi: 10.3389/fpls.2022.878932).
- Rosniza K., Ajit S., Winnie Y.S.P., Joshua Y.L.V., Farahzety A.M., Zulhazmi S., Mohd Abid A. Effect of different LED wavelengths on growth, chlorophyll and anthocyanin content of purple-red pakchoi (Brassica rapa chineensis) in indoor vertical farming. Food Research, 2023, 6(4): 65-70 (doi: 10.26656/fr.2017.6(S4).009).
- Claypool N.B., Lieth J.H. Green light improves photosystem stoichiometry in cucumber seedlings (Cucumis sativus) compared to monochromatic red light. Plants, 2021, 10(5): 824 (doi: 10.3390/plants10050824).
- Goins G.D., Yorio N.C., Sanwo M.M., Brown C.S. Photomorphogenesis, photosynthesis, and seed yield of wheat plants grown under red light-emitting diodes (LEDs) with and without sup-plemental blue lighting. Journal of Experimental Botany, 1997, 48(7): 1407-1413 (doi: 10.1093/jxb/48.7.1407).
- Li H., Tang C., Xu Z., Liu X., Han X. Effects of different light sources on the growth of non-heading Chinese cabbage (Brassica campestris L.). Journal of Agricultural Science, 2012, 4(4): 262 (doi: 10.5539/jas.v4n4p262).
- Tarakanov I.G., Tovstyko D.A., Lomakin M.P., Shmakov A.S., Sleptsov N.N., Shmarev A.N., Litvinskiy V.A., Ivlev A.A. Effects of light spectral quality on photosynthetic activity, biomass production, and carbon isotope fractionation in lettuce, Lactuca sativa L., plants. Plants, 2022, 11(3): 441 (doi: 10.3390/plants11030441).
- Li Y.N., Liu N., Ji F., He D.X. Optimal red:blue ratio of full spectrum LEDs for hydroponic pakchoi cultivation in plant factory. Int. J. Agric. & Biol. Eng., 2022, 15(3): 72-77.
- Saapilin N.S., Yong W.T.L., Cheong B.E., Kamaruzaman K.A., Rodrigues K.F. Physiological and biochemical responses of Chinese cabbage (Brassica rapa var. chinensis) to different light treatments. Chem. Biol. Technol. Agric., 2022, 9: 27 (doi: 10.1186/s40538-022-00293-4).
- Tan T., Li S., Fan Y., Wang Z., Raza M.A., Shafiq I., Wang B., Wu X., Yong T., Wang X., Wu Y., Yang F., Yang W. Far-red light: A regulator of plant morphology and photosynthetic capacity. The Crop Journal, 2022, 10(2): 300-309 (doi: 10.1016/j.cj.2021.06.007).
- Sheerin D.J., Hiltbrunner A. Molecular mechanisms and ecological function of far‐red light sig-nalling. Plant, Cell & Environment, 2017, 40(11): 2509-2529 (doi: 10.1111/pce.12915).
- Kusuma P., Bugbee B. On the contrasting morphological response to far-red at high and low photon fluxes. Front. Plant Sci., 2023, 14: 1185622 (doi: 10.3389/fpls.2023.1185622).
- Van de Velde E., Steppe K., Van Labeke M.C. Leaf morphology, optical characteristics and phytochemical traits of butterhead lettuce affected by increasing the far-red photon flux. Front. Plant Sci., 2023, 14: 1129335 (doi: 10.3389/fpls.2023.1129335).
- Кулешова Т.Э., Галль Н.Р., Удалова О.Р., Панова Г.Г. Многофункциональный комплекс датчиков для фитомониторинга в условиях интенсивной светокультуры. Агрофизика, 2020, 4: 33-39.
- Liu J., van Iersel M.W. Far-red light effects on lettuce growth and morphology in indoor pro-duction are cultivar specific. Plants, 2022, 11(20): 2714 (doi: 10.3390/plants11202714).
- Dou H., Niu G., Gu M. Pre-harvest UV-B radiation and photosynthetic photon flux density interactively affect plant photosynthesis, growth, and secondary metabolites accumulation in basil (Ocimum basilicum) plants. Agronomy, 2019, 9(8): 434 (doi: 10.3390/agronomy9080434).
- Castillejo N., Martínez-Zamora L., Artés-Hernández F. Periodical UV-B radiation hormesis in biosynthesis of kale sprouts nutraceuticals. Plant Physiology and Biochemistry, 2021, 165: 274-285 (doi: 10.1016/j.plaphy.2021.05.022).
- Ермаков Е.И., Панова Г.Г., Черноусов И.Н. Влияние УФ-С радиации на растения и со-путствующую микрофлору. Светотехника, 2004, 5: 22-24.
- He X., He R., Li Y., Liu K., Tan J., Chen Y., Liu X., Liu H. Effect of ratios of red and white light on the growth and quality of pak choi. Agronomy, 2022, 12(10): 2322 (doi: 10.3390/agron-omy12102322).
- Frąszczak B., Kula-Maximenko M. The preferences of different cultivars of lettuce seedlings (Lactuca sativa L.) for the spectral composition of light. Agronomy, 2021, 11(6): 1211 (doi: 10.3390/agronomy11061211).
- Кулешова Т.Э., Желначева П.В., Эзерина Е.М., Вертебный В.Е., Хомяков Ю.В., Панова Г.Г., Кочетов А.А., Синявина Н.Г. Влияние спектрального состава световой среды на фотосинтетические, электро- и морфофизиологические показатели редиса в условиях све-токультуры. Физиология растений, 2024, 71(2): 243-256 (doi: 10.31857/S0015330324020105).
- Кулешова Т.Э., Удалова О.Р., Балашова И.Т., Аникина Л.М., Конончук П.Ю., Мирская Г.В., Дубовицкая В.И., Вертебный В.Е., Хомяков Ю.В., Панова Г.Г. Особенности влияния спектра излучения на продуктивность и биохимический состав тестовых плодо-вых и листовых овощных культур. Журнал технической физики, 2022, 92(7): 1060-1068 (doi: 10.21883/JTF.2022.07.52663.343-21).
- Jayalath T.C., van Iersel M.W. Canopy size and light use efficiency explain growth differences be-tween lettuce and mizuna in vertical farms. Plants, 2021, 10(4): 704 (doi: 10.3390/plants10040704).
- Kang J.H., KrishnaKumar S., Atulba S.L.S., Jeong B.R., Hwang S.J. Light intensity and photo-period influence the growth and development of hydroponically grown leaf lettuce in a closed-type plant factory system. Hortic. Environ. Biotechnol., 2013, 54: 501-509 (doi: 10.1007/s13580-013-0109-8).
- Matysiak B., Ropelewska E., Wrzodak A., Kowalski A., Kaniszewski S. Yield and quality of romaine lettuce at different daily light integral in an indoor controlled environment. Agronomy, 2022, 12(5): 1026 (doi: 10.3390/agronomy12051026).
- Pennisi G., Pistillo A., Orsini F., Cellini A., Spinelli F., Nicola S., Fernandez J., Crepaldi A., Gianquinto G., Marcelis L.F. Optimal light intensity for sustainable water and energy use in indoor cultivation of lettuce and basil under red and blue LEDs. Scientia Horticulturae, 2020, 272: 109508 (doi: 10.1016/j.scienta.2020.109508).
- Gavhane K.P., Hasan M., Singh D.K., Kumar S.N., Sahoo R.N., Alam W. Determination of optimal daily light integral (DLI) for indoor cultivation of iceberg lettuce in an indigenous vertical hydroponic system. Scientific Reports, 2023, 13(1), 10923 (doi: 10.1038/s41598-023-36997-2).
- Kelly N., Choe D., Meng Q., Runkle E.S. Promotion of lettuce growth under an increasing daily light integral depends on the combination of the photosynthetic photon flux density and photo-period. Scientia Horticulturae, 2020, 272: 109565 (doi: 10.1016/j.scienta.2020.109565).
- Palmer S., van Iersel M.W. Increasing growth of lettuce and mizuna under sole-source LED lighting using longer photoperiods with the same daily light integral. Agronomy, 2020, 10(11): 1659 (doi: 10.3390/agronomy10111659).
- Cruz S., Gómez C. Effects of daily light integral on compact tomato plants grown for indoor gardening. Agronomy, 2022, 12(7): 1704 (doi: 10.3390/agronomy12071704).
- Lam V.P., Choi J., Park J. Enhancing growth and glucosinolate accumulation in watercress (Na-sturtium officinale L.) by regulating light intensity and photoperiod in plant factories. Agriculture, 2021, 11(8): 723 (doi: 10.3390/agriculture11080723).
- Kim S., Bok G., Shin J., Park J. Effects of photoperiod and light intensity on the growth and glucosinolates content of three Brassicaceae species in a plant factory. Journal of Bio-Environment Control, 2022, 31(4): 416-422 (doi: 10.12791/KSBEC.2022.31.4.416).
- Martinez-Nolasco C., Padilla-Medina J.A., Nolasco J.J. M., Guevara-Gonzalez R.G., Barranco-Gutiérrez A.I., Diaz-Carmona J.J. Non-invasive monitoring of the thermal and morphometric characteristics of lettuce grown in an aeroponic system through multispectral image system. Ap-plied Sciences, 2022, 12(13): 6540 (doi: 10.3390/app12136540).
- Chen K., Yuan Y., Zhao B., Zhou L., Niu K., Jin X., Gao S., Li R., Guo H., Zheng Y. Digital twins and data-driven in plant factory: an online monitoring method for vibration evaluation and transplanting quality analysis. Agriculture, 2023, 13(6): 1165 (doi: 10.3390/agriculture13061165).
- Wang X., Wu Z., Jia M., Xu T., Pan C., Qi X., Zhao M. Lightweight SM-YOLOv5 tomato fruit detection algorithm for plant factory. Sensors, 2023, 23(6): 3336 (doi: 10.3390/s23063336).
- Liu W., Xu M., Jiang H. Design, integration, and experiment of transplanting robot for early plug tray seedling in a plant factory. AgriEngineering, 2024, 6(1): 678-697 (doi: 10.3390/agriengineer-ing6010040).
- Fukuda H., Wada T. Characteristics of vegetable growing in plant factories and technical issues. In: Plant factory using artificial light /M. Anpo, H. Fukuda, T. Wada (eds.). Elsevier, 2019: 25-31 (doi: 10.1016/b978-0-12-813973-8.00004-x).
- Lubna F.A., Lewus D.C., Shelford T.J., Both A.-J. What you may not realize about vertical farming. Horticulturae, 2022, 8(4): 322 (doi: 10.3390/horticulturae8040322).
- Specht K., Siebert R., Thomaier S., Freisinger U.B., Sawicka M., Dierich A., Henckel D., Busse M. Zero-acreage farming in the city of Berlin: an aggregated stakeholder perspective on potential benefits and challenges. Sustainability, 2015, 7(4): 4511-4523 (doi: 10.3390/su7044511).
- Santamaria P. Nitrate in vegetables: toxicity, content, intake and EC regulation. Journal of the Science of Food and Agriculture, 2006, 86(1): 10-17 (doi: 10.1002/jsfa.2351).
- Kreuger M., Meeuws L., Meeuws G. Applications for breeding and high-wire tomato production in plant factory. In: Smart plant factory /T. Kozai (ed.). Springer, Singapore, 2018: 289-299 (doi: 10.1007/978-981-13-1065-2_18).
- Folta K.M. Breeding new varieties for controlled environments. Plant Biology, 2019, 21(S1): 6-12 (doi: 10.1111/plb.12914).
- Xi L., Zhang M., Zhang L., Lew T.T., Lam Y.M. Novel materials for urban farming. Advanced Materials, 2022, 34(25): 2105009 (doi: 10.1002/adma.202105009).
- Csambalik L., Divéky-Ertsey A., Gál I., Madaras K., Sipos L., Székely G., Pusztai P. Sustain-ability perspectives of organic farming and plant factory systems — from divergences towards synergies. Horticulturae, 2023, 9(8): 895 (doi: 10.3390/horticulturae9080895).
- Awika H.O., Mishra A.K., Gill H., DiPiazza J., Avila C.A., Joshi V. Selection of nitrogen re-sponsive root architectural traits in spinach using machine learning and genetic correlations. Sci-entific Reports, 2021, 11: 9536 (doi: 10.1038/s41598-021-87870-z).
- Egorova K.V., Sinyavina N.G., Artemyeva A.M., Kocherina N.V., Chesnokov Y.V. QTL Analysis of the content of some bioactive compounds in Brassica rapa L. grown under light culture con-ditions. Horticulturae, 2021, 7(12): 583 (doi: 10.3390/horticulturae7120583).
- Артемьева А.М., Синявина Н.Г., Панова Г.Г., Чесноков Ю.В. Биологические особен-ности капустных овощных культур вида Brassica rapa L. при выращивании в интенсив-ной светокультуре. Сельскохозяйственная биология, 2021, 56(1): 103-120 (doi: 10.15389/agrobiology.2021.1.103rus).
- Lejeune P., Fratamico A., Bouché F., Huerga-Fernández S., Tocquin P., Périlleux C. LED color gradient as a new screening tool for rapid phenotyping of plant responses to light quality. Giga-Science, 2022, 11: giab101 (doi: 10.1093/gigascience/giab101).
- Nguyen K.L., Phuong N.T.N., Tuan T.Q., Hang T.T. M. Evaluation of biological traits and bioactive compounds in several spinach varieties (Spinacia oleracea L.) grown in a vertical hydroponic system. Vietnam Journal of Agricultural Sciences, 2023, 6(1): 1699-1710 (doi: 10.31817/vjas.2023.6.1.01).
- Курина А.Б., Железнова К.О., Соловьева А.Е., Синявина Н.Г., Панова Г.Г., Артемь-ева А.М. Изменчивость морфологических и биохимических признаков кресс-салата (Lep-idium sativum L.) из коллекции вир в условиях интенсивной светокультуры. Сельскохозяй-ственная биология, 2023, 58(5): 889-901 (doi: 10.15389/agrobiology.2023.5.889rus).
- Sinyavina N.G., Kochetov A.A., Kocherina N.V., Egorova K.V., Kurina A.B., Panova G.G., Chesnokov Y.V. Breeding approaches for controlled conditions of artificial light culture for small radish and radish (Raphanus sativus L.). Horticulturae, 2023, 9(6): 678 (doi: 10.3390/horticul-turae9060678).


