Светозависимые изменения генерации пероксида водорода и активности пероксидаз проростков пшеницы
Автор: Томилин М.В., Олюнина Л.Н., Веселов А.П.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.7, 2011 года.
Бесплатный доступ
Выявлено участие света в модификации активности пероксидазной ферментной системы внутриклеточного компартмента побегов и корней проростков пшеницы и генерации пероксида водорода. Показано, что в надземных частях проростков свет активирует оксидазную функцию пероксидазы, вызывает накопление пероксида водорода (окислительный взрыв); в корнях - индуцирует равнозначные изменения обеих функций фермента, не вызывая изменения уровня АФК.
Пероксидаза, свет, регуляция
Короткий адрес: https://sciup.org/14323511
IDR: 14323511
Текст научной статьи Светозависимые изменения генерации пероксида водорода и активности пероксидаз проростков пшеницы
Выявлено участие света в модификации активности пероксидазной ферментной системы внутриклеточного компартмента побегов и корней проростков пшеницы и генерации пероксида водорода. Показано, что в надземных частях проростков свет активирует оксидазную функцию пероксидазы, вызывает накопление пероксида водорода (окислительный взрыв); в корнях – индуцирует равнозначные изменения обеих функций фермента, не вызывая изменения уровня АФК.
Известно, что влияние света на обмен веществ опосредовано через систему фоторецепторов, и их возбуждение может вызвать целый каскад реакций, инициирующих изменение активности регулируемых светом генов (соответственно, количества фермента). В работах О.В. Осипенковой (2009) показано, что на ранних этапах деэтиоляции проростков, в условиях резкой смены светового режима экспрессируются ядерные гены стрессовых белков, в частности ELIP, которые играют важную роль в защитных реакциях растений в ответ на действие стрессоров. Биотические и абиотические стрессоры индуцируют накопление активных форм кислорода (АФК), вызывая активацию специфических ферментов, в частности пероксидаз (ПО). Отличительной чертой всех ПО является их полифункциональность, участие в таких биохимических реакциях как оксидазное, пероксидазное и оксигеназное окисление субстратов, что позволяет предполагать активное участие их в контроле уровня АФК и, как следствие, процессов роста, механизмов формирования реакций растений на действие экологических факторов, один из которых – свет (Андреева, 1988; Савич, 1989).
Цель настоящей работы – выявить влияние света на функциональную активность пероксидазной ферментной системы внутриклеточного компартмента побегов и корней проростков пшеницы.
МАТЕРИАЛЫ И МЕТОДЫ
В опытах были использованы проростки яровой пшеницы Triticum aestivum L. сорта «Московская 35» (водная культура), выращенные в темноте. Шестидневные этиолированные проростки помещали под люминесцентные лампы (10 000 лк), продолжительность экспозиции составляла 5, 10, 15 мин; в качестве контроля использовали растения, не экспонированные на свету. Растительный материал в присутствии нерастворимого поливинилпирролидона фиксировали жидким азотом и гомогенизировали в 0,06 М фосфатном буфере (рН 8.0), отношение массы навески к объёму буфера 1:4. Цитоплазматическую фракцию получали центрифугированием гомогената (7000 об/мин, 15 мин). Концентрирование пероксидазного белка осуществляли высаливанием (NH 4 ) 2 SO 4 (70-95% насыщения).
Определение концентрации гемсодержащих белков (ГСБ) проводили спектрофотометрическим методом при 403 нм (спектрофотометр UV-1700 Shimadzu, Япония). Активность исследуемых ферментов в цитоплазматических фракциях побегов и корней проростков пшеницы оценивали спектрофотометрически в момент линейного протекания реакции. Активность бензидин-ПО (БПО) определяли при 590 нм, гваякол-ПО (ГПО) при 470 нм (Гавриленко и др., 1975), аскорбат-ПО (АПО) при 265 нм (Досон и др., 1991). Состав реакционной смеси: 0.5 мл исследуемой пробы, 1.5 мл 0,2 М ацетатного буфера (рН 5.4), 0.5 мл 0.015 % Н2О2 и 0.5 мл 5 мМ 4.4’-диаминодифенила (ε590=39 мМ-1см-1) или 0.5 мл 0.05% гваякола (ε470=26,6*103 М-1см-1) или 0.5 мл 2.5 мМ аскорбата (ε265=7 мМ-1см-1). НАД(Ф)Н-ПО активность регистрировали по уменьшению поглощения при 340 нм. В кювету вносили 0.5 мл исследуемой пробы, 1 мл 0.2 М ацетатного буфера (рН 5.4), 0.5 мл 16 мМ MnCl2, 0.5 мл 1.6 мМ о-кумаровой кислоты и 0.5 мл 0.3 мМ НАДН (ε340=4,23 мМ-1см-1) или 0.5 мл 0.3 мМ НАДФН (ε340=6.22*103 М-1см-1) (Fecht-Christoffers et all., 2006). Активность ИУК-ПО определяли при 254 нм (Loukili et all., 1999). Состав реакционной смеси: 0.5 мл АОР, 1 мл 0.2 М ацетатного буфера (рН 5.4), 0.5 мл 16 мМ MnCl2, 0.5 мл 0.1 мМ р-кумаровой кислоты и 0.5 мл 0.6 мМ ИУК (ε254=18,7 мМ-1см-1). Активность исследуемых ферментов выражали в ммоль субстрата/мин на 1 мг ГСБ. Содержание гидропероксидов (R-OOH) оценивали по реакции с роданистым аммонием (Курганова и др., 1997). Белок АОР осаждали 50% ТХУ (конечная концентрация 7%). После центрифугирования объём надосадочной жидкости доводили до 10 мл этанолом. К равным объемам добавляли 0.2 мл концентрированной HCl и 0.012 мл 5% соли Мора в 3% HCl. Для развития окраски в пробы вносили 0.5 мл 20% роданистого аммония. Оценку R-OOH производили через 10 мин спектрофотометрически против контроля (этанол) при 480 нм. Содержание гидропероксидных группировок выражали в нмоль/мг белка. Количество белка определяли по методу Lowry.
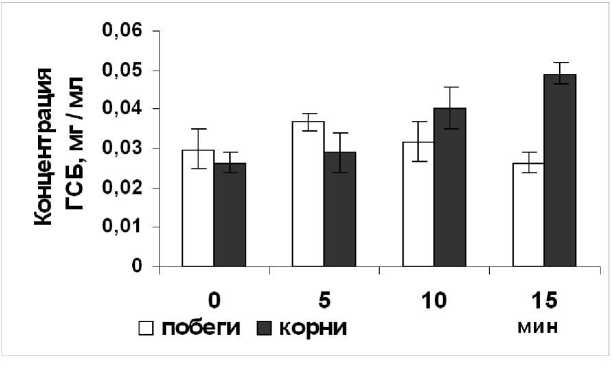
Рисунок 1. Изменение уровня гемсодержащего белка в цитоплазматической фракции побегов и корней в процессе деэтиоляции проростков пшеницы.
Таблица 1 : Уровень активности пероксидазной ферментной системы цитоплазматической фракции побегов и корней проростков пшеницы.
|
Исследуемый орган |
Активность исследуемых ферментов, ммоль / мг ГСБ * мин |
|||||
|
БПО |
ГПО |
АПО |
НАДН-ПО |
НАДФН-ПО |
ИУК-ПО |
|
|
ПОБЕГИ |
23,629±0,231 |
0,005±0,1*10-3 |
0,155±0,013 |
1,067±0,149 |
0,006±0,5*10-3 |
2,489±0,403 |
|
КОРНИ |
21,921±0,111 |
0,002±0,29*10-3 |
0,047±0,007 |
0,285±0,056 |
0,011±0,001 |
3,855±0,514 |
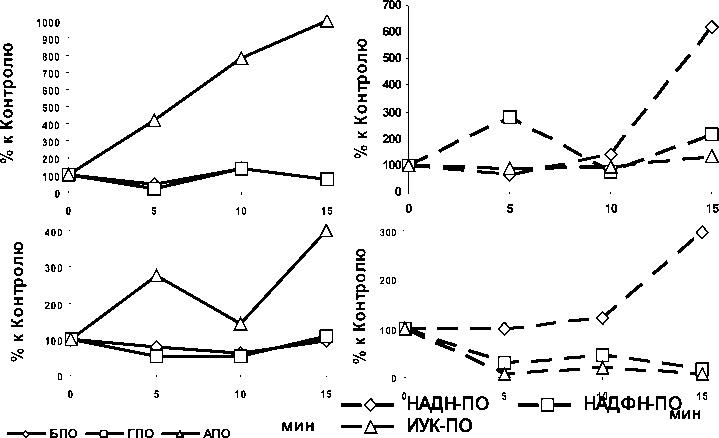
Рисунок 2. Изменение активности пероксидазной ферментной системы в цитоплазматической фракции побегов и корней в процессе деэтиоляции проростков пшеницы.
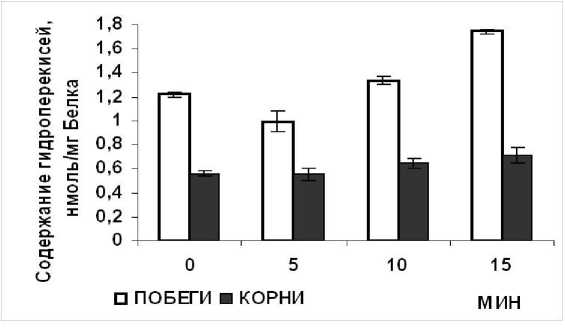
Рисунок 3. Динамика генерации уровня гидропероксидных группировок в цитоплазматической фракции побегов и корней в процессе деэтиоляции проростков пшеницы.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В наших исследованиях кратковременное действие света (5–15 мин) на этиолированные проростки индуцировало разнонаправленное изменения уровня ГСБ во внутриклеточном компартменте побегов и корней (Рис 1). Свет вызывал плавное повышение уровня белка в цитоплазматической фракции корней (в 1.3 раза)
и уменьшение его содержания (в 1.9 раза) в надземных органах опытных проростков. Поскольку известно, что растительные ПО являются секретируемыми ферментами (Schloss et all., 1987), в связи с этим выявленные светозависимые изменения уровня ГСБ в цитоплазматическом компартменте, по-видимому, могли быть связаны с перераспределение пероксидазного белка
(модификация процессов экзо- и эндоцитоза низкомолекулярных белков). Данный эффект света, возможно, является следствием активирования или ингибирования процессов транспорта ГСБ между клеточными компартментами. При этом характер таких модификаций может различаться в побегах и корнях исследуемых проростков пшеницы.
Пероксидаза специфична к субстратам различной природы. Для взаимодействия фермента с молекулой субстрата, последняя должна иметь две структурные особенности: специфическую химическую связь, которую фермент атакует и функциональную группу, ориентирующую молекулу субстрата в активном центре фермента (Граскова, Войников, 2009). Субстраты классических пероксидаз растений принято дифференцировать на 3 группы. К первой относят двухэлектронные доноры, для которых главным является связывание вблизи или проникновение внутрь активного центра. Вторая группа - одноэлектронные ароматические субстраты, которые связываются вблизи активного центра. Третья группа – это субстраты, окисляющиеся по цепи переноса электронов (ABTS, ИУК, НАД(Ф)Н и др.) (Газарян и др., 2006). Таким образом, фермент имеет две различные функции (оксидазную и пероксидазную), что позволяет предполагать в каталитическом действии пероксидазы участие двух независимых активных центров, пространственно разделенных, хотя и близко расположенных друг от друга на молекуле фермента (Gibson, Liu, 1978).
На основе результатов, представленных в табл. 1, можно предположить, что основной пул внутриклеточной антиоксидантной активности ПО сосредоточен в побегах, а прооксидантной
(оксидазная функция ПО) в корнях проростков пшеницы. Следует отметить, что исследуемые органы, вероятно, отличаются и по локализации в цитоплазматической фракции отдельных форм ПО. Так, в надземных органах выявлен повышенный уровень БПО, ГПО, АПО и НАДН-ПО активности, а НАДФН-ПО и ИУК-ПО активности были характерны для корней проростков пшеницы. Таким образом, в цитоплазматической фракции исследуемых органов проростков, возможно, имеет место специфическая направленность окислительновосстановительных реакций.
Как следует из результатов, представленных на рис. 2, в процессе деэтиоляции в побегах и корнях проростков пшеницы происходили колебательные изменения активности пероксидазной ферментной системы цитоплазматического компартмента. В корнях и побегах проростков пшеницы свет стимулировал активность АПО через 5 мин в 2.8-4.2, а при 15минутной деэтиоляции соответственно в 4-10 раза. При этом активность других антиоксидантных (БПО, ГПО) форм ПО были снижены, в частности, уже через 5 мин после воздействия света отмечалось уменьшение активности данных форм ПО в 2-4.7 раза. Динамика оксидазной активности фермента (кроме НАДН-ПО) в процессе деэтиоляции (в побегах и корнях проростков пшеницы) была разнонаправленной. В частности, активность прооксидантных (НАДФН-ПО, ИУК-ПО) форм ПО цитоплазматической фракции корней была снижена: максимум уменьшения (в 5.9-17.8 раз) зафиксировано при 15-минутном экспонировании проростков на свету; в побегах повышена. Следует так же отметить, что модифицирующее действие света на активность
НАДН-ПО побегов и корней реализовалась в повышении активности данной формы при 15минутной деэтиоляции. Таким образом, в исследуемых органах проростков пшеницы свет избирательно модифицировал ПО: нарастание прооксидантной (оксидазная функция всех исследованных форм ПО) в побегах, а в корнях только одну из форм - НАДН-ПО. В последнее время в литературе активно обсуждается роль ПО не только в утилизации перекиси водорода, но и в её образовании, а также в образовании супероксид-анион-радикала. Установлены новые механизмы функционирования ПО, во многом связанные с изучением «гидроксильного» каталитического цикла с участием «соединения III» и генерацией АФК (Passardi et all., 2004). Можно предположить, что в наших исследованиях, свет, оказывая направленное воздействие на пероксидазную систему, мог в цитоплазматической фракции побегов проростков пшеницы индуцировать окислительный взрыв, а в корнях, скорее всего, происходящие равнозначные изменения как оксидазной, так и пероксидазной активности – одна из причин поддержания окислительного гомеостаза, его стабилизация.
Полученные результаты (Рис. 3) отражают изменения уровня АФК, в частности, содержание R-OOH во внутриклеточном компартменте деэтиолированных проростков. Через 5 мин после воздействия свет обратимо уменьшал уровень R-OOH в 1.2 раза в цитоплазматической фракции побегов, и не оказывал воздействия на количество R-OOH в корнях опытных проростков. Интересно отметить, что далее при 15 минутном световом воздействии уровень R-OOH надземных органов увеличивался в 1.4 раза, а для корней – находился вблизи контроля.
Таким образом, свет, оказывая непосредственное влияние на надземные органы проростков, индуцировал в цитоплазматическом компартменте побегов накопление R-OOH (окислительный взрыв); реакция корней в этих условиях, по-видимому, не может быть отнесена к стрессорной.
Работа выполнена при финансовой поддержке ФЦП «Научные и научнопедагогические кадры инновационной России» на 2009–2013 гг. (Государственный контракт № 14.740.11.0732 от 12.10.2010).
Список литературы Светозависимые изменения генерации пероксида водорода и активности пероксидаз проростков пшеницы
- Андреева В.А. Фермент пероксидаза. М., 1988. 127 с.
- Гавриленко В.Ф., Ладыгина М.Е., Хандобина Л. М. Большой практикум по физиологии растений. М.: Высшая школа, 1975. 327 с.
- Газарян И.Г. Хушпульян Д.М., Тишков В.И. Особенности структуры и механизма действия пероксидаз растений//Успехи биол. химии. 2006. Т. 46. С. 303-322
- Граскова И.А., Войников В.К. Слабосвязанные с клеточной стенкой пероксидазы и их участие в защитных механизмах растений//Устойчивость организмов к неблагоприятным факторам внешней среды: Материалы всероссийской научной конференции, 24-28 августа 2009г. -Иркутск: НЦ РВХ ВСНЦ СО РАМН, 2009. С. 105-10
- Досон Р., Элиот Д., Элиот У., Джонс К. Справочник биохимика. М.: Мир, 1991. 544 с.
- Курганова Л.Н., Веселов А.П., Гончарова Т.А., Синицына Ю.В. Перекисное окисление липидов и антиоксидантная система защиты в хлоропластах гороха при тепловом шоке//Физиол. раст. 1997. Т. 77, № 5 С. 725-730
- Осипенкова О.В. Роль ретроградных пластидных сигналов в экспрессии ядерных генов стрессовых белков ELIP1 и ELIP2 у Arabidopsis thaliana. Автореф. дисс. канд. биол. Москва. 2009. 26 с.
- Савич И. М. Пероксидазы -стрессовые белки растений//Успехи современной биологии 1989. Т. 107. С. 406-417
- Fecht-Christoffers M.M., Führs H., Braun Hans-Peter, Horst W.J. The role of hydrogen peroxide-producing and hydrogen peroxide-consuming peroxidases in the leaf apoplast of cowpea in manganese tolerance//Plant Physiology. 2006. V. 140. P. 1451-1463
- Gibson D.M. Liu E.V. Substrate specification of peroxidase isozymes in the developing pea seedling//Ann. Bot. 1978. V. 42. P. 1075-1083
- Loukili A., Limam F., Ayadi A., Boyer N., Ouelhazi L. Purification and characterization of a neutral peroxidase induced by rubbing tomato internodes//Physiol. Plant. 1999. V.105. P. 24-31.
- Passardi F., Penel C., Dunand C. Performing paradoxical: how plant peroxidases modify the cell wall//Trends in Plant Science. 2004. V. 9. P. 534-540
- Schloss P., Walter C., Mader M. Basic peroxidases in isolated vacuoles of Nicotiana tabacum L.///Planta. 1987. V. 170. P. 225-235


