Связь иммунологических показателей с эффективностью неоадъювантной химиотерапии у больных раком молочной железы
Автор: Кухарев Я.В., Стахеева Марина Николаевна, Дорошенко Артем Васильевич, Литвяков Николай Васильевич, Бабышкина Наталья Николаевна, Слонимская Елена Михайловна, Чердынцева Надежда Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (56), 2013 года.
Бесплатный доступ
Экспериментальные и клинические данные свидетельствуют о том, что иммунная система при воздействии конвенциональной противоопухолевой химиотерапии вовлекается в реализацию противоопухолевого эффекта. В работе проведена оценка взаимосвязи иммунологических параметров с эффективностью неоадъювантной химиотерапии (НАХТ) у больных раком молочной железы. В исследование включены 269 больных раком молочной железы (РМЖ) T 1-4M 0 стадии и 24 практически здоровые женщины N0-3сопоставимого возраста. Проведена оценка субпопуляционного состава мононуклеаров крови, их функциональной активности, маркеров апоптоза, аллельного полиморфизма генов цитокинов в зависимости от наличия или отсутствия клинического ответа на НАХТ. Полная регрессия опухоли была сопряжена с повышением числа цитотоксических CD8+-клеток, высокой функциональной активностью лимфоцитов (пролиферация в ответ на митоген, секреция цитокинов TNFα, IL-1β и IL-10, IFN-γ) и нейтрофилов. Выявлена сопряженность функционально высокоактивных генотипов цитокинов и высокой секреции цитокинов клетками крови с объективным клиническим ответом на химиотерапию. Таким образом, полученные данные свидетельствуют о том, что объективный клинический ответ на НАХТ связан со структурной и функциональной сохранностью иммунной системы, при этом важное значение имеют конститутивные характеристики организма больного, обусловливающие уровень экспрессии патогенетически значимых цитокинов, играющих ключевую роль в функционировании иммунной системы.
Рак молочной железы, неоадъювантная химиотерапия, иммунная система, цитокины, генетический полиморфизм
Короткий адрес: https://sciup.org/14056768
IDR: 14056768 | УДК: 618.19
Текст научной статьи Связь иммунологических показателей с эффективностью неоадъювантной химиотерапии у больных раком молочной железы
Использование неоадъювантной химиотерапии (НАХТ) при комбинированном лечении рака молочной железы (РМЖ), обеспечивает возможность выполнения органосохранных операций, выбрать адекватное лекарственное лечение в адъювантном режиме, а также, в случае полной морфологической регрессии опухоли, улучшить отдалённые результаты лечения [11, 12, 19]. Эффективность химиотерапии в существенной мере определяется свойствами опухоли, а именно наличием соответствующих молекулярных мишеней, уровнем экспрессии генов множественной лекарственной устойчивости, адекватностью функционирования механизмов репарации ДНК и апоптоза [2, 22, 27, 33].
В последние годы активно обсуждается вовлечение иммунологических механизмов в обеспечение эффективности ХТ, получены экспериментальные и клинические подтверждения этого феномена. С одной стороны, известно, что клетки иммунной системы являются важным компонентом опухолевого микроокружения, вносящего значимый вклад не только в формирование и прогрессию злокачественных опухолей, но и в обеспечение резистентности к химиотерапии. С другой стороны, показана возможность изменения функционирования компонентов микроокружения с проопухо-левой на противоопухолевую направленность. В качестве факторов, способных индуцировать такие изменения микроокружения, которые приводят к ингибиции роста опухоли, рассматриваются химиотерапия, метрономная терапия, эпигенетическая терапия и ряд других методов [20, 28, 29]. Выявлена высокая значимость изменения экспрессии генов иммунного ответа в опухолевом микроокружении в предсказании эффективности НАХТ, что указывает на участие иммунокомпетентных клеток в реализации противоопухолевого эффекта терапии [15, 16, 28]. Есть сведения, что чувствительность к химиотерапии регулируется макрофагами и лимфоцитами, инфильтрирующими опухоль, при этом уровень СD8+ Т-клеток является предсказательным критерием ответа опухоли [14, 29].
Получены убедительные данные о том, что иммунная система при воздействии конвенциональной противоопухолевой химиотерапии активируется посредством повышения иммуногенности опухолевых клеток, за счет появления на их мембранах неоантигенов и других сигнальных моле- кул в результате повреждения ДНК, ингибиции иммуносупрессорных механизмов, прямого или опосредованного стимулирующего воздействия на иммунные эффекторы [21, 28, 29, 35]. Индуцированная цитостатиками транзиторная лимфопения, по механизму обратной связи, запускает гомеостатическую пролиферацию иммунокомпетентных клеток с отменой опухоль-индуцированной анергии, связанной в том числе с элиминацией иммуносупрессорных Т регуляторных клеток [23, 32]. При этом достигается повышение эффективности лечения [17, 35].
Поскольку иммунокомпетентные клетки поступают в опухолевое микроокружение из пула циркулирующих клеток крови, их конститутивные особенности (способность к пролиферации и секреции цитокинов, чувствительность к апоптозу), очевидно, влияют на реализацию функциональной активности при взаимодействии с опухолевыми клетками. Наряду с этим важная роль иммунной системы в поддержании гомеостаза в условиях повреждающих воздействий различной природы, в том числе и к химиотерапии, предполагает возможность использования ее параметров в качестве дополнительных критериев предсказания эффективности лекарственного лечения [10].
Все вышесказанное делает перспективным изучение роли иммунной системы в реализации противоопухолевого эффекта химиотерапии и оценки возможности использования иммунологических параметров в качестве дополнительных предсказательных критериев.
Цель исследования – оценить взаимосвязь иммунологических параметров с эффективностью неоадъювантной химиотерапии у больных раком молочной железы.
Материал и методы
Исследование проведено с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан». Получено разрешение локального комитета по биомедицинской этике ФГБУ «НИИ онкологии СО РАМН» и информированное согласие пациенток. В исследование включены 269 больных РМЖ T1–4N0–3M0 стадии (средний возраст – 49,1 ± 8,5 года) и 24 практически здоровые женщины сопоставимого возраста (группа контроля). Пациентки в неоадъювантном режиме получали 2–4 курса химиотерапии по схемам
CMF (5-фторурацил, метотрексат, циклофосфан); FAC (5-фторурацил, адриамицин; циклофосфан), после НАХТ проводилась операция в объеме радикальной мастэктомии, радикальной резекции или секторальной резекции с аксиллярной лимфаденэктомией, а также по показаниям – адъювантная химитерапия, лучевая терапия или гормональное лечение. Эффективность НАХТ оценивалась по результатам клинических, инструментальных и морфологических исследований, согласно рекомендациям ВОЗ.
До начала лечения у 131 пациентки оценивались следующие иммунологические параметры: гемограмма; субпопуляционный состав лимфоцитов (иммуноцитохимический метод с использованием моноклональных антител к антигенам CD3, CD4, CD8, CD72, CD25, CD95, HLA-DR («NovoCastra», Великобритания), CD16 («DAKO», Дания), CD95L («BD Biosciences», США); концентрация сывороточных иммуноглобулинов (Ig) классов A, M, G методом радиальной иммунодиффузии по Манчини; концентрация в сыворотке растворимого Fas-рецептора и Fas-лиганда методом ELISA («Bender MedSystems», Австрия). Спонтанную и стимулированную митогенами (ФГА и ЛПС) пролиферативную активность мононуклеарных клеток периферической крови (МНПК) оценивали по включению радиоактивной метки (3Н-тимидин) с последующей регистрацией на сцинтилляционном счётчике («Wallac», Голландия). Рассчитывался индекс стимуляции (ИС) как отношение уровня митогенстимулированной к уровню спонтанной пролиферации клеток. Спонтанную и стимулированную митогенами (ФГА или ЛПС) секрецию интерлейкинов (IL)-1β, IL-4, фактора некроза опухоли-α (TNFα), интерферона-γ (IFNγ) в культуре МНПК определяли методом ИФА с использованием тест-систем производства ЗАО «Вектор-Бест» (Россия), IL-2 и IL-10 – с использованием тест-систем ООО «Цитокин» (Россия). Функциональную активность нейтрофилов определяли по их способности генерировать активные формы кислорода (АФК) в реакции восстановления нитросинего тетразолия («ДиаМ», Германия) (НСТ-тест) [6]. Оценку апоптоза мононуклеарных клеток периферической крови осуществляли методом суправитального окрашивания с использованием флюоресцентного красителя Hoechst 33342 [34].
Для оценки связи полиморфизма генов цитокинов с эффективностью НАХТ проводили анализ полиморфных вариантов специфических участков генома с использованием методов полимеразной цепной реакции и анализа полиморфизма длин рестрикционных фрагментов, используя специфическую структуру праймеров и соответствующие ферменты рестрикции («СибЭнзим», г. Новосибирск). Выделение геномной ДНК из венозной крови осуществляли стандартным методом фенолхлороформной экстракции. Продукты рестрикции разделяли с помощью электрофореза в 2 % агарозном геле, содержащем 0,5 мг/мл бромида этидия, и визуализировали в УФ-свете.
Статистическую обработку полученных результатов проводили с помощью стандартного пакета прикладных программ STATISTICA for Windows 6.0 (StatSoft Inc., США). Для оценки значимости различий средних значений показателей выборок использовался непараметрический критерий Манна–Уитни. При анализе частотных характеристик использовали стандартный критерий χ2 и Фишера. Для оценки силы ассоциации генотипов с эффективностью НАХТ рассчитывали значение критерия отношения шансов (OR). Обсуждаются результаты с достоверностью различий при р<0,05 и с тенденцией различий при 0,05<р<0,1.
Результаты и обсуждение
Лифмогенная распространенность рассматривается в качестве основного фактора прогноза клинического течения РМЖ [18]. С другой стороны, лимфатические узлы являются основным локусом осуществления иммунного ответа, и их метастатическое поражение, очевидно, может снижать его эффективность. Поэтому вначале мы проанализировали взаимосвязь эффекта НАХТ с этим параметром, отражающим сохранность или нарушение структурной организации регионарных лимфоузлов. У больных без лимфогенных метастазов (N0) в 60 % случаев регистрировался объективный ответ на НАХТ, тогда как у пациентов с вовлечением лимфоузлов в злокачественный процесс ответ на ХТ отмечен в 39 % (р=0,03). При этом ни у одного больного с высокой степенью поражения N3 не наблюдалось объективного клинического ответа на НАХТ (табл. 1).
Мы выявили особенности параметров иммунитета у пациентов в зависимости от степени вовлечения лимфоузлов в злокачественный процесс. У больных без регионарных метастазов наблюдалась значимо более высокая спонтанная секреция TNF-α мононуклеарными клетками крови по сравнению с пациентами, имеющими метастазы в лимфоузлы (рис. 1). Высокая степень метастатического поражения регионарных лимфоузлов (N2–3) сопровождалась увеличением относительного и абсолютного количества циркулирующих NK-клеток и лимфоцитов, несущих на мембранах маркеры активации CD95 и CD25 (рис. 1). Экспрессия указанных маркеров свидетельствует о терминальной функциональной дифференцировке и выходе клеток из пула потенциальных эффекторов в связи с их апоптотической гибелью [1].
Анализируя результаты иммунологического обследования, полученные при делении когорты больных на группы с разной эффективностью НАХТ, мы выявили, что эффективность НАХТ была также связана с характеристиками иммунологических лабораторных параметров, зарегистрированными до лечения. Полная регрессия опухоли была сопряжена со смещением соотношения субпопуляций Т-лимфоцитов (CD4/CD8) в сторону повышения количества цитотоксических CD8+-клеток и высокой концентрацией IgG в сыворотке крови (табл. 2). Функциональная активность нейтрофилов у этих пациентов сохранялась на уровне здоровых лиц. Способность к повышению пролиферативной активности лимфоцитов в ответ на ФГА у больных с полной регрессией опухоли после НАХТ не отличалась от таковой здоровых доноров, тогда как во всех других группах больных она была существенно ниже (табл. 2).
У пациенток с полной регрессией опухоли также зарегистрировано повышение показателя, характеризующего процесс апоптоза (FasL несущие лимфоциты, CD95L+) (табл. 2). Активированные естественные киллеры и Т-лимфоциты экспрессируют FasL, который выступает как эффекторная молекула цитотоксических клеток, а растворимый FasL рассматривается в качестве индуктора апоптоза. Эти изменения указывают
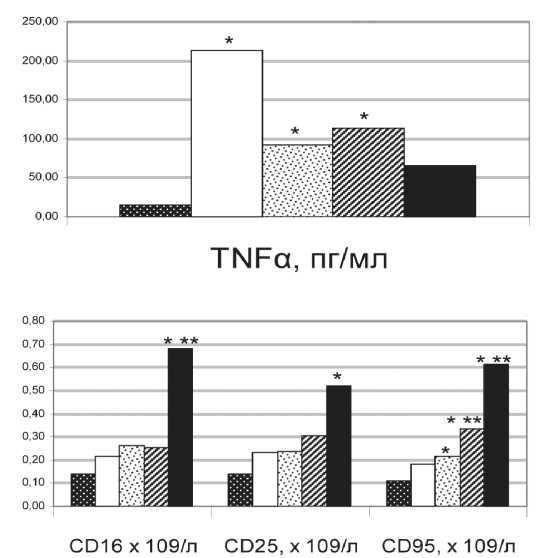
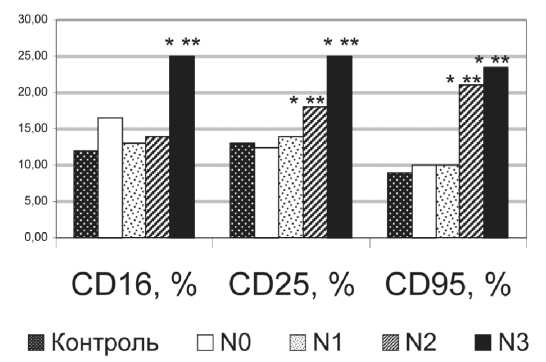
Рис. 1. Иммунологические показатели больных РМЖ с различной степенью поражения регионарных лимфатических узлов.
Примечание: * – значимые различия между подгруппой больных и здоровых доноров (p<0,05);
** – значимые различия с подгруппой больных без метастазов (p<0,05)
Таблица 1
Лифмогенная распространенность опухоли у больных рМж с наличием или отсутствием объективного ответа на наХТ
Таблица 2
|
Исследованные показатели |
Эффективность НАХТ |
Здоровые доноры (n=24) |
|||
|
Полная регрессия (n=9) |
Частичная регрессия (n=52) |
Стабилизация (n=56) |
Прогрессирование (n=14) |
||
|
CD4/CD8 |
0,87(0,76;0,94)* |
1,32 (0,77;1,77) |
1,16 (0,86;1,43) |
1,12 (0,68;1,63) |
1,19 (1,07;1,46) |
|
IgG, г/л |
21,00 (17,10;25,60)* |
13,90 (10,70;19,00)** |
16,10 (12,30;20,40) |
13,25 (9,80;17,10)** |
12,40 (9,50;16,55) |
|
IL-10, пг/мл |
94,70(34,20;241,00) |
42,85 (3,80;212,30) |
14,70 (0,00;141,00) |
8,95 (3,65;14,25)** |
20,40 (4,80;54,90) |
|
IL-10ст, пг/мл |
269,60(134,65;369,15) |
129,00 (32,40;698,00) |
17,25 (7,10;132,70)** |
17,10 (11,40;77,10)** |
47,10 (14,20;245,80) |
|
IL-1, пг/мл |
2914,00(784,00;5528,00)* |
209,00(100,00;1300,00)** |
235,00(119,00;1025,00)** |
727,50(253,50;3000,50) |
344,50 (146,00;1224,00) |
|
TNF-α, пг/мл |
558,50 (55,00;3140,00) * |
127,15(15,00;425,70) * |
105,50 (59,00;450,00) * |
42,00 (6,00;259,00) |
15,65 (1,70;52,00) |
|
CD95L, % |
24,00 (20,50;38,00)* |
17,00 (9,00;30,00) |
23,00 (11,00;41,00) |
19,50 (14,00;31,00) |
17,00 (12,00;21,00) |
|
CD16, % |
10,00(9,00;14,00) |
14,00(7,00;21,00) |
16,00(10,00;22,00) |
19,00(18,00;23,00)* |
12,00 (10,00;16,00) |
|
CD16, ×109/л |
0,21 (0,12;0,52) |
0,22 (0,10;0,31) |
0,29 (0,18;0,43) * |
0,29 (0,26;0,49) * |
0,14 (0,08;0,29) |
|
ФР % |
34,00(19,00;41,00) |
45,00(18,00;60,00)* |
33,00(23,00;50,00)* |
33,00(22,00;52,00)* |
17,00 (8,00;29,50) |
|
ИРФР, у.е |
35,00(26,00;67,00) |
63,00(27,00;95,00)* |
58,00(28,00;87,00)* |
55,00(33,00;69,00)* |
23,50 (12,00;45,50) |
|
Пролиф. ФГА, имп./мин |
27808,50 (8979,50;42456,00) |
19713,50 (7715,00;50890,00) * |
19232,50 (7885,00;42502,00)* |
11536,00 (7763,00;40138,00)* |
31837,00 (22023,00; 57041,00) |
|
IL-4, пг/мл |
7,60 (0,00;18,90) |
7,30 (0,00;16,70) |
2,70 (0,00;16,90) |
7,05 (3,50;9,50) * |
12,20 (9,90;14,30) |
|
Лейкоциты, ×109/л |
5,40 (4,35;6,85) |
5,90 (4,60;8,15) |
5,80 (4,95;7,30) |
5,90 (5,00;6,80) |
5,40 (4,20;6,40) |
|
Лимфоциты, ×109/л |
1,68 (1,49;2,43) |
1,74 (1,29;2,30) |
1,63 (1,35;2,25) |
1,47 (1,39;2,23) |
1,40 (0,76;1,87) |
|
CD25, ×109/л |
0,34(0,24;0,51)* |
0,18 (0,10;0,44) |
0,30 (0,14;0,49) * |
0,24 (0,14;0,32) |
0,14 (0,09;0,25) |
|
CD3, ×109/л |
0,89 (0,64;1,39) |
0,88 (0,58;1,19) |
0,80 (0,62;1,18) |
0,73 (0,66;1,02) |
0,78 (0,41;1,02) |
|
CD8, ×109/л |
0,50 (0,24;0,77) |
0,41 (0,26;0,56) |
0,40 (0,26;0,55) |
0,46 (0,31;0,62) |
0,30 (0,15;0,51) |
|
CD72, ×109/л |
0,39(0,33;0,42)* |
0,26(0,17;0,37)* |
0,29 (0,20;0,47) * |
0,39 (0,20;0,48) * |
0,13 (0,07;0,26) |
Иммунологические показатели больных рМж (до лечения) в зависимости от эффективности наХТ (Ме[Q1;Q3])
Примечание: * – значимые различия между подгруппой больных и здоровых доноров (p<0,05); ** – значимые различия с подгруппой больных с полной регрессией опухоли (p<0,05).
направленностью функционирования клеток иммунной системы.
Для уточнения роли иммунологических факторов в реализации эффекта НАХТ мы сформировали подгруппу пациенток с наиболее благоприятными клиническими характеристиками, исключив из группы с полной регрессией опухоли больных с лимфогенными метастазами. Оказалось, что у пациентов c N0 и с полной регрессией опухоли, указанные выше особенности иммунного статуса сохранялись и был также отмечен более высокий уровень стимулированной секреции TNFα, IL-1β и спонтанной – интерферона (IFN)-γ (данные не представлены). IFN-γ является маркером поляризации лимфоцитов в Т-хелперы 1-го типа, осуществляющие цитотоксические функции в процессе адаптивного иммунного ответа, в том числе и в отношении опухолевых клеток.
Несмотря на то, что IL-10 характеризуется как иммуносупрессорный цитокин [11, 24], есть экспериментальные данные о том, что IL-10 может реализовать противоопухолевую активность посредством активации внутриопухолевых цитотоксических CD8+-лимфоцитов, увеличения экспрессии ими гранзимов – эффекторных молекул цитотоксических Т-лимфоцитов и натуральных киллеров, или опосредованно, стимулируя продукцию IFN-γ Т-хелперами-1 и экспрессию молекул, представляющих опухолевые антигены, обеспечивая формирование адаптивного иммунного ответа [26]. Кроме того, есть данные, что он проявляет антиангиогенные свойства, приводящие к регрессии опухоли [9, 31].
Можно полагать, что повышенная способность к секреции цитокина IL-10 у больных с регрессией опухоли на фоне выраженной провос-палительной направленности иммунных реакций (высокие показатели TNFα и IL-1β) может играть компенсаторно-охранительную роль для иммунной системы, подвергающейся воздействию НАХТ, одновременно внося вклад в элиминацию опухоли. Цитокины выступают в роли универсальных медиаторов межклеточных взаимодействий, в том числе между иммунной системой и опухолью [5]. Многие из них обладают прямой противоопухолевой активностью или регулируют ответ иммунной системы на опухоль и могут рассматриваться в качестве «естественных адъювантов» иммунных реакций. Влияние цитокинов на иммуноопосредованные
процесса
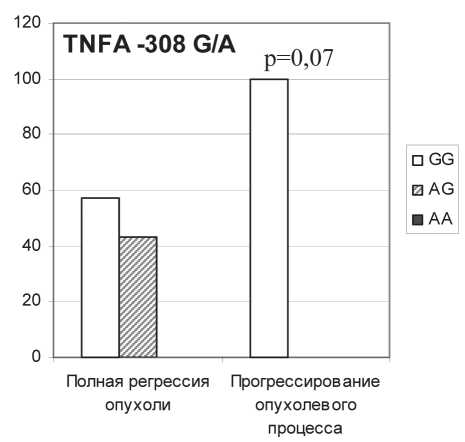
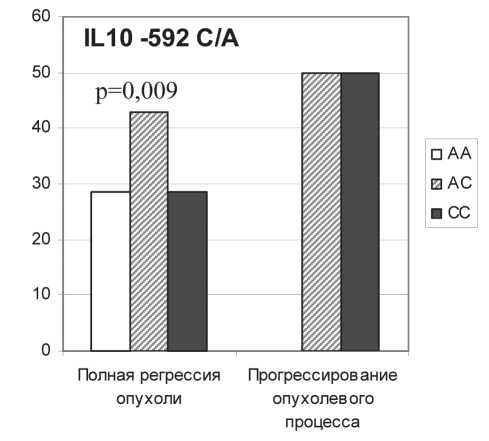
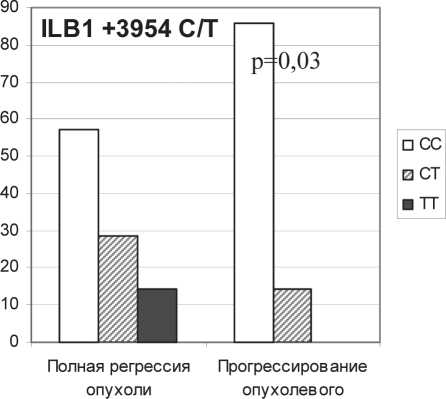
Рис. 2. Ассоциация эффективности НАХТ с полиморфизмом генов цитокинов
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 2 (56)
процессы существенно зависит от количественных характеристик, которые связаны с наличием того или иного полиморфного варианта гена, кодирующего определенный уровень продукции цитокина. Предположив, что высокая продукция цитокинов, выявленная у пациенток с клинически благоприятным ответом на НАХТ (регрессия опухоли), может быть обусловлена генетически, мы провели исследование ассоциации полиморфизма генов цитокинов с эффективностью НАХТ у 269 больных РМЖ.
Установлено, что 86 % больных, для которых отмечено прогрессирование опухоли после НАХТ, несут СC генотип гена IL1В (IL1B +3954 C/T полиморфизм), ассоциированный с низкой экспрессией цитокина, в то время как ТТ-генотип, обеспечивающий высокий уровень экспрессии гена IL1B [4, 13], среди пациентов этой группы не встречался (рис. 2). В то же время более 42 % пациентов с полной регрессией являются носителями Т-аллеля, при этом полная регрессия опухоли ассоциировалась с высокой секрецией IL-1β клетками крови (табл. 2).
Высокая секреция TNFα МНПК была сопряжена с полной регрессией опухоли после проведения НАХТ (табл.2). При тестировании полиморфизма гена TNFα -308 A/G только у носителей GG-генотипа, с которым связана низкая продукция данного цитокина [7, 8, 24], было отмечено прогрессирование опухоли на фоне НАХТ (рис. 2). Полная регрессия опухоли, при которой наблюдалась высокая секреция IL-10 клетками крови пациентов, ассоциировалась с генотипом –592АА гена IL10, который встречался почти у 30 % больных с полной регрессией и только у 5 % больных с менее результативным лечением (рис. 2). Согласно литературным данным, этот генотип обеспечивает высокий уровень экспрессии IL-10 [3, 25, 30]. Представленные результаты указывают на сопряженность функционально высокоактивных генотипов цитокинов и высокой секреции цитокинов клетками крови с объективным клиническим ответом на химиотерапию.
Таким образом, полученные данные свидетельствуют о том, что объективный ответ на НАХТ связан со структурной и функциональной сохранностью иммунной системы. Важное значение имеют конститутивные характеристики организма больного, в частности, генетические полимор- физмы, обусловливающие уровень экспрессии патогенетически значимых цитокинов, играющих ключевую роль в функционировании иммунной системы. Представленные результаты могут послужить основой для выявления иммунологических параметров, обладающих предсказательной значимостью в отношении эффективности предоперационной химиотерапии.


