Связь между сердечно-сосудистым риском и неалкогольной жировой болезнью печени
Автор: Каршина О.О., Сабиров И.С., Кундашев У.К., Мохаммад Э.А., Инаркиев Р.А., Фазилова С.С.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 12 т.10, 2024 года.
Бесплатный доступ
Неалкогольная жировая болезнь печени (НАЖБП) может рассматриваться, как самостоятельное заболевание или как компонент метаболического синдрома, и связана с такими состояниями, как сахарный диабет, ожирение, нарушения липидного обмена и артериальная гипертензия. НАЖБП и атеросклеротически обусловленные сердечно-сосудистые заболевания (АССЗ) имеют общие факторы риска, включая ожирение, сахарный диабет и нарушение липидного обмена. В настоящее время широко распространена гипотеза о том, что НАЖБП является независимым сердечно-сосудистым фактором риска, причем эта связь влияет на возникновение или усугубление атеросклеротического процесса. Это имеет большое значение, для диагностики и оценки риска сердечно-сосудистых заболеваний у пациентов с НАЖБП. Цель обзорного исследования заключается в анализе роли НАЖБП как фактора риска кардиоваскулярных заболеваний, связанных с метаболической дисфункцией. Основное внимание будет уделено распространённым сердечно-сосудистым проявлениям у пациентов с НАЖБП с целью выявления взаимосвязей между метаболическими нарушениями и развитием ССЗ.
Стеатоз печени, атеросклероз, сердечно-сосудистый риск, метаболический синдром, инсулинорезистентность
Короткий адрес: https://sciup.org/14132014
IDR: 14132014 | УДК: 616.36-002.43:616.1 | DOI: 10.33619/2414-2948/109/40
Текст научной статьи Связь между сердечно-сосудистым риском и неалкогольной жировой болезнью печени
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.36-002.43:616.1
Целью данного обзора обобщение имеющихся данных об основных механизмах и корреляции НАЖБП и ССЗ, обсуждается роль НАЖБП как фактора риска ССЗ, связанного с метаболической дисфункцией, и основное внимание уделяется распространённым сердечнососудистым проявлениям у пациентов с НАЖБП.
НАЖБП с ее растущей заболеваемостью является наиболее распространенным хроническим заболеванием печени в развитых странах, распространенность которого составляет от 20% до 30% населения Европы. Фактически, распространенность НАЖБП, согласно исследованиям, опубликованным в период с 2016 по 2019 год, составила 38%, что представляет собой увеличение более чем на 50% за последние 3 десятилетия и НАЖБП стала ведущей причиной хронических заболеваний печени [1].
По данным Bellentani S. пациенты с ожирением от 25% до 90% имеют НАЖБП, а также 70% пациентов с сахарным диабетом (СД) [2].
Данная патология печени имеет широкий спектр заболеваний: от простого стеатоза печеночной ткани до неалкогольного стеатогепатита (НАСГ), цирроза печени и гепатоцеллюлярной карциномы, причем если простой стеатоз, как правило, является стабильным состоянием, но стеатогепатит может прогрессировать до цирроза печени [3].
Печеночная недостаточность как финальный результат при НАЖБП по данным Hyogo H. является вторым по распространенности показанием к трансплантации печени в США [4].
НАЖБП диагностируется в основном у пациентов в возрасте от 40 до 60 лет. Хотя распространенность НАЖБП выше у мужчин, но более быстрое прогрессирование до цирроза печени отмечается у женщин [5].
В 2002 г была установлена корреляция между сердечно-сосудистыми заболеваниями (ССЗ) и патологией печени. У пациентов с бивентрикулярной сердечной недостаточностью при нарушении сердечного выброса и перфузии печеночной ткани могут приводить к ишемическим повреждениям печени. Это объясняется тем, что даже незначительные изменения в работе сердца могут влиять на печень [6].
Необходимо рассматривать взаимосвязь между изменениями в сердце и печени с двух точек зрения. С одной стороны, в печени происходят изменения, вызванные первичным поражением миокарда и сопутствующими нарушениями центральной гемодинамики, кислородным голоданием и гуморальными изменениями [7].
С другой стороны, патология печени может играть ключевую роль в возникновении или обострении уже существующих сердечно-сосудистых нарушений, что, в свою очередь, сказывается на прогнозе состояния пациента [8].
Патогенез взаимовлияния НАЖБП и атеросклеротически обусловленных сердечнососудистых заболеваний. Как печеночный компонент метаболического синдрома, НАЖБП также тесно ассоциированна с другими клиническими проявлениями метаболического синдрома [9].
Распространенность НАЖБП превышает 75% в популяциях с распространенным ожирением, метаболическим синдромом и СД 2 типа, которые характеризуются резистентностью к инсулину [10].
НАЖБП играет важную роль в фиброзе печени, приводя к развитию звездчатых клеток печени с глюкозой или вызывая чрезмерную стимуляцию инсулином фактора роста соединительной ткани [11].
Метаболические нарушения, такие как ожирение, резистентность к инсулину, СД 2 типа и гипертриглицеридемия, тесно связаны с НАЖБП; поэтому стеатоз печени считается проявлением метаболического синдрома в печени [12].
НАЖБП обнаруживается у 30-75% пациентов с СД 2 типа в зависимости от возраста и этнической принадлежности [13, 14].
Инсулинорезистентность способствует развитию НАЖБП. СД 2 типа и инсулинорезистентность способствуют липолизу в жировой ткани и приводят к высвобождению свободных жирных кислот и их накоплению в печени, и, как следствие, к развитию гепатостеатоза [14].
СД 2 типа является существенным фактором риска, который приводит к прогрессированию в спектре от НАСГ до цирроза печени. Данные показывают, что ожирение и СД 2 типа также являются факторами риска гепатоцеллюлярной карциномы [15].
Более того, выявлено, что СД является независимым фактором риска печеночной смертности, а также общей смертности при НАЖБП [16].
Резистентность к инсулину имеет прогностическое значение для фиброза [1 7], хотя есть исследования, выражающие противоположное мнение [18].
Резистентность к инсулину является независимым фактором риска в прогнозировании фиброза печени [19].
Индекс инсулинорезитсентности HOMA-IR является независимым фактором риска фиброза печени. В настоящее время фиброз печени также признан важным маркером смертности при НАЖБП. Пациенты с НАЖБП и высокой инсулинорезистентностью будут приоритетными кандидатами на биопсию печени по сравнению с другими случаями. Включение пациентов с НАЖБП с высоким уровнем HOMA-IR в программы более тщательного наблюдения будет эффективным для снижения показателей смертности и заболеваемости [19].
Метаболизм холестерина играет решающую роль в патогенезе как НАЖБП, так и атеросклероза [20].
Печень является основным органом для метаболизма холестерина. Аномальный метаболизм холестерина в печени не только приводит к НАЖБП, но и стимулирует развитие атеросклеротической дислипидемии. Печень является не только важным органом для синтеза холестерина, но и для экспорта холестерина. Экспорт холестерина из печени необходим для поддержания гомеостаза холестерина в печени. Нарушение гомеостаза холестерина в печени приводит к НАЖБП и атеросклеротическим сердечно сосудистым заболеваниям. Уровень холестерина в гепатоцитах представляет собой динамическое равновесие между эндогенным синтезом, усвоением, этерификацией и выведением. Этот процесс включает преобразование холестерина в нейтральные эфиры холестерина, которые могут накапливаться в цитозольных липидных каплях или секретироваться в качестве основного компонента плазменных липопротеинов, включая липопротеины очень низкой плотности (ЛПНОП), хиломикроны, липопротеины высокой плотности (ЛПВП) и липопротеины низкой плотности(ЛПНП). Все живые клетки могут синтезировать холестерин, и печень человека обеспечивает около 50% от общего синтеза. Биосинтез холестерина — это огромный энергозатратный процесс, требующий большого количества ацетил-КоА, кислорода, АТФ, НАДФН и НАДН. Этот процесс включает согласованные действия более 20 ферментов, большинство из которых расположены в мембране эндоплазматического ретикулума (ЭР) гепатоцитов. 3-гидрокси-3-метилглутарил кофермент А редуктаза (HMGCR) является ключевым ферментом, катализирующим холестерин. АТФ-связывающий кассетный транспортер A1 (ABCA1), ABCG5/ABCG8 и цитохром P450 7A1 (CYP7A1) идентифицированы как ключевые белки, опосредующие экспорт холестерина из печени. Холестерин является высоко гидрофобным липидом, не растворимым в воде, и требует специализированных механизмов для перемещения между органеллами, что включает везикулярные или невезикулярные пути транспорта. Следует отметить, что невезикулярный транспорт является основным механизмом транспорта холестерина и опосредуется диффузными белками-переносчиками, которые имеют гидрофобные полости для связывания холестерина и переноса его через водный цитозоль. Следовательно, нарушение регуляции этих переносчиков усиливает накопление и токсичность. Патологическим признаком является накопление липидов в гепатоцитах, что позволяет предположить наличие тесной связи между аномальным липидным метаболизмом и НАЖБП. При НАЖБП дислипидемия проявляется в виде повышенного уровня триглицеридов (ТГ) и холестерина ЛПНП в сыворотке и сниженного уровня холестерина ЛПВП, которые являются ключевыми факторами риска ССЗ. ССЗ являются основной причиной смертности у пациентов с НАЖБП. Типы дислипидемии оказывают значительное влияние на распространенность НАЖБП. Наиболее распространенной формой дислипидемии у пациентов с НАЖБП является атерогенная дислипидемия, которая характеризуется гипертриглицеридемией, низким уровнем ХС ЛПВП и высоким уровнем ХС ЛПНП [21, 22].
Смешанная гиперлипидемия отмечается у 50% пациентов с НАЖБП. Изолированная гипертриглицеридемия наблюдается у 27% пациентов с НАЖБП, а гиперхолестеринемия — у 17% [23].
Анализ липидных фракций у пациентов с НАЖБП и выявил тенденцию к повышению уровня ТГ и снижению уровня ЛПВП в атерогенном липидном профиле [24].
Существует тесная связь между инсулинорезистентностью и метаболической дислипидемией при СД 2 типа. Инсулинорезистентность способствует увеличению потока свободных жирных кислот (СЖК). Повышенный уровень СЖК увеличивает выработку ТГ и ЛПОНП, а также запускает окислительный стресс и перекисное окисление липидов, все из которых тесно связаны с развитием НАЖБП [25].
Следовательно, эта физиологическая дисфункция также увеличивает риск атерогенеза, тем самым предрасполагая пациентов к атеросклероз-ассоциированным сердечнососудистым событиям. Субклиническое воспаление также играет важную роль в патогенезе НАЖБП. Патогенез НАЖБП до конца не изучен. Механизм прогрессирования обычно объясняется классической теорией патогенеза НАЖБП «множественных ударов», которая гласит, что накопление липидов запускает гепатостеатоз, приводя к множественным повреждениям, включая секрецию адипокинов, воспаление, липотоксичность и нарушение регуляции метаболизма глюкозы и липидов, что в конечном итоге может вызвать НАСГ и цирроз [26, 27].
Цитокины играют важную роль в качестве медиаторов воспаления, фиброза и цирроза при НАЖБП [28].
В предыдущих исследованиях Auguet T. и Hou X. et al. сообщалось о нескольких воспалительных медиаторах, участвующих в развитии и прогрессировании НАЖБП, таких как интерлейкин-1β (ИЛ-1β), интерлейкин-6 (ИЛ-6), фактор некроза опухоли-α (ФНО-α), С-реактивный белок (СRP) и инфламмасома NOD-подобного рецепторного белка 3 (NLRP3) [29, 30].
Некоторые из этих воспалительных медиаторов с иммуномодулирующими функциями можно использовать в качестве биомаркеров для оценки тяжести и прогнозирования НАЖБП [29].
Однако также, сообщалось о непоследовательной связи между воспалительными цитокинами и НАЖБП. Обнаружены положительные связи между воспалительными цитокинами и НАЖБП [30, 31], в то время как в других исследованиях обнаружены отрицательные или нулевые связи [32, 33].
Высокочувствительный С-реактивный белок (Hs-CRP) повышен у пациентов, страдающих НАЖБП, даже в молодом возрасте, поэтому указанный протеин может быть маркером данной патологии печени [29].
В тоже время Hs-CRP не связан с тяжестью НАЖБП или НАСГ [34,35]. Субклиническое воспаление также играет основную роль в патофизиологии атеросклероза. Hs-CRP является более сильным предиктором сердечно -сосудистого риска, чем ЛПНП-Х (липопротеины низкой плотности) [36 ].
Оксидантный стресс и хроническое воспаление, связанное с выработкой цитокинов, включая ИЛ-6, ФНО-α, прокоагулянтные факторы и адипоцитокины, также участвуют в патогенезе НАЖБП [37].
Эти факторы риска также тесно связаны с атеросклерозом. У пациентов с НАЖБП наблюдается ряд нетрадиционных факторов риска сердечно-сосудистых заболеваний, включая гиперурикемию и гиповитаминоз D [38].
Кроме того, существуют общие генетические факторы между НАЖБП и ишемической болезнью сердца, например: полиморфизм гена, кодирующего адипонектин (ADIPOQ), рецептора лептина (LEPR), аполипопротеина C3 (APOC3), рецепторов, активируемых пролифераторами пероксисом (PPAR), белков, связывающих регуляторные элементы стеролов (SREBP), члена 2 суперсемейства трансмембранных белков 6 (TM6SF2), микросомального белка переноса триглицеридов (MTTP), TNF-α и супероксиддисмутазы марганца (MnSOD) [39].
Эти механизмы подтверждают то, что адипокины и цитокины активно принимают участие в формировании и прогрессировании ССЗ у лиц с НАЖБП. Таким образом, снижение выработки адипонектина, обладающего антифиброзными, противовоспалительными и антиатерогенными свойствами, в сочетании с повышением синтеза лептина, который оказывает противоположное действие, способствует переходу стеатоза печени в стеатогепатит и повышает риск развития ССЗ у пациентов с НАЖБП. Связь между сердечно-сосудистым риском и НАЖБП. У лиц с НАЖБП риск сердечнососудистых событий в течение 10 лет был выше, чем у здоровых лиц. НАЖБП считается фактором, способствующим развитию ССЗ. НАЖБП обусловлена, с нарушением липидного обмена, окислительным стрессом, нарушением кишечной микробиоты, хроническим воспалением, инсулинорезистентностью и эндотелиальной дисфункцией, и эти факторы также связаны с ССЗ (Рисунок 1, 2) [40, 41].
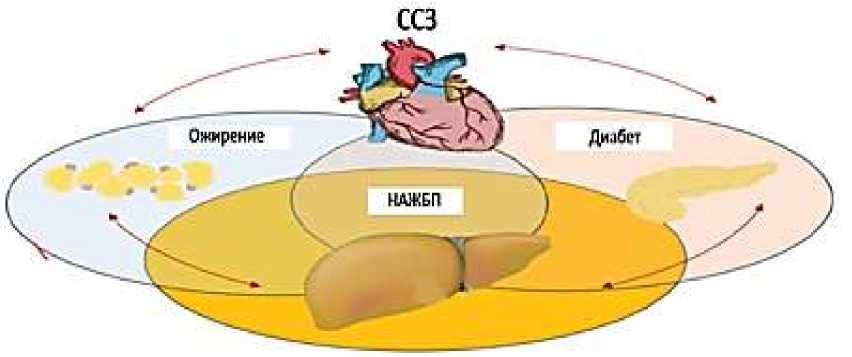
Рисунок 1. Связь между НАЖБП и атеросклеротическими сердечно-сосудистыми заболеваниями
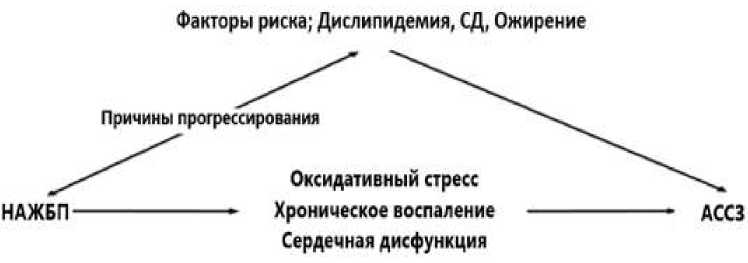
Рисунок 2. Связь между ожирением, сахарным диабетом и ССЗ, и НАЖБП [41, 48]
Средние показатели сердечно-сосудистого риска по шкале Фрамингема у пациентов с НАЖБП и без гепастеатоза печени составили 16,0% и 12,7% для мужчин, а для женщин — 6,7% и 4,6% соответственно [42].
В метаанализе 34 исследований (164 494 участников), указывает на повышенный риск сердечно-сосудистых заболеваний у пациентов с НАЖБП, хотя распространённость НАЖБП не связана со смертностью от сердечно-сосудистых заболеваний в этой группе. Данные этого исследования показывают, что НАЖБП является независимым фактором риска сердечнососудистых заболеваний [43].
Однако НАЖБП тесно ассоциирует с метаболическим синдромом. Поскольку важно отметить, что чрезвычайно сложно разделить компоненты метаболического синдрома в статистическом анализе, предполагают, что высокий сердечно-сосудистый риск у пациентов с НАЖБП является следствием не заболевания печени, а метаболического синдрома [44].
НАЖБП является печеночным проявлением метаболического синдрома и может предсказывать развитие диабета 2 типа независимо от ожирения и возраста [44].
Инсулинорезистентность является ключевым патогенным фактором НАЖБП и диабета 2 типа. Наличие НАЖБП увеличивает риск развития диабета 2 типа в два раза в течение медианного периода в пять лет [45]. У 78% пациентов с НАЖБП развивается диабет 2 типа или нарушается толерантность к глюкозе [46]. У пациентов с НАЖБП и диабетом риск ССЗ повышается в 2-4 раза [47].
Ожирение, СД 2 типа и ССЗ находятся в тесной взаимосвязи и оказывают влияние друг на друга, а также на НАЖБП. Тем не менее, каждое из этих метаболических расстройств обладает своими специфическими характеристиками, что позволяет выделить различные подтипы пациентов. Эти подтипы требуют персонализированного и междисциплинарного подхода для эффективного лечения (Рисунок 2) [48].
Следует отметить, что метаанализ показывает, что НАЖБП также связана с примерно двукратным повышением риска возникновения метаболического синдрома [49]. В метаанализе 37 исследований, включающих 172 573 пациентов с метаболическим синдромом, был обнаружен относительный риск сердечно-сосудистых событий чем в полтора раза выше у пациентов с метаболическим синдромом, чем в здоровой группе [50]. В другом мета анализе, включавшем 16 наблюдательных исследований с 34 043 пациентами с НАЖБП, авторы пришли к выводу, что наличие НАЖБП давало ОШ 1,64 для фатальной и нефатальной частоты сердечно-сосудистых событий, и риск, по-видимому, увеличивался с большей тяжестью НАЖБП [51]. Все больше исследований указывают на наличие связи между НАЖБП и ишемической болезнью сердца [52, 53]. По оценкам, рак и сердечнососудистые заболевания являются основными причинами смерти у пациентов с НАЖБП [54]. В исследование влияет ли НАЖБП на ишемическую болезнь сердца (ИБС) показано, что cтеноз коронарных артерий был тесно связан с жировой дистрофией печени в зависимости от степени тяжести, а также НАЖБП была значимым независимым фактором риска ИБС [55].
Отмечают наличие НАЖБП у 46,7% пациентов с острым коронарным синдромом [56].
У пациентов с НАЖБП наблюдается значительно более высокая частота кальцинированных и некальцинированных коронарных бляшек по сравнению со здоровыми людьми, независимо от частоты метаболического синдрома [57].
Опять же, резерв коронарного кровотока (РКК), измеряемый как максимальное увеличение кровотока через коронарные артерии сверх нормального объема покоя, значительно ниже у пациентов с НАЖБП, чем у здоровых лиц [58].
Продемонстрирована ассоциация НАЖБП и повышенный риск возникновения аритмий, особенно мерцательной аритмии или желудочковых тахиаритмий, которые обычно наблюдаются при диастолической дисфункции левого желудочка [59].
Артериальная гипертензия диагностируется примерно у 50% пациентов с НАЖБП [60].
НАЖБП выступает как независимый фактор риска развития артериальной гипертензии, в то время как повышение артериального давления является независимым предиктором как фиброзных изменений в печени [61], так и её стеатоза [62].
Следовательно, НАЖБП и артериальная гипертензия являются двумя коррелирующими состояниями, которые требуют комплексного терапевтического подхода. [63]. Необходимо отметить, что АГ является одним из ключевых элементов метаболического синдрома, особенно у пожилых людей [64]. Артериальная гипертензия предрасполагает к развитию гипертрофии левого желудочка и увеличивает риск разрыва бляшки. НАЖБП независимо коррелирует с атеросклерозом сонных артерий только у людей с множественными метаболическими нарушениями [65]. Повышенная артериальная жесткость, как маркер гипертрофии сердца и ранних атеросклеротических изменений, была зарегистрирована у пациентов с НАЖБП [66]. Скорость плече-лодыжечного пульсового колебания используется как простой индекс оценки артериальной жесткости [67]. Наблюдается также повышенныеплече-лодыжечные пульсовые колебания у пациентов с НАЖБП, независимо от обычных сердечно-сосудистых факторов риска и наличия метаболического синдрома [68].
Повышенная артериальная жесткость является результатом дегенерации внеклеточного матрикса эластичных артерий, апоптоза эндотелиальных клеток и диффузии макромолекул в артериальную стенку [69]. Снижение сосудистой восприимчивости приводит к увеличению сердечного выброса постнагрузки и недостаточному коронарному кровотоку [70]. В исследовании Moshayedi H. и соавторов НАЖБП была выявлена у 42,7% пациентов с ишемическим инсультом и у 22,7% участников контрольной группы в иранской популяции [71]. По оценкам, риск ишемического инсульта у пациентов с НАЖБП в 1,68 раза выше, чем в общей популяции, и это связано с наличием традиционных факторов риска сердечнососудистых заболеваний [71].
Несмотря на то, что риск развития ишемического инсульта повышен у пациентов с НАЖБП, жировая дистрофия печени не является независимым фактором риска ишемического инсульта [71]. Морфологические и функциональные изменения в сердечных миоцитах наблюдаются в случаях НАЖБП [72]. Стеатоз миокарда является хорошо известным предиктором диастолической сердечной недостаточности [73]. Диастолическая дисфункция встречается в три раза чаще у пациентов с НАЖБП, чем в общей популяции, особенно релаксация левого желудочка, коррелирующая с индексом активности НАЖБП (NAS) [74, 75]. Отмечен высокий индекс массы левого желудочка у пациентов с НАЖБП [76].
У этих пациентов наблюдается значительно большее давление наполнения левого желудочка (соотношение E/e': скорость наполнения митрального клапана [E]/скорость митрального кольца в раннюю диастолу [E/e']) [74]. Однако у пациентов с НАЖБП с ожирением, гипертонией или диабетом также наблюдается нарушение систолической функции левого желудочка [77]. Пациенты с НАЖБП, как правило, демонстрируют наличие эпикардиальной жировой ткани [78], которая действует как источник провоспалительных цитокинов и увеличивает риск сердечно-сосудистых заболеваний [79]. Кроме того, НАЖБП тесно связана с повышенным риском склероза аортального клапана, который является независимым индикатором атеросклероза и увеличивает риск сердечно-сосудистой смерти [80].
Пациенты с НАЖБП имеют высокий риск развития острых или хронических ССЗ с общими патогенными факторами. Поэтому необходимо оценить сердечно-сосудистый риск у пациентов с НАЖБП и определить потенциальные преимущества ранних стратегий профилактики атеросклеротически обусловленной кардиоваскулярной патологии. Необходимо рассматривать НАЖБП как мультисистемное заболевание, которое затрагивает не только печень, но и множество внепеченочных органов. Последствия болезни выходят за пределы печеночных осложнений, что подчеркивает значимость многопрофильного скрининга и индивидуализированного подхода к лечению [81].
Заключение. Связь между НАЖБП и атеросклеротическими сердечно-сосудистыми заболеваниями изначально рассматривалась как эпифеномен, возникающий из-за схожих метаболических факторов риска. Однако на сегодняшний день многие исследования подтверждают, что независимым фактором риска для сердечно-сосудистых заболеваний является НАЖБП. В частности, считается, что НАЖБП активно способствует системному высвобождению проатерогенных и провоспалительных медиаторов, что в свою очередь увеличивает резистентность к инсулину и приводит к аномальным атерогенным липидным профилям, способствующим атерогенезу. Заболевания печени играют важную роль в развитии и тяжести сердечно-сосудистых заболеваний, оказывая значительное влияние на их течение. Общие факторы риска, такие как ожирение и дислипидемия, усугубляют взаимосвязь между НАЖБП и атеросклеротическими поражениями сосудов. Печень играет ключевую роль в синтезе и выведении холестерина, и её дисфункция приводит к нарушениям липидного обмена. Это, в свою очередь, способствует прогрессированию НАЖБП и развитию атеросклеротической дислипидемии, что повышает риск развития атеросклероза. Таким образом, при наличии НАЖБП ухудшение функций печени не только ухудшает метаболические процессы, но и создаёт дополнительные условия для возникновения сердечно-сосудистых заболеваний.
Таким образом, жировая дистрофия печени должна рассматриваться и как самостоятельное заболевание, и как важный фактор, влияющий на прогноз при ССЗ. Это подчеркивает необходимость комплексного подхода к диагностике и лечению пациентов с НАЖБП. Диагноз НАЖБП требует тщательной оценки сердечно-сосудистого риска и выявления субклинического атеросклероза. Это может способствовать более эффективному выявлению пациентов из группы высокого риска, которые являются кандидатами на терапевтическое вмешательство, чтобы справиться с неприемлемым глобальным бременем болезней, связанным с переплетением пандемии метаболических и сердечно-сосудистых заболеваний.
Список литературы Связь между сердечно-сосудистым риском и неалкогольной жировой болезнью печени
- Younossi Z. M., Golabi P., Paik J. M., Henry A., Van Dongen C., Henry L. The global epidemiology of nonalcoholic fatty liver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): a systematic review // Hepatology. 2023. V. 77. №4. P. 1335-1347. https://doi.org/10.1097/HEP.0000000000000004
- Bellentani S. et al. Epidemiology of non-alcoholic fatty liver disease //Digestive diseases. -2010. V. 28. №1. P. 155-161. https://doi.org/10.1159/000282080
- Scorletti E., Calder P. C., Byrne C. D. Non-alcoholic fatty liver disease and cardiovascular risk: metabolic aspects and novel treatments // Endocrine. 2011. V. 40. P. 332-343. https://doi.org/10.1007/s12020-011-9530-x
- Hyogo H., Chayama K., Yamagishi S. Nonalcoholic fatty liver disease and cardiovascular disease // Current Pharmaceutical Design. 2014. V. 20. №14. P. 2403-2411. https://doi.org/10.2174/13816128113199990476
- Loomba R., Sanyal A. J. The global NAFLD epidemic // Nature reviews Gastroenterology & hepatology. 2013. V. 10. №11. P. 686-690. https://doi.org/10.1038/nrgastro.2013.171
- Kenchaiah S., Evans J. C., Levy D., Wilson P. W., Benjamin E. J., Larson M. G., Vasan R. S. Obesity and the risk of heart failure // New England Journal of Medicine. 2002. V. 347. №. 5. P. 305-313. https://doi.org/10.1056/NEJMoa020245
- Сторожаков Г. И., Эттингер О. А. Поражение печени при хронической сердечной недостаточности // Сердечная недостаточность. 2005. Т. 6. №1. С. 32-37.
- Гарбузенко Д. В. Мультиорганные гемодинамические нарушения при циррозе печени // Терапевтический архив. 2007. Т. 79. №2. С. 73-77.
- Milic S., Stimac D. Nonalcoholic fatty liver disease/steatohepatitis: epidemiology, pathogenesis, clinical presentation and treatment // Digestive diseases. 2012. V. 30. №2. P. 158-162. https://doi.org/10.1159/000336669
- Baran B., Akyuz F. Non-alcoholic fatty liver disease: what has changed in the treatment since the beginning? // World Journal of Gastroenterology: WJG. 2014. V. 20. №39. P. 14219. https://doi.org/10.3748/wjg.v20.i39.14219
- Paradis V. et al. High glucose and hyperinsulinemia stimulate connective tissue growth factor expression: a potential mechanism involved in progression to fibrosis in nonalcoholic steatohepatitis // Hepatology. 2001. V. 34. №4. P. 738-744. https://doi.org/10.1053/jhep.2001.28055
- Ekstedt M., Hagstrom H., Nasr P., Fredrikson M., Stal P., Kechagias S., Hultcrantz R. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up // Hepatology. 2015. V. 61. №5. P. 1547-1554. https://doi.org/10.1002/hep.27368
- Lonardo A., Ballestri S., Marchesini G., Angulo P., Loria, P. Nonalcoholic fatty liver disease: a precursor of the metabolic syndrome // Digestive and Liver disease. 2015. V. 47. №3. P. 181-190. https://doi.org/10.1016/j.dld.2014.09.020
- Shields W. W. et al. The effect of metformin and standard therapy versus standard therapy alone in nondiabetic patients with insulin resistance and nonalcoholic steatohepatitis (NASH): a pilot trial // Therapeutic advances in gastroenterology. 2009. V. 2. №3. P. 157-163. https://doi.org/10.1177/1756283X09105462
- Streba L. A. M., Vere C. C., Rogoveanu I., Streba C. T. Nonalcoholic fatty liver disease, metabolic risk factors, and hepatocellular carcinoma: an open question // World journal of gastroenterology: WJG. 2015. V. 21. №14. P. 4103. https://doi: 10.3748/wjg.v21.i14.4103. https://doi.org/10.3748/wjg.v21.i14.4103
- Stepanova M., Rafiq N., Younossi Z. M. Components of metabolic syndrome are independent predictors of mortality in patients with chronic liver disease: a population-based study // Gut. 2010. V. 59. №10. P. 1410-1415. https://doi.org/10.1136/gut.2010.213553
- Rosso C., Mezzabotta L., Gaggini M., Salomone F., Gambino R., Marengo A., Bugianesi E. Peripheral insulin resistance predicts liver damage in nondiabetic subjects with nonalcoholic fatty liver disease // Hepatology. 2016. V. 63. №1. P. 107-116. https://doi.org/10.1002/hep.28287
- Korkmaz H., Unler G. K., Gokturk H. S., Schmidt W. E., Kebapcilar L. Noninvasive estimation of disease activity and liver fibrosis in nonalcoholic fatty liver disease using anthropometric and biochemical characteristics, including insulin, insulin resistance, and 13C-methionine breath test // European journal of gastroenterology & hepatology. 2015. V. 27. №10. P. 1137-1143. https://doi.org/10.1097/MEG.0000000000000407
- Cetin E. G., Demir N., Sen I. The relationship between insulin resistance and liver damage in non-alcoholic fatty liver patients // The Medical Bulletin of Sisli Etfal Hospital. 2020. V. 54. №4. P. 411. https://doi.org/10.14744/SEMB.2018.83604
- Matherly S. C., Puri P. Mechanisms of simple hepatic steatosis: not so simple after all // Clinics in Liver Disease. 2012. V. 16. №3. P. 505-524. https://doi.org/10.1016/j.cld.2012.05.005
- Sahebkar A., Chew G. T., Watts G. F. New peroxisome proliferator-activated receptor agonists: potential treatments for atherogenic dyslipidemia and non-alcoholic fatty liver disease // Expert opinion on pharmacotherapy. 2014. V. 15. №4. P. 493-503. https://doi.org/10.1517/14656566.2014.876992
- Лазебник Л. Б., Туркина С. В. НАЖБП-ассоциированная коморбидность // Экспериментальная и клиническая гастроэнтерология. 2021. №10 (194). С. 5-13. https://doi.org/10.31146/1682-8658-есд-194-10-5-13
- Wanless I. R., Lentz J. S. Fatty liver hepatitis (steatohepatitis) and obesity: an autopsy study with analysis of risk factors // Hepatology. 1990. V. 12. №5. P. 1106-1110. https://doi.org/10.1002/hep.1840120505
- DeFilippis A. P., Blaha M. J., Martin S. S., Reed R. M., Jones S. R., Nasir K., Budoff, M. J. Nonalcoholic fatty liver disease and serum lipoproteins: the Multi-Ethnic Study of Atherosclerosis // Atherosclerosis. 2013. V. 227. №2. P. 429-436. https://doi.org/10.1016/j.atherosclerosis.2013.01.022
- Alkhouri N., Eng K., Lopez R., Nobili V. Non-high-density lipoprotein cholesterol (non-HDL-C) levels in children with nonalcoholic fatty liver disease (NAFLD) // Springerplus. 2014. V. 3. P. 1-9. https://doi.org/10.1186/2193-1801-3-407
- Pierantonelli I., Svegliati-Baroni G. Nonalcoholic fatty liver disease: basic pathogenetic mechanisms in the progression from NAFLD to NASH // Transplantation. 2019. V. 103. №1. P. e1-e13. https://doi.org/10.1097/TP.0000000000002480
- Peng C., Stewart A. G., Woodman O. L., Ritchie R. H., Qin C. X. Non-alcoholic steatohepatitis: a review of its mechanism, models and medical treatments // Frontiers in pharmacology. 2020. V. 11. P. 603926. https://doi.org/10.3389/fphar.2020.603926
- Zhang T. S., Qin H. L., Wang T., Li H. T., Li H., Xia S. H., Xiang X. H. Global publication trends and research hotspots of nonalcoholic fatty liver disease: a bibliometric analysis and systematic review // Springerplus. 2015. V. 4. P. 1-9. https://doi.org/10.1186/s40064-015-1542-1
- Auguet T., Bertran L., Binetti J., Aguilar C., Martinez S., Sabench F., Richart C. Relationship between IL-8 circulating levels and TLR2 hepatic expression in women with morbid obesity and nonalcoholic steatohepatitis // International journal of molecular sciences. 2020. V. 21. №11. P. 4189. https://doi.org/10.3390/ijms21114189
- Hou X., Yin S., Ren R., Liu S., Yong L., Liu Y., Wang H. Myeloid-cell-specific IL-6 signaling promotes microRNA-223-enriched exosome production to attenuate NAFLD-Associated fibrosis // Hepatology. 2021. V. 74. №1. P. 116-132. https://doi.org/10.1002/hep.31658
- Du Plessis J., Van Pelt J., Korf H., Mathieu C., Van der Schueren B., Lannoo M., Van der Merwe S. Association of adipose tissue inflammation with histologic severity of nonalcoholic fatty liver disease // Gastroenterology. 2015. V. 149. №3. P. 635-648. e14. https://doi.org/10.10537j.gastro.2015.05.044
- Cabré N., Luciano-Mateo F., Fernández-Arroyo S., Baiges-Gayá G., Hernández-Aguilera A., Fibla M., Joven J. Laparoscopic sleeve gastrectomy reverses non-alcoholic fatty liver disease modulating oxidative stress and inflammation // Metabolism. 2019. V. 99. P. 81-89. https://doi.org/10.1016/j.metabol.2019.07.002
- Viglino D., Jullian-Desayes I., Minoves M., Aron-Wisnewsky J., Leroy V., Zarski J. P., Pépin J. L. Nonalcoholic fatty liver disease in chronic obstructive pulmonary disease // European Respiratory Journal. 2017. V. 49. №6. https://doi.org/10.1183/13993003.01923-2016
- Yeniova A. O., Kü9ükazman M., Ata N., Dal K., Kefeli A., Basyigit S., Beyan E. High-sensitivity C-reactive protein is a strong predictor of non-alcoholic fatty liver disease. 2014.
- Zimmermann E., Anty R., Tordjman J., Verrijken A., Gual P., Tran A., Jess T. C-reactive protein levels in relation to various features of non-alcoholic fatty liver disease among obese patients // Journal of hepatology. 2011. V. 55. №3. P. 660-665. https://doi.org/10.1016/jjhep.2010.12.017
- Ridker P. M., Hennekens C. H., Buring J. E., Rifai N. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women // New England journal of medicine. 2000. V. 342. №12. P. 836-843. https://doi.org/10.1056/NEJM200003233421202
- Takaki A., Kawai D., Yamamoto K. Multiple hits, including oxidative stress, as pathogenesis and treatment target in non-alcoholic steatohepatitis (NASH) // International journal of molecular sciences. 2013. V. 14. №10. P. 20704-20728. https://doi.org/10.3390/ijms141020704
- Targher G., Bertolini L., Scala L., Cigolini M., Zenari L., Falezza G., Arcaro G. Associations between serum 25-hydroxyvitamin D3 concentrations and liver histology in patients with non-alcoholic fatty liver disease // Nutrition, Metabolism and Cardiovascular Diseases. 2007. V. 17. №7. P. 517-524. https://doi.org/10.1016Zj.numecd.2006.04.002
- Li X. L., Sui J. Q., Lu L. L., Zhang N. N., Xu X., Dong Q. Y., Xuan S. Y. Gene polymorphisms associated with non-alcoholic fatty liver disease and coronary artery disease: a concise review // Lipids in health and disease. 2016. V. 15. P. 1-8. https://doi.org/10.1186/s12944-016-0221-8
- Katsarou A., Moustakas I. I., Pyrina I., Lembessis P., Koutsilieris M., Chatzigeorgiou A. Metabolic inflammation as an instigator of fibrosis during non-alcoholic fatty liver disease // World journal of gastroenterology. 2020. V. 26. №17. P. 1993. https://doi.org/10.3748/wjg.v26.i17.1993
- Nakashima M., Nakamura K., Nishihara T., Ichikawa K., Nakayama R., Takaya Y., Ito H. Association between Cardiovascular Disease and Liver Disease, from a Clinically Pragmatic Perspective as a Cardiologist // Nutrients. 2023. V. 15. №3. P. 748. https://doi.org/10.3390/nu15030748
- Motamed N., Rabiee B., Poustchi H., Dehestani B., Hemasi G. R., Khonsari M. R., Zamani F. Non-alcoholic fatty liver disease (NAFLD) and 10-year risk of cardiovascular diseases // Clinics and research in hepatology and gastroenterology. 2017. V. 41. №1. P. 31-38.
- Wu S., Wu F., Ding Y., Hou J., Bi J., Zhang Z. Association of non-alcoholic fatty liver disease with major adverse cardiovascular events: a systematic review and meta-analysis // Scientific reports. 2016. V. 6. №1. P. 33386. https://doi.org/10.1038/srep33386
- Hamaguchi M., Takeda N., Kojima T., Ohbora A., Kato T., Sarui H., Takeda J. Identification of individuals with non-alcoholic fatty liver disease by the diagnostic criteria for the metabolic syndrome // World journal of gastroenterology: WJG. 2012. V. 18. №13. P. 1508. https://doi.org/10.3748/wjg.v18.i13.1508
- Lallukka S., Yki-Jarvinen H. Non-alcoholic fatty liver disease and risk of type 2 diabetes // Best practice & research Clinical endocrinology & metabolism. 2016. V. 30. №3. P. 385-395. https://doi.org/10.1016Zj.beem.2016.06.006
- Ekstedt, M., Franzen, L. E., Mathiesen, U. L., Thorelius, L., Holmqvist, M., Bodemar, G., & Kechagias, S. Long-term follow-up of patients with NAFLD and elevated liver enzymes // Hepatology. 2006. V. 44. №4. P. 865-873. https://doi.org/10.1002/hep.21327
- Stamler J., Vaccaro O., Neaton J. D., Wentworth D., Diabetes, other risk factors, and 12-yr cardiovascular mortality for men screened in the Multiple Risk Factor Intervention Trial // Diabetes care. 1993. V. 16. №2. P. 434-444. https://doi.org/10.2337/diacare.16.2.434
- Schattenberg J. M., Allen A. M., Jarvis H., Zelber-Sagi S., Cusi K., Dillon J. F., Lazarus J. V. A multistakeholder approach to innovations in NAFLD care // Communications medicine. 2023. V. 3. №1. P. 1. https://doi.org/10.1038/s43856-022-00228-y
- Ballestri S., Zona S., Targher G., Romagnoli D., Baldelli E., Nascimbeni F., Lonardo A. Nonalcoholic fatty liver disease is associated with an almost twofold increased risk of incident type 2 diabetes and metabolic syndrome. Evidence from a systematic review and meta - analysis // Journal of gastroenterology and hepatology. 2016. V. 31. №5. P. 936-944. https://doi.org/10.1111/jgh.13264
- Gami A. S., Witt B. J., Howard D. E., Erwin P. J., Gami L. A., Somers V. K., Montori V. M. Metabolic syndrome and risk of incident cardiovascular events and death: a systematic review and meta-analysis of longitudinal studies // Journal of the American College of Cardiology. 2007. V. 49. №4. P. 403-414.
- Targher G., Byrne C. D., Lonardo A., Zoppini G., Barbui C. Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: a meta-analysis // Journal of hepatology. 2016. V. 65. №3. P. 589-600. https://doi.org/10.1016/jjhep.2016.05.013
- Baharvand-Ahmadi B., Sharifi K., Namdari M. Prevalence of non-alcoholic fatty liver disease in patients with coronary artery disease // ARYA atherosclerosis. 2016. V. 12. №4. P. 201.
- Ajmal M. R., Yaccha M., Malik M. A., Rabbani M. U., Ahmad I., Isalm N., Abdali N. Prevalence of nonalcoholic fatty liver disease (NAFLD) in patients of cardiovascular diseases and its association with hs-CRP and TNF-a // indian heart journal. 2014. V. 66. №6. P. 574-579. https://doi.org/10.1016/j.ihj.2014.08.006
- Armstrong M. J., Adams L. A., Canbay A., Syn W. K. Extrahepatic complications of nonalcoholic fatty liver disease // Hepatology. 2014. V. 59. №3. P. 1174-1197. https://doi.org/10.1002/hep.26717
- Choi D. H., Lee S. J., Kang C. D., Park M. O., Choi D. W., Kim T. S., Lee J. W. Nonalcoholic fatty liver disease is associated with coronary artery disease in Koreans // World Journal of Gastroenterology: WJG. 2013. V. 19. №38. P. 6453. https://doi.org/10.3748/wjg.v19.i38.6453
- Perera N., Indrakumar J., Abeysinghe W. V., Fernando V., Samaraweera W. M., Lawrence J. S. Non alcoholic fatty liver disease increases the mortality from acute coronary syndrome: an observational study from Sri Lanka // BMC Cardiovascular Disorders. 2016. V. 16. P. 1-6. https://doi.org/10.1186/s12872-016-0212-8
- Assy N., Djibre A., Farah R., Grosovski M., Marmor A. Presence of coronary plaques in patients with nonalcoholic fatty liver disease // Radiology. 2010. V. 254. №2. P. 393-400. https://doi.org/10.1148/radiol.09090769
- Kaymako S., Lu A. О. Measurement of the coronary flow velocity reserve in patients with non-alcoholic fatty liver disease // Turk J Gastroenterol. 2012. V. 23. №6. P. 720-726. https://doi.org/10.4318/tjg.2012.0489
- Karajamaki A. J., Patsi O. P., Savolainen M., Kesaniemi Y. A., Huikuri H., Ukkola O. Non-alcoholic fatty liver disease as a predictor of atrial fibrillation in middle-aged population (OPERA Study) // PloS one. 2015. V. 10. №11. P. e0142937. https://doi.org/10.1371/journal.pone.0142937
- Tsang W. C., Ng W. F., Wu P. Y., Chow D. A., Li E. T. H., Wong T. C Predictors of fibrosis in Asian patients with non-alcoholic steatohepatitis // Journal of gastroenterology and hepatology. 2006. V. 21. №1. P. 116-121. https://doi.org/10.1111/j.1440-1746.2005.04146.x
- Sorrentino P., Terracciano L., D'angelo S., Ferbo U., Bracigliano A., Vecchione R. Predicting fibrosis worsening in obese patients with NASH through parenchymal fibronectin, HOMA-IR, and hypertension // Official journal of the American College of Gastroenterology! ACG. 2010. V. 105. №2. P. 336-344. https://doi.org/10.1038/ajg.2009.587
- Zhang T., Zhang C., Zhang Y., Tang F., Li H., Zhang Q., Xue F. Metabolic syndrome and its components as predictors of nonalcoholic fatty liver disease in a northern urban Han Chinese population: a prospective cohort study // Atherosclerosis. 2015. V. 240. №1. P. 144-148. https://doi. org/10.1016/j. atherosclerosis.2015.02.049
- Лазебник Л. Б., Чихирева Л. Н., Чихирев О. А., Ли Е. Д. Выбор антигипертезивной терапии при различных стадиях метаболически ассоциированной стеатозной болезни печени // Экспериментальная и клиническая гастроэнтерология. 2023. №11 (219). С. 52-61. https://doi.org/10.31146/1682-8658-ecg-219-11-52-61
- Сабиров И. С., Каршина О. О., Сабирова А. И., Халматов А. Н. Метаболически ассоциированная жировая болезнь печени и пожилой возраст // Экспериментальная и клиническая гастроэнтерология. 2024. №3. С. 25-32. https://doi.org/10.31146/1682-8658-ecg-223-3-25-32
- Kim H. C., Kim D. J., Huh K. B. Association between nonalcoholic fatty liver disease and carotid intima-media thickness according to the presence of metabolic syndrome // Atherosclerosis. 2009. V. 204. №2. P. 521-525. https://doi.org/10.1016/j.atherosclerosis.2008.09.012
- Salvi P., Ruffini R., Agnoletti D., Magnani E., Pagliarani G., Comandini G., Pazzi P. Increased arterial stiffness in nonalcoholic fatty liver disease: the Cardio-GOOSE study // Journal of hypertension. 2010. V. 28. №8. P. 1699-1707. https://doi.org/10.1097/HJH.0b013e32833a7de6
- Shiotani A., Motoyama M., Matsuda T., Miyanishi T. Brachial-ankle pulse wave velocity in Japanese university students // Internal medicine. 2005. V. 44. №7. P. 696-701. https://doi.org/10.2169/internalmedicine.44.696
- Lee Y. J., Shim J. Y., Moon B. S., Shin Y. H., Jung D. H., Lee J. H., Lee H. R. The relationship between arterial stiffness and nonalcoholic fatty liver disease // Digestive diseases and sciences. 2012. V. 57. P. 196-203. https://doi.org/10.1007/s10620-011-1819-3
- Laurent S., Boutouyrie P., Lacolley P. Structural and genetic bases of arterial stiffness // Hypertension. 2005. V. 45. №6. P. 1050-1055.69. https://doi.org/10.1161/01.HYP.0000164580.39991.3d
- Quinn U., Tomlinson L. A., Cockcroft J. R. Arterial stiffness // JRSM cardiovascular disease. 2012. V. 1. №6. P. 1-8. https://doi.org/10.1258/cvd.2012.012024
- Moshayedi H., Ahrabi R., Mardani A., Sadigetegad S., Farhudi M. Association between non-alcoholic fatty liver disease and ischemic stroke // Iranian journal of neurology. 2014. V. 13. №3. P. 144.
- Iacobellis G., Barbarini G., Letizia C., Barbaro G. Epicardial fat thickness and nonalcoholic fatty liver disease in obese subjects // Obesity. 2014. V. 22. №2. P. 332-336. https://doi.org/10.1002/oby.20624
- Iaccarino G., Ciccarelli M., Sorriento D., Galasso G., Campanile A., Santulli G., Trimarco B. Ischemic neoangiogenesis enhanced by p2-adrenergic receptor overexpression: a novel role for the endothelial adrenergic system // Circulation research. 2005. V. 97. №11. P. 1182-1189. https://doi.org/10.1161/01.RES.0000191541.06788.bb
- Mantovani A., Pernigo M., Bergamini C., Bonapace S., Lipari P., Pichiri I., Targher G. Nonalcoholic fatty liver disease is independently associated with early left ventricular diastolic dysfunction in patients with type 2 diabetes // PLoS One. 2015. V. 10. №8. P. e0135329
- Goland S., Shimoni S., Zornitzki T., Knobler H., Azoulai O., Lutaty G., Malnick S. Cardiac abnormalities as a new manifestation of nonalcoholic fatty liver disease: echocardiographic and tissue Doppler imaging assessment // Journal of clinical gastroenterology. 2006. V. 40. №10. P. 949-955. https://doi.org/10.1097/01.mcg.0000225668.53673.e6
- Trovato F. M., Martines G. F., Catalano D., Musumeci G., Pirri C., Trovato G. M. Echocardiography and NAFLD (non-alcoholic fatty liver disease) // International journal of cardiology. 2016. V. 221. P. 275-279. https://doi.org/10.1016/j.ijcard.2016.06.180
- Rijzewijk L. J., van der Meer R. W., Smit J. W., Diamant M., Bax J. J., Hammer S., Lamb H. J. Myocardial steatosis is an independent predictor of diastolic dysfunction in type 2 diabetes mellitus // Journal of the American College of Cardiology. 2008. V. 52. №22. P. 1793-1799.
- Pisto P., Santaniemi M., Bloigu R., Ukkola O., Kesaniemi Y. A.Fatty liver predicts the risk for cardiovascular events in middle-aged population: a population-based cohort study // BMJ open. 2014. V. 4. №3. P. e004973.
- Iacobellis G., Pistilli D., Gucciardo M., Leonetti F., Miraldi F., Brancaccio G., di Gioia C. R. T. Adiponectin expression in human epicardial adipose tissue in vivo is lower in patients with coronary artery disease // Cytokine. 2005. V. 29. №6. P. 251-255. https://doi .org/10.1016/j.cyto.2004.11.002
- Bonapace S., Valbusa F., Bertolini L., Pichiri I., Mantovani A., Rossi A., Targher G.Nonalcoholic fatty liver disease is associated with aortic valve sclerosis in patients with type 2 diabetes mellitus // Plos one. 2014. V. 9. №2. P. e88371. https://doi.org/10.1371/journal.pone.0088371
- Каршина О. О., Абдилазизова Э. А. Корреляция метаболически ассоциированной жировой болезни печени с основными факторами риска сердечно-сосудистых заболеваний // Вестник Кыргызско-Российского Славянского университета. 2023. Т. 23. № 9. С. 44-50. https://doi.org/10.36979/1694-500X-2023-23-9-44-50


