Связь параметров опухолевого неоангиогенеза с лимфогенным метастазированием при раке прямой кишки
Автор: Степанов Иван Вадимович, Алтыбаев Сельвер Рафаэльевич, Крахмаль Надежда Валерьевна, Рачковский Кирилл Владимирович, Сорокин Дмитрий Александрович, Афанасьев Сергей Геннадьевич, Вторушин Сергей Владимирович, Завьялова Марина Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.16, 2017 года.
Бесплатный доступ
Основным условием для интенсивного роста первичного опухолевого узла является ангиогенез (неоангиогенез), характеризующийся формированием новых сосудов из существующих. Данный процесс отличается последовательностью событий, начинающейся с расширения сосудов, отделения перицитов от сосудистой стенки с последующей пролиферацией эндотелиоцитов и формированием сосудистых клубочков, окруженных стромальными клетками. Оценка плотности микрососудов, а также «сосудистых почек» (кластеров эндотелиоцитов) - наиболее широко используемый метод для количественной оценки внутриопухолевого ангиогенеза. Цель исследования - изучить экспрессионные характеристики маркеров неоангиогенеза (CD34 и VEGFR) в опухолевой ткани и оценить их взаимосвязь с параметрами лимфогенного метастазирования при раке прямой кишки. Материал и методы. Исследовался операционный материал от 130 больных раком прямой кишки ypT1-4N0-2M0 стадии, проходивших комбинированное лечение в торако-абдоминальном отделении НИИ онкологии Томского НИМЦ. Гистологическое и иммуногистохимическое исследование выполнялось по стандартной методике. Диагноз устанавливался согласно классификации ВОЗ (2010). В исследование включались только случаи с аденокарциномой прямой кишки. Результаты. При изучении плотности микрососудов и «сосудистых почек» в опухолевой ткани с использованием антитела к CD34 оказалось, что в подслизистом слое прямой кишки плотность микрососудов выше в случаях с наличием лимфогенных метастазов в сравнении с группой без лимфогенного метастазирования. Плотность микрососудов, определяемая с использованием антитела к VEGFR, в слизистой оболочке, подслизистом и мышечном слоях, серозной оболочке прямой кишки, не различалась в группах с наличием или отсутствием лимфогенных метастазов. Плотность «сосудистых почек» во всех слоях стенки прямой кишки не была связана с лимфогенным метастазированием. Заключение. Проведенное исследование показало, что экспрессия молекулярно-биологических маркеров неоангиогенеза в опухолевой ткани при аденокарциноме прямой кишки связана с параметрами лимфогенного метастазирования.
Рак прямой кишки, экспрессия, ангиогенез, лимфогенное метастазирование
Короткий адрес: https://sciup.org/140254120
IDR: 140254120 | УДК: 616.351-006.6-033.2:611-018.98:616.13/.16 | DOI: 10.21294/1814-4861-2017-16-3-46-51
Текст научной статьи Связь параметров опухолевого неоангиогенеза с лимфогенным метастазированием при раке прямой кишки
Рак прямой кишки (РПК) является третьим по распространенности и четвертым по летальности злокачественным новообразованием в мире [1]. В зависимости от стадии процесса и локализации первичной опухоли определяется дальнейшая тактика и режим терапии РПК. Золотым стандартом лечения РПК является радикальная операция, которая при местнораспространенных опухолях сочетается с неоадъювантной химиолучевой терапией (НАХЛТ) [2]. Известно, что степень дифференцировки опухоли, а также распространенность и выраженность лимфогенного метастазирования при РПК считаются основными гистологическими прогностическими параметрами, способными влиять на результаты комбинированного лечения этой патологии.
В литературе уделяется все больше внимания дополнительным параметрам прогноза при РПК, среди которых особое значение придают определению плотности микрососудов в опухоли и ее связи с метастазированием и эффектами НАХЛТ. Основным условием для интенсивного роста первичного опухолевого узла является ангиогенез (неоангиогенез), характеризующийся формированием новых сосудов из существующих. Регуляция неоангиогенеза заключается в балансе между ингибирующими и стимулирующими факторам роста [3, 4]. Наряду с фактором роста фибробластов, трансформирующим фактором роста, фактором некроза опухоли и другими ангиопоэтинами рецептор эндотелиального сосудистого фактора роста (VEGFR) является мощным индуктором ангиогенеза. Данный процесс характеризуется последовательностью событий, начинающейся с расширения сосудов, отделения перицитов от сосудистой стенки с последующей пролиферацией эндотелиоцитов и формированием сосудистых клубочков, окруженных стромальными клетками. Оценка плотности микрососудов, а также «сосудистых почек» (кластеров эндотелиоцитов) – широко используемый метод для количественной оценки внутриопухолевого ангиогенеза [5]. CD34 – поверхностный антиген, экспрессирующийся в эндотелиальных клетках сосудов. Хотя CD34 обладает высокой чувствительностью и специфичностью, он не имеет избирательности в отношении эндотелия нормальных сосудов и сосудов опухоли. Другим иммуногистохимическим маркером для определения эндотелия микрососудов является CD 105 (эндоглин), экспрессирующийся только в эндотелии сосудов опухолевой ткани [6, 7]. Svagzdys et al., определяя плотность микрососудов после длительной лучевой терапии РПК, отметили, что период выживаемости увеличивался по мере уменьшения плотности сосудов в опухоли [8]. В исследовании Arimoto et al. показано, что прием бевацизумаба сопровождался уменьшением плотности микрососудов в опухоли прямой кишки [9]. Martins et al. установили, что экспрессия VEGF в случаях с метастазами и без таковых была одинаковой, тогда как по мере увеличения стадии РПК экспрессия данного маркера возрастала [10]. Кроме того, отмечена связь между экспрессией VEGF и метастатическим поражением лимфатических узлов при РПК. Выраженность экспрессии VEGF преобладала в группе пациентов с короткой общей выживаемостью в случае метастатического поражения лимфоузлов, тогда как экспрессия в группе с более продолжительной выживаемостью была менее интенсивна. При этом плотность микрососудов преобладала в случае выраженной экспрессии VEGF [11]. Имеются сведения о прогностической значимости плотности микрососудов при некоторых злокачественных новообразованиях, таких как рак мочевого пузыря, молочной железы, почечно-клеточный рак. В частности, известно, что неоадъювантная химиотерапия рака молочной железы сопровождается развитием выраженного антиангиогенного эффекта, проявлявшегося уменьшением плотности микрососудов. Данный феномен коррелирует с увеличением экспрессии антиангиогенных факторов, при этом экспрессия VEGF сохранена [12]. При раке мочевого пузыря экспрессия CD34 в эндотелии микрососудов ассоциирована с высокой частотой рецидивов опухоли [13].
Материал и методы
Исследовался операционный материал от 130 больных раком прямой кишки ypT1—4N0-2M 0 стадии, получавших комбинированное лечение в торакоабдоминальном отделении НИИ онкологии Томского НИМЦ в период с 2000 по 2015 г. Средний возраст составил 57,6 ± 9,3 года. Мужчин было 85 (65,3 %), женщин – 45 (34,7 %).
Морфологическому исследованию подвергалась ткань первичной опухоли. Материал фиксировался в 10-12 % растворе нейтрального формалина. Проводка материала и изготовление гистологических препаратов осуществлялись по стандартной методике. Препараты окрашивались гематоксилином и эозином. Исследование выполнялось с применением светового микроскопа «Carl Zeiss Axio Lab. A1» (Германия). Гистологический тип рака прямой кишки устанавливался согласно рекомендациям ВОЗ (2010). В исследование включались только случаи с аденокарциномой. В паренхиматозном компоненте опухоли отдельно в слизистой оболочке, подслизистой основе, мышечном и серозном/ адвентициальном слоях выделяли железистоподобные, криброзные, солидные структуры и дискретные группы опухолевых клеток.
Иммуногистохимическое исследование выполнялось по стандартной методике. Применялись антитела фирмы Dako к CD34 (Clone QBEnd 10) и anti-VEGFR2 (Mouse monoclonal [EIC] to VEGF Receptor 2). На разной глубине инвазии опухоли изучалась плотность микрососудов и «сосудистых почек» новообразования, визуализированных с помощью позитивной экспресси CD34 и VEGFR в эндотелии. Подсчитывалось количество микрососудов при увеличении ×400 в 10 полях зрения. В операционном материале исследовали все удаленные лимфатические узлы. В препаратах, окрашенных гематоксилином и эозином, выявляли их метастатическое поражение. Обработка полученных данных выполнялась с использованием пакета программ «Statistica 10». Применялся критерий χ2. Обсуждались результаты с достоверностью различий при р<0,05.
Результаты
При изучении плотности микрососудов и «сосудистых почек» в опухолевой ткани на различной
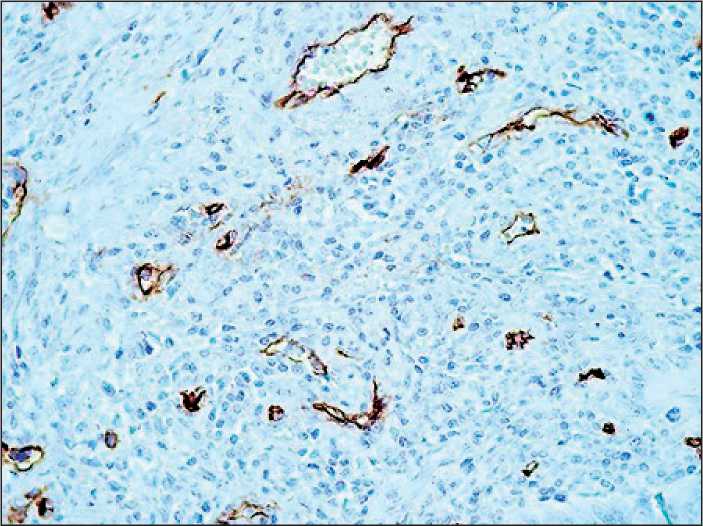
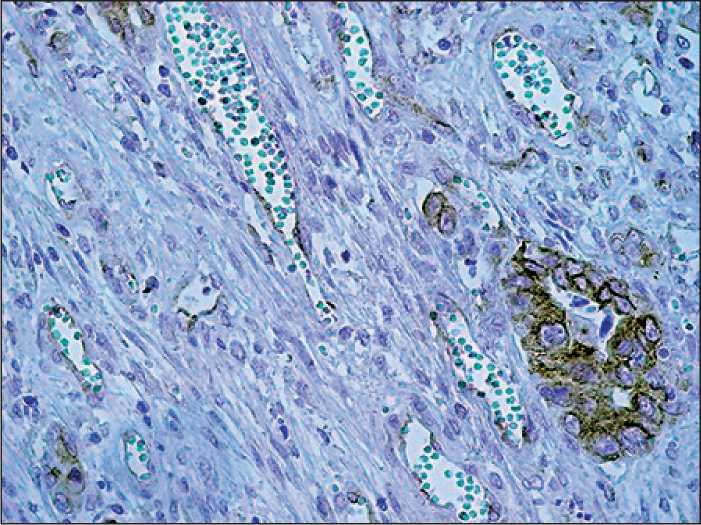
Рис. 2. Экспрессия VEGFR в опухолевых микрососудах и опухолевых структурах рака прямой кишки, ×400
Рис. 1. Экспрессия CD 34 в опухолевых микрососудах и «сосудистых почках», ×400
Таблица 1
Связь плотности микрососудов (экспрессия CD34) с лимфогенным метастазированием при раке прямой кишки
|
Глубина инвазии |
Плотность микрососудов |
F, р |
|
|
N o |
N+ |
||
|
Слизистая оболочка |
6,9 ± 5,2 (n=91) |
6,6 ± 3,4 (n=39) |
F=0,05; р=0,81 |
|
Подслизистый слой |
5,8 ± 4,2 (n=91) |
8,1 ± 7,0 (n=39) |
F=3,2; р=0,01 |
|
Мышечный слой |
5,3 ± 4,7 (n=91) |
7,0 ± 6,1 (n=39) |
F=0,2; р=0,13 |
|
Серозная оболочка |
0,8 ± 0,4 (n=91) |
1,7 ± 0,8 (n=39) |
F=3,2; р=0,07 |
|
Таблица 2 |
|||
|
Связь плотности «сосудистых почек» (экспрессия CD34) с лимфогенным метастазированием при |
|||
|
раке прямой кишки |
|||
|
Глубина инвазии |
Плотность «сосудистых почек» No N + |
F, р |
|
|
Слизистая оболочка |
4,0 ± 2,2 (n=91) |
2,9 ± 2,6 (n=39) |
F=1,18; р=0,27 |
|
Подслизистый слой |
4,0 ± 3,2 (n=91) |
3,9 ± 3,1 (n=39) |
F=0,64; р=0,43 |
|
Мышечный слой |
4,2 ± 3,4 (n=91) |
3,8 ± 3,2 (n=39) |
F=0,11; р=0,73 |
|
Серозная оболочка |
0,6 ± 0,1 (n=91) |
0,9 ± 0,2 (n=39) |
F=0,50; р=0,47 |
|
Таблица 3 |
|||
|
Связь плотности микросоудов (экспрессия VEGFR) с лимфогенным метастазированием при раке |
|||
|
прямой кишки |
|||
|
Глубина инвазии |
Плотность N0 |
микрососудов N+ |
F, р |
|
Слизистая оболочка |
1,4 ± 0,9 (n=91) |
1,8 ± 1,2 (n=39) |
F=0,91; р=0,34 |
|
Подслизистый слой |
1,4 ± 1,1 (n=91) |
1,6 ± 1,2 (n=39) |
F=0,36; р=0,54 |
|
Мышечный слой |
1,2 ± 0,5 (n=91) |
1,2 ± 0,2 (n=39) |
F=0,02; р=0,88 |
|
Серозная оболочка |
0,2 ± 0,1 (n=91) |
0,6 ± 0,3 (n=39) |
F=2,07; р=0,15 |
Таблица 4
Связь плотности «сосудистых почек» (экспрессия VEGFR) с лимфогенным метастазированием при раке прямой кишки
Плотность микрососудов в слизистой, мышечной, серозной оболочках прямой кишки не различалась в группах с наличием или отсутствием лимфогенных метастазов. Плотность «сосудистых почек» во всех слоях стенки прямой кишки не была связана с лимфогенным метастазированием (табл. 2).
Изучение аналогичных параметров неоангиогенеза в аденокарциномах прямой кишки с использованием антитела к VEGFR (рис. 2) выявило, что плотность микрососудов в слизистой оболочке, подслизистом и мышечном слоях, серозной оболочке прямой кишки не различалась в группах с наличием или отсутствием лимфогенных метастазов (табл. 3). Плотность «сосудистых почек» во всех слоях стенки прямой кишки не была связана с лимфогенным метастазированием (табл. 4).
Заключение
Проведенное исследование показало, что экспрессия молекулярно-биологических маркеров неоангиогенеза в опухолевой ткани при аденокарциноме прямой кишки связана с параметрами лимфогенного метастазирования. Следует отметить, что целесообразно выполнять изолированную оценку экспрессионных параметров показателей неоангиогенеза CD34 и VEGFR в опухолевой ткани в разных слоях стенки кишки. Выявленная закономерность увеличения плотности микрососудов в опухолевой ткани в подслизистом слое прямой кишки, отмеченная при позитивной экспрессии антитела к CD34, была ассоциирована с лимфогенным метастазированием. Подобный феномен может указывать на повышенный риск развития этого варианта опухолевой прогрессии уже на ранних стадиях заболевания. Плотность микрососудов, оцененная с использованием антитела к VEGFR не была связана с высоким риском лимфогенного метастазирования, что, несомненно, требует дальнейшего пристального изучения этого маркера в отношении его ассоциации с параметрами опухолевой прогрессии.
Список литературы Связь параметров опухолевого неоангиогенеза с лимфогенным метастазированием при раке прямой кишки
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Intern J Cancer. 2015; 136 (5): E359-E386.
- Афанасьев С.Г., Добродеев А.Ю. Циторедуктивные операции (Нужно ли удалять первичную опухоль? Где предел разумной циторедукции? Практическая онкология. 2014; 15 (2): 93-100.
- Goel S., Duda D.G., Xu L., Munn L.L., Boucher Y., Fukumura D., Jain R.K. Normalization of the vasculature for treatment of cancer and other diseases. Physiol Rev. 2011 Jul; 91 (3): 1071-121. DOI: 10.1152/physrev.00038.2010
- Oklu R., Walker T.G., Wicky S., Hesketh R.J. Angiogenesis and current antiangiogenic strategies for the treatment of cancer. J Vasc Interv Radiol. 2010 Dec; 21 (12): 1791-805. DOI: 10.1016/j.jvir.2010.08.009
- Marioni G., Staffiery A., Manzato E., Ralli G., Lionello M., Giacomelli L., Prosenikliev V., Marchese-Ragona R., Busnardo A., Bolzetta F., Blandamura S. A higher CD105-assessed microvessel density andvorse prognosis in elderly patients with laryngeal carcinoma. Arch Otolaryngol Head Neck Surg. 2011 Feb; 137 (2): 175-80. DOI: 10.1001/archoto.2010.244


