Связь полиморфизмов гена CYP2C19 и клинических исходов у пациентов с инфарктом миокарда в течение 60 месяцев наблюдения
Автор: Гражданкин И.О., Прохорихин А.А., Байструков В.И., Кретов Е.И., Чернявский А.М., Лукинов В.Л.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Патологическая физиология
Статья в выпуске: 4 т.27, 2023 года.
Бесплатный доступ
Цель. Оценить взаимосвязь полиморфизмов гена CYP2C19 и клинических исходов у пациентов после успешной реваскуляризации по поводу острого инфаркта миокарда с подъемом и без подъема сегмента ST на фоне терапии клопидогрелом на протяжении 60 мес. наблюдения.
Клопидогрел, острый коронарный синдром, полиморфизм cyp2c19, предиктор неблагоприятного исхода, реваскуляризация миокарда
Короткий адрес: https://sciup.org/142240113
IDR: 142240113 | DOI: 10.21688/1681-3472-2023-4-64-76
Текст научной статьи Связь полиморфизмов гена CYP2C19 и клинических исходов у пациентов с инфарктом миокарда в течение 60 месяцев наблюдения
Цитировать: Гражданкин И.О., Прохорихин А.А., Байструков В.И., Кретов Е.И., Чернявский А.М., Лукинов В.Л. Связь полиморфизмов гена CYP2C19 и клинических исходов у пациентов с инфарктом миокарда в течение 60 месяцев наблюдения. Патология кровообращения и кардиохирургия. 2023;27(4):64-76. https:// org/10.21688/1681-3472-2023-4-64-76
Ишемическая болезнь сердца является ведущей причиной смерти и инвалидизации в Европе и Северной Америке [1]. Обострение этой патологии — ключевой фактор в развитии неблагоприятных событий. Предпочтительные методы лечения пациентов — первичная чрескожная транслюминальная коронарная ангиопластика с имплантацией стента при остром коронарном синдроме (ОКС) с подъемом сегмента ST и ранняя реваскуляризация при ОКС без подъема ST.
Клопидогрел, тикагрелор и прасугрел в сочетании с аспирином составляют основу антиагрегантной терапии пациентов с инфарктом миокарда (ИМ), перенесших реваскуляризацию [2; 3]. Исследования с клопидогрелом наиболее привлекательны для применения их результатов в клинической практике как со стороны клинических преимуществ, так и со стороны экономических предпосылок. Клопи-догрел — оральный необратимый тиенопиридино-вый блокатор P2Y12-рецепторов тромбоцитов. Является пролекарством, метаболизирующимся через систему цитохромов P450 печени, в секреции которых ведущую роль играет ген CYP2C19 [4].
Генетический полиморфизм CYP450 предполагает различные варианты фармакокинетики препаратов. Так называемый дикий тип гена, аллель CYP2C19*1 , характеризуется нормальной ферментативной активностью CYP2C19. Другой аллельный вариант, CYP2C19*2 , наоборот, связан со сниженной ферментативной активностью изофермента, так же как варианты *3–*8. Аллели CYP2C19*2 и CYP2C19*3 часто называют аллелями сниженной функции или активности фермента цитохрома Р450 и обозначают аббревиатурой LOF (англ. loss of function). Носительство указанных полиморфизмов может быть связано со сниженным метаболизмом клопидогре-ла, что предполагает ослабление его антитромбо-тического эффекта.
Клиническая значимость наличия полиморфизма гена CYP2C19 показана в нескольких крупных исследованиях [5–9]. Риск повторного ишемического события в виде комбинированной конечной точки (сердечно-сосудистая смерть, ИМ, инсульт) или тромбоза стента кратно увеличивался (от 1,5 до 2,8 раза) в группе носителей LOF-аллелей в сравнении с носителями нормальных аллелей в течение 12 мес. наблюдения.
Возможность определять генетические особенности каждого пациента позволяет проводить персонифицированный подбор антитромбоцитарной терапии при ОКС и предлагать больным наиболее безопасный и эффективный вариант. Более того, поскольку цитохром CYP2C19 участвует в метаболизме до 15 % известных препаратов [10], интересно оценить полиморфизм ответственного за его экспрессию гена и отдаленные результаты за пределами периода двойной антитромбоцитарной терапии.
Цель — исследовать взаимосвязь полиморфизмов гена CYP2C19 и клинических исходов у пациентов после успешной реваскуляризации миокарда по поводу острого ИМ с подъемом и без подъема сегмента ST в течение 5-летнего периода наблюдения.
Методы
С 2011 по 2012 г. в НМИЦ им. ак. Е.Н. Мешалкина выполнен проспективный отбор участников среди пациентов, перенесших коронарное стентирование. Исследование одобрено локальным этическим комитетом НМИЦ им. ак. Е.Н. Мешалкина (протокол № 216 от 19.05.2011 г.). Всем больным, успешно прошедшим скрининг, согласно требованиям стандарта надлежащей клинической практики (англ. Good Clinical Practice), предложено добровольное участие в исследовании с обязательным подписанием информированного согласия.
Для включения в исследование требовалось сочетание трех критериев: острый ИМ с подъемом и без подъема сегмента ST, подтвержденный повышением уровня тропонина; успешно проведенная реваскуляризация методом чрескожной транслюминальной коронарной ангиопластики (со стентированием или без) либо аортокоронарного шунтирования; генетическое тестирование на полиморфизм гена CYP2C19 (аллели *2, *3, *17). Критериями невключения являлись: отказ пациента от участия в исследовании; наличие декомпенсации хронического заболевания; активное или недавно перенесенное большое кровотечение; наличие известного онкологического заболевания; возраст менее 18 или более 85 лет; кровоток TIMI 0–I после реваскуляризации связанной с ИМ артерии. В течение первых двух суток после реваскуляризации прооперированных наблюдали по поводу возможных осложнений, связанных как с течением ИМ, так и с процедурой: смерть; кардиогенный шок; желудочно-кишечное кровотечение, иное кровотечение, потребовавшее гемотрансфузии; инсульт; развившаяся пневмония; тромбоэмболия легочной артерии; периопераци-онный ИМ. При развитии вышеописанных осложнений больных, согласно протоколу, не включали в исследование.
Пациенты получали двойную антитромбоцитар-ную терапию, включавшую аспирин (125 мг/сут.) и клопидогрел (нагрузочная доза 300–600 мг, далее 150 мг/сут. в течение 7 дней и переход на 75 мг ежедневно). В случае выполнения аортокоронарного шунтирования терапию прерывали в периопераци-онном периоде и возобновляли после достижения стойкого гемостаза. Рекомендованная продолжительность двойной антитромбоцитарной терапии составляла 12 мес. после инфаркта миокарда.
Все пациенты к концу первых суток получили терапию β-блокатором (метопролола сукцинат или карведилол) или верапамилом, статином (аторвастатин или розувастатин). В течение 48 ч всем больным начали терапию ингибиторами ангиотен-зинпревращающего фермента или антагонистом рецепторов ангиотензина II (валсартан или канде-сартан).
Каждые полгода на протяжении 5 лет осуществляли обязательный телефонный контакт с пациентами для оценки конечных точек. При повторных госпитализациях в НМИЦ им. ак. Е.Н. Мешалкина для реваскуляризации проводили очный осмотр, сбор и анализ медицинской документации.
Конечные точки
Первичная конечная точка (комбинированная) включала такие события, как смерть от всех причин, повторный ИМ и инсульт в течение 60 мес. наблюдения. Вторичными конечными точками определили повторный ИМ за периоды наблюдения 12 мес. и 60 мес., кровотечение в течение 12 мес. после индексной реваскуляризации.
Оценивали неблагоприятные события объединенной группы носительства дефектных аллелей (группа LOF CYP2C19*2 и CYP2C19*3 ) в сравнении с нормой (группа дикого типа CYP2C19 ), а также анализировали результаты сравнения вторичных конечных точек между группами дикого типа, гомозиготного (*2/*2), гетерозиготных (*1/*2, *1/*3) вариантов. Для оценки первичной комбинированной конечной точки сравнивали объединенную группу носительства дефектных аллелей с группой носительства дикого типа.
Смерть определяли как документально подтвержденное фатальное событие сердечно-сосудистого или другого генеза. Повторный ИМ — событие, подтвержденное повышением уровня тропонина в сочетании с клиникой затяжной боли в груди или результатом аутопсии. Инсульт — повреждение головного мозга в результате ишемии или кровоизлияния, установленное по результатам томографии головного мозга или аутопсии.
Статистический анализ
При предварительной проверке непрерывных данных критерием Шапиро – Уилка не выявили нормально распределенных данных. Описательная статистика непрерывных данных представлена в виде медианы и 25–75% процентилей (Ме [Q1; Q3]); категориальных и бинарных данных — в виде абсолютных и относительных (%) значений. Межгрупповое сравнение непрерывных данных проводили U-критерием Манна – Уитни. Сравнение качественных бинарных и категориальных показателей осуществляли с помощью точного критерия Фишера. Для исследования динамики выживаемости и свободы от осложнений строили графики Каплана – Майера, таблицы выживаемости; значимые различия совокупных рисков между группами выявляли с помощью логрангового критерия. Предикторы осложнений определяли построением однофакторных и многофакторных моделей пропорциональных рисков Кокса для ковариат, которые отражены в табл. 1, и генетического полиморфизма CYP450. В многофакторной модели представлены все входящие ковариаты. Отношение рисков (ОР) приведено для однофакторных моделей Кокса, если не указано, что речь идет о многофакторной модели. Все использованные статистические критерии были двусторонними.
Проверку статистических гипотез проводили при критическом уровне значимости р = 0,05, то есть различие считали статистически значимым, если p < 0,05. Все статистические расчеты выполняли в среде раз-
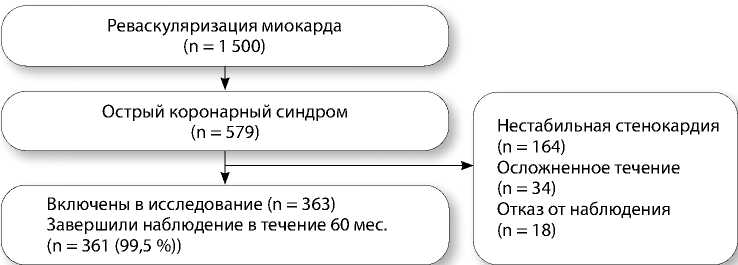
Рис. 1. Профиль исследования
работки RStudio версии 1.2.5001 (RStudio, Inc., Бостон, США) на языке R версии 3.6.1 (The R Foundation for Statistical Computing, Вена, Австрия).
Результаты
В период с 2011 по 2012 г. в центре интервенционной кардиологии НМИЦ им. ак. Е.Н. Мешал-кина было выполнено более 1 500 процедур коронарографии и последующей реваскуляризации миокарда методами чрескожной транслюминальной коронарной ангиопластики (со стентированием коронарных артерий или без) и аортокоронарного шунтирования. Среди данной популяции после скрининга выделили группу пациентов с ОКС, представленным острым ИМ с подъемом и без подъема сегмента ST. На этапе включения в исследование у 34 больных возникли осложнения в раннем послеоперационном периоде, 18 человек отказались от участия (рис. 1).
Всего в исследование было вовлечено 363 пациента с ИМ с подъемом и без подъема сегмента ST. Медиана возраста составила 57 [51; 64] лет. Из общего количества больных 286 (78,8 %) — мужчины и 77 (21,2 %) — женщины. Передний (54 %) и непередний (46 %), в том числе нижний и задний, ИМ представлены в равной степени. ИМ в анамнезе имели 17 % пациентов. Крупноочаговый (с формированием патологического зубца Q) ИМ диагностировали у 291 больного, мелкоочаговый — у 72 человек. У всех исследуемых выявили повышенный уровень тропонина: медиана 3,8 [1,8; 12,0] нг/мл при уровне 99-го процентиля 0,99 нг/мл. Большая часть (83,2 %) пациентов имела в анамнезе артериальную гипертензию. Более половины — стаж табакокурения. По результатам анализов диагностировали гиперхолестеринемию, медиана уровня липопротеидов низкой плотности 3,34 [2,59; 4,18] ммоль/л. Фрак- ция выброса левого желудочка в целом оказалась сохранной, медиана 53 [47; 58] %. Значимые стенозы в коронарных артериях определяли как стенозы 70 % и более по данным коронарографии. В совокупности диагностировали 557 стенозов коронарных артерий: поражение ствола левой коронарной артерии у 3 % пациентов, передней нисходящей артерии — 63 %, огибающей артерии — 42 %, правой коронарной артерии — 55 %. После коронарографии выполняли реваскуляризацию: ангиопластику пораженных артерий в 24 (6,6 %) случаях, ангиопластику со стентированием — 335 (92,3 %), аортокоронарное шунтирование — 4 (1,1 %).
Среди всех пациентов носительство LOF-аллели CYP2C19*2 выявили у 105 человек: у 91 (25,1 %) — гетерозиготный генотип (*1/*2), у 14 (3,9 %) — гомозиготный (*2/*2). LOF-аллель CYP2C19*3 имели 6 (1,7 %) больных, у всех гетерозиготный генотип (*1/*3).
Исходные данные пациентов, разделенных на группы по отсутствию или наличию аллелей, снижающих метаболизм клопидогрела, представлены в табл. 1. Изначально на основании результатов электрокардиографии выявили различие между группами по глубине ИМ: у большей части больных с LOF-аллелями в сравнении с группой дикого типа имелся крупноочаговый ИМ (86,5 против 77,4 %, p = 0,047). Данная клиническая ситуация объясняет более высокую концентрацию тропонина у группы пациентов с LOF-аллелями (4,71 против 3,20 нг/мл, р = 0,049). По этой же причине (наличие крупноочагового ИМ) конечные диастолический и систолический объемы больше в группе пациентов с LOF-аллелями в сравнении с пациентами с нормальным генотипом (107 против 99 мл, р = 0,015 и 50 против 45 мл, р = 0,048 соответственно). По другим показателям клинической или статистической разницы между группами не обнаружили.
Табл. 1. Дооперационные клинико-демографические показатели
|
Показатель |
Популяция исследования CYP2C19 , n = 363 |
Дикий тип CYP2C19 , n = 252 |
LOF CYP2C19*2 + CYP2C19*3 , n = 111 |
p |
|
Мужчины, n (%) |
286 (78,8) |
192 (76,2) |
94 (84,7) |
0,072 |
|
Передний инфаркт миокарда, n (%) Непередний инфаркт миокарда, n (%) |
196 (54) 167 (46) |
140 (55,6) 112 (44,4) |
56 (50,5) 55 (49,5) |
0,424 |
|
Повторный инфаркт миокарда, n (%) |
61 (17) |
39 (15) |
22 (20) |
0,361 |
|
Q-позитивный инфаркт миокарда, n (%) Q-негативный инфаркт миокарда, n (%) |
291 (80,2) 72 (19,8) |
195 (77,4) 57 (22,6) |
96 (86,5) 15 (13,5) |
0,047* |
|
Табакокурение, n (%) |
213 (59) |
143 (57) |
70 (63) |
0,298 |
|
Артериальная гипертензия, степень, n (%) 0 — нет артериальной гипертензии 1 2 3 |
61 (16,8) 16 (4,4) 44 (12,1) 242 (66,7) |
41 (16,3) 8 (3,2) 32 (12,7) 171 (67,9) |
20 (18) 8 (7,2) 12 (10,8) 71 (64) |
0,324 |
|
Инфаркт миокарда с желудочковой тахикардией, n (%) |
15 (4) |
9 (4) |
6 (5) |
0,405 |
|
Инфаркт миокарда с фибрилляцией предсердий, n (%) |
27 (7) |
22 (9) |
5 (4) |
0,195 |
|
Инфаркт миокарда с атриовентрикулярной блокадой 2-й и 3-й степеней, n (%) |
11 (3) |
7 (3) |
4 (4) |
0,742 |
|
Язвенная болезнь, n (%) |
38 (10) |
29 (12) |
9 (8) |
0,36 |
|
Хроническая обструктивная болезнь легких, n (%) |
19 (5) |
15 (6) |
4 (4) |
0,449 |
|
Сахарный диабет, n (%) |
65 (18) |
49 (19) |
16 (14) |
0,299 |
|
Поражение ствола левой коронарной артерии, n (%) |
10 (3) |
7 (3) |
3 (3) |
> 0,999 |
|
Поражение передней нисходящей артерии, n (%) |
227 (63) |
161 (64) |
66 (59) |
0,48 |
|
Поражение огибающей артерии, n (%) |
151 (42) |
102 (40) |
49 (44) |
0,564 |
|
Поражение правой коронарной артерии, n (%) |
199 (55) |
131 (52) |
68 (61) |
0,11 |
|
Реваскуляризация миокарда, n (%): ЧТКА ЧТКА + стент АКШ |
24 (6,6) 335 (92,3) 4 (1,1) |
19 (7,5) 230 (91,3) 3 (1,2) |
5 (4,5) 105 (94,6) 1 (0,9) |
0,652 |
|
Возраст, лет |
57 [51; 64] |
57 [51,75; 63,00] |
57 [50,5; 64,0] |
0,971 |
|
Холестерин общий, ммоль/л |
5,4 [4,54; 6,33] |
5,495 [4,62; 6,30] |
5,29 [4,40; 6,38] |
0,883 |
|
Липопротеины низкой плотности, ммоль/л |
3,34 [2,59; 4,18] |
3,38 [2,62; 4,18] |
3,20 [2,49; 4,22] |
0,556 |
|
Липопротеины высокой плотности, ммоль/л |
1,01 [0,82; 1,28] |
1,03 [0,86; 1,28] |
0,97 [0,80; 1,27] |
0,341 |
|
Триглицериды, ммоль/л |
1,91 [1,38; 2,75] |
1,93 [1,35; 2,75] |
1,9 [1,46; 2,72] |
0,743 |
|
Тропонин, нг/мл |
3,8 [1,8; 12,0] |
3,2 [1,70; 10,68] |
4,71 [2,0; 15,8] |
0,049* |
|
Гемоглобин, г/л |
143 [132,5; 152,0] |
141,5 [131,75; 151,00] |
145 [136; 153] |
0,059 |
|
Фракция выброса левого желудочка, % |
53 [47; 58] |
53 [47; 59] |
52 [47; 57] |
0,356 |
|
Конечный диастолический объем, мл |
101 [86; 123] |
99 [84; 118] |
107 [91,0; 131,5] |
0,015* |
|
Конечный систолический объем, мл |
47 [36; 63] |
45 [36; 61] |
50 [40; 68] |
0,048* |
|
Креатинин, мкмоль/л |
95 [86,00; 107,95] |
96 [86,0; 107,5] |
94 [85,5; 107,9] |
0,76 |
Примечание. LOF — англ. loss of function, потеря функции; ЧТКА — чрескожная транслюминальная коронарная ангиопластика;
АКШ — аортокоронарное шунтирование; * — статистически значимое различие. Данные представлены как Ме [Q1; Q3] или как n (%).
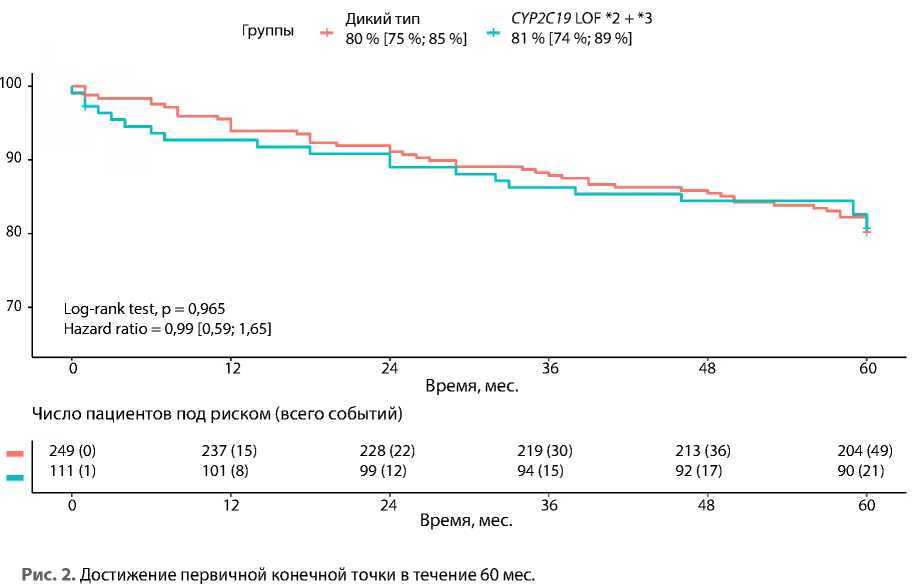
Результаты наблюдения в течение 12 мес. и медикаментозное лечение отражены в предыдущей публикации [11]. В течение 60 мес. после оперативного вмешательства был потерян контакт с двумя пациентами. За этот период события первичной комбинированной конечной точки (смерть от всех причин, повторный ИМ или инсульт) зарегистрированы у 71 из 361 больного: у 50 (20 %, 95% дове- рительный интервал (ДИ) 16–25) в группе с диким генотипом и у 21 (19 %, 95% ДИ 13–27) в группе LOF-аллелей *2 + *3. Различия не имели статистической значимости [ОР 0,99, 95% ДИ 0,59–1,65, лог-ранк тест, p = 0,965] (табл. 2, рис. 2).
Связь носительства LOF-аллелей гена CYP2C19 и наступления первичной конечной точки также не обнаружена при отдельном анализе каждой аллели:
Табл. 2. Клинические исходы в группах дикого типа и LOF CYP2C19*2 , CYP2C19*3 через 60 мес. наблюдения
|
Осложнение |
Дикий тип CYP2C19 , n = 252 |
LOF CYP2C19*2 + CYP2C19*3 , n = 111 |
ОР [95% ДИ] |
p |
|
Летальность от всех причин, n (%) [95% ДИ] |
22 (9) [5–12] |
10 (9) [4–14] |
1,05 [0,5–2,2] |
0,906 |
|
Повторный инфаркт миокарда, n (%) [95% ДИ] |
28 (11) [7–15] |
14 (13) [6–19] |
1,14 [0,6–2,2] |
0,689 |
|
Инсульт, n (%) [95% ДИ] |
7 (3) [1–6] |
1 (1) [0–5] |
0,32 [0,0–2,6] |
0,260 |
|
Комбинированная конечная точка (летальность от всех причин, повторный инфаркт миокарда, инсульт), n (%) [95% ДИ] |
50 (20) [16–25] |
21 (19) [13–27] |
0,99 [0,6–1,7] |
0,965 |
|
Повторная чрескожная транслюминальная коронарная ангиопластика, n (%) [95% ДИ] |
110 (46) [39–52] |
55 (50) [40–59] |
1,13 [0,8–1,6] |
0,445 |
|
Повторное аортокоронарное шунтирование, n (%) [95% ДИ] |
8 (3) [2–6] |
3 (3) [1–8] |
0,85 [0,2–3,2] |
0,813 |
Примечание. LOF — англ. loss of function, потеря функции; ОР — отношение рисков; ДИ — доверительный интервал.
комбинация гомо- и гетерозиготы LOF CYP2C19*2 против дикого типа [ОР 1,00, 95% ДИ 0,60–1,68, p = 0,998]; гетерозигота LOF CYP2C19*3 против дикого типа [ОР 0,86, 95% ДИ 0,12–6,20, лог-ранк тест, p = 0,882].
За 5-летний период наблюдения повторный ИМ развился у 42 (12 %, 95% ДИ 9–15) пациентов.
При анализе путем построения однофакторных моделей регрессии Кокса не выявили статистически значимой связи гомозиготного варианта CYP2C19
(*2/*2) по сравнению с диким типом (*1/*1) и гетерозиготой (*1/*2) с развитием ИМ в течение 60 мес. наблюдения [ОР 1,28, 95% ДИ 0,31–5,38, p = 0,733 и ОР 1,19, 95% ДИ 0,26–5,36, p = 0,823 соответственно] (рис. 3). В объединенной группе носительство хотя бы одной LOF-аллели (*2/*2 + *1/*2 + *1/*3) CYP2C19 также не являлось статистически значимым предиктором повторного ИМ [ОP 1,14, 95% ДИ 0,60–2,17, лог-ранк тест, p = 0,681].
% ,атьлусни и адракоим ыппур аткрафни ,итсоньлател то адобовС
Группы
Дикий тип CYP2C19 (*1/*1) 89 % [85 %; 93 %]
Гетерозигота CYP2C19 (*1/*2) 88 % [81 %; 95 %]
Гомозигота CYP2C19 (*2/*2) 86 % [69 %; 100 %]
% ,адракоим аткрафни огоннесенереп то адобовС
|
0 |
12 |
24 |
36 |
48 |
60 |
|
Число пациентов под риском (всего событий) |
Время мес. |
||||
|
255 (0) |
248 (9) |
241 (14) |
236 (20) |
232 (24) |
227 (29) |
|
91 (0) |
86 (5) |
85 (7) |
83 (8) |
83 (8) |
82 (11) |
|
14 (0) |
13 (1) |
13 (1) |
13 (1) |
12 (2) |
12 (2) |
|
0 |
12 |
24 |
36 Время, мес. |
48 |
60 |
ыппур
Рис. 3. Достижение вторичной конечной точки: инфаркт миокарда в течение 60 мес. наблюдения
Отношение рисков [95% доверительный интервал]
|
2,93 Креатинин выше 105 ммоль/л [1,46–5,90] |
1---------------■--------------- 1 0,003* |
|
Гемоглобин ниже 129,5 г/л 2,74 [1,33–5,60] |
1----------------■----------------1 0,006* |
|
Фракция выброса левого 2,78 желудочка ниже 46,5 % [1,38–5,60] |
1---------------■---------------1 0,004* |
|
Возраст от 65,5 года 2,77 [1,34–5,70] |
1----------------■----------------1 0,006* |
|
CYP2C19 LOF *2 + *3 0,88 i-------------- против дикого типа CYP2C19 [0,41–1,90] |
-----------------1 0,751 |
|
# Events: 32; Global p-value (Log-Rank): 1,6244e-05 AIC: 353,2; Concordance Index: 0,74 0,5 1 |
2 5 |
Рис. 4. Предикторы летальности в течение 60 мес. наблюдения: многофакторная модель регрессии Кокса
Не связанные с носительством аллелей гена CYP2C19 предикторы летальности через 60 мес. наблюдения
В дополнительно проведенном анализе путем построения многофакторной модели регрессии Кокса выявили значимые предикторы летальности в течение 60 мес. наблюдения (рис. 4).
Обсуждение
В результате проведенного исследования нами не выявлено связи полиморфизма гена CYP2C19 с ишемическими событиями первичной конечной точки (смерть, ИМ, инсульт) в течение 60 мес. наблюдения. В более раннем анализе данных мы также не обнаружили значимого влияния носительства LOF-аллелей гена CYP2C19 в сравнении с нормальными аллелями на достижение комбинированной конечной точки (сердечно-сосудистая смерть, ИМ, инсульт) через 12 мес. [11]
Клопидогрел является наиболее часто назначаемым ингибитором P2Y12-рецепторов тромбоцитов. Общая доля этого препарата на рынке антиагреган-тов развитых стран составляет более 70 % [12; 13]. В рутинной клинической практике ценность клопи-догрела прежде всего обусловлена низкой стоимостью, удобством применения и наличием большого числа еще более доступных качественных дженериков. Однако в сравнении с более новыми препаратами (тикагрелор, прасугрел) он имеет недостатки. Так, в ряде фармакокинетических исследований наглядно продемонстрировано, что носительство аллелей CYP2C19*2 и CYP2C19*3 наиболее значимо влияет на уменьшение концентрации как цитохрома P450, так и метаболитов клопидогрела [14]. В крупном метаанализе, авторы которого оценивали опыт применения клопидогрела в дозе 600 мг у 4 341 пациента, выявлено значительное влияние как гомо-, так и гетерозиготного вариантов генотипа CYP2C19*2 на высокий уровень остаточной реактивности тромбоцитов [15]. В отличие от клопидогрела, метаболизм тикагрелора и прасугрела не зависит от цитохрома Р450, а значит, и от влияния широко распространенных мутаций гена CYP2C19 . Таким образом, задача этой и ряда других работ — определить антитромбоцитарный препарат первой линии для лечения пациентов, успешно перенесших коронарную реваскуляризацию.
Взаимосвязь снижения метаболизма клопидо-грела в результате генетической предрасположен- ности и ишемических событий в отдаленном периоде показана в нескольких работах [4; 16–19]. J.-P. Collet и соавт. в когортном исследовании установили, что носительство LOF-аллелей влияет на частоту событий первичной конечной точки (сердечно-сосудистая смерть, нефатальный ИМ, повторная неотложная реваскуляризация) у молодых пациентов с ИМ, при этом нефатальный ИМ был доминирующим компонентом указанной точки и чаще развивался в группе носителей LOF-аллелей [отношение шансов (ОШ) 5,57, 95% ДИ 1,94–16,01, p < 0,001] [7].
В исследовании D.L. Bhatt и соавт., а также анализе 326 публикаций, проведенном I.J. Dahabreh и со-авт., выявлено повышение риска ишемических событий у пациентов, имеющих LOF-аллели CYP2C19 , как в группе пациентов, получавших клопидогрел, так и в группе плацебо [20; 21]. Одним из множества возможных объяснений может являться то, что, по данным C. Bertrand-Thiébault и соавт., носители LOF-аллелей CYP2C19 имеют высокий уровень провоспа-лительных маркеров [22]. Тем не менее M.V. Holmes и соавт. в метаанализе 32 исследований, включавшем 42 016 больных, не обнаружили взаимосвязи между особенностями генотипа CYP2C19 и клиническими сердечно-сосудистыми событиями, хотя носительство дефектных аллелей CYP2C19 обусловливало снижение уровня активного метаболита кло-пидогрела в крови [15].
В исследовании TRITON-TIMI 38 терапия прасу-грелом имела наибольшее преимущество в снижении частоты ишемических событий в сравнении с клопидогрелом в группе пациентов — носителей LOF-аллелей [23]. В исследовании PLATO, включавшем 10 285 больных ОКС с проведенным генетическим анализом, тикагрелор в сравнении с клопи-догрелом был более эффективен в профилактике повторных ишемических событий вне зависимости от генотипа CYP2C19 : 8,6 против 11,2 % [ОШ 0,77, 95% ДИ 0,60–0,99, p = 0,0380] у носителей любой LOF-аллели; 8,8 против 10,0 % [ОШ 0,86, 95% ДИ 0,74–1,01, p = 0,0608] у пациентов без LOF-аллелей. Примечательно, что авторы не выявили статистически значимых различий в частоте ишемических событий у исследуемых с нормальным генотипом CYP2C19 . При этом в группе клопидогрела повторные события через 30 дней наблюдения статистически значимо чаще возникали в группе с LOF-аллелями CYP2C19 (5,7 против 3,8 %, p = 0,028), что приводило к раннему различию в частоте событий в группах лечения пациентов с разными генетическими вариантами CYP2C19 [24].
Различные исследователи высказывали предположение о вероятном увеличении количества ишемических событий в первый год наблюдения у носителей LOF-аллелей метаболизма клопидогрела. Однако наши результаты этого не подтвердили [11]. Тем не менее в ходе вторичного анализа повторных ИМ в течение 12 мес. мы выявили значимость гомозиготного варианта CYP2C19*2 (*2/*2). Носительство указанного варианта увеличивает вероятность развития повторного ИМ в сравнении с диким типом и гетерозиготой [ОШ 5,45, 95% ДИ 1,14–19,97, p < 0,016]. В последующем же значимость наличия гомозиготного варианта LOF-аллелей снижается: в течение 60 мес. наблюдения не выявлено статистически значимой разницы по числу событий ни в группе только гомозигот (*2/*2), ни в объединенной группе (*2/*2 + *1/*2 + *1/*3) в сравнении с диким типом. То есть статистически значимой связи полиморфизма гена CYP2C19 (аллели *2, *3) с развитием повторного ИМ в течение 5-летнего наблюдения не обнаружено.
Предотвращение ранних ишемических событий (тромбоз стента, повторный ИМ) после реваскуляризации можно объяснить агрессивной антитромботической терапией во время госпитализации у всех пациентов исследования: нагрузочная доза клопидогрела 600 мг, далее 150 мг/сут. в течение 7 дней и переход на поддерживающую дозу 75 мг/сут. Данная стратегия позволяет снизить высокую активность тромбоцитов в периоперационном и раннем послеоперационном периодах и уменьшить частоту повторных ишемических событий в отдаленном периоде [25–28]. Однако в более позднем метаанализе выявлено, что использование высоких доз клопидогрела у пациентов — носителей LOF-аллелей не приводило к снижению как клинических конечных точек, так и суррогатных (высокая активность тромбоцитов на терапии антиагре-гантами) [29].
При этом разнятся данные об эффективности дозы аспирина более 75–100 мг на фоне приема различных ингибиторов P2Y12-рецепторов тромбоцитов [30]. Доза аспирина 125 мг/сут. была своеобразным стандартом в нашей клинической практике во время проведения исследования. Потенциально это можно объяснить, во-первых, тем, что это привычная доза препарата — четверть стандартной таблетки ацетилсалициловой кислоты (500 мг), во-вторых, попыткой преодолеть повышенную агрегацию тромбоцитов большей (должной) дозой ингибитора циклооксигеназы-2.
Эффективность антиагрегантной терапии зависит от технически корректного выполнения реваскуляризации инфаркт-связанной артерии и прочих гемодинамически значимых стенозов. Надлежащая техника ангиопластики с имплантацией стента в артерию обусловливает эффективность реваскуляризации в отдаленном периоде за счет снижения количества повторных реваскуляризаций, тромбозов стентов и связанных с ними фатальных исходов.
Вышесказанное в совокупности с результатами настоящего исследования позволяет нам сделать осторожный вывод о снижении значимости генетических факторов метаболизма клопидогрела на клинические исходы после окончания стационарного этапа ранних ишемических событий. Нами установлено, что носительство гомозиготного варианта CYP2C19*2 (*2/*2) ассоциировано с частотой развития нефатального ИМ в течение 12 мес., но при более длительном наблюдении (60 мес.) роль полиморфизма снижается, что, возможно, связано с прекращением терапии после года приема. При этом потенциального значения провоспалитель-ных факторов, влияющих на развитие неблагоприятных событий, не выявлено. Необходимо отметить косвенный анализ этого заключения, так как мы не обнаружили значимого различия в частоте ИМ или фатальных событий между группами с LOF-аллелями CYP2C19 и без них.
Прочими предикторами смерти от всех причин, не связанными с генотипом, были возраст, уровень гемоглобина, повышение креатинина крови и снижение фракции выброса левого желудочка, что совпадает с имеющимися представлениями о неблагоприятных событиях в постинфарктном периоде.
Таким образом, представленная работа расширяет знания о значимости клинического применения клопидогрела у пациентов, успешно перенесших коронарную реваскуляризацию, в общем и о взаимосвязи полиморфизма гена CYP2C19 с отдаленными неблагоприятными событиями в частности. По итогам анализа мы можем утверждать, что клопи-догрел укрепил свои позиции в качестве антитром-боцитарного препарата первой линии.
Ограничения
Ограничением работы является относительно небольшой размер выбранной популяции. Однако, поскольку это единственное проспективное исследование, где оценены 5-летние результаты у пациентов с известным генотипом CYP2C19, предварительный расчет выборки был невозможен. Второе ограничение — неоднородность групп: в группу LOF *2 + *3 попадали больные в клинически более тяжелом состоянии, что, тем не менее, не повлияло на исходы по данным корреляционного анализа. Еще один фактор лимитации результатов — отсутствие контроля приверженности участников лекарственной терапии.
Заключение
-
1. Не выявлено связи полиморфизмов гена CYP2C19 (аллели *2, *3) и частоты развития первичной комбинированной конечной точки (смерть от всех причин, повторный ИМ, инсульт) у пациентов с ИМ после реваскуляризации миокарда на протяжении 60 мес. наблюдения.
-
2. Не выявлено связи гомозиготного варианта CYP2C19 (*2/*2) носительства аллелей, снижающих метаболизм клопидогрела, и повторного ИМ (вторичная конечная точка) у пациентов с ИМ после реваскуляризации миокарда при длительном периоде наблюдения до 60 мес. после исходного события.
-
3. Больший возраст, повышенный уровень креатинина, снижение гемоглобина и систолической функции сердца у пациентов с ИМ — предикторы преждевременной летальности в отдаленном периоде.
Список литературы Связь полиморфизмов гена CYP2C19 и клинических исходов у пациентов с инфарктом миокарда в течение 60 месяцев наблюдения
- Roth G.A., Mensah G.A., Johnson C.O., Addolorato G., Ammirati E., Baddour L.M., Barengo N.C., Beaton A.Z., Benjamin E.J., Benziger C.P., Bonny A., Brauer M., Brodmann M., Cahill T.J., Carapetis J., Catapano A.L., Chugh S.S., Cooper L.T., Coresh J., Criqui M., DeCleene N., Eagle K.A., Emmons-Bell S., Feigin V.L., Fernandez-Solà J., Fowkes G., Gakidou E., Grundy S.M., He F.J., Howard G., Hu F., Inker L., Karthikeyan G., Kassebaum N., Koroshetz W., Lavie C., Lloyd-Jones D., Luivi H.S., Mirijello A., Temesgen A.M., Mokdad A., Moran A.E., Muntner P., Narula J., Neal B., Ntsekhe M., Moraes de Oliveira G., Otto C., Owolabi M., Pratt M., Rajagopalan S., Reitsma M., Ribeiro A.L.P., Rigotti N., Rodgers A., Sable C., Shakil S., Sliwa-Hahnle K., Stark B., Sundstrom J., Timpel P., Tleyjeh I.M., Valgimigli M., Vos T., Whelton P.K., Yacoub M., Zuhlke L., Murray C., Fuster V.; GBD-NHLBI-JACC Global Burden of Cardiovascular Diseases Writing Group. Global burden of cardiovascular diseases and risk factors, 1990-2019: Update from the GBD 2019 Study. J Am Coll Cardiol. 2020;76(25):2982-3021. PMID: 33309175; PMCID: PMC7755038. https://doi. org/10.1016/j.jacc.2020.11.010
- Collet J.-P., Thiele H., Barbato E., Barthélémy O., Bauersachs J., Bhatt D.L., Dendale P., Dorobantu M., Edvardsen T., Folliguet T., Gale C.P., Gilard M., Jobs A., Juni P., Lambrinou E., Lewis B.S., Mehilli J., Meliga E., Merkely B., Mueller C., Roffi M., Rutten F.H., Sibbing D., Siontis G.C.M.; ESC Scientific Document Group. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021 ;42(14):1289-1367. Erratum in: Eur Heart J. 2021;42(19):1908. Erratum in: Eur Heart J. 2021;42(19):1925. Erratum in: Eur Heart J. 2021;42(23):2298. PMID: 32860058. https://doi.org/10.1093/ eurheartj/ehaa575
- Valgimigli M., Bueno H., Byrne R.A., Collet J.-P., Costa F., Jeppsson A., Juni P., Kastrati A., Kolh P., Mauri L., Montalescot G., Neumann F.-J., Petricevic M., Roffi M., Steg P.G., Windecker S., Zamorano J.L., Levine G.N.; ESC Scientific Document Group; ESC Committee for Practice Guidelines (CPG); ESC National Cardiac Societies. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39(3):213-260. PMID: 28886622. https://doi.org/10.1093/eurheartj/ehx419
- Shuldiner A.R., O'Connell J.R., Bliden K.P., Gandhi A., Ryan K., Horenstein R.B., Damcott C.M., Pakyz R., Tantry U.S., Gibson Q., Pollin T.I., Post W., Parsa A., Mitchell B.D., Faraday N., Herzog W., Gurbel P.A. Association of cytochrome P450 2C19 genotype with the antiplatelet effect and clinical efficacy of clopidogrel therapy. JAMA. 2009;302(8):849-857. PMID: 19706858; PMCID: PMC3641569. https://doi.org/10.1001/jama.2009.1232
- Зеленская Е.М., Барбараш О.Л., Ганюков В.И., Кочергин Н.А., Апарцин К.А., Горохова А.В., Папешина С.А., Николаев К.Ю., Батуева К.Ю., Янковская С.В., Тронин А.В., Лифшиц Г.И. Протокол: влияние сочетанного носительства СУР2С19*2 и *17 на эффективность лечения клопидогрелом. Российский кардиологический журнал. 2017;( 10):113-117. https://doi. org/10.15829/1560-4071-2017-10-113-117; Zelenskaya Е.М., Barbarash O.L., Ganyukov V.I., Kochergin N.A., Apartsin КА, Gorokhova A.V., Papeshina S.A., Nikolaev ^Yu., Batueva ^Yu., Yankovskaya S.V., Tronin A.V., Lifshits G.I. The protocol: influence of the combination carriage СУР2С19*2 and *17 on efficacy of clopidogrel. Russian Journal of Cardiology. 2017;(10):113-117. (In Russ.) https://doi. org/10.15829/1560-4071-2017-10-113-117
- Mega J.L., Close S.L., Wiviott S.D., Shen L., Walker J.R., Simon T., Antman E.M., Braunwald E., Sabatine M.S. Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITON-TIMI 38 trial: a pharmacogenetic analysis. Lancet. 2010;376(9749):1312-1319. PMID: 20801494; PMCID: PMC3036672. https://doi. org/10.1016/S0140-6736(10)61273-1
- Collet J.-P., Hulot J.-S., Pena A., Villard E., Esteve J.-B., Silvain J., Payot L., Brugier D., Cayla G., Beygui F., Bensimon G., Funck-Brentano C., Montalescot G. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study. Lancet. 2009;373(9660):309-317. PMID: 19108880. https://doi. org/10.1016/S0140-6736(08)61845-0
- Price M.J., Berger P.B., Teirstein P.S., Tanguay J.-F., Angiolillo D.J., Spriggs D., Puri S., Robbins M., Garratt K.N., Bertrand O.F., Stillabower M.E., Aragon J.R., Kandzari D.E., Stinis C.T., Lee M.S., Manoukian S.V., Cannon C.P., Schork N.J., Topol E.J.; GRAVITAS Investigators. Standard- vs highdose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAVITAS randomized trial. JAMA. 2011;305(11):1097-1105. Erratum in: JAMA. 2011;305(21):2174. Stillablower, Michael E. [corrected to Stillabower, Michael E.]. PMID: 21406646. https://doi. org/10.1001/jama.2011.290
- Cavallari L.H., Lee C.R., Beitelshees A.L., Cooper-DeHoff R.M., Duarte J.D., Voora D., Kimmel S.E., McDonough C.W., Gong Y., Dave C.V., Pratt V.M., Alestock T.D., Anderson R.D., Alsip J., Ardati A.K., Brott B.C., Brown L., Chumnumwat S., Clare-Salzler M.J., Coons J.C., Denny J.C., Dillon C., Elsey A.R., Ha-madeh I.S., Harada S., Hillegass W.B., Hines L., Horenstein R.B., Howell L.A., Jeng L.J.B., Kelemen M.D., Lee Y.M., Magvanjav O., Montasser M., Nelson D.R., Nutescu E.A., Nwaba D.C., Pakyz R.E., Palmer K., Peterson J.F., Pollin T.I., Quinn A.H., Robinson S.W., Schub J., Skaar T.C., Smith D.M., Sriramoju V.B., Starostik P., Stys T.P., Stevenson J.M., Varunok N., Vesely M.R., Wake D.T., Weck K.E., Weitzel K.W., Wilke R.A., Willig J., Zhao R.Y., Kreutz R.P., Stouffer G.A., Empey P.E., Limdi N.A., Shuldiner A.R., Winterstein A.G., Johnson J.A.; IGNITE Network. Multisite investigation of outcomes with implementation of CYP2C19 genotype-guided antiplatelet therapy after percutaneous coronary intervention. JACCCardiovasc Interv. 2018;11(2):181-191. PMID: 29102571; PMCID: PMC5775044. https://doi. org/10.1016/j.jcin.2017.07.022
- Guengerich F.P. Cytochrome P450s and other enzymes in drug metabolism and toxicity. AAPS J. 2006;8(1):E101-E111. PMID: 16584116; PMCID: PMC2751428. https://doi.org/10.1208/ aapsj080112
- Гражданкин И.О., Байструков В.И., Кретов Е.И., Прохорихин А.А., Чернявский А.М. Влияние полиморфизмов гена CYP2C19 на клинические исходы пациентов с инфарктом миокарда в течение 12-месячного периода наблюдения. Комплексные проблемы сердечно-сосудистых заболеваний. 2022;11 (3):17-28. https://doi.org/10.17802/2306-1278-2022-11-3-17-28; Grazhdankin I.O., Baystrukov V.I., Kretov E.I., Prokhorikhin A.A., Chernyavsky A.M. Impact of CYP2C19 gene polymorphisms on clinical outcomes in patients with myocardial infarction during 12-month follow-up. Complex Issues of Cardiovascular Diseases. 2022;11 (3):17-28. (In Russ.) https://doi.org/10.17802/2306-1278-2022-11-3-17-28
- Patel A., Goodman S.G., Tan M., Suskin N., McKelvie R., Mathew A.L., Lutchmedial S., Dehghani P., Lavoie A.J., Huynh T., Lavi S., Philipp R., Khan R., Yan A.T., Radhakrishnan S., Sedlak T., Brunner N., Kim H.H., Cieza T., Kassam S., Fordyce C.B., Heffernan M., Jedrzkiewicz S., Madan M., Ahmed S., Barry C., Dery J.-P., Bagai A.; Canadian ACS Reflective II Investigators. Contemporary use of guideline-based higher potency P2Y12 receptor inhibitor therapy in patients with moderate-to-high risk non-ST-segment elevation myocardial infarction: Results from the Canadian ACS reflective II cross-sectional study. Clin Cardiol. 2021;44(6):839-847. PMID: 33982795; PMCID: PMC8207978. https://doi.org/10.1002/clc.23618
- Karve A.M., Seth M., Sharma M., LaLonde T., Dixon S., Wohns D., Gurm H.S. Contemporary use of ticagrelor in interventional practice (from Blue Cross Blue Shield of Michigan Cardiovascular Consortium). Am J Cardiol. 2015;115(11):1502-1506. PMID: 25846767. https://doi.org/10.1016/j. amjcard.2015.02.049
- Lee C.R., Luzum J.A., Sangkuhl K., Gammal R.S., Sabatine M.S., Stein C.M., Kisor D.F., Limdi N.A., Lee Y.M., Scott S.A., Hulot J.-S., Roden D.M., Gaedigk A., Caudle K.E., Klein T.E., Johnson J.A., Shuldiner A.R. Clinical pharmacogenetics implementation consortium guideline for CYP2C19 genotype and clopidogrel therapy: 2022 update. Clin Pharmacol Ther. 2022;112(5):959-967. PMID: 35034351; PMCID: PMC9287492. https://doi. org/10.1002/cpt.2526
- Holmes M.V., Perel P., Shah T., Hingorani A.D., Casas J.P. CYP2C19 genotype, clopidogrel metabolism, platelet function, and cardiovascular events: a systematic review and meta-analysis. JAMA. 2011;306(24):2704-2714. PMID: 22203539. https://doi. org/10.1001/jama.2011.1880
- FDA drug safety communication: Reduced effectiveness of Plavix (clopidogrel) in patients who are poor metabolizers of the drug. March 8, 2017. Available from: https://www.fda. gov/drugs/postmarket-drug-safety-information-patients-and-providers/fda-drug-safety-communication-reduced-effectiveness-plavix-clopidogrel-patients-who-are-poor
- Trenk D., Hochholzer W., Fromm M.F., Chialda L.-E., Pahl A., Valina C.M., Stratz C., Schmiebusch P., Bestehorn H.-P., Buttner H.J., Neumann F.-J. Cytochrome P450 2C19 681G>A polymorphism and high on-clopidogrel platelet reactivity associated with adverse 1-year clinical outcome of elective percutaneous coronary intervention with drug-eluting or bare-metal stents. J Am Coll Cardiol. 2008;51(20):1925-1934. PMID: 18482659. https://doi.org/10.1016/j.jacc.2007.12.056
- Zhang Y.-J., Li D.-J., Li Z.-Y., Hu X.-L., Li H., Ma Q.-L., Chen X.-P. Influence of genetic polymorphisms in P2Y12 receptor signaling pathway on antiplatelet response to clopidogrel in coronary heart disease. BMC Cardiovasc Disord. 2022;22(1):575. PMID: 36581799; PMCID: PMC9801627. https://doi.org/10.1186/ s12872-022-02988-w
- Olie R.H., Hensgens R.R.K., Wijnen P.A.H.M., Veenstra L.F., de Greef B.T.A., Vries M.J.A., van der Meijden P.E.J., Ten Berg J.M., Ten Cate H., Bekers O., Henskens Y.M.C. Differential impact of cytochrome 2C19 allelic variants on three different platelet function tests in clopidogrel-treated patients. J Clin Med. 2021;10(17):3992. PMID: 34501440; PMCID: PMC8432532. https://doi.org/10.3390/jcm10173992
- Bhatt D.L., Simonsen K.L., Emison E.S., on behalf of the CHARISMA Executive Committee and Investigators. CHARISMA genomics. Paper presented at: Transcatheter Cardiovascular Therapeutics 2009 Meeting; Sept. 30, 2009; San Francisco, California.
- Dahabreh I.J., Moorthy D., Lamont J.L., Chen M.L., Kent D.M., Lau J. Testing of CYP2C19 variants and platelet reactivity for guiding antiplatelet treatment. Comparative Effectiveness Reviews. No. 125. Rockville: Agency for Healthcare Research and Quality (US); 2013. Report No.: 13-EHC117-EF. PMID: 25165804. Available from: https://www.ncbi.nlm.nih.gov/ sites/books/NBK236984
- Bertrand-Thiebault C., Berrahmoune H., Thompson A., Marie B., Droesch S., Siest G., Foernzler D., Visvikis-Siest S. Genetic polymorphism of CYP2C19 gene in the Stanislas cohort. A link with inflammation. Ann Hum Genet. 2008;72(Pt 2):178-183. PMID: 18205890. https://doi.org/10.1111/M469-1809.2007.00417.x
- Mega J.L., Close S.L., Wiviott S.D., Shen L., Hockett R.D., Brandt J.T., Walker J.R., Antman E.M., Macias W.L., Braunwald E., Sabatine M.S. Cytochrome P450 genetic polymorphisms and the response to prasugrel: relationship to pharmacokinetic, pharmacodynamic, and clinical outcomes. Circulation. 2009;119(19):2553-2560. PMID: 19414633. https://doi. org/10.1161/CIRCULATIQNAHA.109.851949
- Wallentin L., James S., Storey R.F., Armstrong M., Barratt B.J., Horrow J., Husted S., Katus H., Steg P.G., Shah S.H., Becker R.C.; PLATO investigators. Effect of CYP2C19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes: a genetic substudy of the PLATO trial. Lancet. 2010;376(9749):1320-1328. PMID: 20801498. https://doi. org/10.1016/S0140-6736(10)61274-3
- Mehta S.R., Tanguay J.-F., Eikelboom J.W., Jolly S.S., Joyner C.D., Granger C.B., Faxon D.P., Rupprecht H.-J., Budaj A., Avezum A., Widimsky P., Steg P.G., Bassand J.-P., Montalescot G., Macaya C., Di Pasquale G., Niemela K., Ajani A.E.,White H.D., Chrolavicius S., Gao P., Fox K.A., Yusuf S.; CURRENT-OASIS 7 trial investigators. Double-dose versus standard-dose clopidogrel and highdose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): a randomised factorial trial. Lancet. 2010;376(9748):1233-1243. PMID: 20817281. https:// doi.org/10.1016/S0140-6736(10)61088-4
- von Beckerath N., Taubert D., Pogatsa-Murray G., Schömig E., Kastrati A., Schömig A. Absorption, metabolization, and antiplatelet effects of 300-, 600-, and 900-mg loading doses of clopidogrel: results of the ISAR-CHOICE (Intracoronary Stenting and Antithrombotic Regimen: Choose Between 3 High Oral Doses for Immediate Clopidogrel Effect) Trial. Circulation. 2005;112(19):2946-2950. PMID: 16260639. https:// doi.org/10.1161/CIRCULATI0NAHA.105.559088
- Montalescot G., Sideris G., Meuleman C., Bal-dit-Sollier C., Lellouche N., Steg P.G., Slama M., Milleron O., Collet J.-P., Henry P., Beygui F., Drouet L.; ALBION Trial Investigators. A randomized comparison of high clopidogrel loading doses in patients with non-ST-segment elevation acute coronary syndromes: the ALBION (Assessment of the Best Loading Dose of Clopidogrel to Blunt Platelet Activation, Inflammation and Ongoing Necrosis) trial. J Am Coll Cardiol. 2006;48(5):931-938. PMID: 16949482. https://doi.org/10.1016/uacc.2006.04.090
- Patti G., Colonna G., Pasceri V., Pepe L.L., Montinaro A., Di Sciascio G. Randomized trial of high loading dose of clopidogrel for reduction of periprocedural myocardial infarction in patients undergoing coronary intervention: results from the ARMYDA-2 (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty) study. Circulation. 2005;111(16):2099-2106. PMID: 15750189. https:// doi.org/10.1161/01.CIR.0000161383.06692.D4
- Zhang L., Yang J., Zhu X., Wang X., Peng L., Li X., Cheng P., Yin T. Effect of high-dose clopidogrel according to CYP2C19*2 genotype in patients undergoing percutaneous coronary intervention — a systematic review and meta-analysis. Thromb Res. 2015;135(3):449-458. PMID: 25511576. https:// doi.org/10.1016/i.thromres.2014.12.007
- Thomas M.R., Storey R.F. Impact of aspirin dosing on the effects of P2Y12 inhibition in patients with acute coronary syndromes. J Cardiovasc Transl Res. 2014;7(1):19-28. PMID: 24309957. https://doi.org/10.1007/s12265-013-9524-6


