Связь реакции растений томата на воздействие солевого стресса с особенностями регуляции биосинтеза фенольных соединений
Автор: Филюшин М.А., Анисимова О.К., Джос Е.А., Щенникова А.В., Кочиева Е.З.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетика и селекция
Статья в выпуске: 1 т.60, 2025 года.
Бесплатный доступ
Солевой стресс оказывает негативное воздействие на урожайность культуры томата (Solanum lycopersicum L.). Одним из современных подходов к повышению солеустойчивости сортов томата может быть прайминг семян (предпосевной) или рассады растворами NaCl (цис-прайминг) или других химических агентов, способных стимулировать солеустойчивость (транс-прайминг). Известно, что прайминг способен приводить к эпигенетическим модификациям в геноме растений, необходимым для повышения эффективности ответа на повторные события засоления. Механизм, лежащий в основе солеустойчивости томата, мало изучен, однако может быть связан с содержанием фенольных соединений и активностью L-фенилаланин-аммоний-лиаз (PAL) - ферментов, катализирующих первую стадию фенилпропаноидного пути. В настоящей работе с использованием различающихся по солеустойчивости сортов томата отечественной селекции впервые определена динамика содержания фенольных соединений и экспрессии ключевых генов фенилпропаноидного (группа генов PAL5) и флавоноидного (CHS2) путей в процессе воздействия на растения солевого стресса. Установлено, что в качестве биомаркеров наличия у растений томата стрессовой памяти могут использоваться концентрация фенольных соединений спустя 1 ч воздействия избытком NaCl и снижение экспрессии генов группы PAL5 спустя 24 ч воздействия. Целью нашего исследования стала оценка возможных связей между солеустойчивостью растений томата и регуляцией биосинтеза фенольных соединений. Использовали образцы четырех сортов томата S. lycopersicum - Отрадный (код сорта 8006741), Гном (9401318), Фонарик (9608117) и VS-342-18 (сорт в процессе разработки/регистрации) селекции Федерального научного центра овощеводства (ФНЦО, Московская обл.). По предварительным данным ФНЦО, сорта Отрадный и Гном могли обладать повышенной устойчивостью к избытку соли в почве, тогда как сорта Фонарик и VS-342-18 чувствительны к засолению. Растения из семян урожая 2023 года получали в экспериментальной установке искусственного климата (ФИЦ Биотехнологии РАН, Россия) при следующем режиме: 16 ч/8 ч (день/ночь), 23 °С/21 °С. Взрослые растения в стадии сформированных 8-10 листьев подвергали воздействию солевого стресса. Для этого опытные и контрольные образцы извлекали из почвы и переносили в воду. Спустя 1 ч опытные растения помещали в водный раствор, содержащий 100 мМ NaCl, для имитации солевого стресса; контрольные растения продолжали находиться в воде. Пробы (все листья с одного растения), отобранные через 1, 6 и 24 ч после начала стрессового воздействия, использовали для анализа содержания фенольных соединений и экспрессии ключевых генов фенилпропаноидного и флавоноидного путей. Целевые гены фенилпропаноидного и флавоноидного путей (гены группы PAL и ген CHS2 ) выбирали, основываясь на позиции генов в метаболическом пути и транскриптомных данных базы TomExpress. Экспрессию генов определяли методом количественной ПЦР в реальном времени (ПЦР-РВ). Последовательности праймеров подбирали, используя сравнительный структурный анализ целевых генов и их мРНК с помощью MEGA 7.0 и NCBI-Blast. Было показано, что у всех четырех сортов к 24-му ч воздействия NaCl наблюдался существенный рост содержания фенольных соединений (в зависимости от сорта в ~ 1,4-4,7 раза в сравнении с контролем), тогда как спустя 1 ч после начала воздействия стресса только наиболее солеустойчивый сорт Отрадный характеризовался активным накоплением фенольных соединений (в ~ 2 раза в сравнении с контролем). Неустойчивые к избытку соли сорта Фонарик и VS-342-18 оказались схожи по профилю изменения концентрации фенолов при стрессе. В то же время устойчивые сорта Отрадный и Гном показали сходную динамику только в период с 6-го по 24-й ч, а в точке 1 ч - прямо противоположную, где наиболее устойчивый сорт Отрадный характеризовался активным накоплением фенольных соединений (в ~ 2 раза в сравнении с контролем), сорт Фонарик - снижением их количества (в ~ 2 раза в сравнении с контролем). С помощью in silico анализа транскриптомов томата среди генов L-фенилаланин-аммоний-лиаз и халконсинтаз были определены целевые гены фенилпропаноидного и флавоноидного путей, наиболее высокоэкспрессирующиеся в листьях томата. Группа выбранных генов включала четыре из 16 известных генов PAL (Solyc09g007890, Solyc09g007900, Solyc09g007910 - PAL5 , Solyc09g007920 - PAL3 ) и один из двух известных генов халконсинтазы CHS2 (Solyc05g053550). Показано, что каждый из четырех сортов томата характеризовался индивидуальной динамикой экспрессии целевых генов при воздействии стресса. Отличием наиболее солеустойчивого сорта Отрадный от других анализируемых сортов стало снижение содержания транскриптов генов группы PAL5 через 24 ч после начала стресса. В случае гена CHS2 неустойчивые сорта Фонарик и VS-342-18 показали прямо противоположную динамику экспрессии гена, тогда как устойчивые сорта Отрадный и Гном имели сходную реакцию. При этом специфических особенностей экспрессии CHS2 у сорта Отрадный в сравнении с другими сортами не наблюдалось.
Томат, солеустойчивость, стрессовая память, гены фенилпропаноидного пути, фенольный метаболизм, содержание фенольных соединений, селекция на устойчивость
Короткий адрес: https://sciup.org/142244147
IDR: 142244147 | УДК: 635.64:58.04:577.2 | DOI: 10.15389/agrobiology.2025.1.21rus
Текст научной статьи Связь реакции растений томата на воздействие солевого стресса с особенностями регуляции биосинтеза фенольных соединений
Томат ( Solanum lycopersicum L., сем. Solanaceae ) — важная и популярная во всем мире овощная культура, на урожайность которой влияют различные стрессовые факторы. Географическим центром происхождения томата ( S. lycopersicum и другие родственные виды секции Lycopersicon ) считают тихоокеанское побережье западной части Южной Америки, для которого характерно сильное засоление почв (1-3). Дикорастущие виды томата обладают солеустойчивостью, однако она снизилась у культивируемого томата в процессе доместикации, поэтому засоление почв стало одним из основных абиотических стрессоров для современных сортов S. lycopersicum (1-3).
Избыточное содержание соли в почве создает осмотический и ионный дисбаланс в клетках растения, что приводит к оксидативному стрессу, изменениям метаболизма и, как следствие, нарушению прорастания семян и жизнеспособности растений (1). В связи с этим получение солеустойчивых сортов и гибридов остается одним из ключевых направлений селекции томата, особенно для сортов защищенного грунта.
Солеустойчивость может иметь генетические основы, а может быть следствием памяти растения о стрессе, которая возникает при первичном стрессовом событии (прайминг, или праймирование) и закрепляется повторными воздействиями стрессора на протяжении жизненного цикла (4). Прайминг изначально был известен как агротехнический прием, заключающийся в предпосевном замачивании семян в растворах с химическими или биологическими добавками для стимуляции развития и стрессоустой-чивости будущих растений (5-7). В настоящее время понятие прайминга охватывает не только семена, но и растения, находящиеся на разных стадиях развития (8-10). В применении к солевому стрессу праймингом для повышения солеустойчивости растений может служить как предпосевное замачивание семян в растворе соли, так и полив таким раствором рассады (10-12). Прайминг приводит к эпигенетическим модификациям, которые при повторных воздействиях засоления инициируют в растении необходимые транскрипционные, метаболические и другие изменения. При этом в отсутствие стресса геном способен вернуться в исходное состояние (13).
Известны две разновидности прайминга — цис-прайминг (одинаковая природа первичного и последующих стрессовых воздействий) и транс-прайминг (первичное воздействие стимулирует эффективный ответ растения на стрессовые факторы другого типа) (13, 14). Это означает, что для повышения солеустойчивости растений в качестве первичного стимула не обязательно должен использоваться избыток NaCl. Показано, что соле-устойчивость растений повышается после обработки растворами CaCl2, KCl, PEG (полиэтиленгликоль), H2O2, фитогормонов (салициловая и ацетилсалициловая кислоты, брассинолид), аскорбиновой кислоты, мелатонина, а также при прайминге воздействием обводнения, статического магнитного поля и других факторов (15, 16). Считается, что эффект транс-прайминга становится следствием сходной реакции транскриптома на ассоциированные типы стрессоров (13, 14, 16).
Память растения о стрессе как результат прайминга может быть как краткосрочной (проявляться в течение жизни), так и долгосрочной (наследоваться мейотически) (13, 17). В последнем случае растения становятся донорами признака и могут быть использованы в селекции солеустойчивых гибридов томата. Уже существующие сорта также могут быть улучшены посредством прайминга вплоть до появления у них наследуемой стрессовой памяти.
Значительная часть генов и метаболитов, участвующих в ответе растения на стрессор, служат маркерами стрессовой памяти, для которых характерно, в первую очередь, изменение экспрессии/содержания при прай-минге (18-20). Сравнение динамики содержания метаболитов и/или степени экспрессии генов памяти у образцов при стрессовом воздействии может быть полезно при селекции стрессоустойчивых сортов и гибридов, как было показано на примере отбора доноров засухоустойчивости среди образцов андского картофеля (21).
Механизм, лежащий в основе солеустойчивости томата, мало изучен, однако его рассматривают с учетом данных по другим видам растений (1). В числе прочего его связывают с содержанием фенольных соединений, которые синтезируются фенилпропаноидным путем, и активностью L-фе-нилаланин-аммоний-лиаз (PAL), которые катализируют первую стадию фе-нилпропаноидного пути, превращая фенилаланин в коричную кислоту (22). Например, у Platycodon grandiflorus в ответ на солевой стресс дифференциально экспрессируется около 9 тыс. генов, изменяется содержание более 400 метаболитов, при этом большинство последних представляют собой продукты флавоноидного метаболического пути (22, 23).
В настоящей работе с использованием различающихся по солеустой-чивости сортов томата отечественной селекции впервые определена динамика содержания фенольных соединений и экспрессии ключевых генов фе-нилпропаноидного (группа генов PAL5 ) и флавоноидного ( CHS2 ) путей в процессе воздействия на растения солевого стресса. Установлено, что в качестве биомаркеров наличия у растений томата стрессовой памяти могут использоваться концентрация фенольных соединений спустя 1 ч воздействия избытка NaCl и снижение экспрессии генов группы PAL5 спустя 24 ч воздействия.
Целью нашего исследования стала оценка возможных связей между солеустойчивостью растений томата и регуляцией биосинтеза фенольных соединений.
Ìåòîäèêà. Использовали образцы четырех сортов томата S. lycoper-sicum — Отрадный (код сорта 8006741), Гном (9401318), Фонарик (9608117) и VS-342-18 (сорт в процессе разработки/регистрации) селекции Федерального научного центра овощеводства (ФНЦО, Московская обл.) . По предварительным данным ФНЦО, сорта Отрадный и Гном могли обладать повышенной устойчивостью к избытку соли в почве, тогда как сорта Фонарик и VS-342-18 чувствительны к засолению. Растения из семян урожая 2023 года получали в экспериментальной установке искусственного климата (ФИЦ Биотехнологии РАН, Россия) при следующем режиме: 16 ч/8 ч (день/ночь), 23 °С/21 °С.
Взрослые растения в стадии сформированных 8-10 листьев подвер- гали воздействию солевого стресса. Для этого опытные и контрольные образцы извлекали из почвы и переносили в воду (время начала опыта — 800). Спустя 1 ч (900) опытные растения помещали в водный раствор, содержащий 100 мМ NaCl, для имитации солевого стресса; контрольные растения оставляли в воде.
Пробы (все листья с одного растения) отбирали в 1000 (1 ч стресса), 15 00 (6 ч стресса) и 9 00 следующего дня (24 ч стресса) и хранили при - 80 ° С. Для каждой временной точки использовали по два индивидуальных растения (два биологических повтора) в контроле и опыте. Все листья с растения собирали, чтобы нивелировать эффект разной стадии физиологического развития. Для этого материал тщательно растирали и перемешивали в фарфоровой ступке пестиком с использованием жидкого азота, и для последующих анализов брали навеску. Пробы использовали для анализа содержания фенольных соединений и экспрессии ключевых генов фенилпропано-идного и флавоноидного путей.
Содержание фенольных соединений определяли по E.A. Ainsworth с соавт. (24). Собранные с одного растения целые листья измельчали растиранием в фарфоровой ступке пестиком с использованием жидкого азота. К навеске массой 20 мг добавляли 2 мл 95 % метанола, предварительно охлажденного при - 20 ° С, перемешивали встряхиванием на вортексе и выдерживали в темноте в течение 48 ч. Затем образец центрифугировали (центрифуга MiniSpin, «Eppendorf», Германия) в течение 5 мин при комнатной температуре и 14000 об/мин, надосадочную жидкость переносили в чистую пробирку. После этого 100 мкл надосадочной жидкости смешивали (вортекс V-32, «Biosan», Латвия) с 200 мкл 10 % реактива Фолина-Чокалтеу и оставляли на 3-4 мин. Полученную смесь смешивали (вортекс V-32, «Biosan», Латвия) с 800 мкл 700 мМ раствора Na 2 CО 3 , выдерживали в темноте 2 ч при комнатной температуре и центрифугировали в течение 5 мин при комнатной температуре (14000 об/мин).
Надосадочную жидкость (1 мл) использовали для измерения поглощения при X = 765 нм (A 765 ) на спектрофотометре Eppendorf BioSpectrometer® basic («Eppendorf», Германия). Концентрацию фенольных соединений (С) представляли как мг-экв. галловой кислоты (GAE) на 1 г сырой массы образца. Использовали последовательно две расчетные формулы: X = (A 765 - b)/a, где a и b — коэффициенты из уравнения регрессии калибровочного графика; С = (X V d)/m, где С — содержание фенольных соединений, мг GAE/г сырой массы, V — объем экстрагента (95 % метанол, 2 мл), d — разведение образца (обычно не требуется, тогда 1), m — масса навески образца, мг.
Экспрессию генов анализировали в тех же листовых пробах, которые использовали для определения содержания фенольных соединений.
Целевые гены фенилпропаноидного и флавоноидного путей (группа генов PAL и ген CHS2) выбирали, основываясь на позиции генов в метаболическом пути и транскриптомных данных (Fragments per kilobase of transcript per million mapped fragments; FPKM) базы TomExpress . Экспрессию генов определяли методом количественной ПЦР в реальном времени (ПЦР-РВ). Последовательности праймеров подбирали, используя сравнительный структурный анализ целевых генов и их мРНК ; с помощью MEGA 7.0 и NCBI-Blast : для генов группы PAL5 5'-cctggtcagattgaggctg-3' и 5'-ccactgtggagatgttcgga-3'; для гена CHS2 5'-ggatgaaatgagaaaggcctca-3' и 5'-tggagcacaacagtctcaac-3'.
Подготовка проб для ПЦР-РВ включала выделение из 0,5 г листовой пробы и очистку суммарной РНК (RNeasy Plant Mini Kit, RNase-free DNase set, «QIAGEN N.V.», Германия), синтез кДНК (GoScript Reverse Transcription System, «Promega», США) и определение их качества (по присутствию полос, соответствующих 18S и 26S рРНК, и соотношению их интенсивности в геле — высокое качество при 26S:18S > 2,0; электрофорез в 1,5 % агарозном геле) и концентрации (Qubit® Fluorometer, «Thermo Fisher Scien-tific», США; Qubit RNA HS Assay Kit, «Invitrogen», США).
Экспрессию целевых генов нормализовали, используя референсные гены Expressed (SGN-U346908) и actin-41 (NM_001330119.1) (25). Для проведения ПЦР-РВ использовали набор «Реакционная смесь для проведения ПЦР-РВ в присутствии SYBR Green I и ROX» (ООО «Синтол», Россия), по 3 нг каждого препарата кДНК, соответствующие праймеры, систему CFX96 Real-Time PCR Detection System («Bio-Rad Laboratories», США). Программа амплификации была следующей: 5 мин при 95 ° С; 15 с при 95 ° С, 40 с при 60 ° С (40 циклов).
Анализы экспрессии генов и содержания фенольных соединений проводили в двух биологических и трех технических повторах. Результаты обрабатывали статистически (GraphPad Prism v. 8, . Данные выражали как средние значения (M) со стандартными отклонениями (±SD). Значимость (p < 0,05) различий между показателями, полученными для разных временных точек, определяли, используя Two-way ANOVA (multiple comparisons, corrected with Bonferroni test).
Результаты . Предполагается, что солеустойчивость растений томата может быть связана, в числе прочего, с активностью генов/ферментов фе-нилпропаноидного (ФАЛ) и флавоноидного (халконсинтаза) пути и содержанием фенольных соединений (23). В нашем опыте по воздействию солевого стресса на взрослые растения четырех сортов томата у двух сортов (Фонарик и VS-342-18) наблюдалось значительное увядание листьев и стебля через 24 ч воздействия стрессора, тогда как два других сорта сохраняли жизнеспособность и демонстрировали визуально слабую реакцию (сорт Гном) или ее отсутствие (сорт Отрадный). Мы предположили, что соле-устойчивость сортов Гном и Отрадный может быть следствием вариабельности генома или унаследованной эпигенетической памяти о солевом стрессе, дающей возможность эффективно приспосабливаться к неблагоприятным условиям.
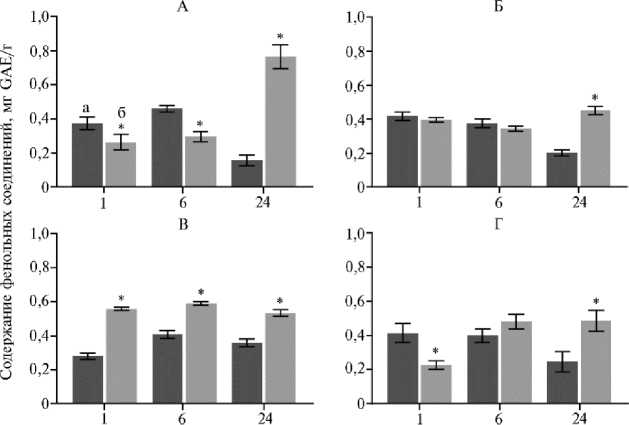
Несмотря на межсортовые различия, у всех четырех сортов к 24-му ч эксперимента наблюдался существенный рост содержания фенольных соединений в листьях (рис. 1), что подтверждает участие последних в приспособлении растения к повышенным концентрациям NaCl.
Неустойчивые к избытку соли сорта Фонарик и VS-342-18, изначально имевшие сходное количество фенольных соединений в листьях, оказались схожи и по профилю изменения концентрации этих веществ при стрессе (см. рис. 1). В то же время устойчивые сорта Отрадный и Гном показали сходную динамику только в период с 6-го по 24-й ч, а через 1 ч — прямо противоположную, где наиболее устойчивый сорт Отрадный характеризовался активным накоплением фенольных соединений, а сорт Фонарик — снижением их количества (см. рис. 1). Такое различие может быть следствием эпигенетической памяти о стрессе у сорта Отрадный. Поэтому концентрация фенольных соединений спустя 1 ч воздействия солевого стресса может быть использована в качестве биомаркера стрессовой памяти.
На концентрацию фенольных соединений непосредственное влияние оказывает активность генов фенольного метаболизма (26). Проведенный in silico анализ экспрессии генов томата (TomExpress) позволил опре- делить целевые гены для дальнейшего анализа среди известных 16 генов L-фенилаланин-аммоний-лиаз (PAL) и двух генов халконсинтаз (CHS). Как критерий отбора генов использовался наибольший уровень экспрессии в листьях томата, то есть для исследования выбирали гены, которые высоко экспрессировались в листьях; гены с низким уровнем экспрессии в анализ не брали.
Продолжительность солевого стресса, ч
Рис. 1. Содержание фенольных соединений в листьях контрольных (а) и опытных (б) растений томата ( Solanum lycopersicum L.) разных сортов в зависимости от продолжительности солевого стресса: А — Фонарик, Б — VS-342-18, В — Отрадный, Г — Гном ( M ±SD, n = 2, N = 3).
* Различия между контролем и опытом статистически значимы при p < 0,05.
Четыре гена PAL (Solyc09g007890, Solyc09g007900, Solyc09g007910, Solyc09g007920) вошли в целевую группу. Значения FPKM для них составили соответственно 0,7507; 0,7685; 2,757 и 2,6883, что было существенно выше, чем для других 12 генов (0-0,1358 для 11 генов и 0,501 для PAL6, Solyc10g086180) . Все четыре выбранных гена PAL расположены на 9-й хромосоме и высокогомологичны , что предполагает происхождение этих паралогов в результате тандемной дупликации одного из них и, как следствие, сходство их функции и активности. Поэтому праймеры к генам PAL были подобраны таким образом, чтобы анализировать общую экспрессию всех четырех паралогич-ных генов.
Целевая группа генов PAL включала PAL5 (Solyc09g007910) (далее по тексту — группа генов PAL5 ), который известен участием в ответах на различные стрессовые факторы, включая избыток NaCl (27, 28). В группу также вошел PAL3 (Solyc09g007920); ранее показано, что сверхэкспрессия гомологичного ему гена GmPAL1.1 у Arabidopsis thaliana повышает соле-устойчивость прорастающих семян (29). Помимо группы генов PAL5 , для другого гена L-фенилаланин-аммоний-лиаз PAL6 (10-я хромосома) ранее показано повышение экспрессии в ответ на солевой стресс (30, 31). Однако в целевую группу PAL6 не вошел, поскольку его экспрессия в листьях в нормальных условиях была в ∼ 5 раз ниже, чем у PAL5 или PAL3 .
В случае халконсинтаз был выбран ген CHS2 (Solyc05g053550). Хотя оба гена CHS активируются при прайминге семян томата метилжасмона-том (28), содержание транскриптов CHS2 в листе в ∼ 1,4 раза (FPKM
0,1656 vs 0,118) превышает таковой CHS1 (Solyc09g091510) .
Анализ экспрессии целевых генов методом ПЦР-РВ показал, что каждый из четырех сортов томата характеризовался индивидуальной динамикой ответа на солевой стресс (рис. 2).
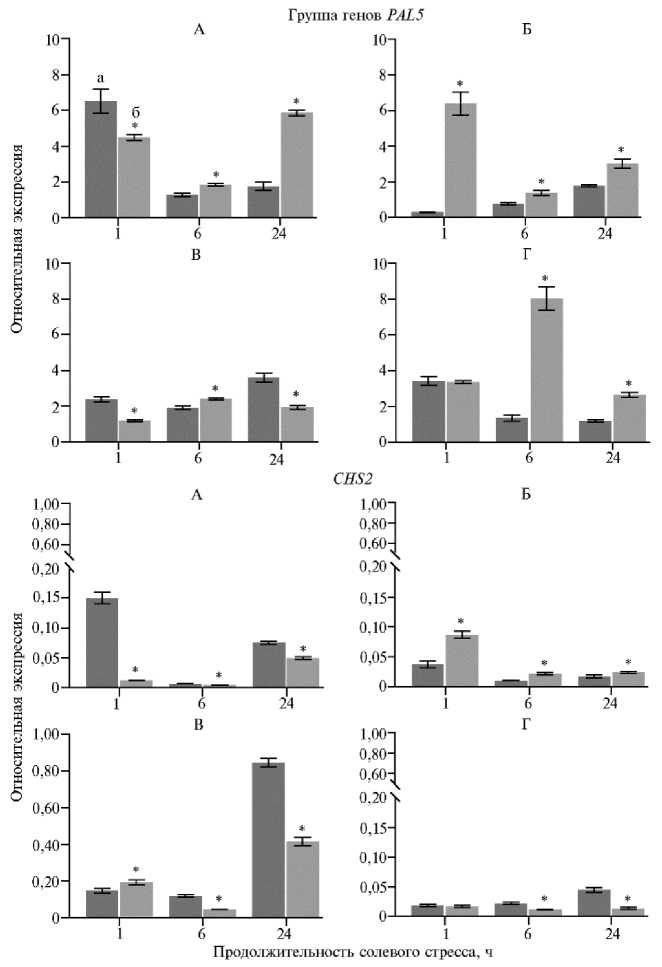
Рис. 2. Дифференциальная экспрессия группы генов PAL5 и гена CHS2 в листьях у сортов томата ( Solanum lycopersicum L.) в зависимости от продолжительности солевого стресса: А — Фонарик, Б — VS-342-18, В — Отрадный, Г — Гном; а — контроль, б — опыт ( M ±SD, n = 2, N = 3).
* Различия между контролем и опытом статистически значимы при p < 0,05.
Только у сорта VS-342-18 экспрессия PAL5 сильно выросла через 1 ч после переноса растений в раствор, содержащий NaCl, и опустилась почти до значений контроля через 6 ч (см. рис. 2), как это было показано для образца томата с неизвестной чувствительностью к избытку соли в исследовании J. Guo с соавт. (27). Неустойчивые сорта Фонарик и VS-342-18
показали схожий профиль экспрессии генов группы PAL5 в период 6-24 ч, а через 1 ч после начала воздействия стресса — прямо противоположный: снижение экспрессии (Фонарик) или ее повышение (VS-342-18) (см. рис. 2).
Устойчивые сорта Отрадный и Гном также имели различия в стрессовой реакции генов группы PAL5 : наблюдалась контрастная динамика через 1 и 24 ч и сходная через 6 ч. Однако к 6-му ч содержание транскриптов PAL5 у сорта Отрадный оказалось почти в 3 раза ниже, чем у сорта Гном, и за счет разнонаправленной динамики к 24-му ч экспрессия PAL5 у этих сортов почти сравнялась. Единственное отличие сорта Отрадный, предположительно имеющего стрессовую память, от других сортов — снижение активности PAL5 через 24 ч (см. рис. 2).
В случае CHS2 неустойчивые сорта Фонарик и VS-342-18 показали прямо противоположную динамику экспрессии гена, тогда как устойчивые сорта Отрадный и Гном имели сходную реакцию (см. рис. 2). При этом профиль CHS2 был противоположен профилю генов PAL5 у сортов, за исключением сорта VS-342-18, у которого динамика экспрессии CHS2 и PAL5 совпадала (см. рис. 2). Каких-либо специфических особенностей экспрессии CHS2 у сорта Отрадный не наблюдалось.
Повышенное накопление фенольных соединений к 24-му ч стрессового воздействия у всех сортов (см. рис. 1) никак не коррелировало с профилем экспрессии генов PAL5 и CHS2 (см. рис. 2), что предполагает гено-тип-специфичную регуляцию биосинтеза фенольных соединений при ответе на стрессор. Следовательно, с учетом полученных нами данных в сочетании с разной солеустойчивостью анализируемых сортов профиль экспрессии CHS2 не подходит для оценки степени проявления признака, тогда как снижение экспрессии генов группы PAL5 через 24 ч (см. рис. 2) может быть использовано как биомаркер памяти.
В пользу последнего свидетельствует участие генов группы PAL5 в ответе на осмотические (включая засоление) и биотические стрессоры (27, 28) и повышение солеустойчивости растения при сверхэкспрессии генов группы PAL5 (29).
В частности, J. Guo с соавт. (27) продемонстрировали присутствие в геноме томата семейства генов SlPAL5 и их сильную экспрессию в молодых и зрелых листьях (27), что соответствовало нашему выбору целевых генов группы PAL5 . Авторы показали, что экспрессия SlPAL5 стимулируется не только воздействием NaCl, но и другими видами стресса (засуха, симулированная маннитолом, и холод) (27). В отличие от наших данных, резкий рост экспрессии гена в ответ на засоление происходил спустя 1 ч после начала воздействия и далее постепенно снижался к 24 ч (27). В нашем исследовании экспрессия SlPAL5 резко выросла к 1-му ч стресса только у солечувствительного сорта VS-342-18 и в целом оказалась генотип-специфич-ной, снизившись к 24-му ч только у сорта Отрадный (см. рис. 2). Подобный контраст может объясняться, во-первых, тем, что авторы (27) использовали вдвое большую концентрацию соли (200 мМ), чем в нашей работе (100 мМ), и ответ растения ожидаемо должен быть более быстрым и выраженным. Во-вторых, в статье J. Guo с соавт. (27) отсутствуют данные о солеустойчивости использованного сорта томата. Тем не менее эти результаты подкрепляют наше предположение о возможном статусе генов группы PAL5 как биомаркера стрессовой памяти.
Еще одним подтверждением статуса генов PAL5 как биомаркеров стало исследование P. Kr o l с соавт. (28), где было продемонстрировано повышение экспрессии PAL5 в ответ на прайминг метилжасмонатом, использованный в целях защиты рассады томата от фузариозного увядания (28). 28
Авторы показали, что такой прайминг повышает устойчивость рассады к грибам Fusarium , и в ответ на инфекцию патогеном в листьях рассады значительно увеличивается содержание фенольных соединений и экспрессия PAL5 (28). Следовательно, гены группы PAL5 участвуют в защитном ответе растений томата не только на абиотические, но и на биотические стрессоры.
Наконец, важным свидетельством ключевой роли генов группы PAL5 в стрессовом ответе растений и, как следствие, в запоминании стресса стало получение и анализ растений Arabidopsis со сверхэкспрессией гена GmPAL1.1 сои ( Glycine max ) (29), продукт которого высокогомологичен белкам томата группы PAL5. Такие трансгенные растения накапливали повышенное количество флавоноидов в листьях, и их семена обладали повышенной устойчивостью к засолению и засухе при прорастании (29).
С учетом имеющихся данных (27-29) выдвинутое нами предположение о генах группы PAL5 как биомаркерах стрессовой памяти требует дополнительных экспериментов по оценке экспрессии этих генов с имитацией повторяющихся (многоцикловых) воздействий солевого стресса и с варьированием условий воздействия (например, продолжительности обработки или концентрации NaCl).
Таким образом, в настоящем исследовании был определен профиль изменения содержания фенольных соединений и экспрессии ключевых генов фенилпропаноидного и флавоноидного пути (группы генов PAL5 и гена CHS2 ) в процессе воздействия избытка NaCl на растения сортов томата Отрадный, Гном, Фонарик и VS-342-18. Подтверждены данные Федерального научного центра овощеводства (ФНЦО) о солеустойчивости сортов Отрадный (наиболее устойчив) и Гном (менее устойчив), а также о чувствительности к засолению сортов Фонарик и VS-342-18. Наибольшей устойчивости сорта Отрадный сопутствовало активное (в ∼ 2 раза) повышение содержание фенольных соединений в начале стрессового воздействия (1 ч), тогда как три других сорта характеризовались снижением (Фонарик, Гном) или отсутствием изменений (VS-342-18) количества фенолов. При этом к 24-му ч стресса все четыре сорта демонстрировали существенный рост содержания фенольных соединений (в ∼ 1,4-4,7 раза). Определены целевые (для анализа экспрессии в динамике стрессового воздействия) гены фенилпропаноид-ного (четыре гена PAL Solyc09g007890, Solyc09g007900, Solyc09g007910 — PAL5 , Solyc09g007920 — PAL3 ) и флавоноидного (ген CHS2 ) путей с наибольшей экспрессией в листьях томата (согласно in silico данным). Каждый из четырех сортов томата характеризовался индивидуальной динамикой экспрессии целевых генов в ответ на засоление. Наиболее устойчивый сорт Отрадный отличался от трех других сортов снижением экспрессии генов группы PAL5 в конце стрессового воздействия (24 ч), тогда как в случае гена CHS2 специфики не обнаружено. На основе результатов исследования выдвинуто предположение, что в качестве биомаркеров наличия у растений томата стрессовой памяти могут использоваться концентрация фенольных соединений спустя 1 ч воздействия солевого стресса и снижение экс-прессионной активности генов PAL5 спустя 24 ч воздействия. Полученные данные могут быть применены в селекции солеустойчивых сортов томата.


