Связь содержания белка DLK-1 в сыворотке крови с выживаемостью больных с глиобластомами
Автор: Рябова А.И., Новиков В.А., Спирина Л.В., Доспан А.Б., Чойнзонов Е.Л., Грибова О.В., Музеник О.А., Сыркашев В.А., Глущенко С.А., Табакаев С.А., Удинцева И.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
По некоторым данным, экспрессия дельта-подобного неканонического лиганда Notch 1 (DLK-1) повышается в глиомах с увеличением агрессивных характеристик опухоли, а также может свидетельствовать о прогрессировании глиобластомы. Цель исследования - изучить диагностическое и прогностическое значение содержания секретируемого DLK-1 в сыворотке крови у пациентов с глиобластомами головного мозга на этапах комбинированного лечения. материал и методы. В исследование включено 39 пациентов с впервые диагностированной глиобластомой головного мозга. Содержание секретируемого DLK-1 оценивалось в парных образцах сыворотки и ликвора у больных глиобластомой перед началом химиолучевой терапии (ХЛТ). Все пациенты с глиобластомой получили комбинированное лечение. В рамках каждого контрольного обследования этих пациентов дополнительно оценивалось содержание секретируемого DLK-1 в сыворотке.
Глиобластома, dlk-1, неинвазивная диагностика, биомаркеры прогноза, биомаркеры прогрессирования
Короткий адрес: https://sciup.org/140308735
IDR: 140308735 | УДК: 616.831-006.484-037:615.153.455.96 | DOI: 10.21294/1814-4861-2024-23-6-41-50
Текст научной статьи Связь содержания белка DLK-1 в сыворотке крови с выживаемостью больных с глиобластомами
Глиобластома (ГБ) является наиболее часто встречающейся первичной опухолью головного мозга высокой степени злокачественности с быстрым ростом и фатальным прогнозом. Общая 1-летняя выживаемость составляет около 40 %, а 5-летняя – варьирует от 0,05 до 6,9 % [1, 2]. Стандартом лечения ГБ является комбинированная терапия, включающая нейрохирургическое вмешательство, адъювантную химиолучевую терапию (ХЛТ) с последующими курсами адъювантной химиотерапии темозоломидом [3–5]. Прогноз заболевания зависит от нескольких факторов, включающих степень резекции опухоли, возраст и функциональный статус пациентов. При наличии в опухоли метилирования промотора MGMT (фермент репарации ДНК О-6-метилгуанин-ДНК-метилтрансферазы) пациенты имеют более высокие показатели выживаемости вследствие большей чувствительности к терапии [6]. Рецидив опухоли является основной причиной смерти пациентов с глиобластомой [7].
Для наблюдения за пациентами и оценки ответа на лечение рекомендуется МРТ головного мозга с использованием стандартных протоколов в соответствии с критериями ответа в нейроонкологии (RANO, Response Assessment in Neuro-Oncology) [8]. Накопление контрастного вещества в зоне облучения головного мозга в сроки до 1 года после проведения лучевой терапии может свидетельствовать не только о возникновении рецидива, но и о постлучевых изменениях головного мозга – феномене «псевдопрогрессии». Общая чувствительность и специфичность стандартной МР-визуализации в оценке ответа на лечение злокачественных глиом не превышает 80 % [9]. Неоднозначные результаты контрольных исследований определяют необходимость поиска биомаркеров для диагностики рецидива заболевания, а также определения прогноза лечения.
Злокачественные новообразования выбрасывают в кровоток и другие физиологические жидкости опухолевое содержимое в виде циркулирующих опухолевых клеток, внеклеточных везикул, свободных внеклеточных нуклеиновых кислот и белков. В настоящее время не идентифицированы белки, являющиеся специфичными для ГБ, поэтому поиск белковых маркеров при этой патологии фокусируется на отклонениях в уровнях нормальных физиологически секретируемых белков, при которых можно надежно диагностировать ГБ и определить прогноз пациента.
Дельта-подобный неканонический лиганд Notch 1 (DLK-1) представляет собой трансмембранный и секретируемый белок в семействе лигандов Notch, способный передавать сигналы Notch-зависимым и независимым образом. Характерными свойствами этого протеина являются активация Notch пути, активация пролиферации во время нейрогенеза в эмбриональный период, а также стимуляция неоангиогенеза [10, 11]. Регуляция экспрессии DLK-1 плохо изучена, однако в экспериментальных исследованиях было показано, что экспрессия DLK-1 повышается в глиомах с увеличением степени злокачественности и агрессивных характеристик опухоли, а также может свидетельствовать о прогрессировании глиобластомы [12, 13]. Определение содержания белка DLK-1 может иметь существенное значение для повышения эффективности диагностики прогрессирования у пациентов с опухолями головного мозга на этапах комбинированного лечения и оценки прогноза пациентов.
Цель исследования заключалась в изучении диагностического и прогностического значения содержания секретируемого DLK-1 в сыворотке крови у пациентов с глиобластомами головного мозга на этапах комбинированного лечения.
Материал и методы
В исследование включено 39 пациентов с впервые диагностированной глиобластомой головного мозга, получавших лечение в НИИ онкологии Томского НИМЦ. Возраст больных варьировал от 19 до 70 лет, медиана составила 55 лет (95 % ДИ 47–61 год). На первом этапе комбинированного лечения всем пациентам выполнялось оперативное вмешательство в условиях нейрохирургических стационаров. Диагноз глиобластомы IDH-wildtype, WHO Grade 4, был установлен при пересмотре микропрепаратов с выполнением иммуногистохимических и молекулярно-генетического исследований в условиях лабораторий НИИ онкологии в соответствии с патоморфологической классификацией ВОЗ опухолей ЦНС 2021 г. [14]. Статус метилирования гена MGMT в опухоли был оценен у 32 пациентов. Исследование выполнялось с использованием ко- личественной метил-специфичной полимеразной цепной реакции в режиме реального времени из материала парафиновых блоков. Метилирование промотора гена MGMT было диагностировано у 10 пациентов, у 22 пациентов промотор MGMT метилирован не был.
В плане комбинированного лечения все пациенты с ГБ получили курс ХЛТ в режиме стандартного фракционирования дозы 2 Гр 5 дней в неделю до СОД 60 Гр с радиосенсибилизацией темозоломидом 75 мг/м2 внутрь ежедневно. Через 4 нед после завершения ХЛТ проводилась оценка результатов лечения. В дальнейшем пациенты получали адъювантную химиотерапию по схеме: Темозоломид 150–200 мг/м2 в 1–5-й дни; цикл 28 дней, с оценкой результатов лечения после каждых 2 курсов химиотерапии. Контрольное обследование включало осмотр невролога, МРТ головного мозга с контрастированием, оценку содержания секретируемого DLK-1 в сыворотке крови. Диагностика прогрессирования процесса осуществлялась на основании критериев RANO-HGG (Response Assessment in Neuro-Oncology criteria for high-grade gliomas) [8].
Содержание секретируемого DLK-1 оценивалось в сыворотке крови и ликворе пациентов. Забор образцов сыворотки и ликвора выполнялся перед началом лучевой терапии (в сроки 4–6 нед после оперативного лечения). Затем образцы сыворотки отбирали при оценке результатов ХЛТ и после каждых 2 курсов адъювантной химиотерапии. Определение содержания секретируемого DLK-1 в сыворотке крови и цереброспинальной жидкости выполнялось с использованием анализатора иммуноферментных реакций АИФР-01 Униплан и наборов иммуноферментного анализа (Cloud clone corporation, США), результаты выражали в нг/мл.
Статистическую обработку результатов проводили с применением пакета программ Statistica 10.0. Проверка нормальности распределения выполнялась с использованием критерия Шапиро–Уилка. Значимость различий независимых параметров в группах при ненормальном распределении оценивалась посредством дисперсионного анализа с использованием Н-критерия Краскела–Уоллеса. Различия считали значимыми при р<0,05. Для оценки выживаемости использовался моментный метод Каплана-Мейера с построением кривых выживаемости.
Результаты
В результате проведенного исследования выявлено, что медиана уровня белка DLK-1 в парных образцах у пациентов до начала химиолучевой терапии в ликворе составила 1,17 нг/мл (95 % ДИ 0,78; 2,89), а в сыворотке крови – 0,27 нг/мл (95 % ДИ 0,26; 0,29), различия были статистически значимы (р=0,006). Учитывая вероятность осложнений после выполнения люмбальной пункции и невозможность серийного повторного взятия образцов ликвора, на этапах комбинированного лечения и динамического наблюдения определение белка DLK-1 на дальнейших этапах комбинированного лечения выполнялось в сыворотке крови. На этапах комбинированного лечения не было обнаружено статистически значимых различий в содержании белка DLK-1 у пациентов с различным ответом на терапию, отмечался широкий размах значений при любой активности онкологического процесса. Наибольшая медиана содержания исследуемого маркера отмечалась при выявлении феномена «псевдопрогрессии», а самая низкая – при стабилизации процесса, р=0,2 (рис. 1).
Было оценено предиктивное влияние уровня DLK-1 в сыворотке пациентов с глиобластомой на результаты ХЛТ. Мы разделили пациентов на группу с контролем опухолевого роста (стабилизация и полная регрессия) и группу с прогрессированием процесса после проведения ХЛТ. Медиана уровня исследуемого белка в сыворотке до начала ХЛТ у пациентов с прогрессированием процесса составила 0,43 нг/мл (95 % ДИ 0,28–1,41), а при контроле опухолевого роста – 1,7 нг/мл (95 % ДИ 1,32–2,02), различия были статистически значимы (р=0,012).
При оценке результатов адъювантной химиотерапии у пациентов с контролем опухолевого роста и прогрессированием процесса не обнаружено предиктивного влияния DLK-1 в сыворотке крови. Медиана содержания исследуемого маркера перед началом адъювантной химиотерапии (через 4 нед после ХЛТ) у пациентов с контролем роста составила 1,6 нг/мл (95 % ДИ 1,32–1,71), а у пациентов с прогрессированием – 0,72 нг/мл (95 % ДИ 0,28– 1,95), различия не были значимыми (р=0,27).
У пациентов с метилированным промотором MGMT в опухоли медиана содержания исследуемого маркера в сыворотке до ХЛТ составила 1,32 нг/мл (95 % ДИ 0,28–1,6), а при отсутствии метилирования промотора MGMT – 0,33 нг/мл (95 % ДИ 0,21–1,19), различия не были значимыми (р=0,07). После ХЛТ уровень DLK-1 у пациентов с метилированным промотором MGMT составил 1,28 нг/мл (ДИ 95 % 0,27–1,61), при отсутствии метилирования промотора MGMT – 1,71 нг/мл (ДИ 95 % 1,43–1,81), различия также не были значимыми (р=0,27).
В исследовании прослежены исходы течения заболевания у 36 пациентов, 3 пациента выбыли из-под наблюдения из-за смены места жительства. Рецидив/продолженный рост опухоли диагностирован у 30 пациентов в сроки от 2 до 34 мес, медиана безрецидивной выживаемости – 7,0 мес (95 % ДИ 4,0–17,3 мес). Без признаков рецидива наблюдаются 6 пациентов в сроки от 18 до 73 мес. Специализированное лечение после прогрессирования продолжают получать 12 больных. Летальный исход зарегистрирован в 19 случаях. Медиана общей выживаемости в исследовании
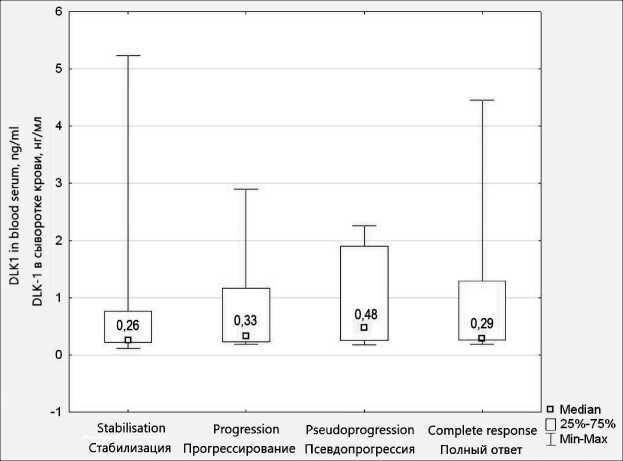
Рис. 1. Содержание DLK-1 в сыворотке крови у больных ГБ в зависимости от ответа на комбинированное лечение. Примечание: рисунок выполнен авторами
Fig. 1. The DLK-1 serum level in patients with glioblastoma depending on the treatment response.
Note: created by the authors составила 23,5 мес (95 % ДИ 13,0–52,1 мес). При оценке нормальности распределения сроков выживаемости пациентов обнаружено, что подавляющее большинство случаев рецидивов возникает в сроки до 10 мес, а летальных исходов – в сроки до 20 мес (рис. 2). Эти сроки мы приняли как критерии благоприятного и неблагоприятного прогноза.
При оценке взаимосвязи между уровнем DLK-1 в сыворотке пациентов с глиобластомой до начала ХЛТ и сроком первого рецидива обнаружено, что уровень маркера у пациентов с благоприятным прогнозом безрецидивной выживаемости составил 1,60 нг/мл (95 % ДИ 1,32–1,71), а у пациентов с неблагоприятным прогнозом – 0,32 нг/мл (95 % ДИ 0,23–0,43), различия значимые (р=0,005). Значимого влияния уровня DLK-1 после адъювантной ХЛТ на сроки первого рецидива не получено. Уровень DLK-1 через 4 нед после адъювантной ХЛТ у пациентов с благоприятным прогнозом безреци-дивной выживаемости составил 1,53 нг/мл (95 % ДИ 0,24–1,91), а при неблагоприятном прогнозе – 0,51 нг/мл (95 % ДИ 0,23–1,81), р=0,55 (рис. 3).
Медиана концентрации DLK-1 в сыворотке до начала ХЛТ у пациентов с благоприятным прогнозом общей выживаемости составила 1,01 нг/мл (95 % ДИ 0,38–1,71), у больных с неблагоприятным прогнозом – 0,32 нг/мл (95 % ДИ 0,28–1,32), различия значимые (р=0,04). Уровень DLK-1 через 4 нед после ХЛТ у пациентов с благоприятным прогнозом общей выживаемости составил 1,53 нг/мл (95 % ДИ 0,39–1,86), при неблагоприятном прогнозе – 0,23 нг/мл (95 % ДИ 0,23–1,28), различия также были значимые (р=0,04).
Обсуждение
Глиобластома является наиболее часто диагностируемой и агрессивной первичной злокачествен-
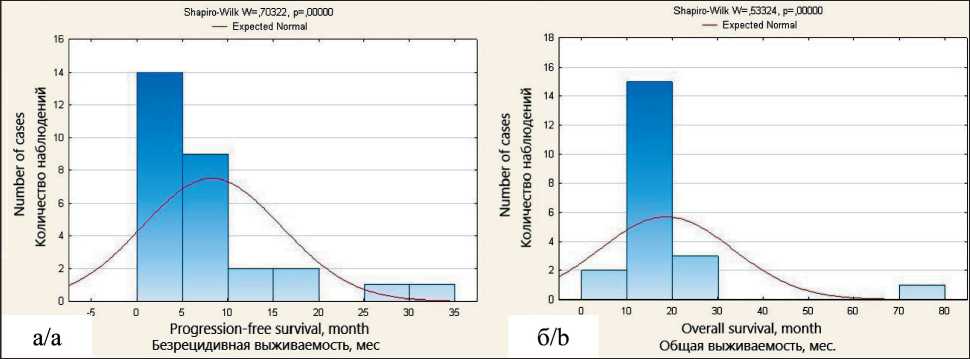
Рис. 2. Распределение сроков безрецидивной (а) и общей выживаемости (б) пациентов с глиобластомой.
Примечание: рисунок выполнен авторами
Fig. 2. Time distribution of relapse-free (a) and overall survival (b) in patients with glioblastoma. Note: created by the authors
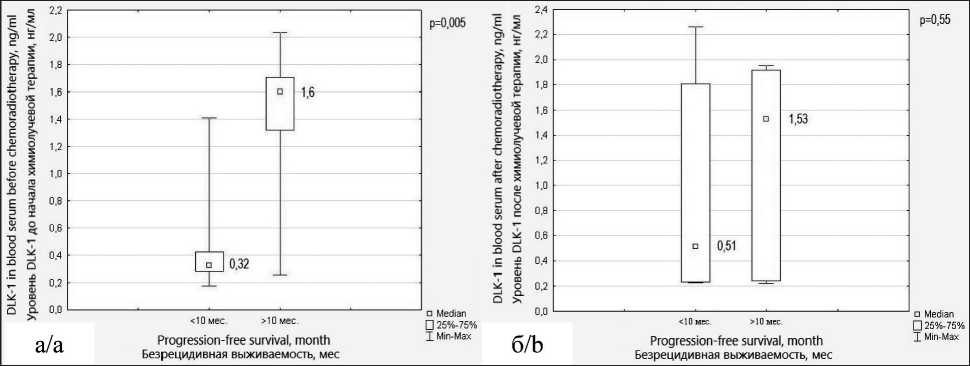
Рис. 3. Уровень DLK-1 в сыворотке крови больных с глиобластомой с неблагоприятным и благоприятным прогнозом безрецидивной выживаемости до начала химиолучевой терапии (а) и после химиолучевой терапии (б). Примечание: рисунок выполнен авторами
Fig. 3. The DLK-1 serum level in glioblastoma patients with favorable and unfavorable prognosis of progression-free survival before starting chemoradiotherapy (a) and after chemoradiotherapy (b). Note: created by the authors
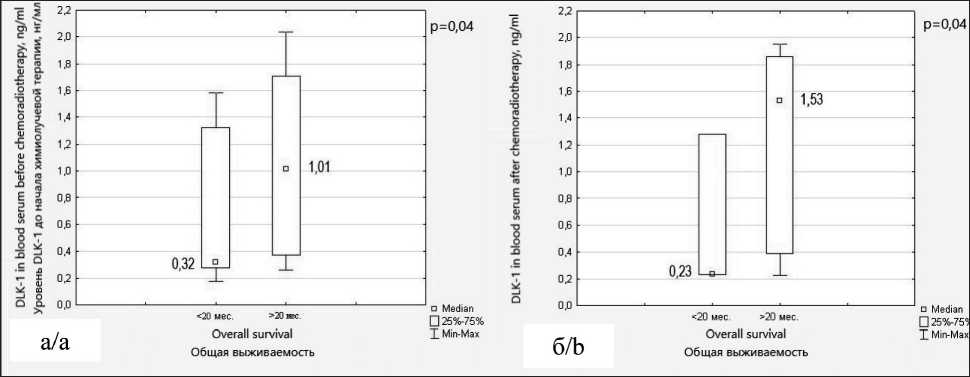
Рис. 4. Уровень DLK-1 в сыворотке крови больных с глиобластомой с неблагоприятным и благоприятным прогнозом общей выживаемости до начала химиолучевой терапии (а) и после химиолучевой терапии (б).
Примечание: рисунок выполнен авторами
Fig. 4. The DLK-1 serum level in patients with glioblastoma with unfavorable and favorable prognosis of overall survival before starting chemoradiotherapy (a) and after chemoradiotherapy (b). Note: created by the authors ной опухолью головного мозга. Своевременное мультидисциплинарное лечение рецидива глиобластомы позволяет увеличить общую выживаемость пациентов, сохранить качество жизни и независимость от постороннего ухода. В течение 12 мес после лучевой терапии появление новых или увеличение существующих ранее очагов накопления контрастного вещества на МРТ в зоне облучения головного мозга может свидетельствовать не только о возникновении рецидива опухоли, но и о постлучевых изменениях головного мозга – феномене «псевдопрогрессии». Псевдопрогрессия обычно возникает в течение 12 нед после лучевой терапии у 10–30 % пациентов с глиобластомой и затем спонтанно регрессирует или стабилизируется без каких-либо изменений противоопухолевого лечения [15]. Этот феномен более распространен при наличии метилированного промотора MGMT в опухоли и свидетельствует об эффективности проводимой терапии и благоприятном прогнозе [16]. Неправильная оценка псевдопрогрессии может привести к преждевременной отмене эффективной терапии или, при недооценке прогрессирования процесса, – к нарастанию неврологического дефицита и ухудшению результатов лечения. Верификация рецидива ГБ с помощью биопсии не проводится вследствие высокоинвазивного характера процедуры и наличия осложнений, которые могут ухудшить состояние пациента. В настоящее время идет активный поиск биомаркеров, которые позволили бы надежно диагностировать глиобластому до оперативного вмешательства, определить ее прогноз и ответ на лечение [17].
Дельта-подобный неканонический лиганд Notch 1 обладает трансмембранной и секретируемой изоформой, определение которой в сыворотке крови происходит при поражении ЦНС и нарушении гематоэнцефалического барьера (ГЭБ). Соотношение между изоформами этого биомаркера является фундаментальным для поддержания нейрональных стволовых клеток в зародышевой нише субвентрикулярной зоны с раннего постнатального периода и на протяжении всей взрослой жизни. Специализированные нишевые астроциты секретируют DLK-1, в то время как нервные стволовые клетки экспрессируют только изоформу, связанную с мембраной. Секретируемый DLK1 действует как нишевый паракринный фактор и посредством мембраносвязанной формы, экспрессируемой нервными стволовыми клетками, регулирует их количество независимым от Jag1 и Notch1 образом. Прекращение экспрессии DLK-1 либо в астроцитах, либо в нервных стволовых клетках приводит к дифференцировке в зрелые нейроны и потере пула стволовых клеток [12, 18].
DLK-1 можно обнаружить не только в цереброспинальной жидкости, но и в образцах сыворотки и плазмы человека. У здоровых людей содержание этого маркера обычно низкое и практически не поддается обнаружению. DLK-1 экспрессируется с высокой частотой при многих распространенных злокачественных новообразованиях (печень, молочная железа, головной мозг, поджелудочная железа, толстая кишка и легкие). Хотя точный механизм, посредством которого функционирует DLK-1, до конца не изучен, известно, что он поддерживает клетки в недифференцированном фенотипе и обладает онкогенными свойствами [10].
В результате проведенного исследования обнаружено, что уровень белка DLK-1 в ликворе у пациентов был значимо выше, чем в сыворотке крови в парных образцах. Полученные результаты более вероятно обусловлены нарушением ГЭБ у пациентов с ГБ и отсутствием активного транспорта исследуемого маркера через ГЭБ.
В экспериментальных исследованиях обнаружено, что экспрессия белка DLK-1 в глиомах выше, чем в нормальном мозге [13, 20]. Среда, обогащенная секретируемым DLK-1, способствовала росту глиомы [19, 21], а введение антитела к DLK-1 блокировало рост клеток, стимулированный DLK-1 [21]. На основании этих данных нами предположена возможность обнаружения прогрессирования глиобластомы при помощи оценки концентрации DLK-1 в сыворотке крови пациентов. Полученные в нашем исследовании результаты не показали значимых различий DLK-1 в сыворотке пациентов с ГБ при стабилизации процесса, прогрессировании, при псевдопрогрессии и полном ответе на терапию. Ранее исследователями показаны противоречивые результаты влияния DLK-1 на онкологический процесс в зависимости от гистологической структуры опухоли. Предположено, что функциональная роль DLK-1 и соотношение его изоформ могут отличаться в разных типах тканей и по-разному влиять на конечный результат [10, 11].
При оценке содержания DLK-1 у пациентов после хирургического лечения ГБ до начала ХЛТ обнаружены значимые различия уровня исследуемого белка в сыворотке в зависимости от непосредственных результатов химиолучевого лечения. Для пациентов с отсутствием чувствительности к ХЛТ с темозоломидом (прогрессирование процесса после ХЛТ) был характерен более низкий уровень DLK-1 в сыворотке крови, по сравнению с больными, у которых диагностирован контроль роста после лучевой терапии. Ранее в клинических исследованиях не проводилась оценка предиктивного влияния уровня дельта-подобного неканонического лиганда Notch 1 на результаты комбинированного лечения глиом. В модельных исследованиях, несмотря на более инвазивный характер глиомы при повышенной экспрессии DLK-1, снижения выживаемости мышей с глиомой обнаружено не было [13].
Оценка прогностического влияния уровня секретируемого DLK-1 у пациентов на безрецидивную и общую выживаемость показала, что у пациентов с высоким уровнем общей и безрецидивной выживаемости содержание DLK-1 в сыворотке перед началом ХЛТ было статистически значимо выше, чем у пациентов с низким уровнем выживаемости. А через 4 нед после завершения ХЛТ (при оценке результатов лечения) уровень DLK-1 был значимо выше у пациентов с высоким уровнем общей выживаемости, но не имел прогностического значения в отношении безрецидивной выживаемости. В выполненных ранее клинических исследованиях оценено прогностическое влияние экспрессии DLK-1 только в опухолевых образцах. В ряде исследований обнаружено, что экспрессия DLK-1 в опухолевых образцах коррелирует с низкой общей выживаемостью у пациентов с раком печени [20], низкой безре-цидивной выживаемостью при немелкоклеточном раке легких [22], низкой общей и безрецидивной выживаемостью у пациентов с гастроинтестинальными опухолями [23] и серозной карциномой яичников высокой степени злокачественности [24]. Адъювантная терапия ассоциировалась с лучшим исходом у пациентов с DLK1-негативными по сравнению с DLK1-позитивным гастроинтестинальными опухолями [23].
Полученные в нашем исследовании результаты согласуются с противоречивыми результатами влияния DLK-1 на онкологический процесс, показанными ранее. Для определения значения этого биомаркера у пациентов с глиомами необходимы дальнейшие исследования с определением различных изоформ DLK-1 на более репрезентативных группах пациентов с глиомами различной степени злокачественности.
Список литературы Связь содержания белка DLK-1 в сыворотке крови с выживаемостью больных с глиобластомами
- Ostrom Q.T., Liao P., Stetson L.C., Barnholtz-Sloan J.S. Epidemiology of glioblastoma and trends in glioblastoma survivorship. Glioblastoma. Elsevier Inc., 2016. P. 11-19.
- Ostrom Q.T., Price M., Neff C., Cioffi G., Waite K.A., Kruchko C., Barnholtz-Sloan J.S. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2016-2020. Neuro Oncol. 2023; 25(12s2): 1-99. https://doi.org/10.1093/neuonc/noad149.
- Weller M., van den Bent M., Preusser M., Le Rhun E., Tonn J.C., Minniti G., Bendszus M., Balana C., Chinot O., Dirven L., French P., Hegi M.E., Jakola A.S., Platten M., Roth P., Rudà R., Short S., Smits M., Taphoorn M.J.B., von Deimling A., Westphal M., Soffietti R., Reifenberger G., Wick W. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. 2021; 18(3): 170-86. https://doi.org/10.1038/s41571-020-00447-z. Erratum in: Nat Rev Clin Oncol. 2022; 19(5): 357-58. https://doi.org/10.1038/s41571-022-00623-3.
- Horbinski C., Nabors L.B., Portnow J., Baehring J., Bhatia A., Bloch O., Brem S., Butowski N., Cannon D.M., Chao S., Chheda M.G., Fabiano A.J., Forsyth P., Gigilio P., Hattangadi-Gluth J., Holdhoff M., Junck L., Kaley T., Merrell R., Mrugala M.M., Nagpal S., Nedzi L.A., Nevel K., Nghiemphu P.L., Parney I., Patel T.R., Peters K., Puduvalli V.K., Rockhill J., Rusthoven C., Shonka N., Swinnen L.J., Weiss S., Wen P.Y., Willmarth N.E., Bergman M.A., Darlow S. NCCN Guidelines® Insights: Central Nervous System Cancers, Version 2.2022. J Natl Compr Canc Netw. 2023; 21(1): 12-20. https://doi.org/10.6004/jnccn.2023.0002.
- Ulitin A.Yu., Zheludkova O.G., Ivanov P.I., Kobyakov G.L., Matsko M.V., Naskhletashvili D.R., Protsenko S.A., Ryzhova M.V. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu pervichnykh opukholei tsentral'noi nervnoi sistemy. Zlokachestvennye opukholi. 2022; 12(3s2-1): 113-40. https://doi.org/10.18027/2224-5057-2022-12-3s2-113-140.
- Di Nunno V., Franceschi E., Tosoni A., Di Battista M., Gatto L., Lamperini C., Minichillo S., Mura A., Bartolini S., Brandes A.A. Treatment of recurrent glioblastoma: state-of-the-art and future perspectives. Expert Rev Anticancer Ther. 2020; 20(9): 785-95. https://doi.org/10.1080/14737140.2020.1807949.
- Chen W., Wang Y., Zhao B., Liu P., Liu L., Wang Y., Ma W. Optimal Therapies for Recurrent Glioblastoma: A Bayesian Network Meta-Analysis. Front Oncol. 2021; 11. https://doi.org/10.3389/fonc.2021.641878.
- Wen P.Y., Macdonald D.R., Reardon D.A., Cloughesy T.F., Sorensen A.G., Galanis E., Degroot J., Wick W., Gilbert M.R., Lassman A.B., Tsien C., Mikkelsen T., Wong E.T., Chamberlain M.C., Stupp R., Lamborn K.R., Vogelbaum M.A., van den Bent M.J., Chang S.M. Updated response assessment criteria for high-grade gliomas: response assessment in neuro-oncology working group. J Clin Oncol. 2010; 28(11): 1963-72. https://doi.org/10.1200/JCO.2009.26.3541.
- van Dijken B.R.J., van Laar P.J., Holtman G.A., van der Hoorn A. Diagnostic accuracy of magnetic resonance imaging techniques for treatment response evaluation in patients with high-grade glioma, a systematic review and meta-analysis. Eur Radiol. 2017; 27(10): 4129-44. https://doi.org/10.1007/s00330-017-4789-9.
- Pittaway J.F.H., Lipsos C., Mariniello K., Guasti L. The role of delta-like non-canonical Notch ligand 1 (DLK1) in cancer. Endocr Relat Cancer. 2021; 28(12): 271-87. https://doi.org/10.1530/ERC-21-0208.
- Grassi E.S., Pietras A. Emerging Roles of DLK1 in the Stem Cell Niche and Cancer Stemness. J Histochem Cytochem. 2022; 70(1): 17-28. https://doi.org/10.1369/00221554211048951.
- Ferrón S.R., Charalambous M., Radford E., McEwen K., Wildner H., Hind E., Morante-Redolat J.M., Laborda J., Guillemot F., Bauer S.R., Fariñas I., Ferguson-Smith A.C. Postnatal loss of Dlk1 imprinting in stem cells and niche astrocytes regulates neurogenesis. Nature. 2011; 475(7356): 381-5. https://doi.org/10.1038/nature10229.
- Grassi E.S., Pantazopoulou V., Pietras A. Hypoxia-induced release, nuclear translocation, and signaling activity of a DLK1 intracellular fragment in glioma. Oncogene. 2020; 39(20): 4028-44. https://doi.org/10.1038/s41388-020-1273-9.
- Louis D.N., Perry A., Wesseling P., Brat D.J., Cree I.A., Figarella-Branger D., Hawkins C., Ng H.K., Pfister S.M., Reifenberger G., Soffietti R., von Deimling A., Ellison D.W. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021; 23(8): 1231-51. https://doi.org/10.1093/neuonc/noab106.
- Abbasi A.W., Westerlaan H.E., Holtman G.A., Aden K.M., van Laar P.J., van der Hoorn A. Incidence of Tumour Progression and Pseudoprogression in High-Grade Gliomas: a Systematic Review and Meta-Analysis. Clin Neuroradiol. 2018; 28(3): 401-11. https://doi.org/10.1007/s00062-017-0584-x.
- Brandes A.A., Franceschi E., Tosoni A., Blatt V., Pession A., Tallini G., Bertorelle R., Bartolini S., Calbucci F., Andreoli A., Frezza G., Leonardi M., Spagnolli F., Ermani M. MGMT promoter methylation status can predict the incidence and outcome of pseudoprogression after concomitant radiochemotherapy in newly diagnosed glioblastoma patients. J Clin Oncol. 2008; 26(13): 2192-7. https://doi.org/10.1200/JCO.2007.14.8163.
- Ryabova A.I., Novikov V.A., Choĭnzonov E.L., Spirina L.V., Yunusova N.V., Ponomareva A.A., Tamkovich S.N., Gribova O.V. Rol' zhidkostnoi biopsii v diagnostike progressirovaniya glioblastomy. Sibirskii onkologicheskii zhurnal. 2022; 21(3): 104-16. https://doi.org/10.21294/1814-4861-2022-21-3-104-116.
- Traustadóttir G.Á., Lagoni L.V., Ankerstjerne L.B.S., Bisgaard H.C., Jensen C.H., Andersen D.C. The imprinted gene Delta like non-canonical Notch ligand 1 (Dlk1) is conserved in mammals, and serves a growth modulatory role during tissue development and regeneration through Notch dependent and independent mechanisms. Cytokine Growth Factor Rev. 2019; 46: 17-27. https://doi.org/10.1016/j.cytogfr.2019.03.006.
- Grassi E.S., Jeannot P., Pantazopoulou V., Berg T.J., Pietras A. Niche-derived soluble DLK1 promotes glioma growth. Neoplasia. 2020; 22(12): 689-701. https://doi.org/10.1016/j.neo.2020.10.005.
- Jin Z.H., Yang R.J., Dong B., Xing B.C. Progenitor gene DLK1 might be an independent prognostic factor of liver cancer. Expert Opin Biol Ther. 2008; 8(4): 371-7. https://doi.org/10.1517/14712598.8.4.371.
- Yin D., Xie D., Sakajiri S., Miller C.W., Zhu H., Popoviciu M.L., Said J.W., Black K.L., Koeffler H.P. DLK1: increased expression in gliomas and associated with oncogenic activities. Oncogene. 2006; 25(13): 1852-61. https://doi.org/10.1038/sj.onc.1209219.
- Takagi H., Zhao S., Muto S., Yokouchi H., Nishihara H., Harada T., Yamaguchi H., Mine H., Watanabe M., Ozaki Y., Inoue T., Yamaura T., Fukuhara M., Okabe N., Matsumura Y., Hasegawa T., Osugi J., Hoshino M., Higuchi M., Shio Y., Kanno R., Aoki M., Tan C., Shimoyama S., Yamazaki S., Kikuchi H., Sakakibara-Konishi J., Oizumi S., Harada M., Akie K., Sugaya F., Fujita Y., Takamura K., Kojima T., Honjo O., Minami Y., Nishimura M., Dosaka-Akita H., Nakamura K., Inano A., Isobe H., Suzuki H. Delta-like 1 homolog (DLK1) as a possible therapeutic target and its application to radioimmunotherapy using 125I-labelled anti-DLK1 antibody in lung cancer models (HOT1801 and FIGHT004). Lung Cancer. 2021; 153: 134-42. https://doi.org/10.1016/j.lungcan.2021.01.014.
- Xu J., Wang M., Zhang Z., Zhao W., Wang C., Tu L., Zhang Y., Cao H. Prognostic values of DLK1 for surgery and imatinib mesylate adjuvant therapy in gastrointestinal stromal tumors. Am J Cancer Res. 2016; 6(11): 2700-12.
- Huang C.C., Cheng S.H., Wu C.H., Li W.Y., Wang J.S., Kung M.L., Chu T.H., Huang S.T., Feng C.T., Huang S.C., Tai M.H. Delta-like 1 homologue promotes tumorigenesis and epithelial-mesenchymal transition of ovarian high-grade serous carcinoma through activation of Notch signaling. Oncogene. 2019; 38(17): 3201-15. https://doi.org/10.1038/s41388-018-0658-5.


