Свойства электростатического потенциала и электронной плотности в сравнении сорбционной активности хромат- и фосфат-анионов
Автор: Шманина Елена Александровна, Барташевич Екатерина Владимировна, Печенюк София Ивановна, Михайлов Геннадий Георгиевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 4 т.5, 2013 года.
Бесплатный доступ
Проведена сравнительная характеристика распределений функций, получаемых на основе электронной плотности и свойств электростатического потенциала на заданном контуре электронной плотности для фосфати хромат-анионов и их протонированных форм с целью исследования возможности использования данных функций в описании относительной сорбционной активности ионов.
Молекулярный электростатический потенциал, электронная плотность, лапласиан электронной плотности, теория qtaim
Короткий адрес: https://sciup.org/147160276
IDR: 147160276 | УДК: 544.723,
Текст научной статьи Свойства электростатического потенциала и электронной плотности в сравнении сорбционной активности хромат- и фосфат-анионов
Решение задач, направленных на ресурсосбережение и снижение рисков техногенных катастроф, требует подходов, основанных на фундаментальных исследованиях структуры и свойств частиц, выступающих загрязнителями окружающей среды. Исследования, ведущиеся в данном направлении, включают как экспериментальные, так и теоретические подходы к изучению сорбционных процессов и действия эффективных сорбентов [1–3]. Отметим важность теоретических подходов, которые позволяют анализировать структурные и электронные особенности строения частиц, поверхностей, адсорбционных комплексов. Подходы, основанные на моделировании структуры и свойств частиц, дают объяснения механизмам невалентных взаимодействий в конденсированных средах, что в свою очередь позволяет прогнозировать условия эффективного извлечения вредных частиц в процессах очистки и разделения. Можно выделить направления, посвящённые либо моделированию свойств сорбента, либо исследованиям строения промежуточного комплекса «сорбат-сорбент», либо свойствам сорбата. Теоретическая оценка сорбционного сродства остается не менее важной задачей, поскольку электронные и пространственные особенности строения частиц содержат необходимую информацию для понимания закономерностей и механизмов протекания сорбции. Такие исследования требуют использования представлений о распределении электронной плотности и формируемых ею особенностей строения, отвечающих за специфику невалентных взаимодействий.
Систематические экспериментальные исследования сорбции анионов на поверхности рентгеноаморфных оксигидроксидов металлов (железа, циркония, алюминия) позволили изучить обширный ряд сорбционных процессов в варьирующихся условиях для ряда анионов, таких как фосфат, карбонат, оксалат, тартрат, цитрат, хромат-анионы [4–8]. Авторы [9] показывают, что положение анионов в относительном ряду их сорбируемости незначительно зависит от природы сорбирующих их оксигидроксидов и ионной среды. В то же время оценка геометрических размеров, формы анионов, их формальных зарядов не позволяет расположить их в ряд симбатно экспериментально наблюдаемому сорбционному сродству. Например, наблюдаемая сравнительно высокая сорбционная активность фосфат-анионов и низкая хромат-анионов никак не может быть объяснена с позиций их сходной геометрической формы и формальных зарядов их гидратированных форм. Экспериментальные данные [9] свидетельствуют, что хромат- и фосфат-анионы обладают контрастно-противоположным адсорбционным сродством по отношению к оксигидроксидам железа или циркония. Известно, что часть исследуемых фосфат и хромат-анионов практически во всей анализируемой в эксперименте области рН существуют в виде гидро- и дигидро-форм: НPO4 2– (при pH 9) или Н 2 PO 4 – (при pH 5), НCrO 4 – (при pH 5).
Соответствующие формы хромат- и фосфат-анионов, обладающие контрастнопротивоположным сорбционным сродством по отношению к оксигидроксидам железа или циркония, выступили объектами нашего исследования. Основной задачей данной работы явилась сравнительная характеристика свойств электронной плотности и распределений молекулярного электростатического потенциала, нанесенного на заданный контур электронной плотности геометрически сходных частиц – фосфат и хромат-анионов, а также их протонированных форм. Мы задались целью оценить возможность интерпретации различной способности к невалентным взаимодействиям исследуемых частиц в терминах полученных данных об их электронной плотности и свойствах электростатического потенциала.
Методы расчетов
Локализация равновесной геометрии ионов PO 4 3– , CrO 4 2– , НPO 4 2– , Н 2 PO 4 – , НCrO 4 – и расчет волновых функций выполнялись методом Кона-Шэма [10] с использованием функционала B3LYP и базисного набора 6-31G** в программе Firefly, version 8.0.0 [11].
В том же приближении, что и оптимизация геометрии, для всех рассматриваемых структур выполнены расчеты волновых функций, которые использовались для вычисления квантовотопологических характеристик электронной плотности на базе теории QTAIM [12]. Поиск критических точек электронной плотности, расчет значений лапласиана электронной плотности и карт электростатического потенциала производились с использованием программы AIMAll 12.06.03 [13].
Мы последовательно обратили внимание на ряд различных величин, полученных на основе электростатического потенциала ( V S ) и его распределении в трехмерном пространстве на поверхности исследуемых анионов. Вычислены величины максимумов ( VS max ) и минимумов ( VS min ) электростатического потенциала, его среднее значение ( V mеan s ). Для анионов среднее значение электростатического потенциала вычислялось следующим образом:
t
V "" = 1 £ V ( r J , t i = 1
где t – общее число точек, задаваемое сеткой на поверхности выбранного контура электронной плотности. Проанализированы закономерности в относительном расположении минимумов и максимумов на поверхности анионов. Наряду с вышеперечисленными величинами была вычислена общая площадь поверхности аниона ( A tot). В качестве внешней сферы частицы мы использовали контур электронной плотности, равный 0,001 ат. ед. [14].
Все процедуры визуализации 2D и 3D карт распределения электростатического потенциала и свойств электронной плотности производились с помощью программных пакетов Multiwfn 2.3 [15], MoleCoolQt [16].
Обсуждение результатов
Ряд современных публикаций [17–28] свидетельствует о том, что молекулярный электростатический потенциал (МЭП) можно рассматривать в качестве фундаментального фактора, определяющего природу и поведение атомов и молекул, их способность к межмолекулярным взаимодействиям. В работах, направленных на поиск взаимосвязи между экспериментально наблюдаемыми сорбционными свойствами и электронными характеристиками частиц, получаемых в результате квантово-химических расчетов, наглядно продемонстрировано успешное использование свойств молекулярного электростатического потенциала (МЭП) [17–19]. Карта электростатического потенциала, как правило, наносится на поверхность частицы, отвечающую контуру электронной плотности, близкой к границам, задаваемым ван-дер-ваальсовыми радиусами. С помощью локальных значений полного электростатического потенциала описываются свойства, включающие в себя потенциальную способность частиц участвовать в межмолекулярных взаимодействиях.
Обратим внимание на то, что пространственное распределение электростатического потенциала зависит от соотношения размеров и зарядов ионов. Для изолированного положительного иона и изолированного нейтрального атома он всюду положителен за пределами ядер и монотонно стремится к нулю с ростом удаления от ядра. В то же время, для изолированных моноядерных отрицательных ионов он монотонно затухает, проходя через ноль и достигая своего единственного отри- цательного минимума на некотором расстоянии от ядра. В дальнейшем, при r→∞, электростатический потенциал стремится к нулю со стороны области отрицательных значений [20, 21].
Д ля ра сс м а тривае м ых нами ф осф а т и хром а т-анионов величина электростатического потенци а ла , на несе нна я н а поверхн ость, задаваемую контуром электронной пл о тнос ти 0, 001 ат. е д. , который близок к границе ван - дер-ваальсового радиуса, везде отрицательна. В силу того, что мы ра с сма три вае м облас ти локализации ег о на и б ол ьш их V s max и наименьших V s min значений, далее в те к с те и спольз у е тс я выражени е «область низких значений потенциала» для б о ль ш и х п о м од у л ю отрицате льн ых ве ли чин п оте нц иа ла.
Ана лиз иру я ве личи ны и положение минимумов и максимумов электро с та т иче ского п отен циа ла на поверхности мо лекул, Поли тцер и соавторы [21, 29] объясняют силу и направленность г а ло г енных с в я зей, пр иб ега я к поня ти ю « σ-hole» (σ-дырка). Она определяется как область повы ш е н ны х (к ак пра вило , по ложи тельных для нейтральных молекул) значений э ле к трос татическо го потенциала на продо лж е н ии ко валентной связи атома галогена. Позднее эти ми ж е а втор а ми б ы ло пре д ло ж е но ис п ольз о ва н ие а налогичной терминологии для концевых атом ов к ис лород а и ли с еры, связанных в молекуле [30 , 3 1]. С точки зрения орбитального подхода [21, 32] такая область хара к т е ри зу е тся истощение м з а с еле нно с ти np z -орбитали атома, если ось z направлена вдоль его ковале нтн ой связ и. Т аким об разом , пон я тие « σ-дырка», описывающее наличие области относи те ль но пов ыше нны х зн аче ний электростатического потенциала, находящейс я на пр од олж ении ковале нтн ой с вя зи а том а, приобре ло у ниверс а льн ый хара к тер.
С у ч ет ом т ого, ч то в и ссле дуемых нами анионах подавляющее число св яз ей – это связи X–O (где Х = С, P, Cr, S ), н ам и бы л о проанализировано распределение областей л о к ализаци и вы со к и х и низких з начен ий э л ектр о ст ат ич еского потенциала на поверхности анионов. Устан о в л ено, ч то в о з можн ы тр и ти п а л о к ал и з аци и о бластей высоких значений потенциала в рассм от р енных анио н ах .
-
1. Лок а лиз а ци я на продо лжении к овале нтн ой с вя з и, та к н а з ы вае м ая σ-дырка [33] – относи те ль ное повыше н ие элект р ос татического потенциала на внешней поверхно сти а том ов кислорода в а нион ах т е траэдрическ ог о ст роения, у которых область истощения электр оста тиче ск ог о п оте н циа ла ф ормируетс я на пр од ол жении связи Х=О. Эти области сосредоточ е ны на ма ксимально д ос ту пн ой вне шней повер хнос ти аниона. Аналогичным образом, для плоских к а р б онат или ок с а-лат- анионов обла с ти в ы соки х значений электростатического потенци а ла , вы д е л е нн ы е на рис. 1, а, б темно-с еры м ц ве том , ра с положены н а а т омах к ислоро д а .
-
2. Концентра ция пов ы шенных значений потенциала на поверхности атомо в водород а . В н а ш е м с л у чае э то анионы кис лых с олей, с о д е ржащие ковалентные О –Н связи, а также С–Н связи в а нион а х ор г аниче ск их с ое д инений.
-
3. Об ла сть наим е нее отр ицатель н ого электро с татич е с к ого поте нциала расположена ортого на ль но плос к ости, в к оторо й рас поло жены s p 2 -гибридизованные орбитали, так называемая «π-дырка» [33 ] . В на ше м слу ча е э та область наблюдается в структурах карбон ат - и оксалат-анионов на д и по д плоск ос тью к арбона тн ой и кар б о к с иль но й групп. Такие области более заметны при ра с смотр е нии ра с преде л ения э лектростатического потенциала на контуре со ответс тву ю щ ем и о н ному рад иу с у к ис лор од а 0, 01 ат. ед . (рис. 1, в, г).
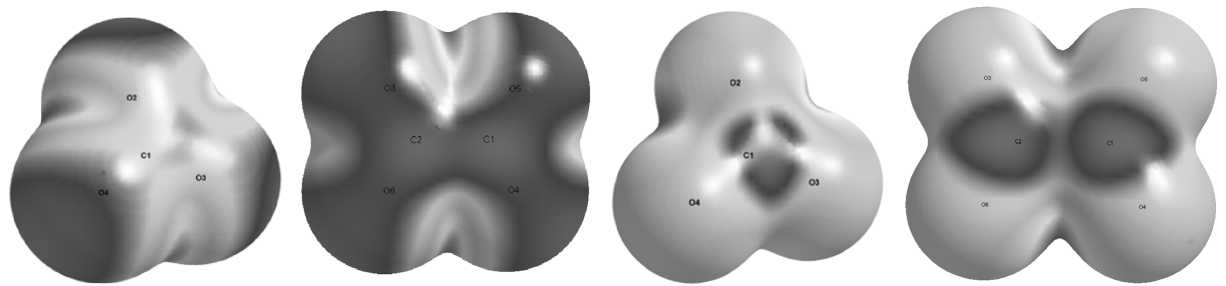
а) б) в) г)
Рис. 1. Локальные значения электростатического потенциала, нанесенные на поверхность, ограниченную контуром электронной плотности 0,001 ат. ед.: а) для CO 3 2– , б) C 2 O 4 2– , и на поверхность, ограниченную контуром электронной плотности 0,01 ат. ед.:в) для CO 3 2– и г) C 2 O 4 2–
Обращение к экстремумам электростатического потенциала обосновано не только традиционным использованием этих величин как дескрипторов межмолекулярных взаимодействий. Как известно, интегрирование свойств по объему, ограниченному выбранной поверхностью, производится с точностью до постоянной интегрирования, которая будет зависеть от размера и индивидуальности сравниваемых частиц. Однако положения экстремальных значений Vsmax и Vsmin определяется однозначно, и может выступать физически обоснованным индикатором при сравнении пространственного расположения областей, отвечающих за способность к невалентным взаимодействиям в разных анионах. Также представляют интерес диапазоны изменений потенциала, вычисление которых произведено на основе разниц его экстремальных значений. Данные о характеристиках электростатического потенциала представлены в табл. 1.
Таблица 1
Значения характеристик электростатического потенциала для фосфат-, гидрофосфат-, дигидрофосфат- и хромат-анионов, рассчитанных на поверхности контура электронной плотности 0,001 ат. ед.
|
Анион |
Vs max, ат. ед. |
Vs min, ат. ед. |
V mеans, ат. ед. |
Ato t , Å2 |
Vs max / Atot , ат. ед./А 2 |
|
H 2 PO 4 – |
–0,083 |
–0,223 |
–0,184 |
373,5 |
–0,00022 |
|
HPO 4 2– |
–0,261 |
–0,409 |
–0,369 |
377,7 |
–0,00069 |
|
PO 4 3– |
–0,516 |
–0,592 |
–0,553 |
377,7 |
–0,00137 |
|
CrО 4 2– |
–0,341 |
–0,389 |
–0,359 |
385,6 |
–0,00088 |
|
HCrО 4 – |
–0,0735 |
–0,207 |
–0,178 |
383,3 |
–0,00092 |
М а кс и м у мы э л е к тро с та тиче с к о го п от е н ц и а ла V s max в непротонированных анионах тетраэдрической конфигурации PO 4 3– , CrO 4 2– , сосредоточены на атомах кислорода на рис. 2, области высо кого э лек трос т а ти че с ког о п оте нциала обозначены более тёмным цветом. Д ля хромат-аниона сре д н и е зн а че н и я э ле к тр ос та ти че ск ого п оте н ц и ал а Vs mean , выделенные белым цветом на рис. 2, о пояс ы в а ю т э к в а т ори а ль н у ю область атома хрома. Минимумы электростати че с к ог о потенциала V s min , в ыд е ле н н ы е н а ри с. 2 с в е тло -серым цветом, сосредоточены по биссектрисам углов О–Cr–O.
М а кс и м альн о е зн а че ни е электростатического потенциала для фосфат-аниона V s max = –0, 516 а т. е д ., э то н и же , че м д ля хром а т-аниона V s max = –0,314 ат. ед. (табл. 1). Следовательно, хромат- а н ион обла д ае т более выраженной способностью к взаимод е й с тв и ям с э лек тр о н одон орны ми и ли форм альн о отри ц а тельн о за ря ж е н н ыми ц е н трами сорбента. Однако если рас сма три ват ь а н и оны в у с л ови ях, близких к экспериментальным [9], то есть уч е с ть, что в ра с тв ор е фосфат- ан ион наход и тс я и с к лю чительно с протонированной форме, следует с ра в н и в а ть с в ой с тв а соответс тв е н н ым об р а зо м протон и ров а н н ых фор м анионов. Известно [9], что дигидрофосфат-анион и гидрохромат-ан ион мо гут совместно сосуществовать в растворе. При с оп о с та в ле н ии р а с че тн ых мак с и му м ов э л е к тро статического потенциала видно, что более вы с ок о е зн а че н и е V s max характерно для дигидрофосфат-аниона. При сравнении минимальных значений потенциала, по л у че н с ле д у ю щ и й ряд , в к отором анионы расположены от большего значени я Vs min к меньшему (ат. ед.): гидрохромат (– 0 , 207) , д и гид ро фосфа т (–0,223), хромат (–0,389), гидрофосфат (–0,409), фосфат (–0,592). То ест ь, в н а б лю да е мы х у с лов и ях ги д ро фосфа т -анион также имеет преимущества перед хромат-ан ион ом. Т ак и м образом, сравнение диапазонов электростат и че с к ог о п оте н ц и а л а , оп ред е ляе м ых ра зн и це й ме жду значениями экстремумов, приводит к выв од у о том, что б ол ьшей потенци альной с п о с об н остью к невалентным взаимодействиям обла д ае т ги д ро фосфа т - ан ион , д ля к оторо го хар а к те рн о на и ме н ьше е зн аче н и е ми н и му ма Vs min и наибольшее значение мак с и м у ма э л е к троста ти чес к о го потенц и ала Vs max .
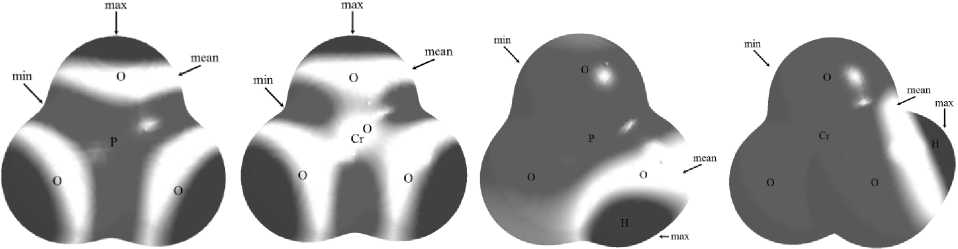
а) б) в) г)
Рис. 2. Локальные значения электростатического потенциала, нанесенные на поверхность, ограниченную контуром электронной плотности 0,001 ат. ед.: а) PO 4 3– , б) CrO 4 2– , в) НPO 4 2– , г) HCrO 4
Для фосфат- аниона средние значения V mеan s расположены в области «экваториального пояса» большого круга атомной поверхности кислородов. В гидрофосфат (НPO 4 2– ), дигидрофосфат (Н 2 PO 4 – ) и гидрохромат-анионах (HCrO 4 – ) минимальные значения электростатического потенциала сосредото чены на атомах кислорода, а максимум электростатического потенциала V s max приходится на атомы водорода ОН групп. Очевидно, что для гидрофосфат и гидрохромат -анионов значения всех представ ленных характеристик электрос татического потенциала (максимальное, минимальное, среднее зна чение электростатического потенциала, среднее отклонение от значений V mеans ) выше, чем для соот ветствующих непротонированных фосфат и хромат -анионов.
Предполагая пространственные аспекты механи зма сорбции, следует ожидать ориентации областей минимумов электрос татического потенциала анионов на области положительного эле к тростатического потенциала со рбента, например, на водороды гидроксильн ых групп или участки поверхностей, формируемые катионами м еталла с ненасыщенной координационной сферой. Од нако данный процесс вероятен в случае непосредственной доступности обл асти минимума эле к тростатического потенциала и в отсутствии других конкурирующих центро в.
При протонировании анионов происходит кардинальное перераспределение электростатиче ского потенциала, которое, вер оятно, будет увеличивать его сорбционное с родство, влияя на п о ведение в процессе сорбции. П ри сопоставлении распределения электроста тического потенциала в области его максимумов, ви дно, что так называемые σ-дырки сосредоточены на каждом из ато мов кислорода. Отметим, что в протонированных формах анионов σ-дырок нет. Области повы шенных значений потенциала наблюдаются только на атомах водорода. Этот факт позволяет предположить, что суще ствую т различные виды связывания с сорбционны ми центрами для пр о тонированной и непротонированной формы анионов.
Наряду с контуром электронной плотности (0,001 ат. ед.), который близок к контуру поверхности, заданной ван-дер- ваальсовым радиусом кислорода (1 ,36 Å) [35], были построены анало гичные изображения для элек тростатического потенциала на контуре (0,0 1 ат. ед.), который по своей величине близок к ионному радиусу кислорода (1,26 Å) [36]. На рис. 3 изображены области максимумов электростатического потенц иала, которые обозначены более тёмным цветом, средние значения – светло- серым, области минимумов электростатического по тенциала – белым на контуре, соответствующему значению электронной плотности 0,01 ат. ед.

а)
б)
в)
г)
Рис. 3. Локальные значения электростатического потенциала, нанесенные на поверхность, ограниченную контуром электронной плотности 0,01 ат. ед.: а) PO 4 3– , б) CrO 4 2– , в) НPO 4 2– , г) HCrO 4 –
М аксимумы электростатич еского потенциала сосредоточены в област и центрального атома (фосфора или хрома), однако в случае фосфат -аниона, средние значения рассматриваемой величины сосредоточены в максимально у даленных от центра областях на поверхности атомов кислорода. Та ким образом, рассмотрение кон тура электронной плотности, более близкого к ядру не приводит к выделению дополнительных раз личий электронной структуре фосфат и хромат-анионов.
На картах распределения лапласиана электронной плотности между атомами фосфор-кислород характерны меньшие значения лапласиана электронной плотности, это означает, что электронная плотность концентрируется вокруг критической точки связи (3, –1) и взаимодействие атомов имеют сравнительно высокую составляющую ковалентного типа. В случае атомов хрома и кислорода межатомные взаимодействия носят характер, определяемый как в большей степени ионный [25] (рис. 4), так как лапласиан электронной плотности локализуется в области близкой к ядрам атомов. Таким образом, при сравнении свойств фосфат- и хромат-анионов пока- зано, что в соответствии с картами лапласиана электронной плотности, большей ковалентной составляющей обладает связь Р–О, по сравнению с Cr–O.
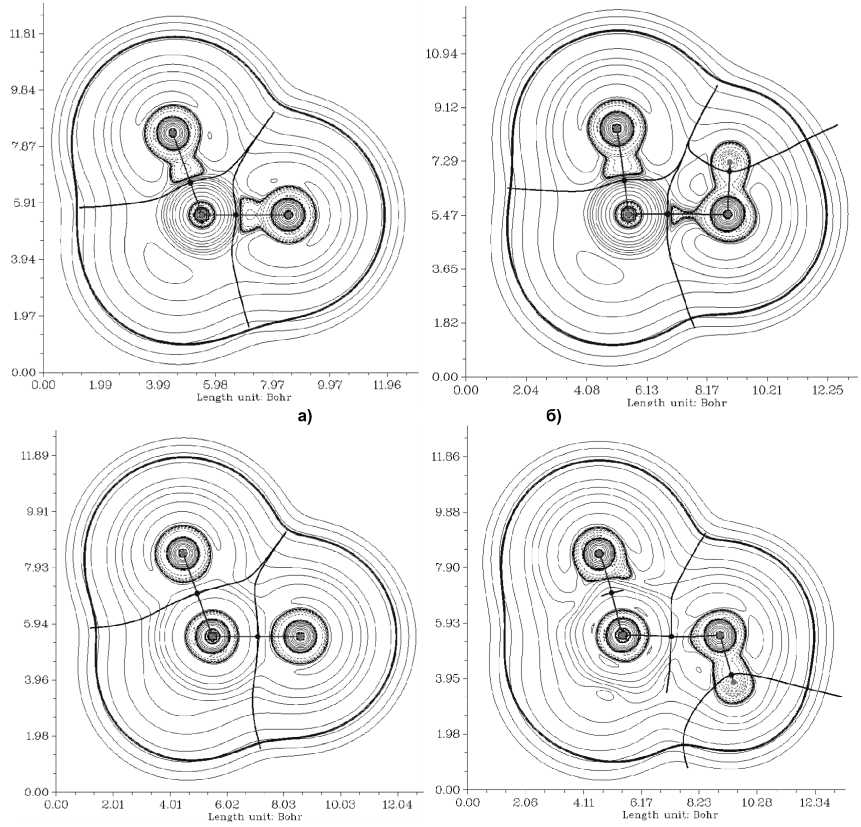
в)
г)
Рис. 4. Карты распределения лапласиана электронной плотности: а) для фосфат-, б) гидрофосфат-, в) хромат-, г) гидрохромат-анионы (сплошными и пунктирными линиями обозначены области положительных и отрицательных значений лапласиана электронной плотности)
Значение электронной плотности в критически х точках связей X–O для протонированных форм выше, чем для непротонир ованных, за исключением связи «центральн ый атом – протони рованный кислород». Также вед ут себя и величины лапласиана электронной плотности в крит ических точках связей (табл. 2).
Таблица 2
Квантово-топологические характеристики в критических точках связей анионов
|
ρ b 1 |
∇ 2ρ b |
ρ b 1 |
∇ 2ρ b |
||
|
Хромат-анион |
Фосфат-анион |
||||
|
Cr – O2 |
0,229 |
0,891 |
P1 – O5 |
0,179 |
0,881 |
|
Гидрохромат- анион |
Гидрофосфат-анион |
||||
|
O2 – H5 |
0,362 |
–1,938 |
O2 – H5 |
0,360 |
–1,933 |
|
Cr1 – O2 |
0,141 |
0,640 |
P1 – O2 |
0,124 |
0,230 |
|
Cr1 – O3 |
0,265 |
0,970 |
P1 – O3 |
0,202 |
1,222 |
|
Cr1 – O4 |
0,262 |
0,965 |
P1 – O4 |
0,197 |
1,125 |
|
Cr1 – O6 |
0,262 |
0,965 |
P1 – O6 |
0,202 |
1,222 |
Использование теории QTAIM позволяет выделить границы атомов на основе вектора нулевого потока градиента электронной плотности в сложных частицах [12]. Такие границы формируют атомные бассейны электронной плотности, называемые ρ-бассейнами [26]. С другой стороны, для функции электростатического потенциала можно провести сепаратрисы (обозначены жирной линией на рис. 5), которые будут формировать границы φ-бассейнов электронейтраль-ных атомов [29].
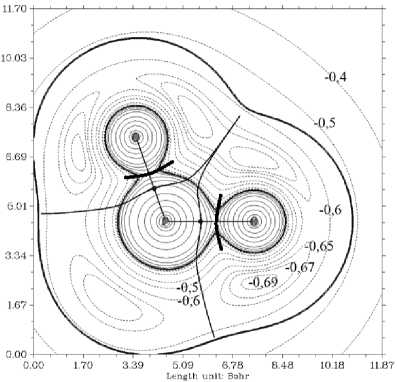
а)
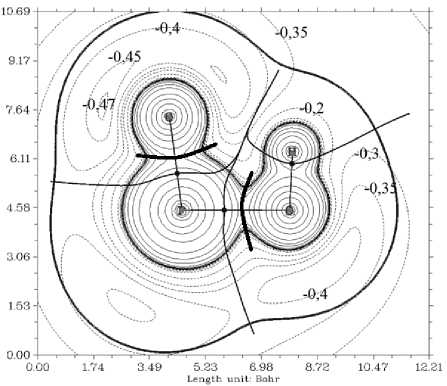
б)
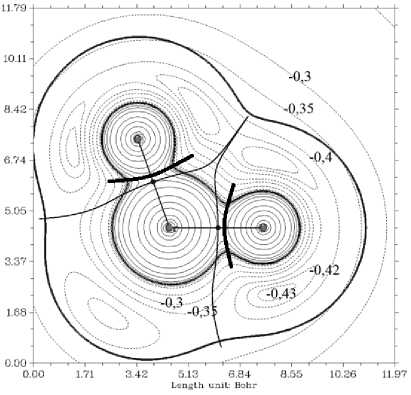
в)
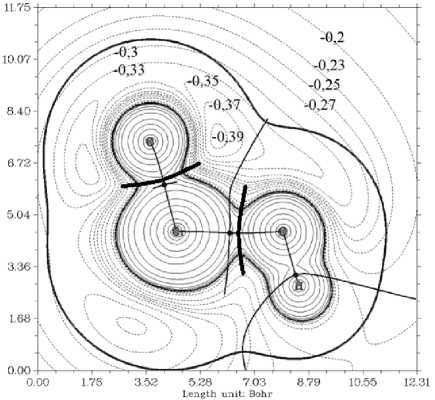
г)
Рис. 5. Контурные карты электростатического потенциала объектов: а) фосфат-, б) гидрофосфат-, в) хромат-, г) гидрохромат-анионы
На рис. 5 представлена суперпозиция атомных бассейнов в хромат- и фосфат-анионах, для чего вычислены градиентные поля [15], на основе чего проведены линии, определяемые как границы атомных бассейнов. Отметим, что φ-бассейн определяет границу электронейтрального атома в ионе для которого вся зарядовая плотность внутри такого бассейна полностью компенсирует заряд ядра данного атома. Интегрирование электронной плотности по объему такого бассейна дает нулевое значение заряда атома.
При сравнении ρ- и φ-атомных бассейнов в хромат- и фосфат-анионах отметим, что для фосфора требуется меньшее количество электронной плотности кислорода для компенсации его заряда. Такая ситуация хорошо согласуется с тем, что концевые атомы кислорода в фосфат-анионе характеризуются более высокой реакционной способностью за счет сил электростатического взаимодействия.
Электроны, принадлежащие атомному бассейну концевого кислорода, в фосфат-анионе в большей степени притягиваются к ядру атома фосфора, чем таковые в хромат-анионе. Кроме того, фосфат имеет более короткое расстояние от ядра центрального иона до контура с плотностью 0,001 ат. ед. Связь Р–О самая короткая (1,60 Å), внешний контур электронной плотности находится на расстоянии 3,31 Å (вдоль линии связи), 2,48 Å (между связями), и контур электронной плотности 0,001 ат. ед. оказывается ближе всего к центральному атому именно в фосфат-анионе. Это хорошо соотносится с тем, что область повышенных значений электростатического потенциала – σ-дырка для фосфат-аниона выражена сильнее. В целом, данные наблюдения за распределением электронной плотности и электростатического потенциала иллюстрируют тот факт, что ядра кислорода в фосфат-анионе оказываются в меньшей степени экранированными вдоль линии их ковалентных связей, а значит, должны проявлять большую способность к невалентным взаимодействиям электростатического характера. Это можно выделить как отдельный фактор, который может оказаться важным при сравнительной оценке сорбционной активности разных анионов сходного строения.
Результаты и выводы
В терминах электростатического потенциала и свойств электронной плотности дано сравнительное описание способности к нековалентным взаимодействиям фосфат и хромат-анионов, а также их протонированных форм.
Электронная плотность, принадлежащая атомным бассейнам кислорода в фосфат-анионе в большей степени притягивается к ядру атома фосфора, чем в хромат-анионе, что наблюдается при анализе суперпозиции атомных бассейнов электронной плотности и электростатического потенциала.
Отсутствие областей истощения электростатического потенциала – σ-дырок на концевых атомах кислорода в гидрофосфат-, дигидрофосфат- и гидрохромат-анионов, позволяет предположить наличие различных видов связывания с потенциальным сорбционным центром для протонированной и непротонированной формы анионов. Показано, что на основе наблюдений за свойствами и распределением электронной плотности и электростатического потенциала можно объяснить экспериментально наблюдаемому факту о том, что большей сорбционной активностью обладает гидрофосфат-анион, для которого характерны наименьшее значение минимума и наибольшее значение максимума электростатического потенциала по сравнению с другими исследованными анионами.
Таким образом, рассмотрение свойств распределения электронной плотности и электростатического потенциала в рассматриваемых близких по форме анионах позволяет объяснить причины различной их способности к нековалентным взаимодействиям электростатического характера. Такая характеризация может оказаться значимой при сравнительной оценке сорбционного сродства и описании механизмов сорбционных процессов.
Список литературы Свойства электростатического потенциала и электронной плотности в сравнении сорбционной активности хромат- и фосфат-анионов
- Особенности необратимой сорбции катионов тяжелых металлов гранулированным сорбентом на основе силикатов и алюмосиликатов кальция/Г.Г. Михайлов, А.Г. Морозова, Т.М. Лонзингер и др.//Вестник ЮУрГУ. -№ 12(229). -2011. -C. 46-53.
- Печенюк, С.И. Сорбция анионов на оксигидроксидах металлов (обзор)/С.И. Печенюк//Сорбционные и хроматографические процессы. -2008. -Т. 8. -Вып. 3. -С. 380-429.
- Шманина, Е.А. Локальные свойства электростатического потенциала в исследовании закономерностей сорбции на поверхности оксигидроксидов/Е.А. Шманина, Е.В. Барташевич, С.И. Печенюк//Сборник тезисов VII Всерос. конф. молодых учёных по химии и наноматериалам «Менделеев-2013». -С. 258-260.
- Печенюк, С.И. Использование значения pH точки нулевого заряда для характеристики свойств оксогидроксидов/С.И. Печенюк//Известия РАН. Серия химическая. -1999. -С. 1029.
- Семушин, В.В. О свойствах поверхности титаногелей/В.В. Семушин, С.И. Печенюк//Сорбционные и хроматографические процессы. -2009. -Т. 9. -№ 3. -С. 448-456.
- Сорбция оксалат-и карбонат-ионов на цирконогелях/С.И. Печенюк, Л.Ф. Кузьмич, Ю.П. Семушина, Г.И. Кадырова//Сорбционные и хроматографические процессы. -2011. -Т. 11.-С. 372-381.
- Печенюк, С.И. Конкурентная сорбция хромат-, оксалат-и карбонат-ионов на цирконогелях/С.И. Печенюк, Л.Ф. Кузьмич, Ю.П. Семушина//Сорбционные и хроматографические процессы. -2012. -Т. 12. -С.189-195.
- Печенюк, С.И. Влияние природы соли-прекурсора оксигидроксидного сорбента на сорбцию оксалат-ионов/С.И. Печенюк, Л.Ф. Кузьмич, Ю.П. Семушина//Журнал физической химии. -2012. -Т. 86. -№ 9. -С. 1584-1587.
- Печенюк, С.И. Адсорбционное сродство анионов к оксигидроксидам металлов/С.И. Печенюк, Л.Ф. Кузьмич, Ю.П. Семушина//Журнал физической химии. -2013. -Т. 87. -№ 3. -С. 505.
- Koch, W. A chemist’s guide to density functional theory/W. Koch, M.C. Holthausen. -Weinheim. Wiley-VCH VerlagGmbH, 2001. -293 p.
- Granovsky, A. -http://classic.chem.msu.su/gran/firefly/index.html
- Бейдер, Р. Атомы в молекулах. Квантовая теория/Р. Бейдер. -М.: Мир, 2001. -532 с.
- Keith, T.A. AIMALL, Version 12.06.03, 2012, Professional. -http://aim.tkgristmill.com.
- Properties of atoms in molecules: atomic volumes/R.F.W. Bader, M.T. Carroll, J.R. Cheeseman, C. Chang//J. Am. Chem. Soc. -1987. -V. 109. -P. 7968.
- Lu, T. Multiwfn: a multifunctional wavefunction analyzer/T. Lu, F. Chen//Journal of Computational Chemistry. -2012. -V. 33. -P. 580-592.
- Hubschle, C.B. MoleCoolQt -a molecule viewer for charge-density research/C.B. Hubschle, B. Dittrich//J. Appl. Cryst. -2011. -V. 44. -P. 238-240.
- Edward, G.M. Calculated surface electrostatic potentials of molecular sieve models containing SiO4, AlO4 and PO4 units/G.M. Edward, J.S. Murray, P. Politzer//J. Mol. Graphics. -1994. -V. 12. -P.169-171.
- Computational study of CO and NO adsorption on magnesium oxide nanotubes/J. Beheshtian, M. Kamfiroozi, Z. Bagheri, A. Ahmadi/Physica E. -V. 44. -2011. -P. 546-549.
- Nature of the NIMOS catalyst edge sites: an atom in molecules theory and electrostatic potential studies/Y. Aray, J. Rodriguez, A.B. Vidal, S. Coll//Journal of Molecular Catalysis A: Chemical. -V. 271. -2007. -P. 105-116.
- Politzer, P. The fundamental nature and role of the electrostatic potential in atoms and molecules/P. Politzer, J.S. Murray//Theor Chem Acc. -2002. -V. 108. -P. 134-142.
- Цирельсон, В.Г. Квантовая химия. Молекулы, молекулярные системы и твердые тела: учебное пособие для вузов/В.Г. Цирельсон. -М.: Бином, 2010. -496 с.
- Murray, J.S. Expansion of the а-hole concept/J.S. Murray, P. Lane, P. Politzer//J. Mol. Mod. -2009. -V. 15.-P. 723.
- Politzer, P. An overview of halogen bonding/P. Politzer, P. Lane, M.C. Concha et al.//J. Mol. Model. -2007. -V. 13. -P. 305.
- Politzer, P. Molecular surface electrostatic potentials in relation to noncovalent interactions in biological systems/P. Politzer, J.S. Murray, Z. Peralta-Inga//International Journal of Quantum Chemistry. -V. 85. -2001. -P. 676-684.
- Shields, Z.P. Directional tendencies of halogen and hydrogen bonds/Z.P. Shields, J.S. Murray, P. Politzer//Int. J. Quantum Chem. -2010. -V. 110. -P. 2823.
- Density functional tight-binding studies of carbon nanotube structures/Z. Peralta-Inga, P. Lane, J. S. Murray et al.//Journal of Structural Chemistry. -2003. -14(5). -P. 431-443.
- Petrova, G.P. Enhanced reactivity of carbonyl compounds on MgO surface: A computational study/G.P. Petrova, G.N. Vayssilov, B. Galabov/Journal of Molecular Catalysis A: Chemical. -V. 342. -2011 -P. 67-73.
- Politzer, P. The electrostatic potential: an overview/P. Politzer, J.S. Murray//Theoretical Chemistry Accounts. -2002. -V. 108. -P. 134.
- Clark, T. σ-Holes/T. Clark//WIREs Computational Molecular Science. -2013. -Vol. 3. -P. 13-20 ( ) DOI: 10.1002/wcms.1113
- Politzer, P. Halogen bonding: an electrostatically-driven highly directional noncovalent interaction/P. Politzer, J.S. Murray, T. Clark//Physical Chemistry Chemical Physics. -2010. -V. 12. -P.7748-7757.
- Piland, G. Halogen bonding of substituted iodobenzenes with potential solvent molecules: A comparison of binding energies/G. Piland, P. Jasien//Computational and Theoretical Chemistry. -Vol. 988. -P. 19-26. - DOI: 10.1016/j.comptc.2012.02.021
- Clark, T. σ-Hole bonding: molecules containing group VI atoms/T. Clark, P. Politzer//Journal Molecular Modeling. -2007. -13. -P. 1033-1038.
- σ-Holes, π-holes and electrostatically-driven interactions/J.S. Murray, P. Lane, T. Clark et al.//Journal Molecular Modeling. -2012. -V. 18. -P. 541-548.
- Китайгородский, А.И. Молекулярные кристаллы/А.И. Китайгородский. -М.: Наука. -1971. -424 с.
- Чупахин, А.П. Общая химия. Химическая связь и строение вещества: учебное пособие/А.П. Чупахин. -Новосибирск: Новосибирский государственный университет, 2003. -168 с.


