Свойства комплексонатов металлов, полученных при утилизации гальванических шламов комплексонами
Автор: Ярынкина Елена Анатольевна, Бузаева Мария Владимировна, Давыдова Ольга Александровна, Ваганова Екатерина Сергеевна, Макарова Ирина Алексеевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.12, 2020 года.
Бесплатный доступ
Утилизация гальванических шламов представляет собой приоритетную задачу в плане охраны окружающей среды от загрязнений тяжелыми металлами. Исследованы процессы избирательного действия комплексонов пирокатехина и динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА-Na) по отношению к ионам металлов, содержащихся в гальваническом шламе. На степень извлечения ионов тяжелых металлов из гальванических шламов оказывает влияние строение комплексона: пирокатехин и ЭДТА-Na проявляют селективность по отношению к меди, никелю, хрому, цинку. Степень извлечения ионов металлов повышается при подкислении среды серной кислотой. Подкисление способствует также максимальному отделению осадка от раствора комплексоната. Структура комплексонатов различна: хелатные комплексы с координированным ионом металла в циклах, протонированные комплексы. Структура комплексонатов меди, образованных пирокатехином и ЭДТА-Na, подтверждена методом ЭПР. При обработке суспензии гальванического шлама пирокатехином в спектрах ЭПР фиксируются парамагнитные комплексы меди (ΙΙ) с параметрами: аCu = 7,8 мТл; g = 2,045. Практически одновременно в спектрах ЭПР пирокатехинолятного комплекса зафиксирован еще один сигнал, принадлежащий комплексу меди с меньшей константой расщепления на ядрах меди (аCu = 7,1 мТл) и со значительным сдвигом g-фактора в область низкого поля, g = 2,078. В процессах извлечения ионов металлов их гальваношлама комплексоном ЭДТА-Na зафиксирована суперпозиция сигналов ЭПР. Спектр ЭПР состоит из 5 уширенных компонент СТС: аCu(1) ≈ 6,6; аCu(2) ≈ 5,4 мТл. Значение g1 = 2,078, g2 = 2,043. Предложены структуры комплексонатов металлов с ионом меди. Комплексонаты металлов содержат медь, никель, хром, цинк. В качестве примеси обнаруживаются кальций, железо, следы свинца. Примеси не оказывают влияния на применение комплексонатов в сельском хозяйстве. Оптимизированы параметры процессов утилизации гальванических шламов с применением комплексонов пирокатехина и ЭДТА-Na. Разработана технологическая схема утилизации. Созданы экспериментальные образцы комплексонатов металлов для использования в сельском хозяйстве. При использовании пирокатехина концентрация ионов металлов в полученном растворе составила: медь - 8,0; никель - 5,0; хром - 3,2; цинк - 2,0 мг/л. В случае ЭДТА-Na: медь - 7,8; никель - 4,8; хром - 3,4; цинк - 2,2 мг/л.
Гальванический шлам, тяжелые металлы, комплексоны, комплексонаты, утилизация
Короткий адрес: https://sciup.org/147234232
IDR: 147234232 | УДК: 544+ | DOI: 10.14529/chem200210
Текст научной статьи Свойства комплексонатов металлов, полученных при утилизации гальванических шламов комплексонами
Химические технологии машиностроительных производств во многом основаны на гальванических и аналогичных процессах с использованием широкого круга соединений тяжелых металлов [1–6]. Опасные для окружающей среды производственные отходы требуют обезвреживания и утилизации [7–9].
Среди множества различных технологий переработки особое место занимает выщелачивание ионов металлов из различных шламов с использованием комплексонов. Разработаны теоретические основы и практические аспекты применения комплексонов в различных областях науки и техники [10–14]. Применение комплексонов многогранно: очистка загрязненных растворов от ионов тяжелых металлов, водоподготовка и водоснабжение, медицина и сельское хозяйство [15– 18]. Микро- и макроудобрения на основе комплексонов (ЭДТА, пирокатехин и другие) способны повышать урожайность сельскохозяйственных культур и улучшать качество продукции на основных типах почв страны более интенсивно, чем традиционные формы микроудобрений. Как показывают исследования, наиболее эффективно применение комплексонатов металлов в пол- ной расчетной дозе (цинк – до 9 кг/га, медь – до 0,9 кг/га), что позволяет увеличить урожайность овощных культур на 9,5–24,4 % относительно фона и улучшить качество продукции по всем биохимическим показателям [15].
Комплексонаты металлов в природных средах быстро дезактивируются и не смещают установившегося равновесия. Использование комплексонатов в макро- и микроудобрениях способствует переводу малодоступных растениям микроэлементов в более подвижные и биологически активные формы. Синтез новых комплексонов и изучение их свойств ведется постоянно, поскольку можно варьировать как лигандами, так и соединениями металлов, что приводит к разнообразным свойствам образующихся комплексонатов металлов [19–23]. Значительный интерес представляют комплексонаты тяжелых металлов, содержащие медь, никель, цинк, хром и другие [24, 25].
Целью настоящей работы явилось изучение свойств комплексонатов металлов, полученных при выщелачивании ионов тяжелых металлов из гальванических шламов комплексонами.
Экспериментальная часть
Объекты исследований – производственные гальванические шламы со станции нейтрализации гальванических сточных вод предприятий г. Ульяновска.
Валовое содержание металлов в гальванических шламах и концентрации металлов в растворах определяли атомно-абсорбционным методом (спектрометр «КВАНТ Z»). Содержание тяжелых металлов в сухом гальваническом шламе составило: медь – 5,62; никель – 4,83; цинк – 3,64; хром – 7,65 г/кг. Спектры электронного парамагнитного резонанса (ЭПР) регистрировали на радиоспектрометре фирмы «Bruker BioSpin GmbH».
Извлечение металлов комплексонами проводили в статистических условиях. В суспензию гальваношлама (влажность – 95 %, плотность – 1,05 г/см3) вводили различные количества комплексона по отношению к объему шлама, перемешивали до достижения максимальной степени извлечения, отфильтровывали, в фильтрате определяли содержание ионов металлов для оценки содержания компонентов. Из полученного фильтрата получали комплексонаты металлов, высушивая их при 105 °С. Оптимальное соотношение объема шлама и раствора комплексона составило Т:Ж = 1:5. Степень извлечения ионов металлов (α, %) комплексонами определяли по разнице валового содержания металлов в исходном гальваническом шламе (С исх ) и после обработки шлама комплексоном (С):
α = (С исх – С) · 100 % / С исх .
В качестве комлексонов использовали: пирокатехин (1,2-дигидроксибензол), ТУ 6-09-4025-83; динатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА-Na). Пирокатехин представляет собой бесцветное кристаллическое вещество с температурой плавления 105 °С. На свету окисляется кислородом воздуха с темным окрашиванием. ЭДТА-Na (трилон Б) представляет собой белое вещество. Комплексоны хорошо растворимы в воде.
Результаты и обсуждение
Комплексоны представляют собой соединения, содержащие атомы кислорода, азота, серы, фосфора, карбонильные, карбоксильные, гидроксильные группы, способные к фиксации ионов металлов с образованием ковалентных и координационных связей. Круг комплексонов очень широк, что связано с множеством сочетаний различных групп в органических молекулах. Распространенными комплексонами являются, в частности, пирокатехин, этилендиаминтетрауксус-ная кислота и их производные. Эти комплексоны были использованы в данной работе.
Фиксация ионов металлов комплексонами определяется во многом их строением. Пирокатехин является бидентатным лигандом и образует с металлом хелатные циклы за счет ковалентных и координационных связей. ЭДТА-Na является полидентатным лигандом с кислотными и основными центрами, что приводит к образованию различных структур комплексонатов металлов.
В литературе практически отсутствую сведения о парамагнитных комплексонатах металлов. Это связано с тем, что фиксируемый ион металла должен иметь на внутренней d- или f-оболочке неспаренный электрон. Содержание магнитных изотопов никеля, железа очень мало для фиксации методом ЭПР. В случае хрома с большим содержанием изотопа 53Cr (9,55 %; I = 3/2) наблюдение парамагнетизма затрудняется сильным уширением линии спектра, что характерно и для
Физическая химия
других переходных металлов. В отличие от других переходных металлов, ион меди (ΙΙ) достаточно надежно наблюдается методом ЭПР.
При обработке суспензии гальванического шлама пирокатехином в спектрах ЭПР фиксируются парамагнитные комплексы меди (ΙΙ) с параметрами: а Cu = 7,8 мТл; g = 2,045 (рис. 1).
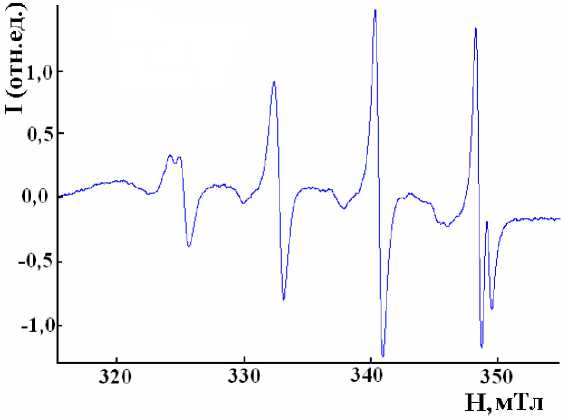
Рис. 1. Спектр ЭПР комплекса пирокатехина с медью. Растворитель – ТГФ, 20 °С
В процессах извлечения ионов металлов из гальванических шламов с вышеприведенными комплексонами нами зафиксированы парамагнитные комплексы меди (ΙΙ), что является прямым доказательством образования комплексонатов меди. Реакции проводили в среде ТГФ.
Практически одновременно в спектрах ЭПР пирокатехинолятного комплекса наблюдается появление другого сигнала, принадлежащего комплексу меди с меньшей константой расщепления на ядрах меди (а Cu = 7,1 мТл) и со значительным сдвигом g-фактора в область низкого поля, g = 2,078. Суперпозиция сигналов ЭПР представлена на рис. 2.
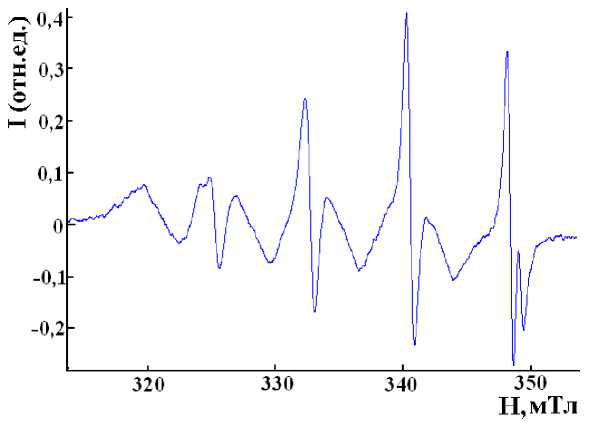
Рис. 2. Суперпозиция спектров ЭПР комплексов пирокатехина с медью. Растворитель – ТГФ, 20 °С
Фиксация разных сигналов ЭПР связана, на наш взгляд, с образованием различных форм комплексов. Можно предположить что первоначальный спектр ЭПР принадлежит бис- пирокатехинолятному комплексу меди (ΙΙ) с заряженной координационной сферой – (Cat2Cu)2– (схема 1). Пирокатехин является слабой кислотой, поэтому второй сигнал может относиться к протонированной форме комплекса меди (ΙΙ) – (Cat2CuН2)2– (схема 2). В этой форме проявляется достаточно сильное влияние внутримолекулярных водородных связей на координацию атома меди, приводящее к уширению линий в спектрах ЭПР, что и наблюдается в экспериментально полученном сигнале. В этом случае неспаренный электрон становится частично делокализованным и константа расщепления на меди уменьшается.
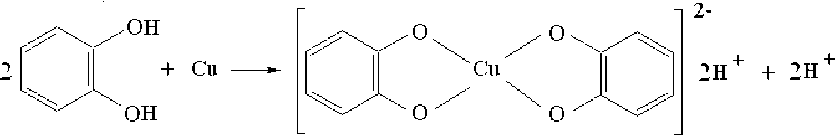
CatH 2 ) (Cat 2 Cu)2–
Схема 1
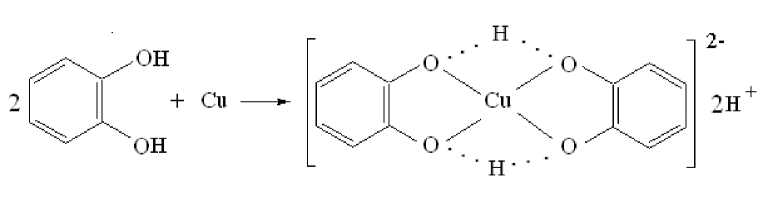
(CatH 2 )
(Cat 2 CuН 2 )2–
Схема 2
Отличительными особенностями ЭДТА-Na являются полидентатность и способность к комплексообразованию с металлами как в кислой, так и в щелочной среде. Разнообразие образующихся комплексонатов металлов определяется наличием в их молекулах групп различной природы – донорных и акцепторных, что приводит к биполярному (цвиттер-ионному) строению комплексонов.
Для комплексов ЭДТА-Na с металлами характерно образование различных протонированных комплексов. В молекуле комплексона в зависимости от характера функциональных групп наблюдается образование различных 4, 5, 6-членных Н-циклов. Водородные связи придают лиганду конфигурацию, схожую с той, которая возникает при координации этого лиганда катионом металла. При этом Н-циклы можно рассматривать как металлоциклы с определенными конформационными изменениями структуры лиганда.
В процессах извлечения ионов металлов их гальваношлама комплексоном ЭДТА-Na нами зафиксирован сигнал ЭПР из 5 уширенных компонент СТС. При условии различных значений g-факторов (g1 = 2,078; g2 = 2,043) пятикомпонентный спектр может быть обусловлен суперпозицией двух четырехкомпонентных с наложением компонент в центральной части сигнала. Отнесение структуры к тому или иному типу комплексов затруднительно. Возможно, что одна из форм имеет строение нормального комплекса, другая форма – протонированного. Можно предположить также, что наблюдается суперпозиция двух протонированных форм. В сравнении с пирокатехинолятными комплексами (Cat 2 Cu)2– константа расщепления на меди уменьшается, что свидетельствует о сильном взаимодействии иона меди с окружением. Из-за наложения широких линий можно оценить лишь приближенное значение расщепления на ядрах меди: а Cu (1) ≈ 6,6; а Cu (2) ≈ 5,4 мТл.
Фиксация методом ЭПР парамагнитных комплексонатов меди подтверждает известные положения о сложности процессов комплексообразования в системе «комплексон – ион металла», а также возможность образования в одной и той же системе различных типов комплексов. Таким
Физическая химия
образом, структура комплексонатов различна: хелатные комплексы с координированным ионом металла в циклах, протонированные комплексы.
На образование комплексонатов металлов оказывает влияние избирательность комплексонов по отношению к тяжелым металлам. Комплексоны пирокатехин и ЭДТА-Na в большей степени извлекают медь и никель, чем цинк и хром. Большое влияние на процессы комплексообразования оказывает кислотность среды. Выщелачивание при подкислении серной кислотой повышает степень извлечения меди и никеля до 90 %, цинка и хрома – 60 % и более. При подкислении образуются сульфаты металлов, часть из которых нерастворима в воде. К ним относятся сульфат свинца, малорастворимый сульфат кальция. Образование этих соединений способствует более полному отделению осадка от раствора комплексонатов. Растворы комплексонатов содержат медь, никель, хром и цинк, необходимые для использования в сельском хозяйстве. В качестве примесей в растворах обнаруживаются кальций в количестве 0,8 мг/л, железо – 1,0 мг/л, следовые количества свинца. Примеси не оказывают влияния на применение комплексонатов в сельском хозяйстве.
Были изучены свойства растворов комплексонатов металлов для их практического применения. Регенерация металлов из комплексонатов может быть проведена различными методами. Термическое разложение комплексонатов металлов происходит при температурах выше 200 °С. Комплексы ЭДТА-Na и меди подвергаются термолизу (в вакууме или в присутствии кислорода) при температуре 240 °С. Соединения металлов и пирокатехина разлагаются при 290–305 °С. При термическом разложении образуются комплексоны и металлы, либо их оксиды.
На основе экспериментального определения оптимальных значений факторов, оказывающих влияние на степень извлечения металлов из осадков сточных вод гальванических производств комплексонами, были определены условия получения целевого продукта – смеси комплексона-тов металлов для использования в качестве микроудобрения и утилизации соединений металлов. Выщелачивание в присутствии комплексонов проводили при подкислении 10–15 % серной кислотой, температуре 30–40 °С в течение 1 ч. Оптимальная концентрация пирокатехина составила 1,0 г/л; ЭДТА-Na – 0,5 г/л. Степень извлечения меди и никеля комплексонами составила более 90 %, цинка и хрома более 60 %.
Утилизацию комплексонов и соединений металлов проводили путем обработки щелочью с отделением гидроксидов металлов при различных рН среды. Интервалы рН осаждения следующие: Cu(OH) 2 – 5,5–10,0; Ni(OH) 2 – 7,7–10,0; Сг(ОН)з – 4,9–6,8; Zn(OH) 2 – 6,4–8,8. Гидроксиды металлов могут использоваться в качестве химических реактивов.
Нами разработана технологическая схема утилизации гальванических шламов с применением комплексонов (рис. 3). Схема включает стадии приготовления реакционной смеси, выщелачивание ионов металлов из смеси комплексонами, использование растворов комплексонов.
На основе предлагаемой технологии получены образцы комплексонатов металлов для использования в сельском хозяйстве. При использовании пирокатехина (концентрация 1,0 г/л) концентрация ионов металлов в полученном растворе составила: медь – 8,0; никель – 5,0; хром – 3,2; цинк – 2,0 мг/л. При использовании ЭДТА-Na (0,5 г/л): медь – 7,8; никель – 4,8; хром – 3,4; цинк – 2,2 мг/л. Перед внесением полученного жидкого удобрения его необходимо концентрировать или перевести в кристаллическую форму.
Выводы
-
1. На степень извлечения ионов тяжелых металлов из гальванических шламов оказывает влияние строение комплексона: пирокатехин и ЭДТА-Na проявляют селективность по отношению к меди, никелю, хрому, цинку. Степень извлечения ионов металлов повышается при подкислении среды серной кислотой. Подкисление спрособствует также максимальному отделению осадка от раствора комплексонатов.
-
2. Структура комплексонатов различна: хелатные комплексы с координированным ионом металла в циклах, протонированные комплексы. Методом ЭПР зафиксированы комплексонаты меди, образованные пирокатехином и ЭДТА-Na. Предложены структуры комплексонатов.
-
3. Комплексонаты металлов содержат медь, никель, хром, цинк. В качестве примеси обнаруживаются кальций, железо, следы свинца. Примеси не оказывают влияния на применение ком-плексонатов в сельском хозяйстве.
-
4. Оптимизированы параметры процессов утилизации гальванических шламов с применением комплексонов пирокатехина и ЭДТА-Na. Разработана технологическая схема утилизации. Созданы экспериментальные образцы комплексонатов металлов для использования в сельском хозяйстве. При использовании пирокатехина концентрация ионов металлов в полученном растворе составила: медь – 8,0; никель – 5,0; хром – 3,2; цинк – 2,0 мг/л. В случае ЭДТА-Na: медь – 7,8; никель – 4,8; хром – 3,4; цинк – 2,2 мг/л.
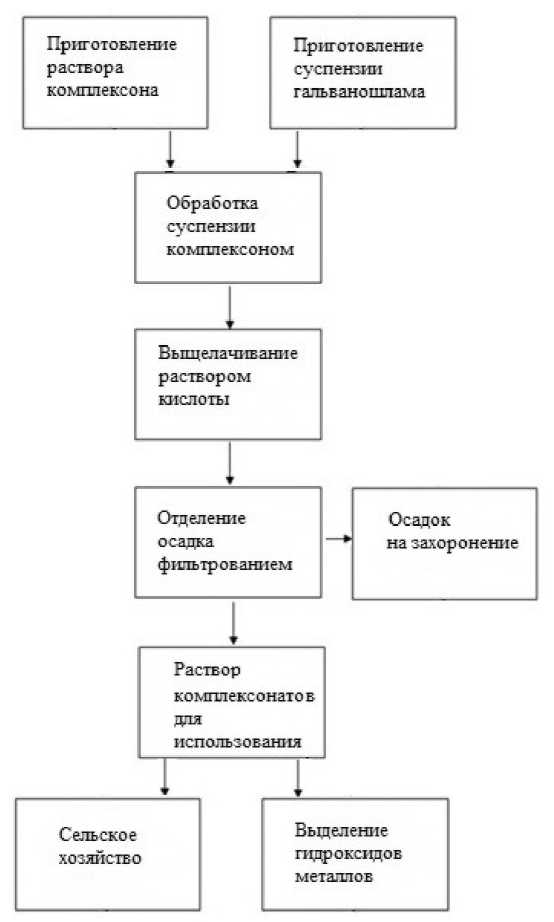
Рис. 3. Технологическая схема утилизации гальванических шламов с применением комплексонов
Работа выполнена при финансовой поддержке Фонда содействия развития малых форм предприятий в научно-технической сфере в рамках программы УМНИК (договор № 12933 ГУ/2018).
Физическая химия
Список литературы Свойства комплексонатов металлов, полученных при утилизации гальванических шламов комплексонами
- Елинек, Т.В. Успехи гальванотехники. Обзор мировой литературы за 2015-2016 гг. / Т.В. Елинек // Гальванотехника и обработка поверхности. - 2017. - Т. 25, № 2. - С. 20-28.
- Петрова, Т.П. Химические покрытия / Т.П. Петрова // Соросовский образовательный журнал. - 2000. - Т. 6, № 11. - С. 57-62.
- Ильин, В.А. Нанотехнологии нанесения кластерных гальванических покрытий / В.А. Ильин // Авиационные материалы и технологии. - 2009. - № 2 (11). - С. 3-7.
- Галлямов, А.Р. Малогабаритное устройство для вневаннового нанесения хром-алмазных покрытий на режущие кромки металлообрабатывающего инструмента / А.Р. Галлямов, И.Д. Иба-туллин, С.Г. Емельянов // Известия Самарского научного центра РАН. - 2014. - Т. 16, № 1(2). -С. 378-381.
- Терешкин, В.А. Гальваническое меднение при производстве печатных плат / В.А. Тереш-кин, Ж.Н. Фантгоф, Л.Н. Григорьева // Технологии в электронной промышленности. - 2005. -№ 1. - С. 16-18.
- Кинетика электроосаждения никеля из растворов различного анионного состава / Ви Тхи Зуен, О.В. Долгих, Н.В. Соцкая, Е.А. Котлярова // Конденсированные среды и межфазные границы. - 2009. - Т. 11. - № 1. - С. 37-46.
- Утилизация гальваношламов сложного состава / Т.А. Трифонова, Н.В. Селиванова, О.Г. Селиванов и др. // Известия Самарского научного центра РАН. - 2012. - Т. 14, № 5(3). -С. 850-852.
- Рубанов, Ю.К. Утилизация отходов гальванического производства / Ю.К. Рубанов, Ю.Е. Токач // Экология и промышленность России. - 2010. - № 11. - С. 44-45.
- Токач, Ю.Е. Технология переработки отходов гальванического производства / Ю.Е. Токач, Ю.К. Рубанов // Известия вузов. Химия и химическая технология. - 2011. - Т. 54, № 2. - С. 125128.
- Дятлова, Н.М. Комплексоны и комплексонаты металлов / Н.М. Дятлова, В.Я. Темкина, К.И. Попов. - М.: Химия, 1988. - 544 с.
- Дятлова, H.M. Теоретические основы действия комплексонов и их применение в народном хозяйстве и медицине / Н.М. Дятлова // Журнал ВХО им. Д.И. Менделеева. - 1984. - Т. 29, вып. 3. - С. 247-260.
- Васильев, В.П. Комплексоны и комплексонаты / В.П. Васильев // Соросовский образовательный журнал. - 1996. - № 4. - С. 39-44.
- Климов, Е.С. / Природные сорбенты и комплексоны в очистке сточных вод / Е.С. Климов, М.В. Бузаева. - Ульяновск: УлГТУ, 2011. - 201 с.
- Chiari, G. On Metal-Oxygen Coordination. A Statistical Method to Determine Coordination Number / G. Chiari // Acta Cryst. B. - 1990. - Vol. 46, № 6. - P. 717-723.
- Туркина, О С. Применение комплексонатов в овощеводстве / О.С. Туркина // Агрохимический вестник. - 2011. - №1. - С. 24-26.
- Завальцева, О.А. Влияние комплексонатов металлов, селективно извлеченных из гальва-ношламов, на развитие проростков злаковых культур / О.А. Завальцева, М.В. Бузаева, Е.С. Климов // Экология и промышленность России. - 2010. - № 10. - С. 18-20.
- Петриченко, В.Н. Применение регуляторов роста растений нового поколения на овощных культурах / В.Н. Петриченко, С.В. Логинов // Агрохимический вестник. - 2010. - № 2. - С. 24-26.
- Гайсин, И.А. Микроудобрения в современном земледелии // И.А. Гайсин, Р.Н. Сагитова, Р.Р. Хабибуллин // Агрохимический вестник. - 2010. - № 2. - С. 13-14.
- Pierpont, C.G. Unique properties of transition metal quinine complexes of the MQ3 series / C G. Pierpont // Coord. Chem. Rev. - 2001. - Vol. 219-221. - P. 415-433.
- О-хиноновые комплексы алюминия. Синтез и строение / А.В. Пискунов, А.В. Малеева, Г.К. Фукин, Е.В. Баранов // Координационная химия. - 2010. - Т. 36, № 3. - С. 163-171.
- Мартыненко, Л.И. Направленный синтез координационных соединений с заданными свойствами / Л.И. Мартыненко // Координационная химия. - 1996. - Т. 22, № 5. - С. 341-342.
- Полякова, И.Н. Синтез и кристаллическая структура трех смешаннолигандных комплексов меди (II) с нитрилотриуксусной кислотой / И.Н. Полякова, В.С. Сергиенко, А.Л. Позняк // Кристаллография. - 2006. - Т. 51, № 3. - С. 491-495.
- Кутолей, Д.А. Штеменко А.В. Взаимодейстквие комплексоната меди на основе ОЭДФ с некоторыми алифатическими аминами / Д.А. Кутолей, А.В. Штеменко // Вопросы химии и химической технологии. - 2008. - № 2. - С. 125-129.
- Окислительное растворение меди в присутствии о-хинонов с электроноакцепторными заместителями / М.В. Бузаева, В.В. Дубровина, О.А. Давыдова, Е.С. Климов // Журнал прикладной химии. - 2011. - Т. 84, Вып. 5. - С. 863-865. DOI: 10.1134/S1070427211050260.
- Утилизация осадков сточных вод гальванических производств с применением комплексонов / Е.А. Ярынкина, М.В. Бузаева, В.С. Гусарова, Е.С. Климов // Вестник ЮУрГУ. Серия «Химия». - 2019. - Т. 11, № 2. - С. 28-38.


