Таксономическая и функциональная характеристика ксеротолерантного культивируемого прокариотного сообщества серозема пустыни Негев
Автор: Белов А.А., Чепцов В.С.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Статьи
Статья в выпуске: 116, 2023 года.
Бесплатный доступ
Несмотря на значительное расширение географии исследований почвенных микроорганизмов в различных, в том числе, экстремальных природных средах, исследования биоразнообразия и метаболической активности почвенных микробных сообществ в условиях дефицита влаги являются немногочисленными. Нами изучено биоразнообразие культивируемых бактерий, выделенных из поверхностного горизонта серозема (Aridic Calcisol) пустыни Негев, после прединкубации почвенных образцов в условиях низкой доступности воды. Выявлено возрастание разнообразия культивируемых бактерий после прединкубации по сравнению с сообществом, выделенным из нативной почвы. Из нативных и прединкубированных образцов были выделены и идентифицированы 153 фенотипически уникальные чистые культуры бактерий 22 родов, относящихся к филумам Actinomycetota, Pseudomonadota, Bacillota и Bacteroidota. Таксономическое разнообразие культивируемых бактерий, выделенных из прединкубированных при активности воды (Aw) 0.90 образцов, было в 2 раза выше, чем при выделении из нативной почвы. Выявлен штамм рода Pedobacter, который может являться представителем не описанного ранее вида бактерий. Обнаружены бактерии родов Aerococcus,Bacillus, Brevibacterium, Staphylococcus и Stenotrophomonas, способные расти при Aw 0.91. Выявлен один штамм рода Microlunatus, способный к росту на безазотистой среде, проявляющий амилазную и протеазную активность и способный расти на среде с Aw вплоть до 0.96. Полученные результаты подтверждают гипотезу о том, что аридные экосистемы, в частности, пустынные почвы и породы, являются депозитарием ранее не изученного таксономического разнообразия бактерий с уникальными физиологическими свойствами, перспективными для изучения и потенциального внедрения в биотехнологические процессы.
Аридизация, актинобактерии, накопительная культура, активность воды, биоразнообразие
Короткий адрес: https://sciup.org/143180765
IDR: 143180765 | УДК: 502.53:631.46 | DOI: 10.19047/0136-1694-2023-116-129-154
Текст научной статьи Таксономическая и функциональная характеристика ксеротолерантного культивируемого прокариотного сообщества серозема пустыни Негев
Наличие и количество доступной воды является важным экологическим фактором, определяющим биоразнообразие и функциональную активность экосистем (Jackson et al., 2000). В макромасштабе обеспеченность доступной влагой, ее сезонная динамика и преобладающее движение (выпадение осадков или испарение) определяют как тип растительных сообществ на рассматриваемой территории, так и направление процессов почвообразования (Savage et al., 1996). Однако на сегодняшний день очевидно, что и процессы почвообразования, и процессы формирования и функционирования фитоценозов протекают в сложных гетерофазных системах, различных по множеству параметров, в частности, по минералогическому и гранулометрическому составу минеральной матрицы, качественному составу и количеству органического вещества, биомассе и разнообразию микроорганизмов, структуре и ярусному распределению растений. Находясь в постоянном взаимодействии, элементы этой системы обуславливают плодородие почв, продуктивность как фитоценозов, так и экоси- стемы в целом, участвуют в глобальных биогеохимических циклах элементов (Adhikari, Hartemink, 2016). В связи с большой распространенностью аридных территорий и высокими темпами ариди-зации все более актуальными становятся исследования влияния дефицита влаги как на различные экосистемы в целом, так и на их отдельные составляющие (Zalibekov, 2011; Kudrevatykh et al., 2022).
Значительный прогресс в изучении микробных сообществ, наблюдающийся в последние десятилетия, во многом связан с развитием и распространением методов молекулярной биологии, применение которых расширило представления о разнообразии прокариот, населяющих природные среды, и позволило обнаружить широкий спектр организмов, ранее не выделявшихся в культуру и потому малоизученных (Solden et al., 2016; Bodor et al., 2020) . Почвы, будучи системой чрезвычайно высокой сложности, характеризуются вариабельностью свойств и процессов, протекающих в ней, что приводит к формированию множества экологических ниш, которые населены различными по составу и функциям микробными сообществами. В связи с этим почвы явлются основным депозитарием микробного разнообразия.
Исследования биоразнообразия и функциональной активности почвенных прокариотных сообществ в условиях дефицита влаги немногочисленны. Большинство исследований, характеризующих почвенные микробные сообщества в условиях низкой доступности воды, были сконцентрированы на описании микробного разнообразия в экосистемах с пониженными значениями активности воды (Aw), рассчитывающейся как отношение давления паров воды над исследуемым раствором к давлению паров воды над дистиллированной водой (Warren-Rhodes et al., 2019; Alotaibi et al., 2020) . Из различных почв засушливых экосистем были выделены представители новых таксонов бактерий преимущественно филу-ма Actinomycetota (Bull, 2011; Montero-Calasanz et al., 2012; Luo et al., 2012; Harwani, 2013; Santhanam et al., 2013) . Проведен ряд работ по определению предельных значений Aw для роста микроорганизмов (Stevenson, Hallsworth, 2014; Lebre et al., 2017; Zenova et al., 2007; Zvyagintsev et al., 2009, 2012) , в ходе которых, как правило, изучались лишь единичные штаммы прокариот.
Влияние изменения доступности воды на таксономическое разнообразие и метаболическую активность почвенных микробных сообществ практически не изучено. Исследования таксономического состава в подобных работах единичны и ограничивались, как правило, лишь определением соотношения биомассы бактерий и грибов или соотношений биомассы грамположитель-ных и грамотрицательных бактерий in situ (Kakumanu et al., 2013) .
В работах по изучению микробных сообществ засушливых природных сред были отмечены значительный биотехнологический потенциал выделенных штаммов и потребность в дальнейших исследованиях ксеротолерантных микроорганизмов, в особенности прокариот, и их таксономического разнообразия и метаболических особенностей, как с фундаментальной, так и с прикладной точек зрения (Margesin et al., 2001; Azua-Bustos et al., 2014; Mohammadipanah et al., 2016) . При этом предполагается, что аридные почвы содержат большой пул бактерий-продуцентов различных биологически активных веществ (Goodfellow et al., 2018) .
Таким образом, на сегодняшний день накоплен массив данных о разнообразии микроорганизмов аридных почв и пород in situ , установлено, что подобные экосистемы содержат множество ранее неизвестных видов бактерий и биотехнологически ценных штаммов. Однако разнообразие и характеристики культивируемых прокариот засушливых экотопов и изменения в структуре культивируемых бактериальных сообществ при изменении активности воды мало изучены.
Цель данного исследования – изучение изменения таксономической структуры культивируемого бактериального сообщества поверхностного горизонта серозема (Aridic Calcisol) пустыни Негев при снижении активности воды и выявление у изолятов биотехнологически перспективной ферментативной активности.
ОБЪЕКТЫ И МЕТОДЫ
Объектом исследования являлось культивируемое бактериальное сообщество, выделенное из поверхностного горизонта серозема, отобранного в пустыне Негев (30°47′ N; 34°46′ E; Израиль, условное обозначение образца SN2). Образец SN2 был асептично отобран с глубины 5–10 см в стерильный полипропиленовый кон- тейнер. Согласно международной классификации реферативной базы данных почв (WRB) данная почва идентифицируется как Aridic Calcisol (Cheptsov et al., 2018).
Для выделения ксеротолерантных бактерий использовали технику накопительных культур: навески почвы массой 5 г помещали в культуральные колбы, содержащие 50 мл жидкой питательной среды R2A (Reasoner, Geldreich, 1985) с добавлением глицерина до значения Aw, равного 0.90. Выбранное значение активности воды считается нижней границей сохранения метаболической активности для большинства бактерий (Cervenka et al., 2002) . Расчет значений Aw проводили по уравнению Норриша (Grant, 2004; Winston, Bates, 1960) . Полученные суспензии инкубировали в течение 14 суток на ротационной качалке со скоростью вращения 200 об./мин. После инкубации суспензии центрифугировали при 3 500 об./мин в течение 2 мин для осаждения минеральных частиц. Далее полученный супернатант центрифугировали при 14 000 об./мин в течение 2 мин для осаждения прокариотных клеток. Клетки ресуспендировали в стерильном фосфатно-солевом буферном растворе (рН = 7.4) и готовили серию 10-кратных разведений. Далее клеточные суспензии высевали на плотную питательную среду R2A c Aw 1.0 для получения единичных колоний и выделения чистых культур. Посевы инкубировали в течение 14 суток при +25 °С, после чего проводили учет фенотипически уникальных колониеобразующих единиц (КОЕ) и их выделение в чистые культуры по стандартной методике (Белов и др., 2020) .
Параллельно проводили микробиологический посев нативного образца, не подвергавшегося предварительному инкубированию, по общепринятой методике посева серии разведений почвенной суспензии (Белов и др., 2020) на плотную питательную среду R2A. Накопительные культуры и посевы проводили в трехкратной повторности.
Всего из исследованных накопительных кульутр выделили 148 штаммов аэробных гетеротрофных бактерий.
Для определения предельных значений Aw, при которых возможен рост выделенных штаммов, проводили культивирование исследуемых бактерий на жидкой питательной среде R3A (Reasoner, Geldreich, 1985) с добавлением разных концентраций глицерина для получения градиента значений Aw от 1.0 до 0.9 с шагом в 0.01 ед. Инкубацию проводили в течение 42 суток при +25 °С в трехкратной повторности, после чего отмечали визульно регистрируемый рост на среде с соответствующей активностью воды.
Определение ферментативной активности чистых культур проводили с использованием селективных питательных сред для всех штаммов бактерий, выделенных из исследованного образца. Для определения нитрогеназной активности штаммы культивировали на безазотистой среде Эшби (Lin, 2012) , стабильный рост на этой среде считали признаком наличия нитрогеназ. Для определения амилазной активности штаммы культивировали на среде с крахмалом в качестве основного источника углерода (дрожжевой экстракт 3 г; растворимый крахмал 10 г; агар-агар 12 г; дистиллированная вода 1 000 мл; рН = 7.5 ± 0.2). После инкубации в течение 72 ч к среде добавляли раствор Люголя для подтверждения гидролиза крахмала по развитию зоны просветления вокруг бактериальных колоний. Определение протеолитической активности проводили с использованием теста на способность к разжижению желатина (Porres, Harris, 1974) .
Для определения таксономической структуры сообществ культивируемых бактерий использовали методы амплификации фрагмента гена 16S рРНК с универсальными вырожденными праймерами и последующее риботипирование с применением рестрикционного анализа ампликонов. Уникальные рибогенотипы секвенировали по Сенгеру для получения нуклеотидной последовательности фрагмента гена 16S рРНК.
Выделение ДНК чистых культур бактерий проводили по ранее описанной методике (Belov et al., 2018) : биомассу чистых культур бактерий суспендировали в Трис-ЭДТА буферном растворе (рН = 7.8) с 5% детергента Triton X-100. Далее суспензии инкубировали на водяной бане при температуре 100 °С в течение 15 мин, затем обрабатывали на гомогенизаторе MiniLys (Bertin Instruments, Франция) при 5 000 об./мин в течение 30 с. Затем суспензию центрифугировали при 14 000 об./мин в течение 3 мин, полученную надосадочную жидкость использовали в качестве матрицы для проведения ПЦР.
Амплификацию фрагмента гена 16S рРНК проводили с праймерной системой 27f + 537r
(27f 5’-AGAGTTTGATCCTGGCTCAG-3’ и
537r 5’-GTATTACCGCGGCTGCTG-3’) по ранее описанной методике (Belov et al., 2018) . Для проведения риботипирования полученные ампликоны последовательно обрабатывали эндонуклеазами рестрикции Alu I, Hae III, и Taq I (SibEnzyme, Россия) с сайтами рестрикции AG↑CT, GG↑CC и T↑CGA соответственно (Cheptsov et al., 2017) . Ферментативные реакции проводили в соответствии с инструкциями производителя на амплификаторе BioRad T-100 (BioRad Laboratories, США). Продукты рестрикции визуализировали в 2%-ном агарозном геле с ДНК-специфичным красителем бромистым этидием. Результаты рестрикции фиксировали с помощью системы гель-документирования Doc-Print II (Vilber Lourmat, Франция). Ампликоны с одинаковыми рестрикционными профилями относили к одному рибогенотипу.
Секвенирование фрагментов гена 16S рРНК проводили в научно-исследовательской компании Евроген (Россия). Редактирование нуклеотидных последовательностей проводили с помощью программы Chromas Lite 2.6.6 (http://technelysium.com.au/wp/chromas/) , выравнивание, сравнение и идентификацию последовательностей выполняли с помощью программы Clustal Omega (https://www.ebi.ac.uk/Tools/msa/clustalo/) и алгоритма BLAST базы данных GenBank (https://blast.ncbi.nlm.nih.gov/) . Полученные последовательности депонировали в базу данных GenBank под номерами OP740548-OP740582.
Обработку полученных результатов проводили с использованием пакета программ Microsoft Office Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Таксономическое разнообразие сообщетв культивируемых бактерий
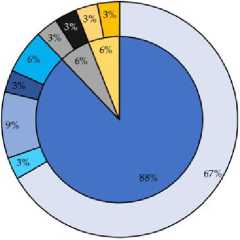
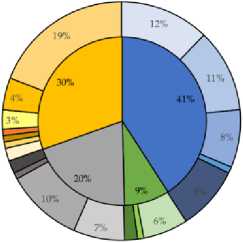
Из нативного неинкубированного образца было выделено 33 фенотипически уникальных типа колоний, в то время как из накопительной культуры с Aw 0.9 было выделено 115 уникальных морфотипов. Культивируемое сообщество, выделенное из натив- ного образца поверхностного горизонта серозема, характеризовалось абсолютным доминированием представителей филума Acti-nomycetota (более 80% изолятов), выявлены единичные представители филумов Bacillota и Pseudomonadota (рис. 1). В сообществе культивируемых бактерий, полученном после прединкубации при пониженной активности воды (Aw 0.9), обнаружены представители тех же филумов, однако их соотношение значительно изменилось: представители филума Actinomycetota оставались доминирующими (41% всех изолятов), значительно увеличилась представленность культивируемых бактерий филумов Bacillota и Pseu-domonadota (20 и 30% от всех изолятов, выделенных в этих условиях, соответственно). Также были выделены представители фи-лума Bacteroidota, доля которых составляла 9% от общего числа изолятов.
В сообществе, выделенном из нативного образца, были выявлены 9 родов аэробных гетеротрофных бактерий, причем представители рода Arthrobacter являлись абсолютными доминантами – на их долю приходилось 67% изолятов (рис. 1). После прединку-бации при низкой доступности воды наблюдалось возрастание разнообразия культивируемых бактерий: были идентифицированы представители 19 родов бактерий, наиболее многочисленными были изоляты, относящиея к роду Stenotrophomonas . Выделялись на питательной среде только из нативного образца и не были обнаружены после прединкубации штаммы родов Brevibacillus , Corynebacterium и Microlunatus . Вероятно, это обусловлено тем, что в нативном образце они являются минорными компонентами (~3%) культивируемого сообщества и не обнаруживались после прединкубации либо ввиду гетерогенности почвенных условий обитания микроорганизмов, либо ввиду низкой конкуретоспособ-ности в условиях пониженной активности воды.
Отдельно стоит отметить, что в ходе исследования был выделен штамм рода Pedobacter , характеризующийся низким сходством нуклеотидной последовательностей (97.7 %) с последовательностями в базе данных GenBank, что указывает на то, что данный изолят может являться представителем ранее не описаннго вида бактерий (Chun et al., 2018) .
BActrriomyetota □ Baifloto Q Pseudomouadofa
QArthrobncter ■Corjmeiucterium BKocuria BMicrolunfltus
QBifiOus ■ВгегИмаПиб DStetcfrophoutonas nSerrdfin
■ Pseudnrth rob utter
a
■ Actino my ce tot a □ Bacterio idota DBacillota О Pseud стопа dota
-
□ Arthrobacter
-
□ Chryseobecterium
-
■ Priestia
IB Pseudomonus
□ Brroiba cterium ElPedobacter ■ Stophi/lococcus DAcirietobacter
В Коси r in
В S ph brgobacteriu m
QDct'tsia
QSerrfltia
-
■ Mi crohn cterium
П Aerococcus
QAlcaligenes
О Stenotrop/iomoMfls
-
■ Pseudo rth robnctcr
В Radii us
-
■ Del/tia
b
Рис. 1. Структура культивируемых бактериальных сообществ нативного образца серозема пустыни Негев ( a ) и инкубированного при активности воды (Aw) 0.9 ( b ). Таксоны, для которырых не указаны доли в сообществе, составляли менее 3%.
Fig. 1. Culturable bacterial communities’ structure isolated from the native Negev desert soil ( a ) and isolated from pre-incubated at water activity (Aw) 0.9 ( b ). Taxa for which percentage in the community are not indicated were less than 3%.
Определение способности к росту при пониженных значениях активности воды (Aw)
Анализ способности штаммов репродуцировать в культуре на средах с низкими значениями Aw выявил большую долю ксе-ротолерантных штаммов, выделенных из сообщества, прединку-бированного при Aw 0.9, по сравнению с сообществом, выделенным из нативного образца (рис. 2). Большинство изолятов, выделенных как из прединкубированного, так и из нативного образца, в качестве нижней границы роста in vitro характеризовались значениями Aw в диапазоне 0.97–0.95. В то же время среди штаммов, выделенных из прединкубированного образца, обнаружены изоля-ты, способные расти на средах с Aw 0.93 и 0.91 (4 и 7 штаммов соответственно). Нижние границы Aw, при которых возможен рост изученных бактериальных культур, представлены на рисунке 2. Наиболее ксеротолерантными по результатам тестирования были представители родов Stenotrophomonas, Staphylococcus, Brevibacterium, Bacillus и Aerococcus .
Ферментативная активность выделенных штаммов
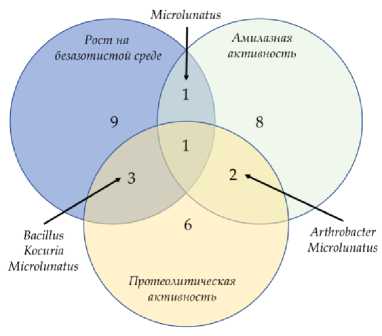
Способность к росту на безазотистой среде, которая может указывать на способность к фиксации молекулярного азота, проявили 27 и 15% штаммов, выделенных из нативного и прединку-бированного при пониженной Aw образцов поверхностного горизонта серозема пустыни Негев соответственно. Амилотилическую активность проявляли 27 и 19% штаммов, выделенных при упомянутых условиях, соответственно.
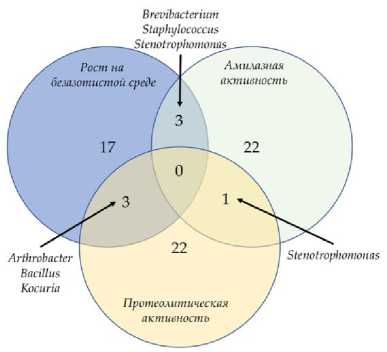
Протеолитическая активность выявлена у 18 и 19% изолятов соответственно. Выявлены штаммы, проявляющие множественную активность исследованных ферментов (рис. 3). Наиболее примечателен штамм рода Microlunatus , выделенный из нативного образца серозема, проявляющий в культуре способность к росту на безазотистой среде, амилолитическую и протеолитическую активности.
Сопоставление прединкубации при пониженной Aw с другими подходами к культивированию
Обнаружение представителей филумов Actinomycetota, Ba-cillota, Pseudomonadota и Bacterioidota является типичным для почв и пород жарких аридных пустынь (Belov et al., 2018, 2019; Sun et al., 2018; Warren-Rhodes et al., 2019; Molina-Menor et al., 2021) .
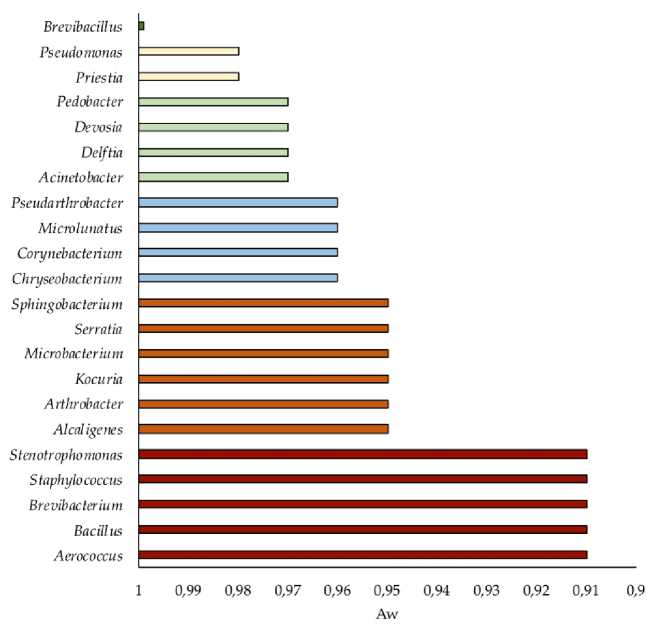
Рис. 2. Нижняя граница активности воды (Aw), при которой зарегистрирован рост представителей различных родов бактерий, выделенных из исследованной почвы.
Fig. 2. Lowest values of water activity (Aw) at which representatives of different genera, isolated from the studied soil, were able to growth.
a
b
Рис. 3. Число штаммов, выделенных из нативного ( а ) и прединкубированнго ( b ) образцов пустынной почвы, способных к росту на безазотистой среде, амилолитической и протеолитической активности.
Fig. 3 . The number of strains isolated from native ( a ) and pre-incubated ( b ) desert soil samples capable to growth on a nitrogen-free medium, amylolytic and proteolytic activity.
В то же время, использование питательных сред с низкой активностью воды для выделения микроорганизмов является редкостью, хотя позволяет выявить более высокое разнообразие культивируемых бактерий, выделяющихся из одного и того же почвенного образца, о чем свидетельствуют результаты проведенного исследования. Высокая доля представителей филума Actinomyce-tota, выделенных из пустынной почвы, хорошо согласуется с данными о множественной стресс-толерантности актинобактерий к широкому спектру физико-химических воздействий, в частности, к присутствию высоких концентраций водорастворимых солей, сильных окислителей, к высоким и низким значениям температур и рН (Zenova et al., 2011; Mohammadipanah, Wink, 2016; Belov et al., 2019, 2020) . Примечательно возрастание доли представителей филумов Pseudomonadota и Bacillota в сообществе прединкубиро-ванного при Aw 0.9 образца. Существенным ограничением метода посева на лабораторные среды является влияние выбора среды и условий культивирования на получаемые результаты. Вероятно, условия пониженной активности воды ближе к условиям существования бактериальных клеток in situ , что способствует культивированию большего разнообразия потенциально культивируемых форм и их дальнейшему выделению. По-видимому, механизм этого явления заключается в небольшом снижении скорости роста быстрорастущих на распространенных универсальных лабораторных питательных средах, в частности, представителей филумов Actinomycetota, благодаря чему снижается конкурентная нагрузка на представителей других филумов.
Как упоминалось выше, аридные экосистемы содержат большой пул неописанных культивируемых микроорганизмов и, в частности, актинобактерий (Goodfellow et al., 2018; Nithya et al., 2018). Проблемы изучения биоразнообразия культивируемых бактерий, их вклада в экосистемные и биосферные процессы и возможное использование в биотехнологических целях являются актуальными для современной почвенной микробиологии и решаются с применением разных техник и подходов: с применением разных питательных сред, инкубации посевов при различных температурах, предватительном увлажнении почв или прединкубаци-ей с добавлением различных источников углерода, реактивирую- щих агентов или, напротив, селективных ингибиторов различных групп микроорганизмов. Например, с помощью посева на несколько питательных сред в градиенте их концентраций из образцов почвенных корочек пустыни Табернас (Испания) было выделено 254 штамма, из которых 31%, предположительно, относились к неописанным видам бактерий (Molina-Menor et al., 2021), инкубация посевов из пустынных почв при различных температурах культивирования позволяет выделить большее разнообразие культивируемых бактерий (Belov et al., 2018, 2019). В то же время применение сред с пониженной активностью воды возможно как с прединкубацией сообществ, выполненной в данной работе, так и без нее с применением техники прямого микробиологического посева почвенной суспензии на серию питательных сред, различающихся активностью воды. Оба указанных подхода позволяют выделить большее разнообразие культивируемых бактерий, однако посев почвенных суспензий на плотные питательные среды в диапазоне Aw от 1.0 до 0.9 позволяет выделить большее число ранее не описанных видов культивируемых бактерий (Cheptsov et al., 2023) по сравнению с выделением из прединкубированных при низкой активности воды.
Большинство культивируемых бактерий не способно к росту на средах с Aw ниже 0.95–0.94, а нижним пределом для подавляющего большинства бактерий считается значение Aw равное 0.9 (Cervenka et al., 2002; Fontana, 2020; Stanaszek-Tomal, 2020). В связи с этим выявленные штаммы, способные к росту при Aw 0.91, могут представлять интерес для дальнейшего изучения физиологических процессов, обуславливающих их способность к росту в условиях низкой обеспеченности доступной влаги, и для внедрения в биотехнологические процессы и разработку бактериальных препаратов, способствующих росту растений. Штаммы, проявляющие способность к росту на безазотистых средах, способные к гидролизу крахмала и полипептидов могут способствовать росту растений. Особый интерес представляют штаммы, способные к осуществлению нескольких ферментативных реакций, сохраняющие активность при низкой доступности влаги. В данном исследовании выявлен один штамм рода Microlunatus, предположительно, способный к проведению всех трех исследованных ферментатив- ных реакций, сохраняющий способность к росту in vitro вплоть до Aw 0.96. Среди штаммов, способных к росту в культуре при Aw 0.93 и 0.91 обнаружены штаммы, способные к росту на безазоти-стой среде и гидролизу крахмала и полипептидов. Дальнейшее изучение ксеротолерантных бактерий может выявить продуцентов биотехнологически значимых ферментов, способных сохранять активность in situ в условиях дефицита влаги.
ЗАКЛЮЧЕНИЕ
Проведено исследование биоразнообразия культивируемых бактерий, способных к репродукции в условиях пониженной доступности воды. В ходе работы микробное сообщество было пре-динкубировано в накопительной культуре с Aw 0.9, рассматривающейся в качестве нижней границы, при которой возможно сохранение метаболической активности большинства прокариот. Из нативной и прединкубированной почв были выделены и идентифицированы 148 фенотипически уникальных чистых культур бактерий 22 родов. Полученные данные свидетельствуют об увеличении таксономического разнообразия культивируемых бактерий при использовании для выделения из аридных почв этапа предин-кубирования на среде с пониженной активностью воды.
В результате работы выделена культура рода Pedobacter , которая, вероятно, является представителем не описанного ранее вида бактерий. Обнаружены штаммы родов Aerococcus, Bacillus, Brevibacterium, Staphylococcus и Stenotrophomonas , способные расти при Aw 0.91, дальнейшее изучение которых перспективно с позиций обнаружения физиологических механизмов ксеротоле-рантности и биотехнологического применения. Выявлены штаммы, проявляющие ферментативную активность, способствующую росту растений.
Полученные результаты подтверждают существующую гипотезу о том, что аридные экосистемы, в частности, пустынные почвы и породы, являются депозитарием ранее не описанных видов бактерий с уникальными физиологическими свойствами. Учитывая интенсификацию процессов аридизации климата и деградации почв, наблюдающуюся в последние десятилетия, изучение микробных сообществ аридных экотопов, их функциональной ак- тивности и потенциала для применения в биотехнологических процессах является актуальной задачей.
Список литературы Таксономическая и функциональная характеристика ксеротолерантного культивируемого прокариотного сообщества серозема пустыни Негев
- Белов А.А., Чепцов В.С., Лысак Л.В. Методы идентификации почвенных микроорганизмов. М.: МАКС Пресс, 2020. 196 с.
- Adhikari K., Hartemink A.E. Linking soils to ecosystem services - A global review // Geoderma. 2016. Vol. 262. P. 101-111. https://doi.org/10.1016/j.geoderma.2015.08.009.
- Alotaibi M.O., Sonbol H.S., Alwakeel S.S., Suliman R.S., Fodah R.A., Jaffal A.S.A., AlOthman N. I., Mohammed A.E. Microbial diversity of some sabkha and desert sites in Saudi Arabia // Saudi Journal of Biological Sciences. 2020. Vol. 27. No. 10. P. 2778-2789. https://doi.org/10.1016/j.sjbs.2020.06.038.
- Azua-Bustos A., González-Silva C. Biotechnological applications derived from microorganisms of the Atacama Desert // BioMed research international. 2014. Vol. 2014. https://doi.org/10.1155/2014/909312.
- Belov A.A., Cheptsov V.S., Manucharova N.A., Ezhelev Z.S. Bacterial communities of Novaya Zemlya archipelago ice and permafrost // Geosciences. 2020. Vol. 10. No. 2. P. 67. https://doi.org/10.3390/geosciences10020067.
- Belov A.A., Cheptsov V.S., Vorobyova E.A. Soil bacterial communities of Sahara and Gibson deserts: Physiological and taxonomical characteristics // AIMS Microbiol. 2018. Vol. 4. No. 4. P. 685. https://doi.org/10.3934/microbiol.2018.4.685.
- Belov A.A., Cheptsov V.S., Vorobyova E.A., Manucharova N.A., Ezhelev Z.S. Stress-tolerance and taxonomy of culturable bacterial communities isolated from a central Mojave Desert soil sample // Geosciences. 2019. Vol. 9. No. 4. P.166. https://doi.org/10.3390/geosciences9040166.
- Bodor A., Bounedjoum N., Vincze G.E., Erdeiné Kis Á., Laczi K., Bende G., Szilágyi A., Kovács T., Perei K., Rákhely G. Challenges of unculturable bacteria: environmental perspectives // Reviews in Environmental Science and Bio/Technology. 2020. Vol. 19. No. 1. P. 1-22. https://doi.org/10.1007/s11157-020-09522-4.
- Bull A.T. Actinobacteria of the extremobiosphere // Extremophiles Handbook, K. Horikoshi (Ed.). Tokyo: Springer, 2011. P. 1203-1240. https://doi.org/10.1007/978-4-431-53898-1_58.
- Cervenka L., Vytrasova M., Jelinek D., Brezina P. Determination of minimum water activity values for the survival of bacteria in a culture medium // Bulletin of Food Research. 2002. Vol. 41. No. 1. P. 59-68. URL: https://agris.fao.org/agris-search/search.do?recordID=SK2002000296.
- Cheptsov V., Vorobyova E., Belov A., Pavlov A., Tsurkov D., Lomasov V., Bulat S. Survivability of soil and permafrost microbial communities after irradiation with accelerated electrons under simulated Martian and open space conditions // Geosciences. 2018. Vol. 8. No. 8. P. 298. https://doi.org/10.3390/geosciences8080298.
- Cheptsov V.S., Belov A.A., Sotnikov I.V. Diversity of Bacteria Cultured from Arid Soils and Sedimentary Rocks Under Conditions of Available Water Deficiency // Eurasian Soil Science. 2023. Vol. 56. No. 5. In press.
- Cheptsov V.S., Vorobyova E.A., Manucharova N.A., Gorlenko M.V., Pavlov A.K., Vdovina M.A., Bulat, S.A. 100 kGy gamma-affected microbial communities within the ancient Arctic permafrost under simulated Martian conditions // Extremophiles. 2017. Vol. 21. No. 6. P. 1057-1067. https://doi.org/10.1007/s00792-017-0966-7.
- Chun J., Oren A., Ventosa A., Christensen H., Arahal D.R., da Costa M.S., Rooney A.P., Yi H., Xu X.W., De Meyer S., Trujillo M.E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // International journal of systematic and evolutionary microbiology. 2018. Vol. 68. No. 1. P. 461-466. https://doi.org/10.1099/ijsem.0.002516.
- Connon S.A., Lester E.D., Shafaat H.S., Obenhuber D.C., Ponce A. Bacterial diversity in hyperarid Atacama Desert soils // Journal of Geophysical Research: Biogeosciences. 2007. Vol. 112. No. G4. https://doi.org/10.1029/2006JG000311.
- Fontana Jr A.J. Minimum Water Activity Limits for Growth of Microorganisms // Water Activity in Foods. 2020. Vol. 406. P. 571-572. https://doi.org/10.1002/9781118765982.
- Goodfellow M., Nouioui I., Sanderson R., Xie F., Bull A.T. Rare taxa and dark microbial matter: novel bioactive actinobacteria abound in Atacama Desert soils // Antonie van Leeuwenhoek. 2018. Vol. 111. No. 8. P. 1315-1332. https://doi.org/10.1007/s10482-018-1088-7.
- Grant W.D. Life at low water activity // Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 2004. Vol. 359. No. 1448. P. 1249-1267. https://doi.org/10.1098/rstb.2004.1502.
- Harwani D. Biodiversity of rare thermophilic actinomycetes in the great Indian Thar desert: an overview // Indo American Journal of Pharmaceutical Research. 2013. Vol. 3. P. 9349-9356.
- Jackson R.B., Anderson L.J., Pockman W.T. Measuring water availability and uptake in ecosystem studies // Methods in ecosystem science. Springer, New York, NY, 2000. P. 199-214. https://doi.org/10.1007/978-1-4612-1224-9_14.
- Kakumanu M.L., Cantrell C.L., Williams M.A. Microbial community response to varying magnitudes of desiccation in soil: a test of the osmolyte accumulation hypothesis // Soil Biology and Biochemistry. 2013. Vol. 57. P. 644-653. https://doi.org/10.1016/j.soilbio.2012.08.014.
- Kudrevatykh I.Y., Kalinin P.I., Mitenko G.V. The effect of changes vegetation cover on the chemical properties of steppe soils during climate aridization // Plant and Soil. 2022. P. 1-20. https://doi.org/10.1007/s11104-022-05704-x.
- Lebre P.H., De Maayer P., Cowan D.A. Xerotolerant bacteria: surviving through a dry spell // Nature Reviews Microbiology. 2017. Vol. 15. No. 5. P. 285-296. https://doi.org/10.1038/nrmicro.2017.16.
- Lin L., Li Z., Hu C., Zhang X., Chang S., Yang L., An Q. Plant growth-promoting nitrogen-fixing enterobacteria are in association with sugarcane plants growing in Guangxi, China // Microbes and environments. 2012. Vol. 27. No. 4. P. 391-398. https://doi.org/10.1264/jsme2.ME11275.
- Luo X., Wang J., Zeng X.C., Wang Y., Zhou L., Nie Y., Fang C. Mycetocola manganoxydans sp. nov., an actinobacterium isolated from the Taklamakan desert // International journal of systematic and evolutionary microbiology. 2012. Vol. 62. No. 12. P. 2967-2970. https://doi.org/10.1099/ijs.0.038877-0.
- Margesin R., Schinner F. Potential of halotolerant and halophilic microorganisms for biotechnology // Extremophiles. 2001. Vol. 5. No. 2. P. 73-83. https://doi.org/10.1007/s007920100184.
- Mohammadipanah F., Wink J. Actinobacteria from arid and desert habitats: diversity and biological activity // Frontiers in microbiology. 2016. Vol. 6. P. 1541. https://doi.org/10.3389/fmicb.2015.01541.
- Molina-Menor E., Gimeno-Valero H., Pascual J., Peretó J., Porcar M. High culturable bacterial diversity from a European desert: The Tabernas desert // Frontiers in Microbiology. 2021. Vol. 11. P. 583120. https://doi.org/10.3389/fmicb.2020.583120.
- Montero-Calasanz M., Göker M., Rohde M., Schumann P., Pötter G., Spröer C., Klenk H. P. Geodermatophilus siccatus sp. nov., isolated from arid sand of the Saharan desert in Chad // Antonie van Leeuwenhoek. 2013. Vol. 103. No. 3. P. 449-456. https://doi.org/10.1007/s10482-012-9824-x.
- Nithya K., Muthukumar C., Biswas B., Alharbi N.S., Kadaikunnan S., Khaled J.M., Dhanasekaran D. Desert actinobacteria as a source of bioactive compounds production with a special emphases on Pyridine-2, 5-diacetamide a new pyridine alkaloid produced by Streptomyces sp. DA3-7 // Microbiological Research. 2018. Vol. 207. P. 116-133. https://doi.org/10.1016/j.micres.2017.11.012.
- Porres J.M., Harris D. Rapid gelatin liquefaction test // American Journal of Clinical Pathology. 1974. Vol. 62. No. 3. P. 428-430. https://doi.org/10.1093/ajcp/62.3.428.
- Reasoner D.J., Geldreich E.E. A new medium for the enumeration and subculture of bacteria from potable water // Applied and Environmental Microbiology. 1985. Vol. 49. No. 1. P. 1-7. https://doi.org/10.1128/aem.49.1.1-7.1985.
- Santhanam R., Rong X., Huang Y., Andrews B.A., Asenjo J.A., Goodfellow M. Streptomyces bullii sp. nov., isolated from a hyper-arid Atacama Desert soil // Antonie van Leeuwenhoek. 2013. Vol. 103. No. 2. P. 367-373. https://doi.org/10.1007/s10482-012-9816-x.
- Savage M.J., Ritchie J. T., Bland W.L., Dugas, W.A. Lower limit of soil water availability // Agronomy Journal. 1996. Vol. 88. No. 4. P. 644-651. https://doi.org/10.2134/agronj1996.00021962008800040024x.
- Solden L., Lloyd K., Wrighton K. The bright side of microbial dark matter: lessons learned from the uncultivated majority // Current opinion in microbiology. 2016. Vol. 31. P. 217-226. https://doi.org/10.1016/j.mib.2016.04.020.
- Stanaszek-Tomal E. Environmental factors causing the development of microorganisms on the surfaces of national cultural monuments made of mineral building materials // Coatings. 2020. Vol. 10. No. 12. P. 1203. https://doi.org/10.3390/coatings10121203.
- Stevenson A., Hallsworth J.E. Water and temperature relations of soil Actinobacteria // Environmental microbiology reports. 2014. Vol. 6. No. 6. P. 744-755. https://doi.org/10.1111/1758-2229.12199.
- Sun Y., Shi Y.L., Wang H., Zhang T., Yu L.Y., Sun H., Zhang Y.Q. Diversity of bacteria and the characteristics of actinobacteria community structure in Badain Jaran Desert and Tengger Desert of China // Frontiers in Microbiology. 2018. Vol. 9. P. 1068. https://doi.org/10.3389/fmicb.2018.01068.
- Warren-Rhodes K.A., Lee K.C., Archer S.D., Cabrol N., Ng-Boyle L., Wettergreen D., Pointing S.B. Subsurface microbial habitats in an extreme desert Mars-analog environment // Frontiers in Microbiology. 2019. Vol. 69. P. 1-11. https://doi.org/10.3389/fmicb.2019.00069.
- Winston P.W., Bates D.H. Saturated solutions for the control of humidity in biological research // Ecology. 1960. Vol. 41. No. 1. P. 232-237. https://doi.org/10.2307/1931961.
- Zalibekov Z.G. The arid regions of the world and their dynamics in conditions of modern climatic warming // Arid Ecosystems. 2011. Vol. 1 No. 1. P. 1-7. https://doi.org/10.1134/S2079096111010094.
- Zenova G.M., Gryadunova A.A., Doroshenko E.A., Likhacheva A.A., Sudnitsyn I.I., Pochatkova T.N., Zvyagintsev D.G. Influence of moisture on the vital activity of actinomycetes in a cultivated low-moor peat soil. // Eurasian Soil Science. 2007. Vol. 40. No. 5. P. 560-564. https://doi.org/10.1134/S1064229307050110.
- Zenova G.M., Manucharova N.A., Zvyagintsev D.G. Extremophilic and extremotolerant actinomycetes in different soil types // Eurasian Soil Science 2011. Vol. 44. No. 4. P. 417-436. https://doi.org/10.1134/S1064229311040132.
- Zvyagintsev D.G., Zenova G.M., Sudnitsyn I.I., Gracheva T.A., Lapygina E.V., Napol’skaya K.R., Sydnitsyna A.E. Development of actinomycetes in brown semidesert soil under low water pressure // Eurasian soil science. 2012. Vol. 45. No. 7. P. 717-723. https://doi.org/10.1134/S1064229312030155.
- Zvyagintsev D.G., Zenova G.M., Sudnitsyn I.I., Gracheva T.A., Napol’skaya K.R., Belousova M.A. Dynamics of spore germination and mycelial growth of streptomycetes under low humidity conditions // Microbiology. 2009. Vol. 78. No. 4. P. 440-444. https://doi.org/10.1134/S0026261709040079.


