Таксономическое разнообразие микробного сообщества холодного железистого источника Дабан-Горхон (Витимское плоскогорье)
Автор: Банзаракцаева Т.Г., Бархутова Д.Д.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 3 (25), 2023 года.
Бесплатный доступ
Были изучены экологические условия обитания микробных сообществ воды и донных осадков железистого источника Дабан-Горхон (Витимское плоскогорье). Вода Дабан-Горхонского источника характеризуется как гидрокарбонатная, кальциево-магниево-натриевая с содержанием железа 2,16 мг/л, температурой 8 °С в летний период. В воде и донных осадках источника с помощью молекулярно-генетических методов было изучено таксономическое разнообразие микробных сообществ, в которых доминировали представители филумов Proteobacteria, Bacteroidota, Actinobacteriota. Результаты исследования таксономического разнообразия на уровне родов показали, что основу микробных сообществ воды и донных осадков холодного железистого источника Дабан-Горхон составляют прокариоты из низкотемпературных пресноводных местообитаний. Была установлена высокая представленность в исследуемых сообществах бактерий цикла железа, распространению которых способствует присутствие железа в воде.
Холодные источники, железистый источник, микробные сообщества, таксономическое разнообразие, психрофилы, дабан-горхон, микробная экология, микроорганизмы
Короткий адрес: https://sciup.org/148328091
IDR: 148328091 | УДК: 579.26 | DOI: 10.18101/2542-0623-2023-3-7-16
Текст научной статьи Таксономическое разнообразие микробного сообщества холодного железистого источника Дабан-Горхон (Витимское плоскогорье)
Жизнь на Земле развивалась в холодных условиях. Самая большая часть глобальной биосферы представлена сообществами, растущими и выживающими при температуре ниже 5 °C [Siddiqui & Cavicchioli 2006; Margesin & Miteva, 2011]. Психрофильные микроорганизмы являются естественными обитателями холодной среды. Исследования в области микробной экологии холодной среды с помощью культурозависимых и независимых от культуры молекулярных методов получили широкое распространение и сформировали комплекс знаний о разнообразии и экологической роли микробных сообществ в холодных экосистемах. Постоянно холодные наземные источники широко распространены и разнообразны по гидрохимическому составу, рН и минерализации. Однако микробные сообщества данных экосистем в настоящее время еще малоизучены [Rudolph et al., 2001, Camacho et al., 2005, Perreault et al., 2007; Perreault et al., 2008, Chaudhary et al., 2009, Li et al., 2012; Guðmundsdóttir et al., 2019]. Исходя из задач микробной экологии, одной из которых является получение представления об особенностях распространения микроорганизмов в различных местах их обитания, необходимо расширять сведения и знания о разнообразии и функционировании микробных сообществ в постоянно холодных наземных источниках.
Целью данной работы было изучение таксономического разнообразия микробных сообществ воды и донных осадков в постоянно холодном железистом источнике Дабан-Горхон (Витимское плоскогорье).
Материал и методика
Дабан-Горхонский холодный железистый источник (52°25′277 ” N 111°48′422 ” E) находится на левобережье реки Уды, в 22 км от села Сосново-Озерское (Еравнин-ский район, Бурятия). Источник имеет чашеобразную воронку диаметром 10–12 м. Вода здесь применяется в лечебных целях при различных заболеваниях.
Пробы воды и донных осадков были отобраны в стерильную стеклянную и пластиковую посуду. Температуру и значения рН в воде измеряли портативным прибором «РН-200» (HM Digital, Китай), минерализацию тест-кондуктометром TDS-4 (Сингапур). Концентрация анионов и катионов, перманганатная окисляемость и жесткость в воде были определены общепринятыми гидрохимическими методами [Унифицированные методы... 1973].
Для выделения ДНК воду фильтровали до забития фильтра через нитроцеллюлозные фильтры (диаметр пор 0,22 мкм). Тотальную ДНК с фильтров извлекали с помощью механической гомогенизации и ферментативного лизиса [Белькова, 2009]. Для выделения ДНК из проб донных осадков использовали набор реактивов MACHEREY-NAGEL Nucleo Spin Soil (MACHEREY-NAGEL, Германия) в соответствии с инструкцией производителя. Качественную оценку выделенной ДНК проверяли на приборе Nano Drop 8000 (Thermo Fisher Scientific Inc, США). Концентрацию ДНК определяли на флуориметре Quantus (Promega, США) с применением набора Quanti Fluords DNA (Promega, США).
Высокопроизводительное секвенирование. ДНК-библиотеки для секвенирования были созданы с использованием праймеров к вариабельной области V3–V4 гена 16S рРНК S-D-Bact-0341-b-S-17 и S-D-Bact-0785-a-A-21
согласно протоколу Illumina chemistry_documentation/16s/ [Klindworth et al., 2013]. Секвенирование проводили в ЦКП «Персистенция микроорганизмов» (Институт клеточного и внутриклеточного симбиоза УрО РАН на секвенаторе Mi Seq (Illumina, США) с использованием Reagent Kit V3 PE600 (Illumina, США).
Качество прочтений оценивали с помощью программы Fast QC v0.11.5. Объединение парноконцевых ридов в контиги (объединенные риды) проводили с использованием программы PEAR [Zhang, 2014]. Для фильтрации объединенных ридов по качеству и длине использовали команду fastq_filtr в программе USEARCH v9.0.1623_win32 [Edgar, 2010]. Последовательности были сгруппированы в OTU (operational taxonomic unit) путем последовательной дерепликации и кластеризации на уровне 97 %, с использованием алгоритма UPARSE [Edgar, 2013]. В процессе кластеризации тестировали и удаляли химерные последовательности. Количественная представленность полученных ОТU в образцах оценивалась через глобальное выравнивание последовательностей ОТU на первоначальные объединенные риды. Из полученных данных исключали последовательности, встречающиеся однократно (синглтоны) или дважды (даблтоны).
Для оценки характеристик разнообразия микробных сообществ были рассчитаны индексы разнообразия с использованием программы Past 3.14 с предварительной нормализацией переменных [Hammer et al., 2001].
Результаты и обсуждение
Вода Дабан-Горхонского источника характеризуется как гидрокарбонатная, кальциево-магниево-натриевая с содержанием железа 2,16 мг/л, с температурой 8 °С в летний период (табл. 1). Вода щелочная (рН 8,99); минерализация составляла 700,3 мг/л, средняя жесткость — 7,40 °Ж. Перманганатная окисляемость была 5,70 мг О/л.
C использованием высокопроизводительного гена 16S рРНК профилирования установлено таксономическое разнообразие микробного сообщества воды и донных осадков холодного источника Дабан-Горхон (Витимское плоскогорье). В исследуемых сообществах воды DG_water и донных осадков значительная доля принадлежала бактериям филумов Proteobacteria (46 % и 24 %), Bacteroidota (27 % и 10 %), Actinobacteriota (13,7 % и 17,7 %) соответственно (рис. 1).
Таблица 1
Физико-химическая характеристика воды Дабан-Горхонского источника
|
Показатель, единица измерения |
Значение показателя |
|
Температура, °С |
8,0 |
|
Водородный показатель (рН) |
8,99 |
|
Общая минерализация, мг/л |
700,3 |
|
Окисляемость перманганатная, мг О/л |
5,7 |
Продолжение табл. 1
|
Показатель, единица измерения |
Значение показателя |
|
Жесткость общая, °Ж |
7,4 |
|
Na+, мг/л |
27,7 |
|
Ca2+, мг/л |
100,2 |
|
Mg2+, мг/л |
29,2 |
|
Fe3+, мг/л |
2,2 |
|
НСО 3 -, мг/л |
457,6 |
|
СО 3 2-, мг/л |
12,0 |
|
NO2-, мг/л |
<0,02 |
|
NO 3 -, мг/л |
0,26 |
|
SO 4 2-, мг/л |
25,3 |
|
Cl-, мг/л |
10,3 |
|
F 2 , мг/л |
<0,1 |
|
Кремниевая кислота, мг/л |
56,8 |
|
СО 2 связанная, мг/л |
— 165,0 |
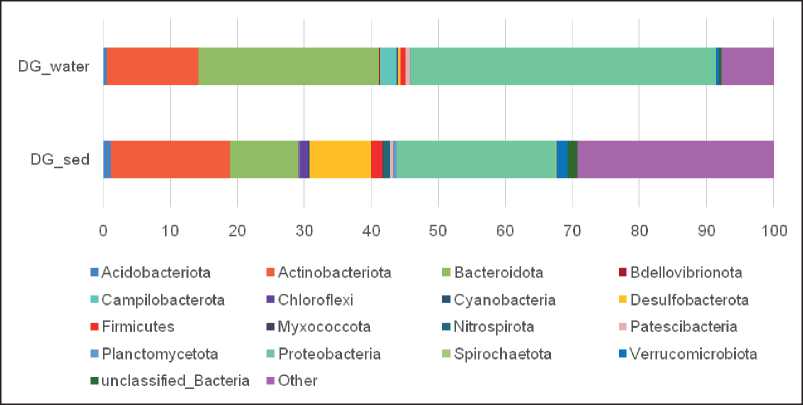
Рис. 1. Состав микробного сообщества на уровне филумов в воде (DG_water) и донных осадках (DGsed) холодного источника Дабан-Горхон
Для оценки характеристик разнообразия микробных сообществ воды и донных осадков источника Дабан-Горхон были рассчитаны индексы разнообразия
Шеннона, Simpson_1-Dи Chao1 (табл. 2). Оценка индексов разнообразия выявила большее разнообразие в микробном сообществе донных осадков.
Таблица 2
OTU и индексы α-разнообразия микробных сообществ холодного источника Дабан-Горхон
|
Индекс |
DG_water |
DG_sed |
|
OTUs |
16157 |
13533 |
|
Simpson_1-D |
0,9802 |
0,9879 |
|
ShannonH |
4,931 |
5,471 |
|
Chao-1 |
416 |
547 |
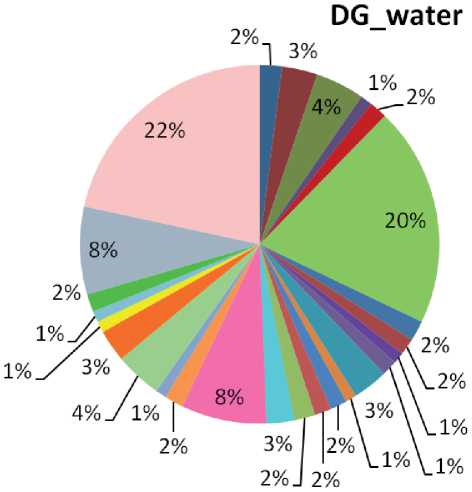
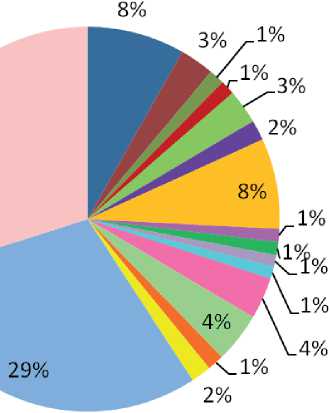
В результате анализа микробного сообщества воды исследуемого источника на уровне семейств/родов установлено преобладание представителей рода Flavobacterium (20 %) семейства Flavobacteriaceae (рис. 2). В сообществе донных осадков доля представителей Flavobacterium была ниже (2,9 %), но также входила в число доминантов (рис. 3). Flavobacterium широко распространены в различных средах умеренных и полярных регионов и являются одним из наиболее представленных родов в арктических и антарктических морских льдах [Liu et al., 2019].
-
■ unclassified Intrasporangiaceae
-
■ unclassified Microbacteriaceae
-
■ unclassified Micrococcaceae
-
■ Nocardioidaceae;Nocardioides
-
■ Chitinophagaceae;Ferruginibacter
Flavobacleriaceae;Flavobaclerium
-
■ Weeksei laceae;Chryseobacteri um
-
■ Sphingobacteriaceae;Pedobacter
-
■ unclassified Bacteroidia
-
■ Arcobacteraceae;Pseudarcobacter
-
■ Caulobacteraceae;Brevundimonas Devosiaceae;Devosia
-
■ unclassified Rhodobacteraceae
-
■ Sphingomonadaceae;Sphingomonas Sphingomonadaceae;Sphingorhabdus Comamonadaceae; Polaromonas unclassified Comamonadaceae unclassified Methylophilaceae
-
■ Oxalobacleraceae;Massilia unclassified Burkholderiales Methylomonadaceae;Metbvlobacter unclassified Methylomonadaceae
-
■ Xanlhomonadaceae;Arenimonas
Рис. 2. Таксономическое разнообразие микробного сообщества на уровне семейство/род в воде холодного источника Дабан-Горхон
DG sed

-
■ unclassified ntrasporangiaceae
-
■ unclassified Microbacteriaceae unclassified Micrococcaceae
-
■ Chitinophagaceae;Ferruginibacter Flavobacteriaceae;Flavobacterium
-
■ unclassified Bacteroidia Geobacteraceae;Geobacter
-
■ unclassified Geobacteraceae
-
■ Nitrospiraceae;Nilrospira
Coma monadaceae; Paucibacter Coma monadaceae; Polaromonas unclassified Comamonadaceae unclassified Burkholderiales
Methylomonadaceae;Methylobacter unclassified Methylomonadaceae Unclassified
Other
Рис. 3. Таксономическое разнообразие микробного сообщества на уровне семейство/род в донных осадках холодного источника Дабан-Горхон
В исследуемых сообществах были выявлены последовательности, установленные как представители семейства Comamonadaceae (5–10 %). Среди Comamonadaceae были определены представители рода Polaromonas . Характерно, что виды Polaromonas чаще всего связаны с холодными и/или бедными питательными веществами местообитаниями, включая ледниковые талые воды и отложения [Gawor et al., 2016]. В исследуемых сообществах также были обнаружены метанотрофы рода Methylobacter (3 % — DGwater, 1,5 % — DG_sed), ближайшие гомологи которых были выделены в основном из водно-болотных экосистем, характеризующихся низкими температурами и олиготрофностью [Chowdhury et al., 2013].
В сообществах воды и донных осадков источника Дабан-Горхон была выявлена значительная доля последовательностей, не классифицированных на разных таксономических уровнях. Высокий процент (1–8 %) был представлен актинобактериями семейств Intrasporangiaceae , Micrococcaceae , Microbacteriaceae . Также высокий процент в сообществах был отнесен к неклассифицированным — Burkholderiales (4 % в обоих сообществах). Однако в результате нашего анализа по базе данных NCBI и Ez Bio Cloud сиквенс, назначенный как « Gammaproteo-bacteria ; unclassified_Burkholderiales», был отнесен к Betaproteobacteria ; семейство Gallionellaceae . Известно, что семейство Gallionellaceae включает аэробные железоокисляющие бактерии, распространенные в местах выхода в ксилород-ную атмосферу анаэробных грунтовых вод, содержащих двухвалентное железо.
В микробном сообществе донных осадков была выявлена значительная доля бактерий рода Geobacter (7,6 %). Бактерии рода Geobacter способны восстанавливать трехвалентное железо [Nevin et al., 2005]. Для сообщества воды характерной особенностью была высокая представленность бактерий рода Brevundimonas семейства Caulobacteraceae (>3 %). Brevundimonas встречается в различных средах обитания, таких как почвы, глубокие подводные отложения, активный ил, черный песок, водные среды. Отмечено, что Brevundimonas активно развиваются и функционируют в олиготрофных условиях [Epova et al., 2022]
Проведенные исследования выявили в микробных сообществах воды и донных осадков источника Дабан-Горхон высокий процент неклассифицированных последовательностей (8–29 % unclassified), которые не имеют никакого сходства с известными последовательностями прокариот, доступными в базах данных.
Заключение
Источник Дабан-Горхон является постоянно холодным источником. Вода источника характеризуется как гидрокарбонатная, кальциево-магниево-натриевая с содержанием железа 2,16 мг/л.
Проведенные молекулярные исследования таксономического разнообразия микробных сообществ воды и донных осадков источника Дабан-Горхон выявили преобладание протеобактерий. Было установлено, что исследуемые микробные сообщества имеют как сходства, так и различия на уровне семейств.
Результаты исследования таксономического разнообразия микробного сообщества воды и донных осадков холодного источника Дабан-Горхон показали, что основу данных сообществ составляют бактерии, чьи ближайшие гомологи были обнаружены в низкотемпературных пресноводных экосистемах. Широкое распространение в исследуемых сообществах бактерий цикла железа вероятно связано с присутствием железа в воде. Большая доля неклассифицированных последовательностей в исследуемых сообществах предполагает высокий потенциал для выделения новых бактериальных таксонов.
Список литературы Таксономическое разнообразие микробного сообщества холодного железистого источника Дабан-Горхон (Витимское плоскогорье)
- Белькова Н. Л. Модифицированная методика выделения суммарной ДНК из водных проб и грунтовых вытяжек методом ферментативного лизиса. Молекулярно-генетические методы анализа микробных сообществ. Разнообразие микробных сообществ внутренних водоемов России: учебно-методическое пособие. Ярославль: Принтхаус, 2009. С. 53-83. Текст: непосредственный.
- Унифицированные методы анализа вод I под редакцией Ю. Ю. Лурье. Изд. 2. Москва: Химия, 1973. 378 с. Текст: непосредственный.
- Camacho A., Rochera C., Silvestre J. José, Vicente E., Hahn M. W. Spatial Dominance and Inorganic Carbon Assimilation by Conspicuous Autotrophic Biofilms in a Physical and Chemical Gradient of a Cold Sulfurous Spring: The Role of Differential Ecological Strategies. Microbial Ecology. 2005; 50: 172-184. doi:10.1007Is00248-004-0158-x
- Chaudhary A., Haack Sh. K., Duris J. W., MarshT. L. Bacterial and Archaeal Phylogenetic Diversity of a Cold Sulfur-Rich Spring on the Shoreline of Lake Erie, Michigan. Applied and Environmental Microbiology. 2009; 75(15): 5025-5038. doi:10.1128IAEM.00112-09
- Chowdhury T. R., Dick R. P. Ecology of Aerobic Methanotrophs in Controlling Methane Fluxes from Wetlands. Applied Soil Ecology. 2013; 65: 8-22. https://doi.org/10.1016/j. apsoil.2012.12.014
- Edgar R. C. Search and Clustering Orders of Magnitude Faster than BLAST. Bioinformatics. 2010; 26: 2460-2461.
- Edgar R. C. UPARSE: Highly Accurate OTU Sequences from Microbial Amplicon Reads. Nature Methods. 2013; 10: 996-998.
- Epova E. Y., Shevelev A. B., Akbayev R. M. et al. Heterotrophic Microbiota from the Oligotrophic Waters of Lake Vostok, Antarctica. International Journal of Environmental Research and Public Health. 2022; 19(7): 4025. doi:10.3390/ijerph19074025
- Gawor, J., Grzesiak, J., Sasin-Kurowska, J. et al. Evidence of Adaptation, Niche Separation and Microevolution within the Genus Polaromonas on Arctic and Antarctic Glacial Surfaces. Extremophiles. 2016; 20: 403-413. https://doi.org/10.1007/s00792-016-0831-0
- Guömundsdottir R., Kreiling A. K., Kristjansson B. K., Marteinsson V. &., Palsson S. Bacterial Diversity in Icelandic Cold Spring Sources and in Relation to the Groundwater Amphipod Crangonyxislandicus. PLoS One. 2019; 14(10): e0222527. doi:10.1371/journal. pone.0222527
- Hammer 0., Harper D. A. T., Ryan P. D. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica. 2001; 4(1): 1-9. http:// palaeo-electronica.org/2001_1/past/issue1_01.htm
- Klindworth A., Pruesse E., Schweer T., Peplies J., Quast C., Horn M., Glöckner F. O. Evaluation of General 16S Ribosomal RNA gene PCR Primers for Classical and Next-Generation Sequencing-Based Diversity Studies. Nucleic Acids Res. 2013; 41(1): e1. doi 10.1093/nar/gks808
- Li G., Jiang H., Hou W., Wang S., Huang L., Ren H., Deng S., Dong H. Microbial Diversity in Two Cold Springs on the Qinghai-Tibetan Plateau. Geosci. Front. 2012; 3: 317-325. doi:10.1016/j.gsf.2011.12.004.
- Liu Q., Liu H. C., Zhou Y. G., Xin Y. H. Microevolution and Adaptive Strategy of Psychrophilic Species Flavobacterium bomense sp. nov. Isolated From Glaciers. Frontiers in Microbiology. 2019; 10: 1069. doi: 10.3389/fmicb.2019.01069. PMID: 31178833; PMCID: PMC6538692.
- Margesin R., Miteva V. Diversity and ecology of psychrophilic microorganisms. Research in Microbiology. 2011; 162(3): 346-361. https://doi.org/10.1016Zj.resmic.2010.12.004
- Nevin K. P., Holmes D. E., Woodard T. L., Hinlein E. S., Ostendorf D. W., Lovley D. R. Geobacter bemidjiensis sp. nov. and Geobacter psychrophilus sp. nov., Two Novel Fe(Iii)-Reducing Subsurface Isolates. International Journal of Systematic and Evolutionary Microbiology. 2005; 55(Pt 4): 1667-1674. doi: 10.1099/ijs.0.63417-0. PMID: 16014499.
- Perreault N. N., Andersen D. T., Pollard W. H., Greer C. W., Whyte L. G. Characterization of the Prokaryotic Diversity in Cold Saline Perennial Springs of the Canadian High Arctic. Applied and Environmental Microbiology. 2007;. 73(5). P. 1532-1543. doi.org/10.1128/AEM.01729-06
- Perreault N. N., Greer C. W., Andersen D. T., Tille S., Lacrampe-Couloume G., Lollar B. Sh., Whyte, L. G. Heterotrophic and Autotrophic Microbial Populations in Cold Perennial Springs of the High Arctic. Applied and Environmental Microbiology. 2008; 74: 68986907. doi:10.1128/AEM.00359-08
- Rudolph C., Wanner G., Huber R. Natural Communities of Novel Archaea and Bacteria Growing in Cold Sulfurous Springs with a String-of-Pearls-Like Morphology. Applied and Environmental Microbiology. 2001; 67(5): 2336-2344. doi:10.1128/aem.67.5.2336-2344.2001.
- Siddiqui K. S., Cavicchioli R. Cold-Adapted Enzymes. Annual review of biochemistry. 2008; 75: 403-433. https://doi.org/10.1148/annurev.biochem.75.103004.142723
- Teixeira L. M., Merquior V L. C. The Family Moraxellaceae. In: Rosenberg E., DeLong E. F., Lory S., Stackebrandt E., Thompson F. (eds). The Prokaryotes. Springer, Berlin, Heidelberg, 2014. https://doi.org/10.1007/978-3-842-38922-1_245
- Willems A. The Family Comamonadaceae. The Prokaryotes: Alphaproteobacteria and Betaproteobacteria, 2013, pp. 777-851. 10.1007/978-3-642-30197-1_238.
- Zhang J., Kobert K., Flouri T., Stamatakis A. PEAR: a Fast and Accurate Illumina Paired-End reAd Merger. Bioinformatics. 2014; 30: 814-820.


