Таксономическое разнообразие микробного сообщества в различных термальных зонах горячего источника Гарга (Байкальская рифтовая зона)
Автор: Лаврентьева Е.В., Раднагуруева А.А., Иванов В.Л., Батурина О.А., Бархутова Д.Д.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 3 (25), 2023 года.
Бесплатный доступ
Изучено таксономическое разнообразие микробного сообщества микробных матов и донных осадков с использованием анализа ампликонов гена 16S рРНК. В данных образцах микробных матов доминировали Pseudomonadota, Cyanobacteriota, Icnovibacteriota, Chloroflexota и Deinococcota. С понижением температуры возрастает доля представителей Bacillota, Actinomycetota. В микробном сообществе донных осадков во всех изученных термальных зонах доминируют представители филумов Pseudomonadota, Bacteroidota, содоминантами в донных осадках являлись Bacillota. Проведенные исследования позволили установить таксономический состав и соотношение основных групп микроорганизмов в микробных сообществах микробных матов и донных осадков в горячем источнике Гарга.
Таксономическое разнообразие, 16s ррнк, температурные зоны, горячий источник, микробный мат, донные осадки, байкальская рифтовая зона
Короткий адрес: https://sciup.org/148328089
IDR: 148328089 | УДК: 579.26 | DOI: 10.18101/2542-0623-2023-3-58-67
Текст научной статьи Таксономическое разнообразие микробного сообщества в различных термальных зонах горячего источника Гарга (Байкальская рифтовая зона)
Сведения о разнообразии и структуре микробных сообществ в горячих источниках в настоящее время стремительно пополняются усилиями ученых со всего мира и благодаря современным подходам молекулярной экологии. Состав микробных сообществ и их разнообразие в наземных горячих источниках были изучены в Йеллоустонском национальном парке и Большом Бассейне, США [Klatt et al. 2011], Японии [Everroad et al. 2012], Исландии [Tobler and Benning 2011], Румынии [Coman et al. 2013], Китае [Wang et al. 2013; Song et al. 2013] и на Камчатке (Россия) [Бонч-Осмоловская и др., 1999; Гумеров и др., 2011]. Было показано, что различные физико-химические (температура, рН) и гидрохимические условия горячих источников определяют разнообразие и доминирующие группы микроорганизмов и влияют на структуру микробных сообществ.
Тем не менее все еще необходимы дополнительные исследования для изучения влияния температуры на численность, разнообразие и состав микробного сообщества при различных температурах.
Байкальский регион, где распространены экстремальные экосистемы с резко градиентными физико-химическими характеристиками, является уникальной нишей для экстремофильных микроорганизмов. Горячий источник Гарга находится в долине р. Гарга и расположен в отрогах Икатского хребта на высоте 674 м над уровнем моря. Участок выхода сложен водноледниковыми верхнечетвертичными отложениями, которые перекрывают палеозойские граниты и связаны с мощным Гаргинским разломом, протягивающимся в северо-восточном направлении на 30–40 км [Геохимическая деятельность... 2011].
Ранее проведенные исследования в горячем источнике Гарга традиционными микробиологическими и молекулярно-генетическими методами выявили разнообразие микробных сообществ — представителей основных функциональных групп микроорганизмов продуцентов и деструкторов органического вещества, активно осуществляющих геохимическую деятельность [Геохимическая деятельность... 2011, Розанов, 2017, Лаврентьева и др., 2017].
Цель данной работы — установить таксономическое разнообразие микробного сообщества в различных термальных зонах горячего источника Гарга.
Объекты и методы исследования
Высокотемпературный горячий источник Гарга расположен в отрогах Икат-ского хребта, окаймляющего котловину с восточной стороны (54°19ʹ203ʺ с. ш. 110°59ʹ646ʺ в. д.). Вода изливается в небольшую пещеру и далее, стекая по ручью, образует травертины высотой 1,5–2 м. В горячем источнике Гарга максимальная температура воды на изливе достигает 75 ºС, по течению термального ручья температура снижается до 30–36 ºС.
Для определения разнообразия микробного сообщества нами были определены следующие точки отбора образцов в температурных зонах: для микробных матов — температуры 65, 55 и 43 ºС; для донных осадков — 75, 55, 43 ºС. На местах отбора проб в воде были измерены рН и температура с помощью портативного рН метра рН-200 HM Digital (Южная Корея) с сенсорным термометром. Минерализацию определяли при помощи тест-кондуктометра TDS-4 (Сингапур).
Макрокомпонентный состав воды определяли с помощью гидрохимических методов в ЦКП ГИН СО РАН (г. Улан-Удэ). Микроэлементный состав донных осадков был определен методом ICP-MS на приборе высокого разрешения ELEMENT 2 (Finnigan MAT, США) в ЦКП ИГХ СО РАН (г. Иркутск).
Для молекулярно-генетического анализа пробы микробных матов и донных осадков отбирали в стерильные пластиковые 15 мл пробирки типа Falkon и фиксировали этанолом до конечной концентрации 50 % (об/об.). Пробы были доставлены в лабораторию в сухом льду и до выделения ДНК находились в холодильнике при + 4 ºС.
Выделение ДНК из микробных матов и донных осадков проводили с помощью набора DNeasy PowerSoil Kit (Qiagen, США) по протоколу производителя. Качественную и количественную оценку полученных препаратов ДНК проводили с помощью спектрофотометра Nanodrop 1000 (Thermo Fisher Scientific, США). Регион V3-V4 гена 16S рРНК был амплифициро-ван с помощью праймеров 343F (5’-CTCCTACGGRRSGCAGCAG-3’) и 806R (5’-GGACTACNVGGGTWTCTAAT-3’), содержащих адаптерные последовательности (Illumina), линкер и баркод [Fadrosh et al., 2014]. Амплификацию проводили в условиях, описанных ранее [Brouchkov et al., 2017]. Ампликоны смешивали по 200 нг каждый и чистили в 1 %-м агарозном геле с помощью набора MinElute Gel Extraction Kit (Qiagen). Секвенирование проводили в ЦКП «Геномика» СО РАН (ИХБФМ СО РАН) на секвенаторе MiSeq (Illumina), используя набор Reagent Kit v3 (2 × 300, Illumina).
Полученные парные последовательности анализировались с помощью UPARSE скриптов, используя Usearch v11.0 [Edgar, 2013]. Биоинформатическая обработка была проведена в ноябре 2017 г. и включала перекрывание парных ридов, фильтрацию по качеству и длине, учет одинаковых последовательностей, отбрасывание синглетонов, удаление химер и получение ОТЕ (Операционные таксономические единицы) с помощью алгоритма кластеризации UPARSE. Таксономическая принадлежность последовательностей OTU определялась с помощью SINTAX [Edgar, 2016] и референсной базы 16S RDP training set v16 [Wang et al., 2007].
Альфа-разнообразие анализировали Usearch. Серверы NCBI и EzBioCloud были использованы для поиска ближайших гомологов.
Результаты и обсуждение
Температура воды в трех местах отбора образцов микробных матов составила от 43 до 65 °С и донных осадков от 43 до 75 °С. Значение рН варьировали по течению горячего ручья от 8.2 до 9.0. Содержание сероводорода составило 0,46 мг/дм3. Вода источника относится к горячинскому типу сульфатно-натриевых кремнистых терм (рис. 1). Преобладание сульфатов натрия, содержание радона от 35 до 43 эман и небольшая минерализация до 1.0 г/л являются характерной особенностью источника Гарга.
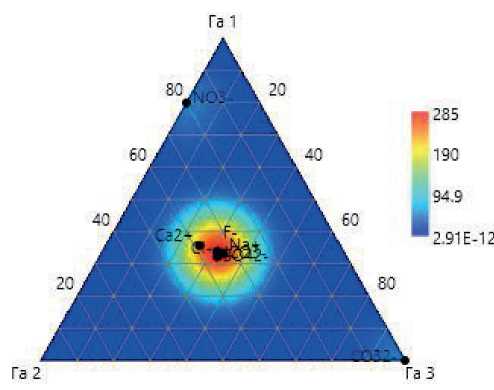
Рис. 1. Гидрохимическая характеристика воды в горячем источнике Гарга при различных температурах
Оценка индексов разнообразия по Шеннону и Симпсону выявила наибольшее разнообразие микробного сообщества в микробных матах, за исключением точки отбора Га 2 (табл. 1).
Таблица 1
Оценка разнообразия в микробных сообществах горячего источника Гарга
|
Индекс |
Га 1 65 °С мм |
Га 1 74 °С до |
Га 2 55 °С мм |
Га 2 55 °С до |
Га 3 43 °С мм |
Га 3 43 °С до |
|
Simpson |
1,0 |
0,7 |
0,4 |
0,6 |
1,0 |
0,7 |
|
Shannon |
3,3 |
1,8 |
1 |
2,1 |
2,9 |
2,3 |
Таксономический состав микробного сообщества
Высокопроизводительное секвенирование по гену 16S рРНК в термальном источнике Гарга показало, что домен Bacteria был доминирующим прокариотным компонентом по сравнению с доменом Archaea . На рисунке 2 показано относительное изобилие прокариотных филумов в микробном сообществе микробных матов и донных осадков. 13 доминирующих прокариотных филумов (> 1 %) было обнаружено в микробном сообществе микробных матов и донных осадков. Доминирующими членами сообщества микробного мата при температуре 65 °C были Pseudomonadota, Cyanobacteriota, Ignavibacteriota, Chloroflexota и Deinococcota . В термальной зоне 55 °С в составе микробного мата также доминировали представители филумов Pseudomonadota, Cyanobacteriota и Deinococcota, однако их относительное обилие было ниже. В термальной зоне 43 °С в микробном мате возрастает доля представителей Bacillota, Actinomycetota. В микробном сообществе донных осадков во всех изученных термальных зонах доминируют представители филумов Pseudomonadota, Bacteroidota , содоминантами в донных осадках являлись Bacillota.
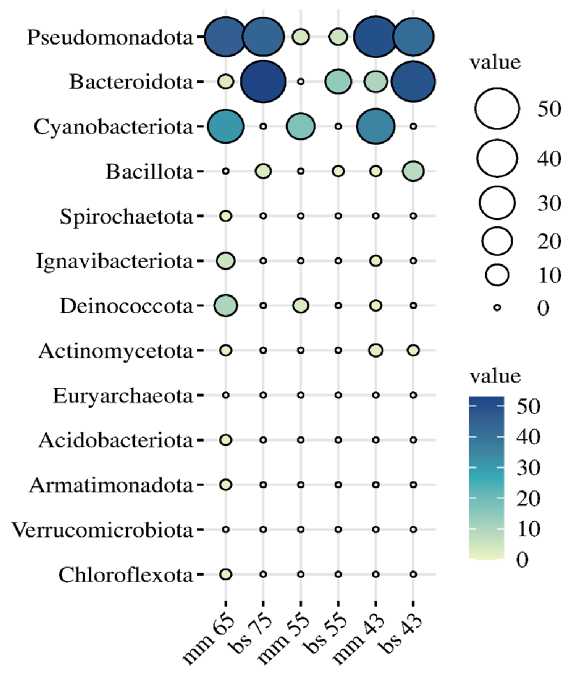
Рис. 2. Относительное обилие прокариотных филумов в микробном сообществе воды и донных осадков горячего источника Гарга
На уровне рода в микробном сообществе донных осадков доминировал Sediminibacterium — представитель филума Bacteroidota (рис. 3). Эти грамотри-цательные бактерии могут быть строгими или факультативными анаэробами или облигатными аэробами. Другим распространенным таксоном в донных осадках являлись представители бактерий Meiothermus . Эти бактерии обычно ответственны за аэробные процессы деструкции органического вещества в микробном сообществе в высокотемпературной зоне горячих источников.
В микробном сообществе микробных матов доминировали цианобактерии, для которых таксономия еще не назначена.
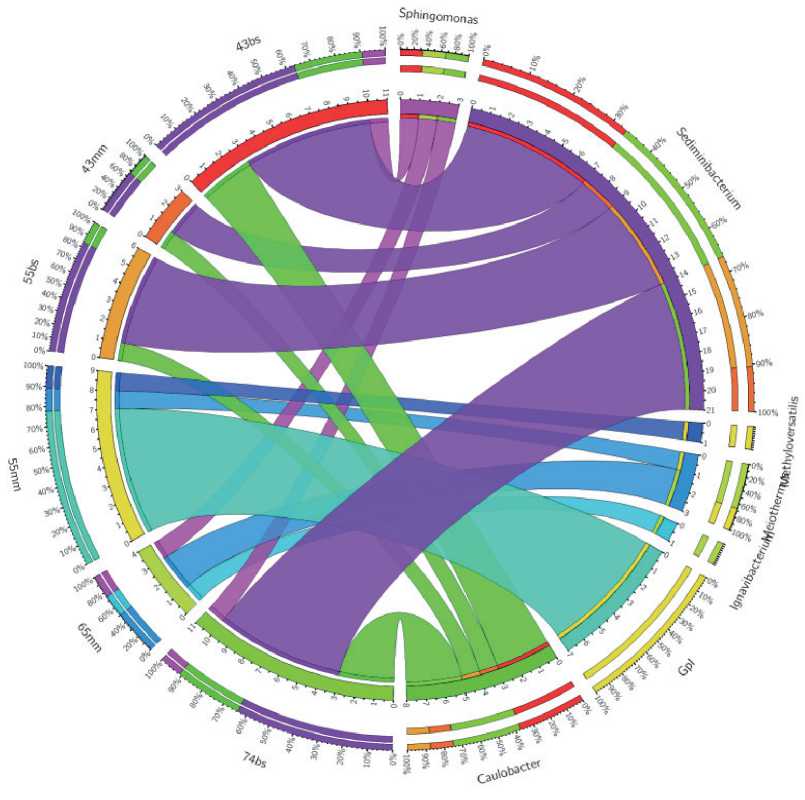
Рис. 3. Относительное обилие на родовом уровне в микробном сообществе микробных матов и донных осадков горячего источника Гарга
В ранее проведенных исследованиях было показано, что структура микробного мата представлена разнообразными филогенетическими группами мезофильных и термофильных бактерий с различными метаболическими и экологическими функциями. Наибольшую долю в сообществе составил филум Firmicutes/Bacillota [Лаврентьева и др., 2017].
В работе Розанова и др. (2017) было показано, что первичные продуценты в микробном мате представлены цианобактериями рода Leptolyngbya . Гетеротрофные микроорганизмы были в основном представлены актинобактериями и проте-обактериями. Планктомицеты, хлорфлекси и хлороби были в изобилии в среднем слое микробных матов, в то время как гетеротрофные микроорганизмы, представленные в основном фирмикутами (Clostridia, строгие анаэробы), и доминировали в нижней части микробного мата.
Оценка прокариотного разнообразия микробного сообщества
Для визуализации оценки количества общих и уникальных таксонов на уровне рода среди образцов микробных матов и донных осадков была использована диаграмма Венна (рис. 4). Общее число уникальных таксонов, обнаруженных в образцах микробных матов, составило от 6,9 % до 35 %. В донных осадках число уникальных таксонов составило от 5 до 20 %. Общие таксоны для образцов микробных матов составили 7 % и в донных осадках — 50 %.
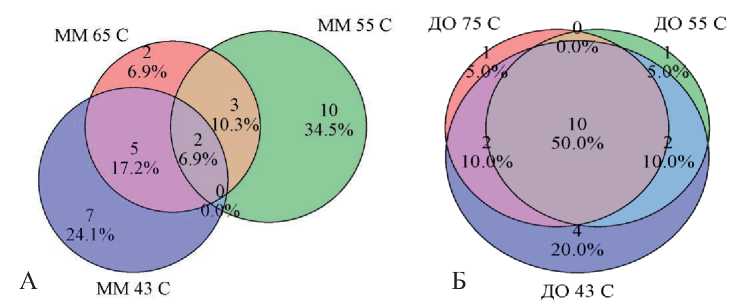
Рис. 4. Диаграмма Венна. Оценка количества общих и уникальных таксонов на уровне рода среди образцов микробных матов (А) и донных осадков (Б)
Таким образом, проведенные исследования позволили установить таксономический состав и соотношение основных групп микроорганизмов в микробных сообществах микробных матов и донных осадков в горячем источнике Гарга. Определяющим фактором в микробном мате, влияющим на видовое разнообразие, является температура. Общей чертой во всех изученных термальных зонах является присутствие существенной доли бактерий, участвующих на разных этапах в продукции и деструкции органического вещества в микробных матах и донных осадках. Большое количество филогенетически разнообразных, метаболически разнонаправленных групп свидетельствует о сбалансированном сложном сообществе, где каждая группа занимает свою экологическую нишу.
Результаты этого исследования расширяют наше понимание микробной экологии в горячем источнике Гарга.
Список литературы Таксономическое разнообразие микробного сообщества в различных термальных зонах горячего источника Гарга (Байкальская рифтовая зона)
- Геохимическая деятельность микроорганизмов гидротерм Байкальской рифтовой зоны / Б. Б. Намсараев, Д. Д. Бархутова, Э. В. Данилова [и др.]. Новосибирск: Гео, 2011. 302 с. Текст: непосредственный.
- Филогенетический анализ микробного мата в горячем источнике Гарга (Байкальская рифтовая зона) и разнообразие природных пептидаз / Е. В. Лаврентьева, А. А. Раднагуруева, Т. Г. Банзаракцаева [и др.] // Вавиловский журнал генетики и селекции. 2017. № 21(8). С. 959-963. DOI 10.18699/VJ17.319. Текст: непосредственный.
- Bonch-Osmolovskaya E. A., Miroshnichenko M. L., Slobodkin A. I. et al. Biodiversity of Anaerobic Lithotrophic Prokaryotes in Terrestrial Hot Springs of Kamchatka. Microbiology (Moscow). 1999; 68: 343-351.
- Bonch-Osmolovskaya E. A. Thermophilic Microorganisms: a general overview. Proc. Winogradsky Inst. Microbiol. In: V F. Galchenko (ed.) Thermophilic microorganisms. Moscow, 2011, pp. 5-14
- Brouchkov A., Kabilov M., Filippova S. et al. Bacterial Community in Ancient Permafrost Alluvium at the Mammoth Mountain (Eastern Siberia). Gene. 2017; 636: 48-53. https://doi. org/10.1016/j.gene.2017.09.021.
- Coman C., Druga B., Hegedus A. et al. Archaeal and Bacterial Diversity in Two Hot Spring Microbial Mats from a Geothermal Region in Romania. Extremophiles. 2013; 17: 523-534.
- Edgar R. C. UPARSE: Highly Accurate OTU Sequences from Microbial Amplicon Reads. Nat. Methods. 2013; 10: 996-998.
- Everroad R. C., Otaki H., Matsuura K., and Haruta S. Diversification of Bacterial Community Composition along a Temperature Gradient at a Thermal Spring. Microbes Environ. 2012; 27: 374-381.
- Fadrosh D. W., Ma B., Gajer P. et al. An Improved Dual-Indexing Approach for Multiplexed 16S rRNA Gene Sequencing on the Illumina MiSeq Platform. Microbiome. 2014; 2. Art. 6: 1-7. https://doi.org/10.1186/2049-2618-2-6
- Gumerov V M., Mardanov A. V., Beletsky A. V. et al. Molecular Analysis of Microbial diversity in the Zavarzin Spring, Uzon Caldera, Kamchatka. Microbiology (Moscow). 2011; 80: 244-251.
- Klatt C. G., Wood J. M., Rusch D. B. et al. Community Ecology of Hot Spring Cyanobacterial Mats: Predominant Populations and their Functional Potential. ISME J. 2011; 5: 1262-1278.
- Podar P. T., Yang Z., Bjornsdottir S. H., and Podar M. Comparative Analysis of Microbial Diversity across Temperature Gradients in Hot Springs from Yellowstone and Iceland. Front. Microbiol. 2020; 11: 1625. doi: 10.3389/fmicb.2020.01625.
- Rozanov A. S., Bryanskaya A. V., Ivanisenko T. V. et al. Biodiversity of the Microbial Mat of the Garga Hot Spring. BMC Evol Biol. 2017; Dec 28, 17(Suppl 2): 254. doi: 10.1186/ s12862-017-1106-9. PMID: 29297382; PMCID: PMC5751763.
- Song Z. Q., Wang F. P., Zhi X. Y. et al. Bacterial and Archaeal Diversities in Yunnan and Tibetan Hot Springs, China. Environ. Microbiol. 2013; 15(4): 1160-1175.
- Wang S., Hou W., Dong H. et al. Control of Temperature on Microbial Community Structure in Hot Springs of the Tibetan Plateau. PLoS One. 2013; 8(5): e62901.


