Тактика хирургического лечения глиобластом с различными МР-характеристиками
Автор: Лахина Ю.С., Гуляев Д.А., Красношлык П.В., Митрофанова Л.Б., Петров А.А., Белов И.Ю., Чиркин В.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Нейрохирургия
Статья в выпуске: 4 т.16, 2020 года.
Бесплатный доступ
Цель: обосновать необходимость применения интраоперационного мониторинга (ИОМ) для хирургического лечения глиобластом (ГБ) с различными магнитно-резонансными характеристиками. Материал и методы. Исследовано 59 пациентов 24-76 лет, оперированных по поводу ГБ. Выделено три группы наблюдения по типу ГБ: 1-я - без неконтрастируемой зоны (nCEZ) (л=18); 2-я - с неконтрастируемой частью, гиперинтенсивной в Т2 FLAIR-режиме, соответствующие Sawaya I (п=26); 3-я - с гиперинтенсивной в Т2 FLAIR-режиме зоной, соответствующие Sawaya II (л=15). Результаты. В 1-й и 3-й группах наблюдений у всех пациентов удалось достигнуть радикального удаления опухоли, вне зависимости от использования ИОМ. Во 2-й группе наблюдений тотального удаления удалось достичь в 69,2% случаев. Анализ безрецидивного периода в трех группах не выявил значимых отличий (р=0,05). Выявлена тенденция к увеличению безрецидивного периода при использовании ИОМ (р=0,07). Использование ИОМ значимо увеличивает общую выживаемость (р=0,04). Заключение. Применение ИОМ для хирургического лечения ГБ с nCEZ, инфильтрирующей функционально значимые зоны головного мозга, способствует радикальному удалению таких опухолей. Учитывая то, что ткань, соответствующая гиперинтенсивной области в режиме Т2 FLAIR содержит раковые стволовые клетки, имеет высокий по сравнению с другими компонентами опухоли потенциал и наиболее часто является источником для продолженного роста, тотальность ее резекции обеспечивает наиболее высокую продолжительность безрецидивного периода.
Глиобластома, неконтрастируемая зона глиобластомы, раковые стволовые клетки, функционально значимая зона глиобластомы
Короткий адрес: https://sciup.org/149135614
IDR: 149135614 | УДК: 616.831-006.484
Текст научной статьи Тактика хирургического лечения глиобластом с различными МР-характеристиками
1 Введение. Глиобластома — один из известных гистологических видов первичных злокачественных опухолей центральной нервной системы, для которого эффективность существующей комбинированной терапии не очевидна, а использование таргетного препарата, блокирующего универсальные пути онкогенеза, пока не доказано [1]. В создавшихся условиях большинство специалистов признает необходимость достижения максимально возможной циторедукции для увеличения продолжительности безрецидивного периода [2, 3]. Основным фактором, сдерживающим по-настоящему онкологическую резекцию рассматриваемых новообразований, является распространение опухоли в функционально значимые зоны (ФЗЗ) головного мозга, что наблюдается в более чем половине наблюдений [4-6]. В таких случаях для достижения оптимального онкофункционального баланса в современной нейрохирургии принято использовать дополнительные интраоперационные технологии: оптическую, магнитную и метаболическую навигацию, нейрофизиологический мониторинг (ИОМ), а также «awake surgery» [6]. Очевидно, что ценностные значения таких методик для опухолей с непохожим биологическим поведением будет различно [5]. Использование персонифицированного подхода к выбору той или иной методики в зависимости от локализации опухоли, ее гистологической структуры, цели хирургического лечения и особенностей конкретного больного может улучшить результаты лечения данной группы пациентов, с одной стороны, а с другой стороны, повысит экономическую целесообразность выполняемых вмешательств [7, 8].
Цель исследования — обосновать необходимость применения ИОМ для хирургического лечения ГБ с различными МРТ-характеристиками.
Материал и методы. В исследование вошло 59 наблюдений пациентов в возрасте от 24 до 76 лет, оперированных по поводу внутримозговых глиальных опухолей высокой степени злокачественности (ГБ), верифицированных гистологически. Средний возраст 55 лет (σ=12,6). Половое соотношение было в пользу женщин, доля которых составила 54,2% (32 наблюдения). Преимущественной локализацией опухоли стала теменная доля (32,2% случаев), расположение опухоли в лобной доле наблюдалось в 30,5% случаев, в височной — в 11,9%, в базальных ядрах — в 5,1 % случаев, комбинация указанных местоположений была представлена в единичных наблюдениях. Поражение обоих полушарий отмечалось в равном количестве наблюдений. Оценка клинической картины заболевания предполагала выявление очаговой неврологической симптоматики в виде синдромов раздражения и выпадения долей больших полушарий головного мозга, гипер-тензионного синдрома, а также оценку когнитивных функций на основании шкал MMSE (Краткая шкала оценки психического статуса — Mini-Mental State Examination) и MоCA (Монреальская когнитивная шкала — Montreal Cognitive Assessment), и проводилась предоперационно и в ранний послеоперационный период (до 10 суток). Пароксизмальный синдром выявлен у 32,2% пациентов (19), при этом у всех пациентов диагностированы приступы с фокальным началом с переходом в билатеральные тонико-клонические приступы (ILAE, 2017); моторные наруше-
ния были выявлены в 45,8% случаев, речевые нарушения — в 25,4% наблюдений. Оценка исходов хирургического лечения пациентов с эписиндромом проводилась по шкале Engel. Снижение когнитивных функций признавалось при оценке по шкале MоCA менее 26 баллов, и было выявлено у 86,4% пациентов. Функциональный статус пациентов оценивался на основании шкалы Карновского.
Во время предоперационного планирования на основании данных магнитно-резонансной томографии головного мозга на Т1-постконтрастных и Т2-FLAIR-изображений в трех взаимно перпендикулярных плоскостях (сагиттальной х поперечной х вертикальной) оценивались размеры опухоли в целом и отдельно ее гиперинтенсивной в T2-FLAIR-режиме, но неконтрастируемой части (nCEZ).
Нами было выделено три типа ГБ: ГБ без некон-трастируемой зоны (nCEZ) (18 наблюдений, 30,5% пациентов), опухоли, имеющие неконтрастируемую часть, гиперинтенсивную в Т2-FLAIR-режиме, соответствующие Sawaya I (26 пациентов, 44,1 %), и третья группа — опухоли, имеющие гиперинтенсивную в Т2-FLAIR-режиме зону, соответствующие Sawaya II (15 пациентов, 25,4%).
В первой группе ИОМ был выполнен у 15 пациентов (83,3%). Необходимо отметить, что в данной группе преобладали пациенты, у которых опухоль локализовалась в лобной доле (8 пациентов, 44,4%), при этом в 55,6% наблюдений поражено было доминантное полушарие. До операции моторный дефицит был в 38,9% случаев (7 пациентов), речевой — 16,7% (3 пациента). У 50% пациентов был выявлен пароксизмальный синдром. Когнитивные нарушения отмечались у подавляющего большинства пациентов (17), или в 94,4% случаев.
Во второй группе ИОМ выполнен у 22 пациентов (84,6%). Преимущественно поражение локализовалось в теменной доле — 8 наблюдений (30,8%), при этом 14 наблюдений (53,9%) были в недоминантном полушарии. Двигательные нарушения были выявлены в 50% случаев, речевые нарушения — у 38,5% пациентов. В данной группе пароксизмальный синдром был у 5 пациентов, что составило 19,2%. Когнитивные нарушения были обнаружены у подавляющего большинства пациентов (24 случая), что составило 92,3%.
В третьей группе ИОМ выполнен во время оперативного вмешательства в 8 случаях (53,3%), в данной группе преобладали мужчины, составившие 60%. В большинстве наблюдений опухоль поражала теменную долю (7 наблюдений, 46,7%), при этом в 53,33% случаев — доминантное полушарие. В неврологическом статусе моторный дефицит был в 7 наблюдениях (46,7%), речевой — в 2 (13,4%). Пароксизмальный синдром был установлен у 2 пациентов (13,3%). Когнитивные нарушения были выявлены у 10 пациентов (66,7%).
В процессе выполнения гистологической верификации операционного материала проводилось определение молекулярно-генетических параметров (IDH mt, метилирование промотора MGMT-гена) для последующего клинико-морфологического сопоставления. Использовался протокол F. B. Abreu et al. «IDH Ѕ RGQ PCR Kit» [9]. Опухолей, имеющих мутацию IDH-гена, в нашей серии было 3 (5,1%), что коррелировало со встречаемостью этого типа мутаций в мировой практике, одновременно с этим метилированный промотор гена MGMT был обнаружен в 19 случаях
(32,2%). Достоверных отличий групп по молекулярно-генетическим параметрам не было.
Интраоперационный мониторинг использовался в 45 (76,3%) операций. Выбор методики мониторинга осуществлялся на основании предоперационного планирования, и зависел в основном от биологического поведения опухоли, а именно преобладания процессов пролиферации и диффузии. В случае ГБ всегда предполагалось удаление en block, для чего формировалось широкое трепанационное окно на основании топографо-анатомических взаимоотношений, позволяющее визуализировать не только саму опухоль, ее неконтрастируемую зону, но и область центральных извилин, хорошо узнаваемые анатомические ориентиры (средняя линия, венозные коллекторы, вены сильвиевой группы, роландова вена). После проведения краниотомии и вскрытия твердой мозговой оболочки проводилась визуальная оценка коры для выявления инфильтрации ее опухолью и проводилось моторное картирование, а при помощи электрода Raabe проводился активный контроль целостности моторных проводящих путей.
Хирург стимулировал прецентральную кору с регистрацией моторных вызванных ответов на мышцах. Для получения моторных вызванных потенциалов (МВП) применялась техника Taniguchi [10]: стимул — пачка из четырех монофазных прямоугольных импульсов продолжительностью 0,3–0,5 мс, частотой 500 Гц. Начальная сила тока — 10 мА, повышение силы стимула — с шагом 3–5 мА до получения моторных ответов. Максимальная используемая сила тока — до 30 мА. В случае картирования мышц лица количество стимулов в одной пачке было три, т. к. при большем количестве возрастал риск перекрытия ответа от небольших мышц-эффекторов лица с очередным стимулом. При регистрации МВП фильтрация составляла от 30 до 3000 Гц, эпоха анализа — 100 мс, амплитуда на деление — 20–500 мкВ. Ответы, которые выявлялись при наименьшей силе электрической стимуляции, соответствовали расположению моторной зоны.
Статистическая обработка данных проводилась с использованием методов параметрического анализа в пакете компьютерных программ Statistica 10 (StatSoft Inc.) Для определения нормальности распределения использовались критерии Колмогорова — Смирнова. Все количественные показатели имели нормальное распределение, что предполагало объединение их в вариационные ряды, в которых проводился расчет средних арифметических величин ( М ), стандартных отклонений (σ), границ доверительного интервала — 95% ДИ. Номинальные данные описывались с указанием абсолютных значений и процентных долей.
При сравнении средних величин в нормально распределенных совокупностях количественных данных рассчитывался t -критерий Стьюдента. Полученные значения этого коэффициента оценивались путем сравнения с критическими значениями. Различия показателей считались статистически значимыми при уровне значимости p <0,05.
Результаты. В нашем исследовании радикальным признавалось удаление 100% контраст-нака-пливающей и контраст-ненакапливающей частей опухоли, субтотальным — удаление 100% контраст-накапливающей зоны и менее 53,2% контраст-нега-тивной зоны, частичным удалением — резекция исключительно контраст-накапливающей зоны.
В первой группе наблюдений ГБ, не имеющих nCEZ, у всех 18 пациентов удалось достигнуть радикального удаления опухоли, вне зависимости от использования ИОМ. Отмечалось незначительное нарастание моторного и речевого дефицита до 44,4% (8 человек) и 27,8% (5 человек) соответственно. При этом у 2 пациентов удалось достичь контроля за судорожными приступами по шкале Engel IA и у остальных 7 пациентов — I D. Необходимо также отметить, что когнитивная дисфункция сохранялась в послеоперационный период без значимого регресса интеллектуально-мнестических нарушений. При оценке качества жизни пациентов по шкале Карновского отмечалась положительная тенденция в виде увеличения среднего значения по шкале с 71,1 (о=6,8) до 75,6% (о=5,1). Продолженный рост опухоли в данной группе был выявлен в 72,2% случаев (13 наблюдений).
Во второй группе наблюдений ГБ, у которых nCEZ не распространялась в ФЗЗ, тотального удаления удалось достичь в 69,2% случаев, субтотального — в 23,1%, частичного — 7,7%. В ранний послеоперационный период несколько возросло количество пациентов с двигательными нарушениями — до 15 наблюдений (57,7%), и с речевыми — до 12 пациентов (46,2%). Применение ИОМ не оказало влияния на динамику моторного и речевого дефицита в группе, однако анализ радикальности удаления показал, что его отсутствие значимо повышало риск частичного удаления опухоли ( p =0,034). При оценке эффективности хирургического вмешательства по шкале Engel все 5 пациентов можно было отнести к IIА классу. Отмечалось, что количество пациентов с когнитивными нарушениями выросло до 96,15%. В данной группе была выявлена тенденция к повышению качества жизни в среднем с 68,5 (σ=6,75) до 72,21 (σ=6,52).
В третьей группе пациентов с ГБ, имеющими непосредственное распространение nCEZ на ФЗЗ, радикального удаления удалось достичь в 100% случаев. В ранний послеоперационный период количество больных с двигательными нарушениями снизилось до 3 (20%), с речевыми — до 5 человек (27,8%). При этом у всех пациентов с пароксизмами удалось достичь контроля за судорожными приступами по шкале Engel IA. Несмотря на общую благоприятную тенденцию к регрессу неврологического дефицита в этой группе также не было получено значимой корреляции с количество проводимых операций с использованием ИОМ. В послеоперационный период количество пациентов с интеллектуально-мнести-ческими нарушениями выросло до 25 (96,15%), что, очевидно, было связано с преобладанием в группе наблюдения пациентов с поражением доминантной теменной доли. При оценке качества жизни пациентов по шкале Карновского, так же как и в других группах, отмечалась тенденция к положительной динамике в виде увеличения среднего значения по шкале с 70,7 (о 5,94) до 74,7% (о=5,16).
Летальных исходов в ранний послеоперационный период в нашей серии пациентов не было. Катамнез составил 27 месяцев, в течение которого у 45 пациентов (76,3%), относящихся к наблюдениям ГБ, имеющих nCEZ, выявлен продолженный рост опухоли, 39 пациентов (66,1%) умерли от основного заболевания, 2 пациента (3,4%) — в связи с развившимися летальными тромбоэмболическими осложнениями в отдаленный послеоперационный период. Тромбоэмболические осложнения встречались как среди пациентов первой группы, так и второй, независимо от радикальности удаления. Все пациенты за период наблюдения получили стандартную однотипную адъювантную терапию.
Анализ безрецидивного периода в трех группах не выявил значимых отличий (рис. 1). Средняя продолжительность безрецидивного периода для группы ГБ, не имеющей nCEZ, составила 7,19 месяца (±1,2), для второй группы — 8,89 месяца (±0,5), для третьей — 6,8 месяца (±0,5).
Анализ общей выживаемости в группах показал значимо лучший прогноз для пациентов, у которых ГБ не имела nCEZ (рис. 2). OS для группы ГБ, не имеющей nCEZ, составила 11,3 месяца (± 1,2), для второй группы — 9,3 месяца (± 0,4), для третьей — 7,6 месяца (± 0,35).
Анализ значения ИОМ в оценке безрецидивного периода выявил тенденцию к увеличению продолжительности этого показателя при использовании ИОМ ( р =0,07) (рис. 3). Продолжительность безрецидив-ного периода для группы без применения ИОМ составила 5,4 месяца (± 0,1), применение ИОМ способствовало росту среднего значения безрецидивного периода до 8,4 месяца (± 0,15).
Оценка влияния использования ИОМ на общую выживаемость выявило значимое увеличение ее при использовании ИОМ ( р =0,04) (рис. 4). Для группы пациентов, у которых в ходе оперативного вмешательства использовался ИОМ, OS составила 10,5 месяца (± 0,5), в наблюдениях без ИОМ — 6,21 месяца (± 0,4).
Обсуждение. У больных всех трех групп был проведен анализ эффективности применения ИОМ в рамках оценки тотальности удаления, динамики послеоперационного неврологического дефицита, качества жизни и сроков продолжительности безре-цидивного периода и продолжительности жизни.
Для опухолей без nCEZ при оценке динамики моторных и речевых нарушений у пациентов в послеоперационный период не было выявлено достоверной корреляции c данными ИОМ и нарастанием неврологического дефицита. Этот факт мог быть объяснен с позиции того, что у таких пациентов еще на этапе планирования должно быть принято решение о тотальном удалении опухоли. Поскольку данная опухоль по сути разрушает проводящие пути белого вещества, что кардинально отличает ее от LGG, применение ИОМ с целью сохранения трактов как теоретически необоснованно, так и в разной степени прогностически не оправдано. В этих наблюдениях удаление опухоли проводилось по анатомическим ориентирам или с применением метаболической навигации.
Так же, как и в первой группе, для ГБ, у которых nCEZ не распространялась на ФЗЗ, ИОМ не оказал значимого влияния на динамику неврологического статуса. Исключение составили опухоли из третьей группы, у которых зона теоретической резекции может распространяться на так называемую зону перифокальных изменений, в которой находятся клетки, экспрессирующие CD133-белок, но еще сохранена нейронная и проводниковая архитектоника головного мозга [11]. Именно в этих случаях теоретически оправдано и прогностически целесообразно проведение ИОМ с целью тотальной резекцией этой зоны. Таким образом, удаление узловых ГБ по зоне контрастного накопления не требует ИОМ, а удаление ГБ с nCEZ требует применения функционального мониторинга.
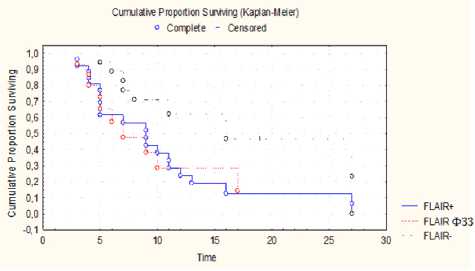
Рис. 1. Анализ безрецидивного периода в группах
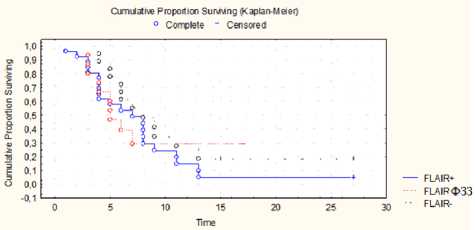
Рис. 2. Анализ общей выживаемости в группах
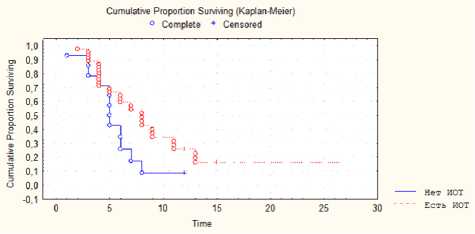
Рис. 3. Анализ значения интраоперационного мониторинга в оценке безрецидивного периода
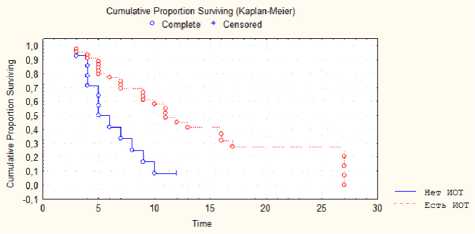
Рис. 4. Оценка влияния использования интраоперационного мониторинга на общую выживаемость
Анализ значения ИОМ в оценке безрецидивного периода выявил тенденцию к увеличению продолжительности этого показателя при использовании ИОМ (р=0,07). Данный факт мог стать результатом влияния ИОМ на радикальность удаления контраст-не-накапливающей зоны ГБ, являющейся, в сущности, наиболее агрессивным и склонным к формированию участков рецидива опухоли при продолженном росте. Таким образом, электрофизиологический контроль позволяет удалить nCEZ без усугубления неврологического дефицита, что увеличивает радикальность удаления, а соответственно, продолжительность без-рецидивного периода.
Отсутствие положительной корреляции объема удаления неконтрастируемой части и продолжительности безрецидивного периода, отмеченная во многих исследованиях, очевидно, связана с тем, что в нашем исследовании преобладают опухоли дикого типа IDH, с одной стороны. С другой стороны, еще A. L. Baldock et al. разделили GBM на «узловые» и «диффузные» на основе математического расчета «относительной инвазивности» [12]. Это исследование показало, что для узлового типа есть прямая зависимость показателей безрецидивного периода и продолжительности жизни от тотальной резекции, чего не было выявлено для диффузных. Таким образом, основную роль все же играет биологическое поведение опухоли, которое, однако, невозможно описать имеющимися в настоящее время генетическими параметрами, так как IDH m и метилирование промотора MGMT. Использование ИОМ позволяет увеличить радикальность удаления для опухолей с выраженной неконтрастируемой частью, распространяющейся в ФЗЗ головного мозга, а также способствует увеличению продолжительности жизни таких пациентов.
Отсутствие отрицательной динамики в неврологическом статусе у пациентов с ГБ, распространяющимися в ФЗЗ, даже при радикальном удалении, можно было объяснить тем, что опухоль, скорее всего, располагалась не в непосредственно анатомически признанной моторной коре, а в мостиках, соединяющих извилины (pli de passage), что способствовало сохранению моторных проводников.
С нашей точки зрения, отсутствие значимой зависимости между безрецидивным периодом и продолжительностью жизни могло быть связано с небольшой выборкой и тем, что на безрецидивный период влияет не только биологическое поведение опухоли, но и другие факторы, например опыт хирурга и время установления факта продолженного роста. Если в двух группах удалось достичь 100% радикальности удаления, то в группе с гиперинтенсивной кон-траст-негативной зоной в режиме FLAIR, соответствующей Sawaya I, радиальность составила всего 69,2%, что нивелировало преимущества по сравнению с другими группами и со средними показателями для популяции в работах, не учитывающих важность этого фрагмента HGG.
Анализ общей выживаемости в группах показал значимо лучший прогноз для пациентов, у которых ГБ не имела контраст не накапливающей зоны. С одной стороны, данный факт был связан с достижением тотальности удаления опухоли в 100% наблюдений радикальности в группе, что было обусловлено предоперационным планированием. С другой стороны, отсутствие гиперинтенсивного в режиме Т2-FLAIR участка в структуре HGG, как известно, содержащего плюрипотентные химио- и радиорезистентные клетки, могло быть связано с менее агрессивным биологическим поведением опухоли [13].
Заключение. Полученные результаты подтверждают необходимость радикального удаления не только контраст-накапливающей части, но и неконтра-стируемой зоны опухоли. Учитывая то, что ткань, соответствующая гиперинтенсивной области в режиме Т2-FLAIR, содержит раковые стволовые, имеет высокий по сравнению с другими компонентами опухоли потенциал и наиболее часто является источником для продолженного роста, тотальность ее резекции обеспечивает наиболее высокую продолжительность безрецидивного периода, а применение ИОМ способствует радикальному удалению опухолей с nCEZ, которая инфильтрирует ФЗЗ головного мозга.
Список литературы Тактика хирургического лечения глиобластом с различными МР-характеристиками
- Wang H, Xu T, Jiang Y, et al. The challenges and the promise of molecular targeted therapy in malignant gliomas. Neoplasia 2015; 17 (3): 239–55.
- Burger PC, Vogel FS, Green SB, Strike TA. Glioblastoma multiforme and anaplastic astrocytoma. Pathologic criteria and prognostic implications. Cancer 1985; 56 (5): 1106–11.
- Stummer W, Reulen HJ, Meinel T, et al. ALA-Glioma Study Group. Extent of resection and survival in glioblastoma multiforme: identification of and adjustment for bias. Neurosurgery 2008; 62 (3): 564–76.
- De Witt Hamer PC, Robles SG, Zwinderman AH, et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol 2012; 30 (20): 2559–65.
- Lacroix M, Abi-Said D, Fourney DR, et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg 2001; 95 (2): 190– 8.
- Lang FF, Sawaya R, Suki D, et al. Glioblastoma resection. J Neurosurg 2012; 116 (5): 1166–7.
- Eljamel MS, Mahboob SO. The effectiveness and cost-effectiveness of intraoperative imaging in high-grade glioma resection; a comparative review of intraoperative ALA, fluorescein, ultrasound and MRI. Photodiagnosis Photodyn Ther 2016; (16): 35–43.
- Gerritsen JKW, Arends L, Klimek M, et al. Impact of intraoperative stimulation mapping on high-grade glioma surgery outcome: a meta-analysis. Acta Neurochir (Wien) 2019; 161 (1): 99–107.
- Abreu FB de, Gallagher TL, Liu EZ, Tsongalis GJ. Determining methylation status of methylguanine DNA methyl transferase (MGMT) from formalin-fixed, paraffin embedded tumor tissue. Methods X 2014; (1): 42–8.
- Szelényi A, Senft C, Jardan M, et al. Intra-operative subcortical electrical stimulation: a comparison of two methods. Clin Neurophysiol 2011; 122 (7): 1470–5.
- Altrock PM, Liu LL, Michor F. The mathematics of cancer: integrating quantitative models. Nat Rev Cancer 2015; 15 (12): 730–45.
- Baldock AL, Rockne RC, Boone AD, et al. From patientspecific mathematical neuro-oncology to precision medicine. Front Oncol. 2013; 62 (3): 1–11.
- Altmann C, Keller S, Schmidt MHH. The Role of SVZ Stem Cells in Glioblastoma. Cancers (Basel) 2019; 11 (4): 448.


