Тактика хирургического лечения при метастатическом поражении верхнешейного отдела позвоночника
Автор: Бажанов С.П., Гуляев Д.А., Ульянов В.Ю., Островский В.В., Толкачев B.C.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 3 т.14, 2018 года.
Бесплатный доступ
Продемонстрирован случай успешного хирургического лечения пациента с метастатическим поражением верхнешейного отдела позвоночника с учетом концепции мульдидисциплинарного подхода. Проведено одномоментное двухэтапное хирургическое вмешательство: первым этапом выполнен окципитоспондилодез полисегментарной конструкцией; вторым — удаление опухоли из расширенного комбинированного доступа. Установлено, что предлагаемая тактика хирургического лечения позволяет осуществить радикальное вмешательство в одну хирургическую сессию без нарастания неврологического дефицита в послеоперационном периоде.
Верхнешейный отдел, метастатическая опухоль, позвоночник, тактика, хирургическое вмешательство
Короткий адрес: https://sciup.org/149135132
IDR: 149135132
Текст научной статьи Тактика хирургического лечения при метастатическом поражении верхнешейного отдела позвоночника
данные свидетельствуют о разнонаправленности и противоречивости методик хирургического лечения пациентов с метастатическим поражением верхнешейного отдела позвоночника, однако большинство авторов склоняются к необходимости осуществления оперативных вмешательств из расширенных комбинированных доступов, соответствующих концепции современной онкологической хирургии [5, 6]. При этом мультидисциплинарный подход, основанный на совместном сотрудничестве нейрохирурга со смежными специалистами при выполнении подобных операций, является наиболее целесообразным [7–9].
Цель: продемонстрировать возможность одномоментного двухэтапного хирургического лечения пациента с метастатическим поражением верхнешейного отдела позвоночника.
Описание клинического случая. Проведен анализ данных медицинской карты стационарного больного, находившегося на лечении в отделении нейрохирургии НИИТОН СГМУ. Пациент К. 55 лет поступил на стационарное лечение в отделение нейрохирургии НИИТОН СГМУ с направительным диагнозом: метастатическое поражение структур 2-го шейного позвонка с синдромом острой атлантоаксиальной нестабильности. Жалобы при поступлении на боль и ограничение движений в шейном отделе позвоночника, невозможность удерживать голову (со слов пациента «голову приходится поддерживать обеими руками»), затруднение при глотании твердой пищи, слабость в верхних и нижних конечностях. Из анамнеза известно, что ранее больному было выполнено хирургическое вмешательство по поводу низкодифференцированного рака мочевого пузыря. Была проведена цистпростатвезикулэктомия с расширенной подвздошно-паховой лимфодиссекцией и формированием илеокондуита по методике Бриккера. Какая-либо адъювантная терапия не осуществлялась. Через 3 месяца с момента хирургического вмешательства стал отмечать перечисленные жалобы, связанные с дисфункцией в шейном отделе позвоночника, позже присоединились признаки дисфагии. Проведено комплексное клинико-интраскопическое обследование на предмет выявления отдаленных метастазов, в том числе позитронно-эмиссионное сканирование в режиме «весь организм», верифицировано интенсивное накопление радиофармпрепарата (2-фтор-2-дезокси-D-глюкоза) в области заглоточного пространства на уровне С1-С2 позвонков. Других патологических очагов накопления радиофармпрепарата выявлено не было.
При объективном осмотре отмечалось ограничение подвижности шейного отдела позвоночника во всех плоскостях. В неврологическом статусе оценка по шкале Karnovsky 70 баллов. Отмечалась гипе-стезия в зоне иннервации корешков спинномозговых нервов, отходящих на уровне С1-С2 позвонков с обеих сторон. Проводниковые расстройства были представлены тетрапарезом до 4 баллов в верхних и нижних конечностях, нарушением чувствительности по спинально-проводниковому типу с уровня С2 сегментов с обеих сторон.
На компьютерных томограммах верхнешейного отдела позвоночника, выполненных в предоперационном периоде, отмечаются значительные остеолитические вторичные изменения в структурах С2 позвонка с формированием обширного мягкотканого компонента, деформирующего заднюю стенку глотки с распространением патологической ткани в просвет позвоночного канала и компрессией твердой мозговой оболочки (рис. 1).
Учитывая массивную зону опухолевой деструкции костно-связочного аппарата верхнешейного отдела позвоночника с вовлечением в неопластический процесс передней дуги атланта, тела и зуба С2 позвонка, а также паравертебральных тканей, было принято решение об одномоментном двухэтапном хирургическом лечении: первым этапом выполнен окципитоспондилодез полисегментарной системой; вторым — удаление опухоли С2 позвонка из расширенного трансмандибулярного циркумглоссально-ре-трофарингеального доступа.
Полисегментарный окципитоспондилодез с трансфасеточной фиксацией полиаксиальными винтами осуществляли в положении пациента на животе в условиях жесткой трехточечной фиксации шейного отдела позвоночника в скобе Mayfield-Kees (рис. 2).
Второй этап хирургического вмешательства проводили с участием челюстно-лицевого хирурга. Предоперационную разметку трансмандибулярного циркумглоссально-ретрофарингеального доступа проводили по методике, предложенной DeMonte F. и соавт. (2001) (рис. 3).
Техника хирургического вмешательства представлена следующим образом: после установки назога-
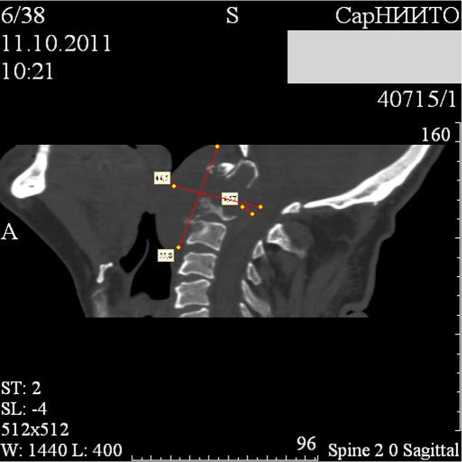
Рис. 1. Остеолитические изменения в структурах С2 позвонка с мягкотканым компонентом, деформирующим заднюю стенку глотки
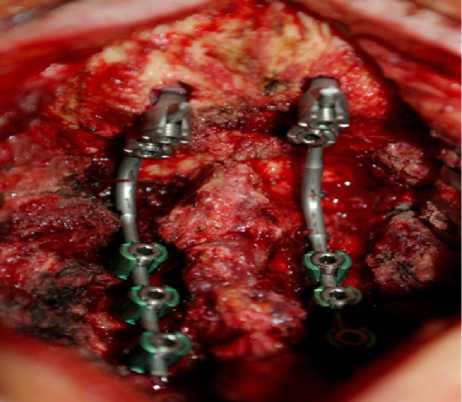
Рис. 2. Окципитоспондилодез полисегментарной конструкцией
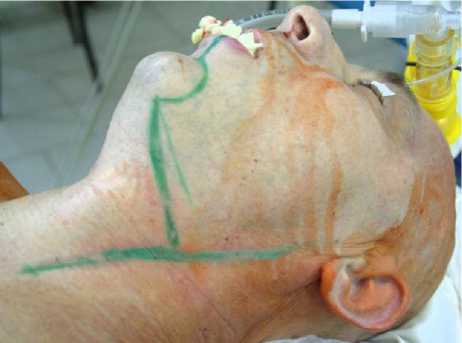
Рис. 3. Предоперационная разметка разреза мягких тканей при осуществлении хирургического доступа по методике DeMonte F. и соавт. (2001)
стрального зонда в положении пациента на спине производили разрез кожи и подкожно-жировой клетчатки по переднему краю грудино-ключично-сосцевидной мышцы от угла нижней челюсти и до уровня перстневидного хряща. Производили мягкотканую диссекцию с обнажением влагалища грудино-ключично-сосцевидной мышцы и пересечением левой лопаточно-подъязычной мышцы, мобилизовывали сосудисто-нервный пучок в сонном и лопаточно-трахеальном треугольниках шеи. Далее разрез продлевали вверх до уровня поднижнечелюстного треугольника, а также вокруг левой полуокружности подбородка на середину нижней губы, осуществляли мобилизацию поднижнечелюстного футляра с поднижнечелюстной железой. По возможности на всем протяжении мобилизовывали ствол левого подъязычного нерва, лигировали общую лицевую вену и лицевую артерию. Для создания более широкого хирургического подхода к срединным образованиям шеи производили диссекцию мышц от подъязычной кости (заднее брюшко двубрюшной мышцы, шило-подъязычную мышцу).
Следующим этапом операции выполняли срединную ступенчатую остеотомию тела нижней челюсти с предварительным наложением титановых мини-пластин для облегчения последующего сопоставления рассеченных фрагментов нижней челюсти. После медианного разъединения фрагментов тела нижней челюсти приступали к внутриротовому этапу вмешательства, а именно препарированию структур дна полости рта. Осуществляли инцизию в месте перехода слизистой оболочки дна рта в слизистую языка, а далее разрез продолжали по внутренней поверхности крыловидно-челюстной складки до бугра верхней челюсти. Выделяли язычный нерв, после чего рассекали мышцы дна полости рта. Отводили единый костно-мягкотканый лоскут нижней трети лица кверху, что позволяло создать оптимальный обзор всей площади хирургического вмешательства с оптимальным углом операционного действия. Срединно расположенные висцеральные структуры шеи смещали от вентральной поверхности шейного отдела позвоночника в медиальную сторону, внутреннюю сонную артерию и внутреннюю яремную вену мобилизовывали вплоть до наружного основания черепа, а именно до входа в наружное отверстие сонного канала и яремное отверстие соответственно. После мобилизации вентральной поверхности шейного отдела позвоночника под оптическим увеличением производили дискэктомию на уровне С2-С3 позвонков до задней продольной связки. Опухоль на уровне С1-С2 позвонков удаляли единым блоком, в том числе с использованием высокотехнологичных моторных систем, предназначенных для резекции костных структур (высокооборотный бор, костный дезинтегратор). С целью повышения абластичности вмешательства производили иссечение задней продольной связки на уровне С1-С2 позвонков вплоть до интактной твердой мозговой оболочки (рис. 4).
Для повышения радикальности вмешательства производили максимальное удаление эпидуральной клетчатки вместе с эпидуральными венами. В случае повреждения твердой мозговой оболочки выполняли ушивание ее дефекта, с дополнительной пластикой медицинским клеем для профилактики ликвореи, а также уменьшения риска развития имплантационных метастазов по ликворной системе. После завершения основного этапа вмешательства выполняли дренирование зоны оперативного вмешательства,
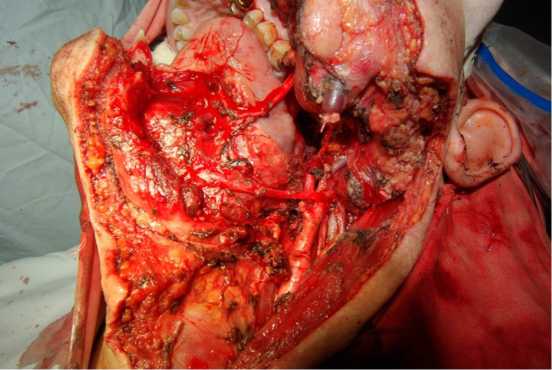
Рис. 4. Трансмандибулярный паралингвальный ретрофарин-геальный доступ к верхнешейному отделу позвоночника по методике DeMonte F. и соавт. (2001)
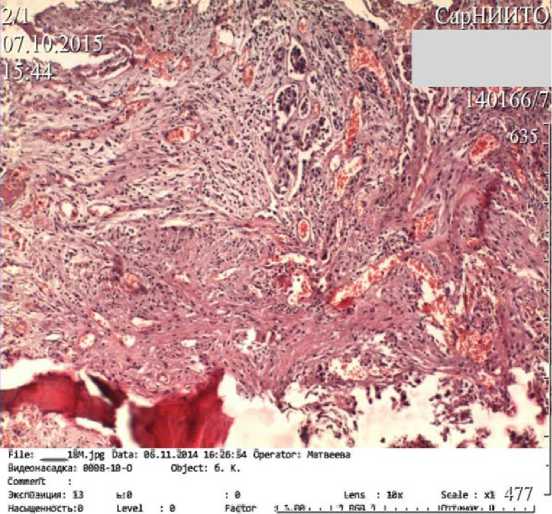
Рис. 5. Гистологическая картина операционного материала остеосинтез нижней челюсти микропластинами, послойное ушивание мягких тканей.
Операционный материал был отправлен на гистологическое исследование: среди фиброзной стромы с большим количеством полнокровных сосудов, воспалением и некрозами отмечены комплексы опухолевых клеток вытянутой формы, напоминающие переходный эпителий с формированием сосочковых структур, что свидетельствовало о метастазе рака мочевого пузыря (рис. 5).
Послеоперационный период протекал без осложнений, оценка по шкале Karnovsky 80 баллов, отмечен полный регресс двигательных и чувствительных расстройств, зона гипестезии по корешковому типу была сохранена на дооперационном уровне. После удаления назогастрального зонда отмечен регресс дисфагии. Швы в зонах дорсального и вентрального доступов были сняты на 14-е сутки, натяжение первичное. В качестве медикаментозной терапии, проводимой в послеоперационном периоде, применяли нестероидные противовоспалительные препараты и антибиотики широкого спектра действия в профилактических дозировках на срок не более 5 дней.
На 15-е сутки после хирургического вмешательства пациент был выписан из нейрохирургического стационара и представлен на онкологический консилиум для решения вопроса о дальнейшем проведении адъювантной терапии.
Обсуждение . Согласно данным [10], тактика одномоментного двухэтапного хирургического лечения позволяет осуществить радикальное хирургическое вмешательство в одну хирургическую сессию с привлечением смежных специалистов. Расширенный трансмандибулярный-циркумглоссальный-ретро-фарингеальный доступ позволил нам осуществить оптимальный обзор верхних отделов пара- и ретро-фарингеального пространств, а также области носоглотки, что создало адекватный угол операционного действия в этих труднодоступных анатомических зонах, необходимый для осуществления полноценной диссекции магистральных сосудов шеи и важных в функциональном отношении нервных стволов. Это дает возможность радикально удалить патологический очаг в структурах С1-С2 позвонков с учетом принципов абластики.
Заключение. Мультидисциплинарный подход в случае хирургического лечения пациентов с вторичными злокачественными опухолями области верхнешейного отдела позвоночника и краниовертебрального перехода позволяет радикально и с наименьшим риском развития неврологического дефицита в послеоперационном периоде удалить опухоль из подобных труднодоступных топографо-анатомических зон.
Список литературы Тактика хирургического лечения при метастатическом поражении верхнешейного отдела позвоночника
- Кушель Ю.В. Анатомо-хирургическое обоснование трансмандибулярного ретрофарингеального и трансцервикального ретрофарингеального доступов к основанию черепа: дис.... канд. мед. наук. М., 1999; 163 с.
- DeMonte F, Diaz Е, Callender D, et al. Transmandibular, circumglossal, retropharyngeal approach far chordomas of the clivus and upper cervical spine. Neurosurg focus 2001; 10 (3), Article 10: 1
- La Corte E., Aldana PR. Endoscopic approach to the upper cervical spine and clivus: an anatomical study of the upperlimits of the transoral corridor. Acta Neurochir (Wien) 2017 Apr; 159(4) 633-9. DOI: 10.1007/S00701-017-3103-6
- Hutchinson IL. The hazard of mandibulotomy in an irradiated field. Oral Dis 1997; 3 (2): 64
- Infante-Cossio P, Torres-Carranza E, Cayuela A, et al. Impact of treatment on quality of life for oral and oropharyngeal carcinoma. Int j oral maxillofac surg 2009; 38: 1052-8
- Infante-Cossio P, Torres-Carranza E, Cayuela A. Quality of life in patients with oral and oropharyngeal cancer. Int j oral maxillofac surg 2009; 38: 250-5
- Jalil MFA, Story RD, Rogers M. Extended maxillotomy for skull base access in contemporary management of chordomas: Rationale and technical aspect. Journal of clinical neuroscience 2017; (39): 212-5. DOI: 10.1016/j.jocn.2017.01.031
- James D, Crockard HA. Surgical access to the base of the skull and upper cervical spine by extended maxillotomy. Neurosurgery 1999; 29: 411-6
- Janecka IP, Sekhar L, Jones N, et al. Treatment of cancer of the skull base. In: Fee W, Goepfert H, Johns M, eds.Head neck cancer. New York: ВС Decker, 1990; p. 382-4
- Valentini V, Cassoni A, Battisti A, Gennaro P, lannetti G. Transmandibular Approaches. In: Cranial, craniofacial and skull base surgery. New York: Springer, 2010; 319-29. DOI: 10.1007/978-88-470-1167-0_24


