Тебуконазол регулирует состав жирных кислот этиолированных проростков озимой пшеницы
Автор: Корсукова А.В., Горностай Т.Г., Грабельныч О.И., Дорофеев Н.В., Побежимова Т.П., Соколова Н.А., Дударева Л.В., Войников В.К.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.12, 2016 года.
Бесплатный доступ
Изучен состав жирных кислот побегов неочищенных и закаленных до холодных этиолированных проростков озимой пшеницы, выращенных из семян, обработанных защитным средством на основе тебуконазола «Бункер» (содержание тебуконазола 60 г на литр, г / л), и устойчивость к морозостойкости сеянцев , Показано, что обработка семян озимой пшеницы препаратом «Бункер» (1,5 микролитра на грамм семян, мкл / г) сопровождается увеличением ненасыщенности жирных кислот в побегах и увеличением проростков морозостойкостью (- 8 ° C, 24 часа). Наиболее выраженное снижение содержания насыщенной пальмитиновой кислоты и увеличение содержания ненасыщенной α-линоленовой кислоты наблюдалось при холодном упрочнении проростков озимой пшеницы, выращенных из семян, обработанных защитным средством на основе тебуконазола. Сделан вывод о том, что обработка семян защитным средством на основе тебуконазола вызывает изменение состава жирных кислот саженцев озимой пшеницы для повышения их морозостойкости.
Короткий адрес: https://sciup.org/14323993
IDR: 14323993
Текст научной статьи Тебуконазол регулирует состав жирных кислот этиолированных проростков озимой пшеницы
Низкотемпературная адаптация морозостойких травянистых растений характеризуется структурными перестройками клеточных мембран, благодаря которым минимизируется риск их повреждения внеклеточным льдом, увеличивается текучесть липидного бислоя мембран и снижается температура его фазового перехода из жидкокристаллического в гелеобразное состояние, увеличивается проницаемость мембран для оттока воды в межклетники, что предотвращает внутриклеточное льдообразование (Khochachka and Somero, 1988; Vereshchagin, 2007; Trunova, 2007). Изменение жирнокислотного состава мембранных липидов при холодовом закаливании заключается в увеличении содержания мононенасыщенных и полиненасыщенных жирных кислот (МНЖК и ПНЖК) (Vereshchagin, 2007; Makarenko et al. , 2010). Считается, что наибольшее значение при низкотемпературной адаптации злаков имеет увеличение содержания ПНЖК – α-линоленовой кислоты (Vereshchagin, 2007). Увеличение степени ненасыщенности жирных кислот связано с работой ацил-липидных десатураз (Los', 2014). Показано, что к увеличению активности данных ферментов может приводить обработка растений экзогенной абсцизовой кислотой (АБК), которая совместно с низкотемпературным закаливанием ещё в большей степени усиливает десатуразную активность (Bakht et al. , 2006). В литературе имеются данные, что производные 1,2,4-триазола – ингибиторы синтеза стеринов и терпеноидов – приводят к повышению содержания эндогенной АБК (Prusakova and Chizhova, 1998; Chizhova et al. , 2005).
Ранее нами было показано, что обработка семян озимой пшеницы производным 1,2,4-триазола – тебуконазолом ((1-(4-хлорфенил)-4,4-диметил-3-(1H-1,2,4-триазол-1-илметил)-3-пентанол)) приводит к ингибированию ростовых процессов у этиолированных проростков озимой пшеницы, индукции синтеза низкомолекулярных дегидринов и повышению морозоустойчивости проростков (Korsukova et al. , 2015). Поскольку производные 1,2,4-триазола вызывают повышение содержания АБК, которая в свою очередь увеличивает активность десатураз, что приводит к увеличению ненасыщенности жирных кислот в составе липидов, можно предположить, что тебуконазол-содержащий препарат способен оказывать влияние на жирнокислотный состав липидов, повышая устойчивость проростков озимой пшеницы к низким температурам.
В связи с этим в настоящей работе изучалось влияние обработки семян тебуконазол-содержащим препаратом «Бункер» на жирнокислотный состав побегов этиолированных проростков озимой пшеницы. MATERIALS AND METHODS
В работе использовали этиолированные проростки озимой пшеницы ( Triticum aestivum L., сорт «Иркутская»). Семена обрабатывали тебуконазол-содержащим протравителем семян (водносуспензионный концентрат) «Бункер» (1,5 мкл/г семян) – системным фунгицидом профилактического и лечебного действия фирмы «Август» (Россия), содержание тебуконазола в препарате 60 г/л. Семена проращивали на влажной фильтровальной бумаге на воде в темноте при 24 °С в течение 3-х суток.
Холодовое закаливание 3-х суточных этиолированных проростков из необработанных и обработанных препаратом «Бункер» семян проводили в течение 7-ми суток при температуре 2 °С в камере тепла/холода MKT-240 (ЦКП СИФИБР СО РАН «Фитотрон»).
Для определения морозоустойчивости холодозакалённые этиолированные проростки из необработанных и обработанных препаратом «Бункер» семян промораживали при температуре -8 °С в течение 24 ч. Затем проростки оттаивали при 2 °С в течение суток, после чего оставляли растения отрастать в темноте при 24 °С в течение 7-и суток. Количество выживших после промораживания проростков выражали в процентах от общего числа проростков.
Для изучения жирнокислотного состава анализировали метиловые эфиры жирных кислот (МЭЖК). Исследуемый материал по 1 г замораживали в жидком азоте и хранили при –80 °С. Затем образцы растирали в ступке с жидким азотом до порошкообразного состояния. Экстракцию липидов, получение и анализ МЭЖК проводили по ранее описанной методике (Grabel’nykh et al. , 2014). Хлороформные экстракты липидов хранили при -20 °C с добавлением ионола до концентрации 0,05% (Keits, 1975). Анализ МЭЖК проводили методом газовой хроматографии-масс-спектрометрии 5973/6890N MSD/DS (“Agilent Technologies”, США). Детектор – квадрупольный масс-спектрометр, способ ионизации – электронный удар, энергия ионизации – 70 эВ; анализ проводили в режиме регистрации полного ионного тока. Для разделения смеси МЭЖК использовали капиллярную колонку HP-INNOWAX (30
м × 250 мкм × 0,50 мкм) со стационарной фазой (ПЭГ). Газ-носитель – гелий, скорость потока газа – 1 мл/мин. Температура испарителя – 250 °C, источника ионов – 230 °C, детектора – 150 °C; температура линии, соединяющей хроматограф с масс-спектрометром, 280 °C. Диапазон сканирования – 41–450 а.e.м. Объём вводимой пробы – 1 мкл, делитель потока – 5 : 1. Разделение смеси МЭЖК выполняли в изотермическом режиме при 200 °C. Для идентификации МЭЖК проводили расчёт эквивалентной длины алифатической цепи (ECL), использовали библиотеки масс-спектров NIST 05, Christie и сравнение времени удерживания со временем удерживания стандартных соединений. Относительное содержание жирных кислот определяли в весовых процентах от общего их содержания в образце. Для оценки ненасыщенности жирных кислот использовали индекс двойной связи (Double Bond Index): DBI = ΣP j n j /100, где P j – содержание жирной кислоты (вес. %) и n j – количество двойных связей в каждой кислоте (Lyons et al. , 1964). В таблице также представлены показатели Σ SFA – сумма насыщенных жирных кислот, Σ USFA – сумма ненасыщенных жирных кислот, Σ USFA /Σ SFA – отношение суммы ненасыщенных жирных кислот к сумме насыщенных жирных кислот.
Статистическую обработку данных осуществляли с помощью программного пакета SigmaPlot 12.5. Эксперименты проводили не менее чем в 3-х кратной повторности (n). В связи с тем, что характер распределения большинства данных отличался от нормального, для характеристики выборки представлена медиана (Me), а разброс значений в выборке – в виде интерквартильной широты [25%;75% процентиль] или доверительного интервала (95% рассчитанный по методу Уилсона). Нормальность распределения проверялась с помощью критерия Шапиро-Уилка. Для доказательства наличия значимых различий между медианами по вариантам использовали H-критерий Краскела-Уоллиса. Для сравнения пропорций (данные по выживаемости) использовали Z-тест. Различия между экспериментальными данными считали статистически значимыми при p≤0,05.
RESULTS AND DISCUSSION
В таблице 1 приведён жирнокислотный состав побегов этиолированных проростков озимой пшеницы, выращенных из семян обработанных и необработанных тебуконазол-содержащим препаратом «Бункер», до и после холодового закаливания. Как видно из данных, представленных в таблице 1, жирные кислоты, входящие в состав побегов озимой пшеницы, содержат в углеродной цепи от 14 до 22 атомов.
В контрольных проростках до закаливания среди насыщенных жирных кислот (НЖК) преобладают: пальмитиновая (С16:0), стеариновая (С18:0) и бегеновая (C22:0) кислоты, а среди мононенасыщенных и полиненасыщенных жирных кислот (МНЖК и ПНЖК) – олеиновая (C18:1(n-9)), линолевая (C18:2(n-6)) и α-линоленовая (C18:3(n-3)) кислоты. Содержание остальных НЖК, МНЖК и ПНЖК не превышает 1% (Таблица 1).
По сравнению с контрольными растениями в незакалённых проростках озимой пшеницы, выращенных из семян, обработанных протравителем
«Бункер», наблюдалось снижение содержания НЖК и увеличение содержания ПНЖК (Таблица 1). Содержание α-линоленовой кислоты статистически значимо увеличилось на 9,8%, в то же время наблюдалась тенденция к снижению содержания линолевой кислоты (на 5,5%), DBI повысился на 2,5%, а отношение Σ USFA /Σ SFA – на 3%. Полученные данные свидетельствуют о том, что обработка семян озимой пшеницы тебуконазол-содержащим препаратом «Бункер» уже в контрольных условиях приводит к увеличению степени ненасыщенности жирных кислот, характерному для низкотемпературной адаптации злаков.
Холодовое закаливание контрольных проростков озимой пшеницы из необработанных семян не приводило к существенным различиям качественного состава жирных кислот (Таблица 1). У закалённых растений увеличивалось содержание α-линоленовой кислоты (на 8,6%), вероятно, частично обусловленное снижением содержания линолевой кислоты (на 8,8%). Также наблюдали значительное увеличение содержания бегеновой кислоты (на 94%) в закалённых проростках в сравнении с контрольными.
Жирнокислотный состав закалённых проростков озимой пшеницы, выращенных из семян, обработанных протравителем «Бункер», качественно соответствовал жирнокислотному составу контрольных проростков, но существенно отличался от них по количественному содержанию жирных кислот. В закалённых растениях из обработанных семян наблюдали снижение содержания НЖК и увеличение содержания ПНЖК, что выражалось в статистически значимом снижении содержания пальмитиновой кислоты и увеличении содержания α-линоленовой кислоты. Наряду с этим наблюдалась тенденция к снижению содержания линолевой кислоты. Увеличение показателей DBI и отношения ΣUSFA/ΣSFA (Таблица 1) превышало таковое у контрольных незакалённых проростков, контрольных закалённых проростков и незакалённых проростков, выращенных из семян, обработанных препаратом «Бункер». Таким образом, нами установлено, что обработка семян озимой пшеницы препаратом «Бункер» сопровождается увеличением содержания α-линоленовой кислоты в побегах проростков, выращенных из этих семян как в незакалённом состоянии, так и после закаливания. Увеличение содержания ПНЖК в растениях наблюдали и при обработке семян другими регуляторами роста (Zhigacheva et al., 2011). Повышение содержания ПНЖК, особенно α-линоленовой кислоты, рассматривается как адаптивное изменение клеток растений к действию низких температур (Vereshchagin, 2007).
Холодозакалённые проростки озимой пшеницы, выращенные из обработанных препаратом «Бункер» семян, были более устойчивы к действию отрицательных температур, чем контрольные растения. Так, после промораживания озимой пшеницы в течение 24 ч при температуре -8 °C выживаемость проростков из обработанных препаратом семян превысила выживаемость контрольных растений в 1,6 раза (Рисунок 1).
Таким образом, обработка семян тебуконазол- содержащим протравителем «Бункер» приводит к повышению ненасыщенности жирных кислот в побегах этиолированных проростков озимой пшеницы. Повышение ненасыщенности, главным образом, связано с увеличением содержания α-линоленовой кислоты и особенно выражено в условиях холодового закаливания. Увеличение числа двойных связей в жирных кислотах, как известно, снижает температуру фазового перехода и способствует нормальному функционированию мембран в области пониженных температур (Khochachka and Somero, 1988; Vereshchagin, 2007). Обработка семян тебуконазол-содержащим препаратом и холодовое закаливание (2 °С, 7 суток) сопряжены с изменениями в жирнокислотном составе побегов проростков, что приводит к повышению устойчивости растений к действию низких температур.
В литературе имеются данные об АБК-индуцируемой десатурации НЖК мембранных липидов. Так, обработка листьев нута экзогенной АБК с последующим низкотемпературным закаливанием или без него приводит к усилению ацил-липидной десатурации (Bakht et al. , 2006). Принимая во внимание тот факт, что производные триазола вызывают увеличение содержания эндогенной АБК (Prusakova and Chizhova, 1998; Chizhova et al. , 2005), можно предположить, что увеличение степени ненасыщенности жирных кислот у злаков из обработанных тебуконазол-содержащим препаратом «Бункер» семян (как до, так и после закаливания), вероятно, является АБК-зависимым.
Table 1. Жирнокислотный состав (вес. %) побегов этиолированных проростков озимой пшеницы, выращенных из необработанных (Контроль) и обработанных препаратом «Бункер» семян
|
Жирная кислота |
До закаливания |
Холодовое закаливание |
||
|
Контроль ( n =4) |
«Бункер» ( n =3) |
Контроль ( n =3) |
«Бункер» ( n =3) |
|
|
C14:0 миристиновая |
0,63 [0,15;0,72] |
0,74 [0,18;0,90] |
0,50 [0,45;0,67] |
0,52 [0,32;0,64] |
|
C15:0 пентадециловая |
0,13 [0,00;0,29] |
0,23 [0,05;0,32] |
0,39 [0,08;0,60] |
0,32 [0,23;0,33] |
|
C16:0 пальмитиновая |
27,47 [26,55;28,67] |
27,02 [25,38;29,36] |
28,99д [25,21;30,75] |
24,51д [22,29;25,87] |
|
C16:1* |
0,53 [0,13;0,98] |
0,31 [0,04;0,62] |
0,86 [0,73;1,13] |
0,77 [0,55;0,89] |
|
C17:0 маргариновая |
0,10 [0,00;0,22] |
0,00 [0,00;0,20] |
0,00 [0,00;0,18] |
0,15 [0,00;0,17] |
|
C18:0 стеариновая |
1,00 [0,89;1,88] |
0,86 [0,78;1,36] |
1,47 [1,11;1,91] |
1,09 [0,93;1,33] |
|
C18:1(n-9) олеиновая |
8,24б,в [7,92;8,58] |
8,01е [7,78;8,42] |
6,57б,е [5,54;7,47] |
7,22в [6,71;8,11] |
|
C18:1(n-7) цис -вакценовая |
0,92в [0,75;1,05] |
1,09г,е [0,99;1,27] |
0,78 [0,58;0,81] |
0,62в,г,е [0,48;0,90] |
|
C18:2(n-6) линолевая |
32,58 [31,01;33,31] |
30,79 [30,05;32,35] |
29,70 [27,46;32,33] |
27,02 [25,64;28,16] |
|
C18:3(n-3) α-линоленовая |
26,69а,б,в [26,48;27,64] |
29,33а,г [26,29;30,62] |
28,99б,д [25,64;31,72] |
35,33в,г,д [29,89;37,40] |
|
C20:0 арахиновая |
0,13б [0,03;0,14] |
0,00г,е [0,00;0,09] |
0,32б,д,е [0,30;0,40] |
0,18г,д [0,00;0,27] |
|
C20:1(n-11) гондоиновая |
0,54 [0,12;0,60] |
0,52 [0,44;0,62] |
0,48 [0,43;0,59] |
0,51 [0,36;0,57] |
|
C20:2(n-9) |
0,00в [0,00;0,23] |
— |
— |
0,30в [0,00;0,33] |
|
C22:0 бегеновая |
0,84б,в [0,67;1,20] |
0,90г,е [0,81;1,16] |
1,63б,е [1,32;1,94] |
1,71в,г [1,53;1,91] |
|
DBI |
1,56а,в [1,55;1,57] |
1,60а,г [1,51;1,65] |
1,53д [1,47;1,67] |
1,70в,г,д [1,52;1,78] |
|
ΣSFA |
30,62 [30,05;31,03] |
29,93 [27,71;32,69] |
33,95 [28,97;35,30] |
28,32 [25,89;34,07] |
|
ΣUSFA |
69,38 [68,98;69,95] |
69,98 [67,31;72,24] |
66,06 [64,70;71,03] |
71,68 [65,93;74,12] |
|
ΣUSFA/ΣSFA |
2,27а,в [2,22;2,33] |
2,34а,г [2,06;2,61] |
1,95д [1,83;2,47] |
2,53в,г,д [1,94;2,86] |
Примечание: C16:1 * – сумма изомеров пальмитолеиновой кислоты; DBI (Double Bond Index) – индекс двойной связи; ΣSFA – сумма насыщенных жирных кислот; ΣUSFA – сумма ненасыщенных жирных кислот; ΣUSFA/ΣSFA – отношение суммы ненасыщенных жирных кислот к сумме насыщенных жирных кислот. n =3-4. Me [25%;75%]. Статистическую значимость отличий ( р ≤0,05) определяли, используя H-критерий Краскела-Уоллиса. а – различия между вариантами контроль до закаливания и «Бункер» до закаливания статистически значимы; б – различия между вариантами контроль до закаливания и контроль закаливание статистически значимы; в – различия между вариантами контроль до закаливания и «Бункер» закаливание статистически значимы; г – различия между вариантами «Бункер» до закаливания и «Бункер» закаливание статистически значимы; д – различия между вариантами контроль закаливание и «Бункер» закаливание статистически значимы; е – различия между вариантами «Бункер» до закаливания и контроль закаливание статистически значимы.
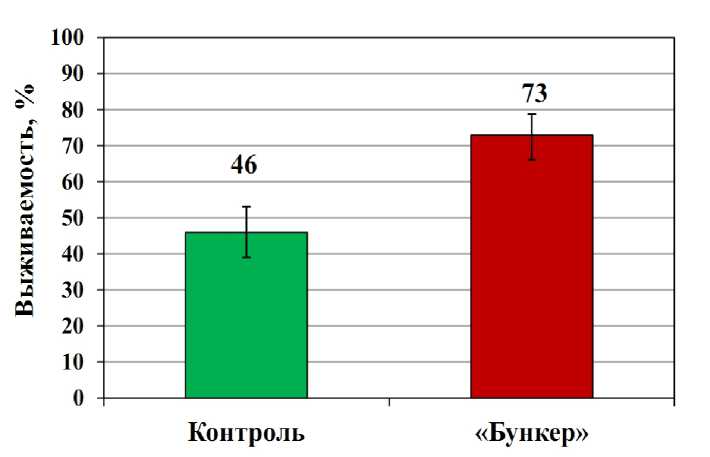
Figure 1. Влияние обработки семян препаратом «Бункер» на выживаемость проростков озимой пшеницы после действия отрицательной температуры –8 °С (24 ч).
Обозначения: Контроль – холодозакалённые проростки, выращенные из необработанных семян, «Бункер» – холодозакалённые проростки, выращенные из обработанных семян. Барами указан доверительный интервал (95% рассчитанный по методу Уилсона). Различия между вариантами статистически значимы z=6,422, p ≤0,001 (Z-тест для сравнения пропорций).
CONCLUSION
Учитывая ранее проведённые исследования (Korsukova et al. , 2015) можно заключить, что обработка тебуконазол-содержащим препаратом оказывает комплексное влияние на клеточный метаболизм озимых злаков и происходящие изменения в содержании стрессовых белков и жирнокислотном составе направлены на повышение морозоустойчивости растений.
Список литературы Тебуконазол регулирует состав жирных кислот этиолированных проростков озимой пшеницы
- Bakht J., Bano A., Dominy P. (2006) The role of abscisic acid and low temperature in chickpea (Cicer arietinum) cold tolerance. II. Effects on plasma membrane structure and function. J. Exp. Bot., 57, 14, 3707-3715
- Chizhova S.I., Pavlova V.V., Prusakova L.D. (2005) Soderzhanie abstsizovoi kisloty i rost rastenii yarovogo yachmenya pod deistviem triazolov. Fiziologiya rastenii , 52, 108-114
- Grabel'nykh O.I., Kirichenko K.A., Pobezhimova T.P., Borovik O.A., Pavlovskaya N.S., Lyubushkina I.V., Koroleva N.A., Voinikov V.K. (2014) Vliyanie kholodovogo shoka na zhirnokislotnyi sostav i funktsional'noe sostoyanie mitokhondrii zakalennykh i nezakalennykh prorostkov ozimoi pshenitsy. Biol. membrany , 31, 3, 204-217
- Keits M. (1975) Tekhnika lipidologii. Vydelenie, analiz i identifikatsiya lipidov. M.: Mir , 233 s
- Khochachka P. and Somero Dzh. (1988) Biokhimicheskaya adaptatsiya. M.: Mir , 568 s
- Korsukova A.V., Borovik O.A., Grabelnych O.I., Voinikov V.K. (2015) The tebuconazole-based protectant of seeds “Bunker” induces the synthesis of dehydrins during cold hardening and increases the frost resistance of wheat seedlings. Journal of Stress Physiology and Biochemistry , 11, 4, 118-127
- Los' D.A. (2014) Desaturazy zhirnykh kislot. M.: Nauchnyi mir , 372 s
- Lyons J.M., Wheaton T.A., Pratt H.K. (1964) Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plants. Plant Physiol., 39, 2, 262-268
- Makarenko S.P., Dudareva L.V., Katyshev A.I., Konenkina T.A., Nazarova A.V., Rudikovskaya E.G., Sokolova N.A., Chernikova V.V., Konstantinov Yu.M. (2010) Vliyanie nizkikh temperatur na zhirnokislotnyi sostav kontrastnykh po kholodoustoichivosti vidov zlakov. Biol. membrany , 27, 6, 482-488
- Prusakova L.D. and Chizhova S.I. (1998) Primenenie proizvodnyh triazola v rastenievodstve (obzor). Agrohimija , 10, 37-44
- Trunova T.I. (2007) Rastenie i nizkotemperaturnyj stress. M.: Nauka , 54 s
- Vereshchagin A.G. (2007) Lipidy v zhizni rastenii. M.: Nauka , 76 s
- Zhigacheva I.V., Misharina T.A., Terenina M.B., Krikunova N.N., Burlakova E.B., Generozova I.P., Shugaev A.G., Fattakhov S.G., Konovalov A.I. (2011) Zhirnokislotnyi sostav membran mitokhondrii prorostkov gorokha v usloviyakh nedostatka uvlazhneniya i umerennogo okhlazhdeniya. Doklady Akademii nauk , 437, 4, 558-560


