Технология концентрата жирных кислот на основе низкосортного рыбного жира
Автор: Петров Борис Федорович
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 4-2 т.13, 2010 года.
Бесплатный доступ
Разработана технология получения концентрата жирных кислот на основе низкосортного рыбного жира. Практическое применение нового продукта предполагает его использование в технических целях для замены традиционных источников жирных кислот.
Технология, концентрат жирных кислот, низкосортные рыбные жиры
Короткий адрес: https://sciup.org/14294252
IDR: 14294252 | УДК: [665.213
Текст научной статьи Технология концентрата жирных кислот на основе низкосортного рыбного жира
-
1. Введение
Рыбный жир, обладая высокой биологической активностью, является ценным сырьем для фармацевтической, пищевой и кормовой промышленности. Однако высокая ненасыщенность углеводородного скелета жирных кислот в молекулах рыбного жира часто служит причиной его глубоких гидролитических и окислительных превращений. Это обстоятельство делает невозможным широкое использование его в указанных областях. Жир с измененной молекулярной структурой целесообразно использовать для получения концентрата жирных кислот (КЖК), который является сырьем для получения поверхностно-активных и пленкообразующих материалов технического назначения ( Bimbo , Crowther , 1990).
-
2. Выбор способа гидролиза рыбного жира
КЖК получают гидролизом смесей глицеридов. Гидролиз жира можно проводить в гетерогенных дисперсных средах типа "жир-вода", однако скорость процесса в этом случае сравнительно невелика. Для повышения взаимной растворимости жира в воде и увеличения скорости его гидролиза обычно используют подогрев, повышенное давление, катализаторы (сульфокислотный контакт, минеральные кислоты, оксиды щелочных металлов) и ферменты. Гидролиз триглицеридов идет ступенчато с образованием промежуточных продуктов: ди- и моноглицеридов. По мере образования этих продуктов, обладающих по сравнению с триглицеридами большей растворимостью в воде, скорость расщепления глицеридов повышается. Конечными продуктами гидролиза жира являются смеси жирных кислот и глицерин ( Тютюнников , 1974).
-
3. Исследование процесса ферментативного гидролиза рыбного жира
Существуют различные способы гидролиза жира: контактный (в присутствии сульфокислотного контакта и серной кислоты), с использованием окисей щелочноземельных металлов (цинка, кальция, магния), безреактивный и ферментативный (энзиматический) ( Арутюнян и др. , 1985).
Для расщепления рыбных жиров ни один из указанных способов пока не нашел применения в промышленности. Наиболее перспективным для этих целей следует считать ферментативный (энзиматический) способ. Он не требует сложного оборудования и больших энергозатрат. Однако основным его недостатком является высокая стоимость катализатора процесса – липолитических ферментных препаратов. Для обеспечения рентабельности энзиматического способа в нем следует применять ферментные препараты с минимальной степенью очистки, а также создать условия многократного использования биокатализатора.
Возможность применения в биотехнологических процессах ферментных препаратов без глубокой степени очистки обусловлена высокой избирательностью действия содержащегося в них активного белка – фермента. Это позволяет интенсифицировать реакцию даже в присутствии различных сопутствующих ферменту примесей (Fullbrook, 1983). Многоразовое использование фермента, сохранение его нативных свойств обеспечивает метод иммобилизации, т.е. реакция взаимодействия фермента с матрицей полимера-носителя с образованием биологически-активного полимерного материала, обладающего липолитической активностью. В результате не только продлевается срок действия биокатализатора, но обеспечиваются условия для проведения непрерывного производственного процесса (Janshekar, Feichter, 1982).
Ферментативный гидролиз рыбного жира проводили с помощью панкреатической липазы в свободном и иммобилизованном состоянии.
Препарат свободной липазы представлял собой 10 %-ый глицериновый раствор измельченной поджелудочной железы свиньи.
Иммобилизацию ферментного препарата осуществляли на поливиниловом спирте марки 16/1 по ГОСТ 10779-78 по методике, предложенной специалистами проблемной лаборатории полимеров Московского государственного университета прикладной биотехнологии.
Субстратом для расщепления служил рыбный жир с кислотным числом (60.9±0.3) мгКОН/г и числом омыления (196±1.0) мгКОН/г. Изучение методом тонкослойной хроматографии фракционного состава жира показало наличие в нем (%): триглицеридов 62.1±0.5; диглицеридов 11.3±0.1; моноглицеридов и оксикислот 5.3±0,2; свободных жирных кислот 21.3±0.4.
Процесс гидролиза вели при непрерывном перемешивании реакционной смеси, соотношении жира и воды 1:0.5, температуре смеси 37 ° С, рН смеси 7.0.
Активность ферментных препаратов определяли по методике ВНИРО, основанной на количественном определении жирных кислот, отщепляемых от триглицеридного субстрата – очищенного медицинского рыбного жира. О количестве отщепляемых жирных кислот судили по приросту кислотного числа реакционной смеси.
Эффективность процесса гидролиза рыбного жира оценивали по изменению его степени расщепления – глубине гидролиза. Глубину гидролиза ( Г ) рассчитывали по формуле:
Г = (КЧ / ЧО) • 100, (1)
где КЧ – кислотное число жира, мгКОН/г; ЧО – число омыления, мгКОН/г.
Изучение активности ферментных препаратов показало, что они обладают невысокой способностью к расщеплению триглицеридного субстрата. Активность липазы в свободном состоянии составила (44.7±0,2) ед/10 г препарата, иммобилизованной липазы (48.4±0.2) ед/10 г препарата. В связи с этим для увеличения активности ферментов в процессе гидролиза использовали желчные соли и хлорид кальция.
Ферментные препараты вносили в реакционную смесь в количестве 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 % от массы гидролизуемого жира. Количество вносимой иммобилизованной липазы пересчитывали на площадь ее поверхности, что соответственно составило 20, 40, 60, 80, 100, 120, 140, 160, 180, 200 см2/г гидролизуемого жира.
Желчные соли вводили в реакционную смесь в виде консервированной медицинской желчи. Количество вводимой желчи составило 5, 10, 15, 20, 25, 30, 35, 40 % от массы смеси "жировой объект-вода-фермент".
Хлорид кальция добавляли к смеси "жировой объект-вода-фермент" в количестве 0.2, 0.4, 0.6, 0.8, 1.0, 2.0, 3.0, 4.0 %.
Процесс гидролиза контролировали через 2, 4, 6, 8, 10, 12 ч после его начала.
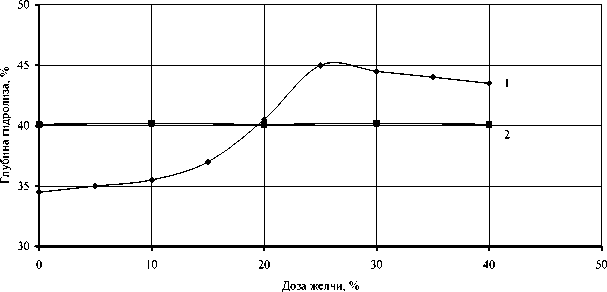
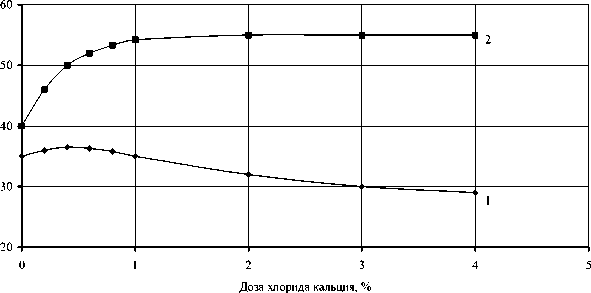
Исследованиями установлено, что желчные соли оказывают стимулирующее действие только на свободную липазу (рис. 1а, кривая 1), а хлорид кальция только на иммобилизованную липазу (рис. 1б, кривая 2). Активность свободной липазы в присутствии 25 % желчи сохранялась в течение 10 ч (рис. 2а, кривая 1), иммобилизованной в присутствии 1 % хлорида кальция в течение 8 ч (рис. 2а, кривая 2). Инактивация ферментов при отсутствии в реакционной смеси соответствующего активатора наступала через 4 ч (рис. 2а, кривые 3,4).
Иммобилизованная липаза по сравнению со свободной формой показала способность глубже гидролизовать глицериды субстрата (рис. 2б, кривая 2), а также возможность ее многократного использования – до 90 раз.
Отмечена необходимость промывки раствором детергента и водой иммобилизованного фермента от остатков гидролизованного жира после каждой реакции ферментолиза. В противном случае активность липазы постепенно снижается, и через 10 циклов она полностью утрачивает способность к расщеплению глицеридов субстрата. По-видимому, это явление связано с блокировкой активных центров фермента образующимися в ходе реакции гидролиза свободными жирными кислотами.
Результаты эксперимента показали целесообразность использования для гидролиза низкосортного рыбного жира панкреатической липазы в иммобилизованном состоянии.
Рис. 1. Изменение глубины гидролиза технического полуфабриката рыбного жира в зависимости от дозы вносимой желчи (вверху) и хлорида кальция (внизу) при продолжительности ферментолиза 6 ч в присутствии:
-
1 – свободной липазы (10 %);
-
2 – иммобилизованной липазы (20 см2/г)
Рис. 2. Изменение глубины гидролиза технического полуфабриката рыбного жира в зависимости от продолжительности ферментолиза (вверху) и от дозы фермента при продолжительности ферментолиза 6 ч (внизу):
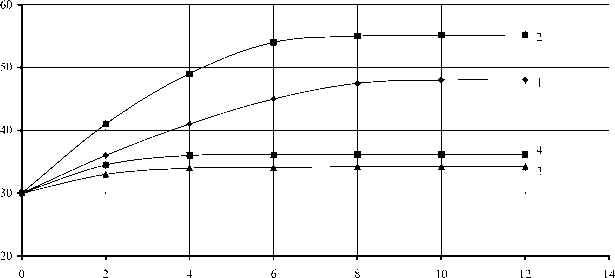
Продолжительность ферментолиза, ч
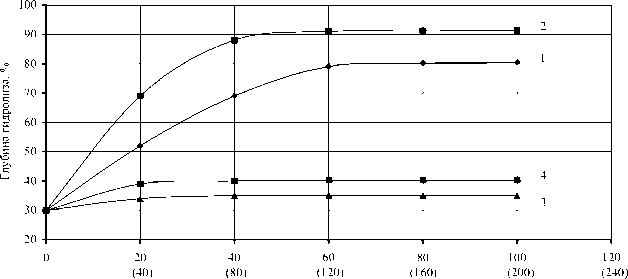
Доза фермента, % (см2/г)
Поиск оптимальных условий протекания процесса гидролиза жира иммобилизованным ферментом осуществляли путем построения математической модели в предполагаемой области нахождения оптимума по методу Бокса-Уилсона с использованием ротатабельных планов второго порядка ( Адлер , 1976). Поверхность отклика эксперимента аппроксимировали полиномами второго порядка. Расчет коэффициентов уравнений регрессии осуществляли на ПЭВМ по методу наименьших квадратов. Адекватность полученных математических зависимостей оценивалась с помощью критерия Фишера.
Критерием оптимизации процесса ферментолиза являлась глубина гидролиза жира ( y ). Факторами, оказывающими существенное влияние на процесс, считали дозу хлорида кальция, дозу фермента, продолжительность процесса ферментолиза.
Аппроксимация экспериментальных данных полиномной моделью второго порядка позволила получить уравнение регрессии следующего вида:
y = – 31 x 1 2 – 0.0023 x 2 2 – 0.42 x 3 2 + 72 x 1 + 0.63 x 2 + 7.5 x 3 + + 0.3 x 1 x 3 – 0.009 x 2 x 3 – 17,
где x 1 – доза хлорида кальция, %; x 2 – доза иммобилизованного фермента, см2/г; x 3 – продолжительность процесса ферментолиза, ч.
Анализ поверхности отклика функции показал, что оптимальными для протекания процесса ферментолиза рыбного жира являются следующие условия: доза хлорида кальция 1 %, доза иммобилизованного фермента 120 см2/г, продолжительность процесса 8 ч.
Значение критерия оптимизации в точке оптимума составляет 93.4 %. Экспериментальное значение глубины гидролиза жира при оптимальных условиях равно (93.6±1.1) %.
Анализ фракционного состава липидов рыбного жира до и после гидролиза показывает, что изученный процесс способствует повышению содержания свободных жирных кислот в объекте от 20 до 70 %. Жирнокислотный состав липидов при этом меняется незначительно и составляет (%): насыщенных жирных кислот – 22, мононенасыщенных – 32; полиненасыщенных – 46.
Химический состав гидролизованного рыбного жира характеризуется наличием в нем значительного количества воды (в среднем 47 %). Данное обстоятельство препятствует последующему использованию полученного продукта в различных химико-технологических процессах. С целью удаления избыточной влаги и повышения концентрации жировых веществ водно-жировую систему подвергали тепловой обработке в делительной воронке, помещенной в водяной термостат. Температуру процесса варьировали от 20 до 95 ° С, продолжительность от 0 до 1 ч.
В ходе нагрева наблюдалось расслоение водно-жировой системы на два слоя – водный и жировой. По-видимому, этот процесс связан с разрушением дисперсной структуры объекта за счет уменьшения вязкости входящих в ее состав ингредиентов с последующим разделением образующихся фаз под действием силы тяжести. По окончании тепловой обработки водный слой отделяли от жирового.
Исследованиями установлено, что степень обезвоживания жирового слоя увеличивается с повышением температуры нагрева. Однако температура процесса не должна превышать 100 ° С, в противном случае возможен переход водной фазы реакционной смеси в парообразное состояние и выброс ее из реактора. Продолжительность разделения фаз в реакционной смеси составляет 10 мин.
Анализ химического состава обезвоженного объекта показал, что по содержанию воды (не более 5 %), кислотному числу (порядка 180 мгКОН/г продукта) он может быть отнесен к КЖК.
КЖК из рыбного жира апробирован для флотации апатито-нефелиновой руды в качестве замены традиционных жирнокислотных собирателей – талловых масел, масляного гудрона, синтетических жирных кислот, соапстока после рафинации растительных масел. Эксперименты показали, что введение указанных кислот в состав флотационной смеси позволяет при сохранении качества получаемого концентрата увеличить выход фосфатных соединений (оксида фосфора Р 2 О 5 ) из исходной руды. Это свидетельствует о более высокой избирательности действия кислот рыбного жира как флотационного реагента по сравнению с традиционными собирателями.
фермента в процессе гидролиза. Присутствие хлорида кальция в реакционной смеси стимулирует активность иммобилизованной липазы и позволяет существенно повысить степень расщепления рыбного жира.


