Технология получения нанесенного катализатора на основе алюмосиликатной матрицы, модифицированной оксидом европия
Автор: Кузнецова И.В., Сугатов Д.С., Грызлова В.И.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 1 (91), 2022 года.
Бесплатный доступ
Количество используемых во всем мире автомобилей постоянно растёт. В связи с этим, проблема борьбы с загрязнителями атмосферы - выхлопными газами двигателей внутреннего сгорания приобретает особую актуальность. За прошедшее время автопроизводители внесли много улучшений в конструкцию автомобильного двигателя и топливных систем, чтобы соответствовать требованиям допустимого уровня загрязнения. Одним из лучших решений данной проблемы является использование, так называемого каталитического преобразователя (конвертера) или просто катализатора с высоким содержанием благородных металлов, основная функция которых - это одновременное окисление несгоревших углеводородов и CO, а также восстановление оксидов азота. Было обнаружено, что добавление редкоземельных металлов к Pd, Pt - катализаторам улучшает их свойства и снижает долю благородных металлов в составе катализаторов. В работе представлены результаты исследования комплексообразования в системе Eu3+-лиганд, где лиганд-органическая кислота, фотоколориметрическим и потенциометрическим методами. В системе Eu3+-галловая кислота образуется устойчивый комплекс состава MeLnx - 1:2. В системе Eu3+- щавелевая кислота образуется устойчивый комплекс состава MeLnx - 1:1. В системе Eu3+-валин образуется устойчивый комплекс состава MeLnx - 1:2. Показана новая методика получения комплексных соединений, заключающаяся в добавление в раствор, содержащий растворы соли Eu3+ и органический кислоты, в водно-спиртовой среде, пероксида водорода H2O2 для блокировки восстановления Eu3+→Eu2+. Разработана технология получения автомобильного катализатора, состоящая из последовательных этапов: получение комплексных соединений, нанесение полученных комплексных соединений на керамические блочные матрицы, сушка, нанесение платиновой (палладиевой) кислоты, прокаливание. Наличие иона Eu3+ в керамической матрице доказано методом элементного анализа. Технология может быть применена для решения проблемы загрязнения окружающей среды такими загрязнителями, как выхлопные газы автомобилей, содержащих в своем составе множество вредных веществ.
Автомобильный катализатор, соединения европия, органические кислоты, элементный анализ, ик-спектроскопия, фотоколориметрический метод, потенциометрический метод
Короткий адрес: https://sciup.org/140293760
IDR: 140293760 | УДК: 360
Текст научной статьи Технология получения нанесенного катализатора на основе алюмосиликатной матрицы, модифицированной оксидом европия
Сегодня количество используемых во всем мире автомобилей постоянно растёт. В связи с этим, проблема борьбы с загрязнителями атмосферы – выхлопными газами двигателей внутреннего сгорания приобретает особую актуальность. Это приводит к ужесточению систем нормирования автомобильных выхлопов во всем мире [1]. За прошедшее время автопроизводители внесли много улучшений в конструкцию автомобильного двигателя и топливных систем, чтобы соответствовать требованиям допустимого уровня загрязнения. Одним из лучших решений данной проблемы является использования, так называемого каталитического преобразователя (конвертера) или просто катализатора с высоким содержанием благородных металлов, основная функция которых – это одновременное окисление несгоревших углеводородов и CO, а также восстановление оксидов азота [2]. Однако чтобы соответствовать жестким экологическим требованиям, производители вынуждены увеличивать содержание благородных металлов в составе каталитических композиций, что приводит к удорожанию каталитического конвертера [3]. Было обнаружено, что добавление редкоземельных металлов к Pd, Pt – катализаторам улучшает их свойства и снижает долю благородных металлов в составе катализаторов [4–6]. Авторы работы [7] исследовали системы SnО2–СеО2, полученные путем со-осаждения в водно-изопропанольной среде с последующей термической обработкой для окисления CO. Церий обладает переменной степенью окисления +3, +4 и может отдавать лишний кислород или его задерживать в реакциях окисления выхлопных газов Авторы [8, 9] исследовали каталитические свойства: удельную поверхность, общий объем пор и энергию активации нового катализатора, содержащего церий в сравнении с традиционным катализатором. Данные говорят о том, что новый катализатор по всем свойствам лучше традиционного. Авторы [10] определяли активность палладиевых катализаторов на керамических носителях с добавками оксидов редкоземельных элементов (ОРЗЭ). В работе [11] описан метод приготовления катализатора, основанный на пропитке матрицы растворами комплексных соединений металлов. Этот метод позволяет получить более равномерное распределение частиц металла по объему катализатора. Промотирование алюмооксидного катализатора ОРЗЭ приводит к увеличению его каталитической активности. Россия обладает крупнейшей ресурсной базой редкоземельных элементов. По последним данным общие запасы редкоземельных металлов в России составляют 12 млн тонн, то есть 10 процентов от общемировых. В современных реалиях инфраструктурная составляющая является ключевым фактором экономической эффективности освоения месторождений полезных ископаемых. Этот факт диктует необходимость более полного освоения месторождений, обладающих благоприятным географическим положением. Среди наиболее перспективных из них выделяется Ловозерский щелочной массив [12]. Еще планируется освоение крупнейшего в России Якутского Томторского месторождения редкоземельных металлов и Зашихинского месторождения в Забайкалье. На Томторе руду начнут добывать в 2025 году. Также в Московской области намечен запуск предприятия по разделению редкоземельных металлов, извлеченных из отходов минеральных удобрений [13]. Таким образом, использование РЗЭ в различных областях исследований является перспективным направлением. В последнее время увеличивается число публикаций по исследованию свойств материалов, содержащих оксид европия. В работе [14] определяли магнитные и структурные свойства Еu2О3 и Eu(OH)3. Авторы [15] исследовали фотокаталитические свойства сверхмалых нанокластеров платины, нанесенных на оксид европия. В статье [16] проведен обзор по синтезу, характеристикам (структурным, морфологическим, оптическим) и применению оксида европия. Европий имеет переменную степень окисления +2, +3, поэтому может быть применен наравне с церием в окислительно-восстановительном катализе.
Цель работы – получение нанесенного катализатора на основе алюмосиликатной матрицы, модифицированного оксидом европия и исследование его свойств.
Материалы и методы
В качестве исходных реагентов были использованы следующие реактивы: нитрат европия - Eu(NO 3 ) 3 -5H 2 O, органические кислоты: щавелевая С 7 Н 6 О 5 , галловая Н 2 С 2 О 4 , валин C5H ii NO2, соляная кислота - НС1, хлорид натрия – NaCl, гидроксид натрия – NаОН, этиловый спирт – С 2 Н 5 OH, перекись водорода – Н 2 О 2 , палладиевая (платиновая) кислоты – Н 2 [РdСl 6 ].
Предлагается получить катализаторы Pd (Pt)/ Еu 2 О 3 –Аl 2 О 3 по следующей схеме (рисунок 1).
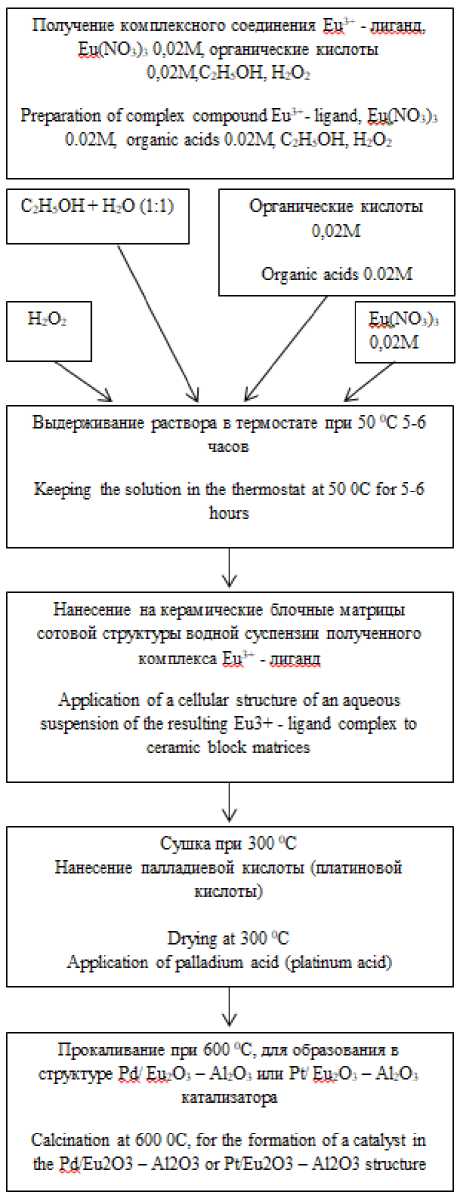
Рисунок 1. Схема получения автомобильного катализатора
Figure 1. The scheme of obtaining an automotive catalyst
Керамическую подложку производили из глины Лукошинского месторождения (Липецкая область). Глину размалывали, готовили пресс-порошок, прессовали на гидравлическом прессе пластины, сушили и обжигали при 1250 ℃. Готовые пластины имели водопоглоще-ние 6,7% и механическую прочность 269 мПа.
Составы комплексных соединений определяли фотоколориметрическим и потенциометрическим методами [17, 18]. Для определения состава комплексов фотоколориметрическим методом готовили растворы каждого из компонентов (соль европия и кислота щавелевая или галовая) с одинаковой молярной концентрацией и смешивали их в антибатных соотношениях (от 1:9 до 9:1), сохраняя неизменным общий объем раствора (VМ + VR = const), и, как следствие, сумму общих молярных концентраций металла и лиганда (сМ + сR = с = const). Концентрация металла в серии растворов будет сМ = с (1 - x), а концентрация лиганда: сR = с⋅x, где x – мольная доля лиганда в смеси металл– лиганд. Определяли максимальное светопогло-щение на длинах волн 340–670 нм. Измерения светопоглощения проводили при постоянных значениях ионной силы, температуры и рН растворов. Состав комплекса МеLnn определяли по следующей формуле: n = хmах/1 - хmах, где. n – количество лигандов в комплексе, хmах – соотношение при максимальном значении оптической плотности D .
При определении состава комплексных соединений потенциометрическим методом проводили потенциометрическое титрование при 20 °С раствором NаОН 0,4 н. На каждое титрование готовили раствор общим объемом 25 мл, содержащий: по 2,5 мл растворов нитрата европия и валина с молярной концентрацией С = 0,1 M, 0,5 мл раствора НСl для снижения кислотности среды, 1мл раствора NaCl, для создания ионной силы µ = 0,1. По результатам титрования построили кривые титрования, определили константу устойчивости полученного комплексного соединения и его приблизительный состав.
Идентификацию комплексного соединения в растворе проводили с помощью ИК-спектро-скопии (спектрометр Bruker VERTEX 70).
Элементный анализ керамической подложки, пропитанной полученным комплексным соединением, проводился с помощью Oxford INСАЕnеrgу 250 – системы энергодисперсионного микроанализа для электронной микроскопии и микрорентгеноспектрального анализа.
Результаты и обсуждение
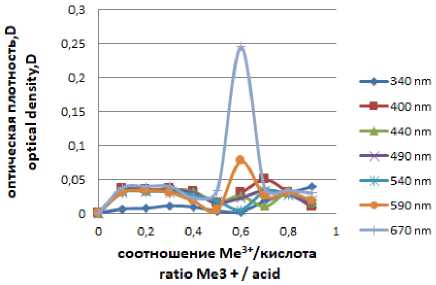
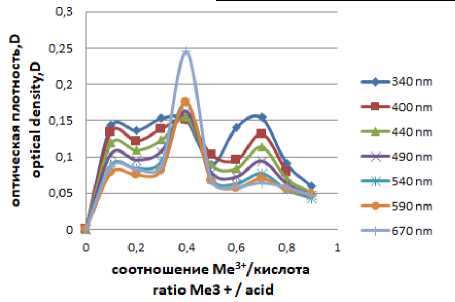
На рисунке 2 (а, б) представлены кривые поглощения исследуемых комплексных соединений при различных длинах волн. Наибольшее значение оптической плотности наблюдаем при 670 нм. В результате фотоколориметрическо-го метода исследования установили, что Еu3+ образует устойчивый комплекс со щавелевой кислотой состава МеLnх 1:1 (пик высокой интенсивности на кривой поглощения), а с галловой кислотой устойчивый комплекс состава МеLn х 1:2 (о чем также говорит высота пика на кривой поглощения).
(a)
Рисунок 2. Кривая поглощения Еu 3+ /галловая кислота
Figure 2. Еu 3+ /gallic acid absorption curve
(b)
По результатам потенциометрического метода исследования (рисунок 3) определили, что в процессе комплексообразования в системе Еu3±валин, участвуют 2 группы (-COOH), так как расход щелочи при нейтрализации в процессе титрования эквивалентен количеству карбоксильных групп, участвующих в комплексообразовании. Таким образом, в системе Еu3± валин образуется комплекс состава МеLn х – 1:2, что указывает на тетраэдрическую геометрию комплекса [19].
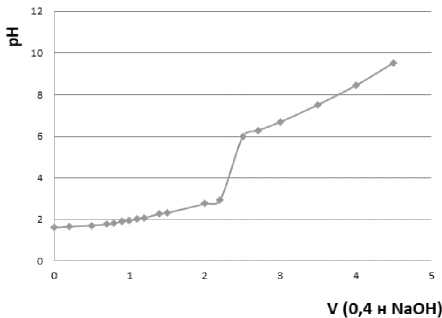
Рисунок 3. Кривая титрования смеси Еu 3+ /валин (1:2) гидроксидом натрия
Figure 3. Titration curve of Еu 3+ /valin mixture (1: 2) with sodium hydroxide
Еu3+ – валин, Еu3+ – щавелевая кислота, Еu3+– галовая кислота данные комплексы были синтезированы по схеме (рисунок 1). При синтезе комплексных соединений в водно-спиртовой среде использовали раствор пероксида водорода, который позволяет получить устойчивую форму европия в степени окисления +3. Наличие комплексного соединения в растворе было доказано ИК-спектроскопией (рисунок 4).
Для получения катализатора выдерживали 3 керамических пластины в растворе полученных комплексных соединений Еu3+ – валин, Еu3+ – щавелевая кислота, Еu3+ – галловая кислота в течении суток и высушили. Элементный анализ показал наличие европия в составе керамики. Причем подложка, пропитанная раствором неустойчивого комплекса Еu3+ – валин, содержит наибольшее количество европия (12,284%). По всей видимости, при суточной выдержке пластины в растворе происходит разрушение комплекса и образованные свободные ионы европия диффундируют в поры керамической подложки. Подложки, модифици- рованные ионами европия, можно использовать в технологии дальнейшего нанесения растворов благородных металлов по предложенной технологической схеме (рисунок 1).
По данным потенциометрии были рассчитаны константа диссоциации валина (7.66) и константа устойчивости образующегося комплексного соединения ( 0,69). Численное значение константы устойчивости комплекса говорит о малой устойчивости данного соединения. Тем не менее, синтез данного комплекса как отдельной фазы может быть использован при постановке и проведении различных химических и биохимических исследований, а также для банка данных [20].
После определения возможности существования комплексных соединений в системах
Раствор Еи5+-валин
Euj+-valine solution
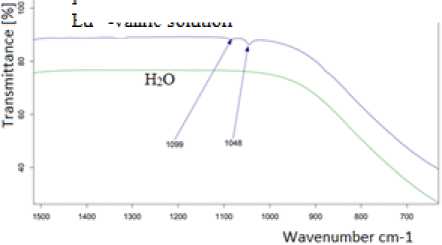
Рисунок 4. ИК-спектроскопия раствора Еu 3 ±валин
Figure 4. IK-spectroscopy of Еu 3 – valine solution
Заключение
Фотоколориметрическим и потенциометрическим методами определено, что в системе Еu3+ – галловая кислота образуется устойчивый комплекс состава МеLnх – 1:2. В системе Еu3+ – щавелевая кислота образуется устойчивый комплекс состава МеLnх – 1:1.
В системе Еu+ – валин образуется комплекс состава МеLnх – 1:2. При синтезе комплексных соединений использовали пероксид водорода Н 2 О 2 для блокировки восстановления Еu3+→Еu2+. Наибольшее количество иона Еu3+ в керамическую матрицу переходит из комплексного соединения Еu3+ – валин.
Список литературы Технология получения нанесенного катализатора на основе алюмосиликатной матрицы, модифицированной оксидом европия
- Kaur N. Palladium catalysts: synthesis of five-membered N-heterocycles fused with other heterocycles // Catalysis Reviews. 2015. V. 57. №. 1. P. 1-78. doi: 10.1080/01614940.2014.976118
- Das P., Linert W. Schiff base-derived homogeneous and heterogeneous palladium catalysts for the Suzuki-Miyaura reaction // Coordination Chemistry Reviews. 2016. V. 311. P. 1-23. doi: 10.1016/j.ccr.2015.11.010
- Clavadetscher J., Indrigo E., Chankeshwara S.V., Lilienkampf A. et al. In-Cell Dual Drug Synthesis by Cancer-Targeting Palladium Catalysts // Angewandte Chemie. 2017. V. 129. №. 24. P. 6968-6972.
- Siyu Lin, Linyan Yang, Xue Yang, Renxian Zhou Redox properties and metal-support interaction of Pd/Ce0 67 Zr0 33 O2-Al2 O3catalyst for CO, HC and NO xelimination // Applied Surface Science. 2014. V. 305. P. 642-649.
- Colussi S., Leitenburg C., Dolcetti G., Trovarelli A. The role of rare earth oxides as promoters and stabilizers in combustion catalysts // Journal of Alloys and Compounds. 2004. V. 373. P. 387-392.
- Wei Liu, Wenxin Tong, Xinxin Lu, Shanghua W Effects of different types of rare earth oxide additives on the properties of silicon nitride ceramic substrates // Ceramics International. 2019. V. 45. № 9. doi:10.1016/j.ceramint.2019.03.176
- Liberman E.Y., Simakina E.A., Izotova A.O., Kon'kova T.V. et al. Synthesis and activity of nanodispersed SnO2-CeO2 catalyst in the oxidation reactions of carbon monoxide and methane // Kinetics and Catalysis. 2021. V. 62. № 1. P. 155-159.
- Слептерев А.А., Цырульников П.Г. Палладиевые катализаторы, на оксиде алюминия, модифицированном оксидами РЗЭ // Омский научный вестник. 2013. № 1 (117). С. 51-58.
- Mohallem N. D. S., Viana M. M., Silva R. A. Automotive catalysts: performance, characterization and development // New Trends and Developments in Automotive Industry. IntechOpen, 2011.
- Дубко А.И., Юдин Н.В., Пинчук Ю.А., Обухов Е.О. Исследование активности палладиевых катализаторов на керамических носителях с добавками оксидов редкоземельных элементов (ОРЗЭ) // Успехи в химии и химической технологии. 2017. Т. 31. № 5.
- Muñoz F.F., Baker R.T., Leyva A.G., Fuentes R.O. Reduction and catalytic behaviour of nanostructured Pd/gadolinia-doped ceria catalysts for methane combustion // Applied Catalysis B: Environmental. 2013. V. 136-137. P. 122-132.
- Lalomov A., Bochneva A. Rare-metal potential of placer deposits and weathering crusts of the Russian Arctic // Arctic: Ecology and Economy. 2018. P. 111-122. doi: 10.25283/2223-4594-2018-4-111-122
- Kasatkin V.V., Kasatkin A.V., Ilyichev V.A., Sedov N.S. et al. Post-prospecting radioecological surveys on the Tomtorskoye rare metal deposite (Sakha Republic (Yakutia) //Radiation Hygiene. 2008. V. 11. № 4. doi: 10.21514/1998-426X-2018-11-4-18-27
- Lee D., Seo J., Valladares L.D.L.S., Avalos Quispe O. et al. Magnetic and structural properties of yellow europium oxide compound and Eu(oH)3 // Journal of Solid State Chemistry. 2015. V. 228. P. 141-145. doi: 10.1016/j.jssc.2015.04.018
- Ren C., Li W., Li H., Liu X. et al. Ultrasmall Pt nanoclusters deposited on europium oxide: A newly active photocatalyst for visible-light-driven photocatalytic hydrogen evolution // Applied Surface Science. 2019. V. 480. P. 96-104. doi: 10.1016/j.apsusc.2019.02.192
- Kumar S., Prakash R., Singh, VivekK. Synthesis, Characterization, and Applications of Europium Oxide: A Review // Reviews in Advanced Sciences and Engineering. 2016. V. 4(4). P. 247-257. doi: 10.1166/rase.2015.1102
- Balaram V. Rare earth elements: A review of applications, occurrence, exploration, analysis, recycling, and environmental impact // Geoscience Frontiers. 2019. V. 10. № 4. P. 1285-1303.
- Трошина М.А. О комплексообразовании в системе «Сульфат хрома (III) - сульфат алюминия-сульфат титанила-вода» // Вектор науки ТГУ. 2017. № 1. С. 24-28. doi: 10.18323/2073-5073-2017-1-23-29
- Aliyu H.N., Naaliya J. Potentiometric studies on essential metal (II) amino acid complexes // Global Advanced Research Journal of Microbiology. 2012.V. 1(5). Р. 72-78.
- Xu L., Feng L., Han Y., Jing Y. et al. Supramolecular self-assembly enhanced europium (III) luminescence under visible light // Soft Matter. 2014. V. 10. №. 26. P. 4686-4693. doi: 10. 10.1039/c4sm00335g


