Технология производства и биокаталитические свойства протеолитического ферментного препарата
Автор: Тихонов Сергей Леонидович, Брашко Иван Сергеевич, Тихонова Наталья Валерьевна, Тихонова Мария Сергеевна, Лазарев Владимир Александрович
Рубрика: Пищевые ингредиенты, сырье и материалы
Статья в выпуске: 2 т.9, 2021 года.
Бесплатный доступ
Цель проведения исследования заключается в разработке технологии получения протеолитического ферментного препарата на основе коллагеназы, выделенной из внутренностей рыбы и исследование биокаталитической активности в зависимости от рН и температуры. Протеолитическую активность ферментного препарата определяли методом Ансона. Разработана технология получения ферментного препарата, включающая выделение внутренностей кеты, обработку рыбного сырья сверхвысоким давлением 100-200 МПа в течение 60 с, измельчение до частиц 500-600 мкм, экстракцию и гомогенизацию в изотоническом растворе в соотношении 1:3 при температуре 35-37 °С в течение 3-4 часов с частотой вращения 100-200 оборотов в минуту, центрифугирование (3000 об./мин); ультрафильтрацию через керамические мембраны с лимитом пропускания до 21 кДа, упаковку в полиэтиленовые пакеты емкостью 50 мл, стерилизацию сверхвысоким давлением в 300 МПа в течение 60-120 с. Температуру при экстрагировании задавали с помощью блока управления, регулирующего работу компрессора, входящего в комплексную синхронно-смесительную установку. Применяемая технология ультрафильтрации гомогенизата заключается в разделении исходного раствора, поданного в циркуляционный бак, на ферментный препарат и водный раствор, непрерывно отводящийся из аппарата. При производстве ферментного препарата по указанной технологии с целью недопущения инактивации фермента проводили контроль температурного режима при гомогенизации с помощью установления необходимой температуры, регулирующей работу компрессора с охлаждающей жидкостью. В ходе исследований установлен оптимум активности образцов ферментного препарата - рН от 7 до 9, температура от 37 до 42 °С.
Пищевая биотехнология, технология производства, ферменты, ферментный препарат, коллагеназа
Короткий адрес: https://sciup.org/147234339
IDR: 147234339 | УДК: 615.35 | DOI: 10.14529/food210203
Текст научной статьи Технология производства и биокаталитические свойства протеолитического ферментного препарата
Особое внимание при гидролизе коллагенсодержащих белков в пищевой отрасли привлекает коллагеназа, позволяющая раскручивать тройные спирали коллагена и расщеплять пептидные цепи до небольших остатков – олигопептидов [1–3].
Сырьем для производства протеолитических ферментных препаратов, содержащих фермент коллагеназу, являются микроорганизмы (бактерии семейства Clostridium) и железы желудочно-кишечного тракта сельскохозяйственных животных, внутренние органы рыбы, камчатского краба [4, 5]. Продуцентами коллагеназы являются патогенные микроорганизмы Clostridium histolyticum. Коллагеназы, полученные методом бактериального синтеза отличаются высокой специфичностью, повышенной каталитической способностью гидролизовать нативный, а также модифицированный коллаген [6, 7]. Выделяют следующие изоформы коллагеназы, соответствующие первому классу I (α, β, γ) и второму классу II (δ, ε, ζ). Следует отметить, что изоформы β и ζ отличаются высокой молекулярной массой, а изоформы α, γ, δ и ε имеют низкую молекулярную массу за счет усечения полипептидной цепи [8].
Согласно классификации, принятой Комитетом Международного союза биохимии и молекулярной биологии, коллагеназы, полученные бактериальным синтезом, относятся к семейству M9 подсемейства М9А и М9В типа М09.002 (коллагеназа I) и M09.003 (коллагеназа II) металлопептидаз MEROPS, родов Vibrio и Clostridium.– M9A и M9B. Такие коллагеназы имеют номер EC 3.4.24.3 [9].
Биосинтез коллагеназы проводят путем культивирования продуцентов на питательных средах, содержащих мясопептонный бульон, аминокислоты и другие вещества. Вместе с тем отмечается тенденция производ- ства коллагеназы путем культивирования микроорганизмов на растительных пептонах [10, 11].
Но вместе с тем, биосинтез коллагеназы бактериями рода Clostridium имеет недостаток - одновременно происходит синтез целого ряда протеолитических ферментов, в частности, клострипаин, эластаза, желатиназа и др., что не позволяет проводить эффективное получение заданного фермента [12]. Более того, клострипаин разрушает коллагеназу, так как она является для него субстратом [13].
При анализе рынка протеолитических ферментных препаратов, предназначенных для использования в биотехнологических, медицинских, ветеринарных и косметических целях, содержащих фермент коллагеназу, установлено, что в составе ферментных препаратов содержатся ферменты, продуцируемые бактериями рода Clostridium или содержащимися в пищеварительном тракте рыб и камчатского краба [14, 15].
В связи с этим целью исследования является разработка технологии получения протеолитического ферментного препарата на основе коллагеназы, выделенной из внутренностей рыбы и исследование биокаталитической активности в зависимости от рН и температуры.
Объекты и методы исследований
Протеолитическую активность (ПА) ферментного препарата определяли методом Ансона по ГОСТ 20264.2-88 рассчитывали по формуле, в качестве субстрата использовали коллаген, рН устанавливали с помощью фосфатно-буферного раствора, за единицу проте- олитической активности брали количество фермента, которое катализирует переход в не осаждаемый трихлоруксусной кислотой оса- док - количество субстрата, содержащее
1 мкмоль тирозина:
ПА =
cx Dx 10 О О
ТЭх 1 Охт '
где с - отношение объемов реакционной смеси и раствора ферментного препарата после добавления трихлоруксусной кислоты; D - оптическая плотность раствора; ТЭ - тирозиновый эквивалент, определяемый по калибровочной прямой (мкмоль/см3); 10 - продолжительность гидролиза (мин); m - масса ферментного препарата для реакции в 1 см3 раствора (мг); 1000 - коэффициент пересчета мг в г.
За 100 % активности исследуемого ферментного препарата брали максимальную определенную нами активность 543 ед./г.
Обработку сырья сверхвысоким давле- нием проводили с помощью гидростата, принципиальная схема которого представлена на рис. 1.
Установка для обработки рыбного сырья сверхвысоким давлением представляет собой рабочую камеру, заполненную жидкостью (дистиллированной водой и глицериновым маслом), которая является средой, передающей давление на продукт. Для создания давления используется мощный гидравлический насос. Рабочая камера выполнена из стали с толщиной стенок 5–10 см в зависимости от величины давления, которое создается в ней. В рабочую камеру вмонтирован клапан, через который выходит воздух при заполнении ка-
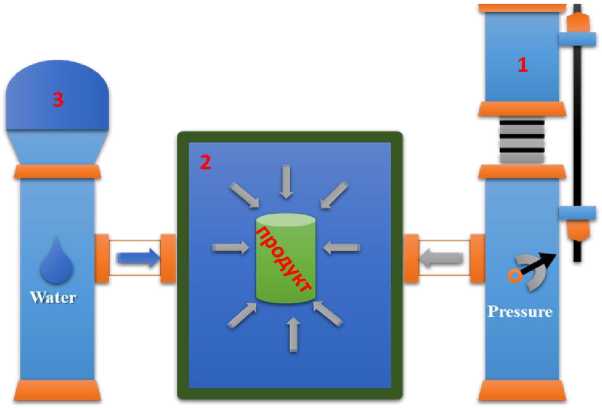
Рис. 1. Принципиальная схема установки для обработки сырья
меры продуктом и передаточной жидкостью. После того, как в камере давление достигло требуемой величины, начинается декомпрессия, путем открытия выпускного клапана. Пищевой продукт в рабочей камере равномерно обрабатывается сверхвысоким давлением со всех сторон. Для обработки сверхвысоким давлением следует отбирать сырье с высоким содержанием воды, в частности, органы пищеварительной системы рыбы. При обработке сырья сверхвысоким давлением отмечается некоторое повышение температуры, так как при возрастании давления совершается работа и, соответственно, происходит некоторое нагревание продукта, поэтому, в нашей технологии лучше использовать замороженное рыбной сырье.
Также при рассмотрении влияния сверхвысокого давления на сырье целесообразно рассмотреть возможность использования различных видов упаковки.
К упаковке предъявляются следующие требования:
– не должна иметь незаполненных пространств или содержать воздух (необходимо упаковывать в вакуумной машине);
– упаковочный материал должен быть прочным, гибким, обладать обратимой деформацией и быть без структурных повреждений.
Экстракцию и гомогенизацию рыбного сырья, обработанного сверхвысоким давлением, осуществляли в универсальной синхронно-смесительной установке на кафедре пищевой инженерии Уральского государственного экономического университета. Используемая установка предназначена для выполнения комплексных задач по смешиванию, эмульгированию, охлаждению, пастеризации (рис. 2).
Экстракцию и гомогенизацию проводили в изотоническом растворе в соотношении 1:3 при температуре 35–37 °С в течение 3–4 часов с частотой вращения лопастей 100–200 оборотов в минуту. Температуру задавали с помощью блока управления, регулирующего работу компрессора, входящего в комплексную синхронно-смесительную установку. При нормальном режиме работы происходит циклический опрос всех датчиков, подключенных к системе, все данные передаются на компьютер, подключенному к устройству. На дисплей выводится текущая температура. Температура сырья устанавливается с помощью кнопки «Охлаждение» на блоке управления, или «Нагрев» в ручном режиме, или с помощью установленной на компьютере программы. Процесс смешивания также аналогично контролируется с помощью компьютерной программы и кнопки «Смеситель», которая включает соответствующее устройство, состояние каждого исполнительного элемента индицируется соответствующим светодиодом и индикатором дисплея. Работа всех кнопок дублируется на компьютере. С помощью режима «Редактирование настроек» устанавливается необходимая температуру смешивания и частота вращения лопастей в смесителе.

Рис. 2. Универсальная синхронносмесительная установка
Процесс ультрафильтрации проводили в лабораторных условиях на установке, представленной на рис. 3.
Установка ультрафильтрации состоит из следующих основных узлов и элементов. Циркуляционный бак 1 объемом 50 литров предназначен для загрузки исходного ферментного раствора и слива готового продукта после ультрафильтрации. Милливольтметр 2 необходим для наблюдения за температурой раствора в процессе ультрафильтрации посредством контроля электродвижущей силы, наводимой в соединенной с ним термопаре 6 типа «хромель-алюмель». Для компенсации влияния температуры окружающей среды использован классический сосуд Дьюара 3 в виде герметич-
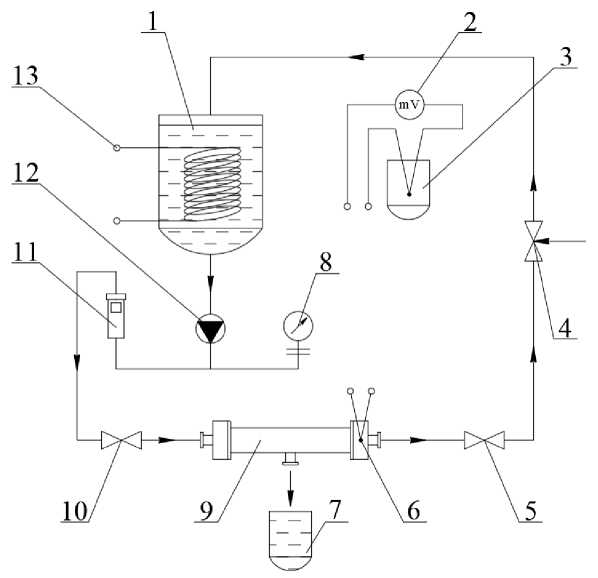
Рис. 3. Схема установки для получения раствора ферментного препарата методом ультрафильтрации: 1– бак для исходного раствора/готового концентрата; 2 – милливольтметр; 3 – сосуд Дьюара; 4 – регулировочный вентиль; 5, 10 – вентили; 6 – термопара; 7 – сосуд для отвода пермеата; 8 – манометр с разделителем; 9 – ультрафильтрационная ячейка; 11 – ротаметр; 12 – насос; 13 – змеевик
ной емкости из пенопласта с помещенным вовнутрь льдом. Регулировочный вентиль 4 предназначен для управления давлением внутри контура при работе установки. Вентили 5 и 10 предназначены для герметичного отключения части контура системы при сборке и разборке ультрафильтрационной ячейки 9. Сосуд 7 предназначен для отвода пермеата в процессе получения ферментного препарата. Ротаметр 11 предназначен для определения расхода исходного раствора сырья. Центробежный насос 12 служит для создания давления в контуре и обеспечивает необходимую для ультрафильтрации скорость потока ферментного препарата. Змеевик 13 служит для изменения температуры раствора в процессе работы установки с помощью подачи через него воды заранее известной температуры.
Все металлические детали установки, контактирующие с раствором, выполнены из нержавеющей стали 12Х18Н10Т. Основным рабочим элементом установки является ультрафильтрационная ячейка 9. Она представляет собой цилиндр длиной 900 миллиметров, в который помещаются керамические мембраны КУФЭ длиной 800 миллиметров с размером пор 21 кДа, изготовленные из диоксида титана анатазной модификации с напыленным селективным слоем α-оксида алюминия.
Работа установки заключается в разделении исходного раствора, поданного в циркуляционный бак, на ферментный препарат и водный раствор, непрерывно отводящийся из аппарата.
Результаты и их обсуждение
Разработана технология получения ферментного препарата:
– выделение внутренностей кеты;
– обработка сверхвысоким давлением 100–200 МПа в течение 60 с;
– измельчение до частиц 500–600 мкм;
– экстракция и гомогенизация в изотоническом растворе в соотношении 1:3 при температуре 35–37 °С в течение 3–4 часов с частотой вращения 100–200 оборотов в минуту;
– центрифугирование (3000 об./мин);
-
– ультрафильтрация через керамические мембраны с лимитом пропускания до 21 кДа;
-
– упаковка в полиэтиленовые пакеты емкостью 50 мл;
-
– стерилизация сверхвысоким давлением в 300 МПа в течение 60–120 с.
В технологии получения ферментного препарата использован процесс гомогенизации, позволяющий в результате механического воздействия разрушить лизосомы клеток внутренних органов рыбы, где локализуются протеолитические ферменты в неактивной форме (иначе активные ферменты гидролизовали бы клетки рыбы), следует отметить, что предварительное измельчение внутренних органов рыбы увеличивает скорость экстракции ферментов в раствор, что согласуется с результатами исследований [16].
Используемая нами мембранная ультрафильтрация гомогенизата внутренних органов кеты позволяет удалить из раствора нерастворимые липидно-белковые комплексы с большой молекулярной массой, что согласуется с исследованиями [17].
Предложенная технология выделения фермента из отходов рыбного сырья (внутренностей) будет экономически целесообразной по сравнению с ферментами микробного синтеза, в частности, микробной коллагеназой, так как источник сырья – отходы рыбной промышленности достаточно доступны и дешевы, что согласуется с результатами исследований [18]. Обработка полученного ферментного препарата сверхвысоким давлением позволяет увеличить его стабильность при хранении, путем бактерицидного действия на микрофлору, что доказано в исследованиях [19] по обработке животного сырья высоким давлением в сочетании с активной упаковкой на основе эфирного масла. Установленный автором [20] синергетический эффект применяемых воздействий способствует снижению количества L. monocytogenes ниже предела обнаружения в течение 60 суток хранения при низких положительных температурах (от 0 до 4 °С). Однако при повышении температуры хранения до 8 °С рост L. monocytogenes возобновлялся. Следовательно, полученный ферментный препарат следует хранить при низких положительных температурах – менее 4 °С. Об эффективности обработки высоким давлением в отношении снижения общего количества аэробных и молочнокислых бактерий в сырье животного происхождения сообщается в работе [21].
На рис. 4 представлено влияние рН на активность фермента ферментного препарата при температуре 40 ° С.
Из рис. 4 следует, что активность ферментного препарата зависит от рН и максимальная активность (100 %) при рН на уровне 8. Сдвиг рН в щелочную сторону приводит к снижению активности. Так, активность ферментного препарата при рН 10 составляет 89 %. Оптимум активности образцов ферментного препарата наблюдается при рН от 7 до 9.
На рис. 5 представлено влияние температуры на активность ферментного препарата при установленном нами оптимуме рН 8.
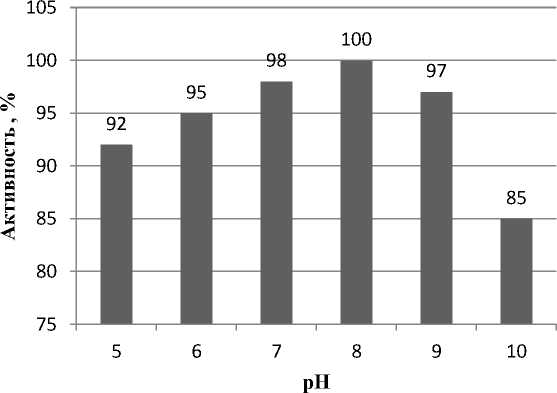
Рис. 4. Влияние рН на активность ферментного препарата при температуре 40 °С, %
ферментный препарат
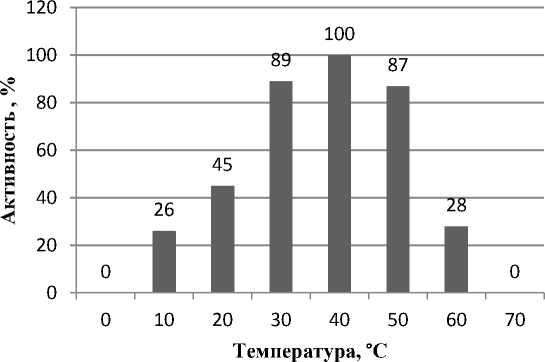
Рис. 5. Влияние температуры на ферментный препарат при оптимуме рН 8
ферментный препарат
Повышение температуры до определенных пределов увеличивает скорость любой химической реакции, так как с повышением температуры увеличивается скорость движения молекул и, соответственно, взаимодействие химических веществ, ускоряется скорость реакции. Но для реакции с участием фермента-катализатора характерен температурный оптимум, при превышении которого происходит денатурация активного центра фермента. Установлено, что оптимум каталитической активности ферментного препарата находится при температурном режиме от 37 до 42 ° С. Результаты исследований согласуются с данными [21, 22] по аналогичному влиянию рН и температуры на протеолитическую активность ферментного препарата, сходного по эффективности с коллагеназой и имеющего полный набор протеиногенных аминокислот с преобладанием аспаргина и глютамина.
Выводы
Разработана технология производства ферментного препарата из рыбного сырья, включающая обработку органов пищеварительной системы рыбы кеты сверхвысоким давлением 100–200 МПа в течение 60 с, измельчение сырья с последующей экстракцией и гомогенизацией в изотоническом соотношении 1:3 при температуре 35–37 °С в течение 3–4 часов с частотой вращения 100–200 оборотов минуту, центрифугирование ультрафильтрации через керамические мембраны с лимитом пропускания до 21 кДа, упаковка в полиэтиленовые пакеты емкостью 50 мл и стерилизация сверхвысоким давлением. При производстве ферментного препарата по указанной технологии с целью недопущения инактивации фермента проводится контроль температурного режима при гомогенизации с помощью установления необходимой температуры, регулирующей работу компрессора с охлаждающей жидкостью. Используемая технология ультрафильтрации гомогенизата заключается в разделении исходного раствора, поданного в циркуляционный бак, на ферментный препарат и водный раствор, непрерывно отводящийся из аппарата. При ультрафильтрации гомогенизата регуляции температуры использован классический сосуд Дьюара в виде герметичной емкости из пенопласта с помещенным вовнутрь льдом. В результате исследований установлено влияние рН и температуры на биокаталитическую активность ферментного препарата. Определен оптимум рН (7–9) активности ферментного препарата. Сдвиг рН в щелочную сторону приводит к снижению активности. Установлено, что оптимум каталитической активности ферментного препарата находится при температурном режиме от 37 до 42 °С.
Список литературы Технология производства и биокаталитические свойства протеолитического ферментного препарата
- Egui Rojo M.A., Moncada Iribarren I., Carballido Rodriguez J., Martinez-Salamanca J.I. Experience in the use of collagenase Clostridium histolyticum in the management of Peyronie's disease: current data and future prospects // Therapeutic Advances in Urology. 2014. Vol. 6, No. 5. P. 192-197. DOI: 10.1177/1756287214537331
- Murphy A., Lalonde D.H., Eaton C. et al. Minimally invasive options in Dupuytren's contracture: aponeurotomy, enzymes, stretching, and fat grafting // Plastic and Reconstructive Surgery. 2014. Vol. 134, No. 5. P. 822-829.
- Eckhard U., Huesgen P.F., Brandstetter H., Overall C.M. Proteomic protease specificity profiling of clostridial collagenases reveals their intrinsic nature as dedicated degraders of collagen // Journal of Proteomics. 2014. Vol. 100. P. 102-114.
- Daboor S.M., Budge S.M., Ghaly A.E. et al. Isolation and activation of collagenase from fish processing waste// Advances in Bioscience and Biotechnology. 2012. Vol. 3. P. 191-203.
- Souchet N., Laplante S. Recovery and characterization of a serine collagenolytic extract from snow crab (Chionoecetesopilio) byproducts // Applied Biochemistry and Biotechnology. 2011. Vol. 163. P. 765-779.
- Руденская Г.Н., Можина Н.В. Коллаге-нолитические ферменты патогенных микроорганизмов // Биомедицинская химия. 2004. № 6. С.539-553.
- Pat. WO 2013177647 A1 Meio de cultura para bacterias do genero clostridium livre de componentes de origem animal e processo para produ^ao de sobrenadantecontendoumaoumais proteases com atividadecolagenolitica e gelatinolitica / M.C. Alegria, L.C. Fardelone, M.B.R. Delalana, J.E. Thiemann, F.S. Astolfi, R.C.D. Moreira, O. De Castro Pacheco. 5 December 2013.
- Pat. US 8715985 B2 Clostridium histolyticum recombinant collagenases and method for the manufacture thereof / F. Bertuzzi, A. Cuttitta, G. Ghersi, S. Mazzola, M. Salamone, G. Seidita. 6 May 2014.
- Duarte A.S., Correia A., Esteves A.C. Bacterial collagenases: A review // Critical Reviews in Microbiology. 2014. Epub ahead of print.
- Certificate of Origin Policy (TSE/BSE) 01-000-014 Rev. 1 Effective Date: August 3, 2005 // Sigma-Aldrich. URL: https://www. sigmaaldrich.com/content/dam/sigmaaldrich/cou ntries/italy/certOfOriginPolicy. pdf (accessed: 01.07.2015).
- Pat. WO 2013177647 A1 Meio de cultura para bacterias do genero Clostridium livre de componentes de origem animal e processo para produ^ao de sobrenadantecontendoumaoumais proteases com atividadecolagenolitica e gelatinolitica / M.C. Alegria, L.C. Fardelone, M.B.R. Delalana, J.E. Thiemann, F.S. Astolfi, R.C.D. Moreira, O. De Castro Pacheco. 5 December 2013.
- Jozwiak J., Grzela T., Jankowska-Steifer E. et al. Lethal factor of Clostridium histolyticum kills cells by apoptosis // FEMS Immunology and Medical Microbiology. 2007. Vol. 49. P. 296-303.
- Wang H., Van Blitterswijk C.A., Bertrand-De Haas M. et al. Improved enzymatic isolation of fibroblasts for the creation of autologous skin substitutes // In Vitro Cellular & Developmental Biology - Animal. 2004. Vol. 40. No. 89. P. 268-277.
- Патент 2484811 РФ МПК A61K 38/43 Ферментный ранозаживляющий препарат / Демина Н.С., Рототаев Д.А. (РФ) -№ 2011133921, заявл. 15.08.2011, опубл. 20.06.13.
- Патент 2280076 РФ C12N9/48 C12N9/64 Ферментный препарат из гепато-панкреаса промысловых видов крабов и способ его получения: на изобретение / Артюков А.А., Мензорова Н.И., Козловская Э.П., Ко-фанова Н.Н., Козловский А.С., Рассказов В.А. (РФ) - № 2004135771/13, заявл. 06.12.04.; опубл. 20.07.2006.
- Патент РФ № 2610669 Способ получения протеолитического препарата для медицинского применения Авторы: Зайчук Марина Патентообладатель: Общество с ограниченной ответственностью «Научно-исследовательский институт средств противоожоговой терапии» (RU) Дата подачи заявки: 16.10.2015. Опубл.: 14.02.2017. Бюл. № 5.
- Патент RU №2352634 C12N9/00 Способ получения ферментного препарата из рыбного сырья. Авторы: Артюхов И.Л., Ива-нушко С.Н., Коваль С.Я., Черевко Е.А. Патентообладатель: ООО «Дальтехфермент» (RU). Дата подачи заявки: 15.11.2007 опубл. 20.04.2009.
- Daboor S.M., Budge S.M., Chaly А.Е., et al. Extraction and Purification of Collagenase Enzymes: A Critical Review // American Journal of Biochemistry and Biotechnology. 6 (4): 239263,2010.
- Andreou V., Tsironi, T., Dermeson-louoglou, E., Katsaros, G., Taoukis, P.S. (2018). Combinatory effect of osmotic and high pressure process in on shelf life extensions animal origin products - Application to child characteristics // Food Packaging and Shelf Life, 15, 43-51. DOI: 10.1016/j .fpsl.2017.11.002
- Stratakos, A.C., Delgado-Pando, G., Linton, M., Patterson, M.F., Koidis, A. (2015). Synergism between high-pressure processing and active packaging against listeria monocytogenes in ready-to-eat chicken breast // Innovative Food Science and Emerging Technologies, 27, 41-47. DOI: 10.1016/j .ifset.2014.11.005
- Антипова, Л.В. Физико-химические и биокаталитические свойства протеолитического комплекса препарата «Протепсин» /Л.В. Антипова, М.В. Горбунков // Вестник Воронежского государственного университета инженерных технологий. 2016. № 1. С. 89-93. DOI: 10.20914/2310-1202-2016-1-89-95
- Antipova, L.V. The experience of enzyme preparations application in the processing of animal origin raw materials / L.V. Antipova, M.Y.Gorbunkov, S.A. Storublevtsev // European Journal of Natural History. 2015. № 2. P.42-43.


