Temperature stress and consequences of its influence on functional activity of mitochondria in maize etiolated seedlings
Автор: Grabelnych O.I., Pobezhimova T.P., Koroleva N.A., Fedoseeva I.V., Stepanov A.V., Lyubushkina I.V., Zhivetev M.A., Graskova I.A., Voinikov V.K.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 3 т.11, 2015 года.
Бесплатный доступ
Treatments of 30-min influences of high (32, 37, 42, 47, 52 °С) and low (0, 17, 22 °С) temperatures on viability of shoots, common activity of peroxidase, content of reactive oxygen species (ROS), intactness and oxidative activity of mitochondria from etiolated maize seedlings have been studied. It has been shown that 17, 32, 37 и 42 °С temperatures cause intensification of peroxidase activity, and 52 °С depresses this enzyme activity and then led to total death of shoots. ROS content in mitochondria increased during the treatment of seedlings with 0, 17, 22, 37 и 42 °С temperatures. All temperature exposures led to decrease of succinate oxidation rates in mitochondria, at that 47 и 52 °С temperatures inhibited mitochondria respiration to an even greater degree. However, if after the action of the temperature 47 °C the phosphorylating activity was maintained in the mitochondria, after 52 °C it was absent and mitochondria had reduced intactness of outer mitochondria membrane. Low temperatures led to uncouple of oxidative phosphorylation and activating of cyanide-resistant respiration. Role of mitochondria in plant response on the temperature stress has been discussed.
Temperature stress, survival, peroxidase, mitochondria, reactive oxygen species, intactness, oxidative activity, maize
Короткий адрес: https://sciup.org/14323930
IDR: 14323930
Текст научной статьи Temperature stress and consequences of its influence on functional activity of mitochondria in maize etiolated seedlings
В жизни любого организма, а особенно растений, температура окружающей среды является одним из основных факторов, определяющих его существование. Изменение температуры ведет к самым разнообразным и часто неблагоприятным последствиям. Одним из таких последствий является развитие окислительного стресса, связанного с избыточной генерацией активных форм кислорода (АФК). Показано усиление образования АФК при повышении температуры в культурах клеток табака, арабидопсиса и озимой пшеницы (Volkov et al., 2006; Lokato et al., 2008; Fedyaeva et al., 2014). Увеличение содержания АФК и продуктов перекисного окисления липидов происходит и при действии на растения низких температур (Suzuki, Mittler, 2006; Xu et al., 2013; Grabel’nykh et al., 2014; Lyubushkina et al., 2014). Избыточная генерация АФК в клетках растений может приводить к дисфункции митохондрий и гибели клеток (Marchi et al., 2012; Weir et al., 2003). В то же время митохондрии сами являются источником АФК (Møller, 2001, 2007; Schwarzlander, Finkemeir, 2013). В нефотосинтезирующих частях растений митохондрии и их электрон-транспортная цепь (ЭТЦ) вносят основной вклад в продукцию АФК в клетке (Møller, 2001, 2007). На культуре клеток и этиолированных проростках растений показано, что митохондрии являются основным источником генерации АФК в них при тепловом и холодовом шоке (Vacca et al., 2004; Grabel’nykh et al., 2014; Fedyaeva et al., 2014; Lyubushkina et al., 2014). АФК, образующиеся в митохондриях, могут выступать в качестве сигнальных молекул, участвующих в передаче внутриклеточных сигналов, регуляции экспрессии генов и активации защитных систем клетки или запуске программ клеточной гибели (Gray et al., 2004; Rhoads et al., 2006; Volkov et al., 2006).
Регуляция функционирования митохондрий важна для поддержания клеточного гомеостаза в клетках растений при стрессе (Schwarzlander, Finkemeir, 2013). В условиях стресса возрастает потребность в энергии для поддержания целостности и функциональной активности внутриклеточных структур, поэтому сохранение сопряжения процессов окисления и фосфорилирования в митохондриях необходимо для развития адаптивных реакций. Ранее изучалась энергетическая активность митохондрий кукурузы под действием повышенных температур на побеги и культуру клеток (Pobezhimova et al. , 1990; Varakina et al. , 1991). Было установлено, что действие температур 36, 41 и 46 °С в течение 3 ч не приводит к изменению энергетической активности митохондрий, а температура 51 °С вызывает резкое снижение скорости дыхания митохондрий. Происходит ли при этом генерация в митохондриях АФК и, какие комплексы ЭТЦ в большей степени задействованы в этом процессе, неизвестно.
Одним из ферментов, участвующих в детоксикации АФК в стрессовых условиях, является пероксидаза. Пероксидазы (ЕС 1.11.1.7) относятся к оксидоредуктазам с широким спектром субстратов (Zaharova et al., 2011), и катализируют большинство реакций, протекающих во всех типах тканей и органелл живых организмов, включая окислительно-восстановительные реакции фотосинтетического аппарата растительных клеток и энергетического обмена митохондрий (Andreeva, 1988). Наличие множества изоформ этого фермента, кодируемых разными участками генома, позволяет ей быть как ткане- так и органелл-специфичным ферментом (Andreeva, 1988; Davydova et al., 1998). Благодаря своей выраженной функциональной значимости для растительного организма и его тонкой генетической и метаболической регуляции (Andreeva, 1988), этот фермент способен быстро реагировать на внешние воздействия и активно участвовать в быстром ответе на стресс и в формировании длительной адаптации. Пероксидазу также отличает высокая термостабильность (Müftügil, 1985; Thongsook, Barrett, 2005; Fedulov et al., 2006) и способность долго сохранять функциональность вне живого организма (Andreeva, 1988).
Целью работы явилось изучение влияния флуктуации температуры среды (низкие – фоновые – высокие температуры) на активность пероксидазы в побегах кукурузы, выживаемость побегов и функциональную активность изолированных из них митохондрий.
MATERIALS AND METHODS
В работе использовали этиолированные проростки кукурузы (Zea mays L., гибрид Катерина СВ), выращенные на влажной фильтровальной бумаге при 27°С в темноте в течение 4 суток. Побеги проростков в возрасте 4-х суток срезали и помещали в стакан с водой с температурой 0, 17, 22, 27, 32, 37, 42, 47 или 52 °С в инкубатор на 30 мин. После обработки одну часть побегов оставляли на отрастание при температуре 27°С для определения их жизнеспособности, а другую часть использовали для определения общей активности пероксидазы и выделения митохондрий.
Жизнеспособность побегов кукурузы определяли по их отрастанию через 5 суток после действия температуры. Количество выживших побегов оценивали в процентах от общего числа побегов.
Выделение и определение общей активности гваякол-пероксидазы осуществляли по стандартной методике как описано в работе (Romanova et al. , 2013).
Митохондрии выделяли из побегов проростков с помощью дифференциального центрифугирования по ранее опубликованной методике (Grabel’nykh et al. , 2011).
Общее содержание АФК в изолированных митохондриях определяли с использованием 1 мкМ 2’,7’-дихлорофлуоресцеин диацетата (H2DCF-DA) по методике, опубликованной ранее (Korsukova et al., 2013). Флуоресценцию DCF измеряли на спектрофлуорофотометре RF-5301PC (SHIMADZU, Япония). Для возбуждения флуоресценции DCF использовали свет с длиной волны 480 нм, испускание регистрировали при длине волны 524 нм.
Скорости поглощения кислорода митохондриями определяли с использованием кислородного электрода Кларка и полярографа Oxytherm system (“Hansatech Inst.”, Англия) в ячейке объемом 1,4 мл при 26 °С. Реакционная среда содержала 18 мМ КН 2 РО 4 , 125 мМ КСl, 1 мМ МgСl 2 , 5 мМ ЭДТА, рН 7,4. В качестве субстрата окисления использовали 8 мМ сукцинат в присутствии 5 мМ глутамата и 3 мкМ ротенона. Рассчитывали скорость окисления сукцината в состоянии 3 (V 3 ) – скорость поглощения кислорода при фосфорилировании АДФ; состоянии 4 (V 4 ) -скорость поглощения кислорода после истощения АДФ; дыхательный контроль по Чансу и Вильямсу (ДК=V 3 /V 4 ) (Еstabrook, 1967). Максимальную скорость окисления сукцината измеряли в присутствии 100-200 мкМ АДФ.
Интактность внешней мембраны митохондрий рассчитывали по скорости аскорбат-зависимого стимулируемого цитохромом с KCN-чувствительного поглощения кислорода в отсутствие и в присутствии 0,04% Тритона Х-100 (Grabel’nykh et al. , 2014). Концентрацию митохондриального белка определяли согласно методу Лоури (Lowry et al. , 1951).
Представлены средние арифметические значения и их стандартные отклонения.
RESULTS AND DISCUSSION
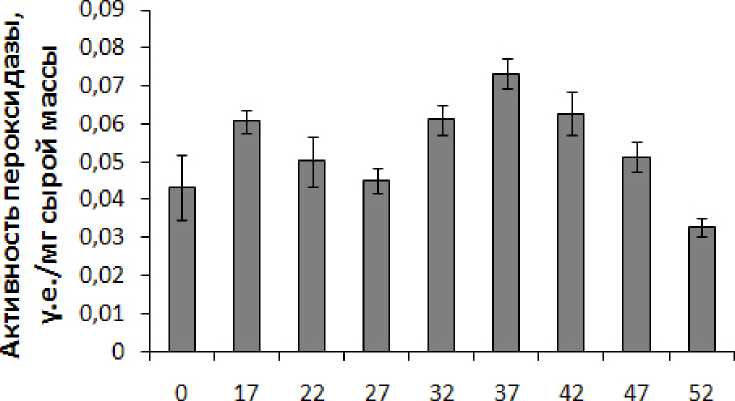
Из рис. 1 видно, что флуктуации температуры среды приводят к изменению активности гваякол-зависимой пероксидазы в тканях побегов кукурузы, при этом наблюдается два пика ее активности, один с максимумом при 17 °С, другой при 37 °С (рис. 1). Следует рассмотреть по отдельности действие повышенных и пониженных температур на активность пероксидазы в тканях побегов кукурузы. В диапазоне повышенных температур 32 – 42 °С происходило значительное увеличение активности данного фермента с максимумом при 37 °С, когда активность пероксидазы была на 63% выше по сравнению с контролем (рис. 1). При дальнейшем повышении температуры до 47 °С увеличение активности пероксидазы не было таким значимым, а повышение температуры воздействия до 52 °С приводило к угнетению активности фермента, которое составило 27% (рис. 1). В отличие от действия повышенных температур, на которые пероксидаза реагировала более выражено, понижение температуры среды на 5 °С – до 22 °С не сопровождалось достоверным изменением активности фермента (рис. 1). Увеличение активности пероксидазы происходило только после действия на побеги температуры 17 °С (на 35% по сравнению с контролем), а при 0 °С активность пероксидазы также не отличалась от ее активности при контрольной температуре (27 °С) (рис. 1).
Анализ выживаемости побегов кукурузы, подвергнутых температурной обработке, выявил, что в диапазоне температур 17 – 37 °С их жизнеспособность не изменяется или изменяется незначительно (рис. 2). В то же время повышение температуры воздействия до 42 °С приводило к гибели 30% проростков, температура 47 °С вызывала гибель 70% проростков, а температура 52 °С – гибель всех проростков (рис. 2). Охлаждение побегов кукурузы до 0 °С не сопровождалось значительным снижением выживаемости (рис. 2). Существует предположение, что генетически детерминированная устойчивость к стрессам коррелирует с уровнем антиоксидантной активности или способности клеток нарастить антиоксидантный потенциал (Polesskaya, 2007). Данные по изменению выживаемости побегов кукурузы после действия повышенных и пониженных температур согласуются с данными по изменению активности пероксидазы в тканях побегов кукурузы и свидетельствуют в пользу защитной роли этого антиоксидантного фермента при температурном стрессе.
Митохондрии растений являются источником образования АФК, при этом в генерации АФК принимают участие комплексы I, II и III ЭТЦ (Møller, 2001; Gleason et al., 2011). В зависимости от температурной обработки побегов было различным содержание АФК в изолированных из них митохондриях (рис. 3). После действия повышенных (37 и 42 °С) и пониженных (22, 17 и 0 °С) температур на побеги кукурузы наблюдали повышение содержания АФК в митохондриях (рис. 3). Наибольшее увеличение содержания АФК отмечали в митохондриях, изолированных из побегов, подвергнутых обработке температурами 37 °С (77%-ое увеличение), 42 °С (86%-ое увеличение), 17 °С (112%-ое увеличение) и 0 °С (84%-ое увеличение) (рис. 3). Отсутствие значимых изменений в содержании АФК в митохондриях кукурузы из побегов, подвергнутых воздействию температур 47 и 52 °С, может отчасти объясняться ингибированием активности ферментов эстераз, необходимых для отщепления диацетатного остатка от H2DCF-DA (Maxwell et al., 1999).
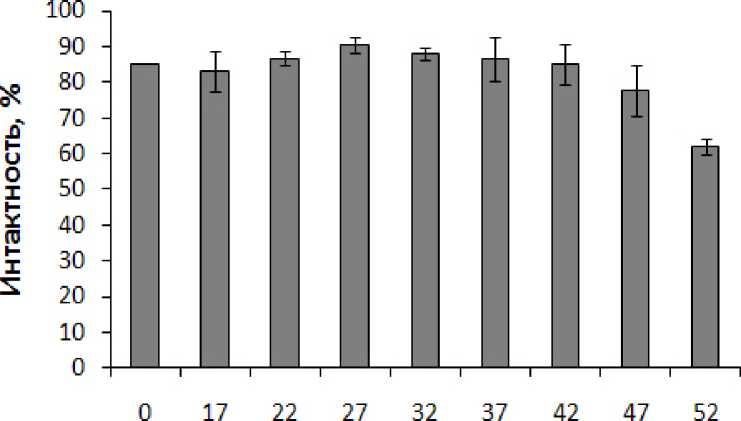
Повышенное содержание АФК в митохондриях в результате действия на побеги кукурузы пониженных температур (0, 17 и 22 °С), возможно, явилось одной из причин нарушения интактности мембран митохондрий (рис. 4), их окислительной и фосфорилирующей активности (рис. 5). В то же время при снижении температуры обработки побегов с 27 °С (температура выращивания кукурузы) до 22, 17 и, особенно 0 °С, в митохондриях возрастало цианид-резистентное дыхание, связанное с активацией альтернативной оксидазы (не показано). Если при температуре 27 °С цианид-резистентное дыхание в митохондриях составляло около 8%, то при понижении температуры до 22, 17 и 0 °С оно возрастало до 12, 16 и 21%, соответственно.
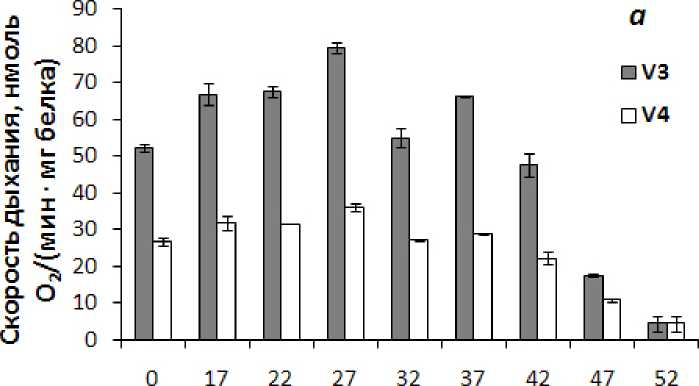
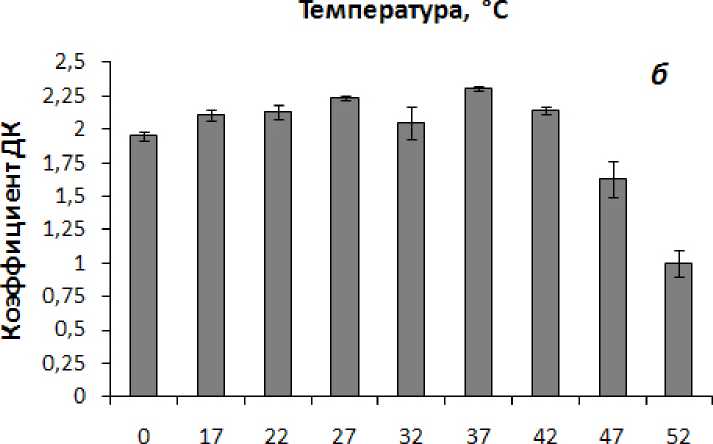
Анализ окислительной активности митохондрий кукурузы выявил, что все изученные в работе температуры в той или иной степени вызывают снижение скорости окисления субстрата – сукцината (рис. 5а). Наряду со снижением скорости окисления сукцината митохондриями воздействие повышенных температур 42-52 °С приводило к снижению степени сопряжения процессов окисления и фосфорилирования в митохондриях, о чем свидетельствует падение коэффициента ДК (рис. 5б). Значительное ингибирование скорости окисления сукцината митохондриями при 52 °С сопровождалось отсутствием перехода митохондрий в состояние дыхательного контроля (рис. 5б). Интерес представляют данные по некоторой стимуляции скорости фосфорилирующего дыхания митохондрий кукурузы при температуре 37 °С, по сравнению с температурой 32 °С, и связанное с этим возрастание коэффициента ДК (рис. 5).
Температура, °C
Figure 1. Активность гваякол-зависимой пероксидазы в побегах кукурузы, подвергнутых 30-минутной температурной обработке. n=18. M±S.D.
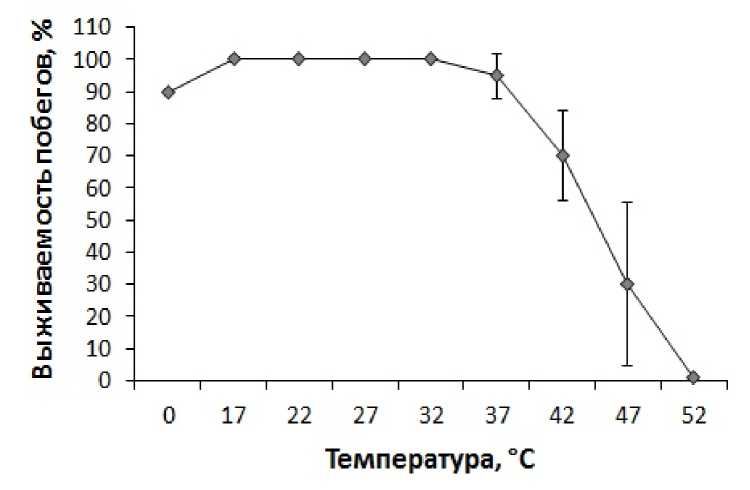
Figure 2. Выживаемость побегов кукурузы, подвергнутых 30-минутной температурной обработке.
n=30. M±S.D.
Q
го
ф о ф Q
О
Ф
I— 5
е
о
500 -|
450 -
400 -
350 -
300 -
250 -
200 -
150 -
100 -
50 -О -
0 17 22 27 32 37 42 47 52
Температура, °C
-
Figure 3. Содержание АФК в митохондриях, изолированных из побегов кукурузы, подвергнутых 30-минутной температурной обработке. n=6. M±S.D.
Температура, °C
-
Figure 4. Интактность внешней мембраны митохондрий, изолированных из побегов кукурузы подвергнутых 30-минутной температурной обработке. n=3. M±S.D.
Температура, °C
Figure 5. Скорость окисления сукцината ( а ) и коэффициент ДК ( б ) в митохондриях, изолированных из побегов кукурузы, подвергнутых 30-минутной температурной обработке. n=3-4. M±S.D.
Обозначения: V 3 – скорость фосфорилирующего дыхания (состояние 3), V 4 – скорость нефосфорилирующего дыхания (состояние 4), коэффициент ДК – коэффициент дыхательного контроля по Чансу и Вильямсу (V 3 /V 4 ).
Таким образом, в этиолированных побегах кукурузы выявлены закономерности изменения активности антиоксидантного фермента -пероксидазы и функциональной активности митохондрий при действии повышенных и пониженных температур. Известно, что слабое внешнее воздействие на организм, расположенное в зоне его экологической толерантности, оказывает стимулирующий и адаптирующий эффект, а более сильное воздействие приводит к угнетению жизненных функций организма. Кукуруза является теплолюбивым растением, при воздействии температур в диапазоне 32-42 °С у проростков кукурузы включаются адаптационные механизмы, о чем свидетельствует возрастающая активность пероксидазы, в отличие от действия повреждающей температуры 52 °С, когда активность фермента снижается. Известно, что для кукурузы температуры 32-47 °С относятся к закаливающим, а температура 52 °С – повреждающей; температуры 17-27 °С относятся к фоновым, а температура 0 °С – повреждающей (Titov et al., 2006). Повреждение побегов кукурузы при температуре 42 и 47 °С и отсутствие значимого повреждения при температуре 0 °С (рис. 2) вероятно объясняется тем, что используемый в нашей работе гибрид кукурузы является холодостойким, поэтому температурные границы зон теплового и холодового закаливания у него смещены.
В этиолированных тканях митохондрии являются основным источником АФК (Møller, 2001). Можно предположить, что образующиеся в митохондриях АФК могут выполнять сигнальную функцию и приводить к усилению синтеза белков теплового шока при тепловом стрессе или синтеза белков холодового шока при холодовом стрессе. При этом, если при стрессе в митохондриях сохраняется фосфорилирующая активность, то клетки растений остаются жизнеспособными, если же процесс фосфорилирования нарушен, то они погибают. В дальнейшем планируется выявить компоненты ЭТЦ митохондрий, ответственные за генерацию АФК при действии повышенных и пониженных температур на растения.
ACKNOWLEDGEMENT
Авторы благодарны за помощь в работе Т.Е. Путилиной. Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 15-04-06533).
Список литературы Temperature stress and consequences of its influence on functional activity of mitochondria in maize etiolated seedlings
- Andreeva V.A. (1988) Ferment peroksidaza. M.: Nauka, 128 s.
- Davydova G.F., Ermakov O.A., Panasenko A.I. and Tishchenko (1988) Lekarstvennyje preparaty iz rastitelnogo syrja. Peroksidaza. Himija rastitelnogo syrja, 1, 15-18
- Estabrook R.W. (1967) Mitochondrial respiratory control and the polarografic measurement of ADP:O ratio. Methods Enzimol., 10, 41-47
- Fedulov A.L., Spiridovich E.V. and Rahmanko E.M. (2006) Vydelenije peroksidazy iz obolochek semeni soi. Trudy Belorusskogo gosudarstvennogo universiteta. Serija “fiziologicheskije, biohimicheskije I molekuljarnyje osnovy funktsionirovanija biosistem”, 1, 212-220.
- Fedyaeva A.V., Stepanov A.V., Lyubushkina I.V., Pobezhimova T.P. and Rikhvanov E.G. (2014) Heat shock induces production of reactive oxygen species and increases inner mitochondrial membrane potential in winter wheat cells. Biochemistry (Mosc.), 79(11), 1202-1210
- Gleason C., Huang S., Thatcher L.F., Foley R.C., Anderson C.R., Carroll A.J., A.H. Millar and Singh K.B. (2011) Mitochondrial complex II has a key role in mitochondrial-derived reactive oxygen species influence on plant stress gene regulation and defense. PNAS, 108(26), 10768-10773
- Grabel’nykh O.I., Kirichenko K.A., Pobezhimova T.P., Borovik O.A., Pavlovskaya N.S., Lyubushkina I.V., Koroleva N.A. and Voinikov V.K. (2014) Influence of cold shock on the fatty acid composition and functional state of mitochondria in hardened and nondhardened seedlings of winter wheat. Biologicheskie membrany, 31(3), 204-217.
- Grabel’nykh O.I., Pobezhimova T.P., Pavlovskaya N.S., Koroleva N.A., Borovik O.A., Lyubushkina I.V. and Voinikov V.K. (2011) Antioxidant function of alternative oxidase in mitochondria of winter wheat during cold hardening. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology, 5, 249-257
- Gray G.R., Maxwell D.P., Villarimo A.R. and McIntosh L. (2004) Mitochondria/nuclear signaling of alternative oxidase gene expression occurs through distinct pathways involving organic acids and reactive oxygen species. Plant Cell Rep., 23, 497-503
- Korsukova A.V., Grabelnych O.I., Pobezhimova T.P., Koroleva N.A., Fedoseeva I.V., Pavlovskaya N.S., Lyubushkina I.V., Borovik O.A., Fedyaeva A.V, Voznenko S.A., Ilyushneva E.M. and Voinikov V.K. (2013) Cold hardening prevents H2O2-induced programmed cell death in maize coleoptiles. J. Stress Physiol. Biochem., 9, 246-257
- Locato V., Gadaleta C., De Gara L., and De Pinto M.C. (2008) Production of reactive species and modulation of antioxidant network in response to heat shock: a critical balance for cell fate. Plant Cell Environ., 31, 1606-1619
- Lowry O.H., Rosebrough N.J., Farr A.L. and Randall R.J. (1951) Protein measurement with the folin phenol reagent. J. Biol. Chem., 193, 265-275
- Lyubushkina I.V., Grabelnych O.I., Pobezhimova T.P. Stepanov A.V., Fedyaeva A.V., Fedoseeva I.V. and Voinikov V.K. (2014) Winter wheat cells subjected to freezing temperature undergo death process with features of programmed cell death. Protoplasma, 251, 615-623
- Marchi S., Giorgi C., Suski J.M., Agnoletto C., Bononi A., Bonora M., De Marchi E., Missiroli S., Patergnani S., Poletti F., Rimessi A., Duszynski J., Wieckowski M.R. and Pinton P. (2012) Mitochondrial-ROS crosstalk in the control of cell death and aging. J. Signal Transduction, 2012, 329635
- Maxwell D.P., Wang Y., McIntosh L. (1999) The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells. Proc. Natl. Acad. Sci., 96, 8271-8276
- Møller I.M. (2001) Plant mitochondria and oxidative stress: electron transport, NADPH turnover, and metabolism of reactive oxygen species. Annu. Rev. Plant Physiol. Plant Mol. Biol., 52, 561-591
- Møller I.M. (2007) Mitochondrial electron transport and oxidative stress. Plant Mitochondria. Annu. Plant Rev., 31, 185-211
- Müftügil N. (1985) The peroxidase enzyme activity of some vegetables and its resistance to heat. J. Sci. Food Agri., 36, 877-880
- Pobezhimova T.P., Varakina N.N., Voinikov V.K. (1990) Energeticheskaya aktivnost isolirovannyh mitohondrii i dyhanye intaktnyh kletok suspensionnoj kultury kukuruzy pri hipertermii. Phyziologiya rastenii, 22(6), 537-541.
- Polesskaya O.G. (2007) Rastitelnaya kletka i aktivnyje formy kisloroda: Uchebnoye posobie. M.: Izdatelstvo “KDU”, 140 s.
- Rhoads D.M., Umbach A.L., Subbaiah C.C. and Siedow J.N. (2006) Mitochondrial reactive oxygen species. Contribution to oxidative stress and interorganellar signaling. Plant Physiol., 141, 357-366
- Romanova I.M., Zhivet’yev M.A., Penzina T.A. and Graskova I.A. (2013) Dynamics of Pinus sylvestris L. needles activity in Predbaikal’ye forests. J. Stress Physiol. Biochem., 4, 139-144
- Schwarzlander M. and Finkemeir I. (2013) Mitochondrial energy and redox signaling in plants. Antioxid. Redox Signal., 18, 2122-2144
- Suzuki N. and Mittler R. (2006) Reactive oxygen species and temperature stresses: A delicate balance between signaling and destruction. Physiol. Plant., 126, 45-51
- Thongsook T. and Barrett D.M. (2005) Heat inactivation and reactivation of broccoli peroxidase. J. Agric. Food Chem., 53, 3215-3222
- Titov A.F., Akimova T.V., Talanova V.V. and Topchieva L.V. (2006) Ustojchivost rastenij v nachalnyj period dejstvija neblagoprijatnyh temperatur. M.; Nauka, 143 s.
- Vacca R.A., de Pinto M.C., Valenti D., Passarella S., Marra E. and De Gara L. (2004) Production of reactive oxygen species, alteration of cytosolic ascorbate peroxidase, and impairment of mitochondrial metabolism are early events in heat shock-induced programmed cell death in tobacco Bright-Yellow 2 cells. Plant Physiol., 134, 1100-1112
- Varakina N.N., Pobezhimova T.P. and Voinikov V.K. (1991) Dejistvie hipertermii na energericheskyuy aktivnost mitohondrii i rost prorostkov kukuruzy. Phyziologiya rastenii, 38(2), 304-311.
- Volkov R.A., Panchuk I.I., Mullineaux P.M. and Schoffl F. (2006) Heat stress-induced H2O2 is required for effective expression of heat shock genes in Arabidopsis. Plant Mol. Biol., 61, 733-746
- Weir I.E., Pham N.-A. and Hedley D.W. (2003) Oxidative stress is generated via the mitochondrial respiratory chain during plant cell apoptosis. Cytometry, 54A(2), 109-117
- Xu J., Li Y., Sun J., Du L., Zhang Y., Yu Q. and Liu X. (2013) Comparative physiological and proteomic response to abrupt low temperature stress between two winter wheat cultivars differing in low temperature tolerance. Plant Biol., 15, 292-303
- Zaharova G.S., Uporov I.V. and Tishkov V.I. (2011) Peroksidaza iz kornei hrena: modulirovanije svojistv himicheskoji modifikatsieji belkovoji globuly i gema. Uspehi biologicheskoji himii, 51, 37-64.


