Температурная градуировка устройства для измерения активности холинэстераз
Автор: Жуковский Ю.Г., Краснов Н.В., Паульс Я.И., Самокиш А.В., Самокиш В.А., Сочилина Е.Е.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Исследования, приборы, модели и методы анализа
Статья в выпуске: 2 т.17, 2007 года.
Бесплатный доступ
Зависимость активности ацетилхолинэстеразы эритроцитов и холинэстеразы плазмы человека от температуры была определена на специально созданной модели прибора. Линейная корреляция этой активности с температурой была найдена в интервале от 15 до 30 °C. Полученные результаты могут использоваться в переносных устройствах, работающих без термостатирования пробы.
Короткий адрес: https://sciup.org/14264487
IDR: 14264487 | УДК: 577.152.311-82
Текст научной статьи Температурная градуировка устройства для измерения активности холинэстераз
Скорость ферментативных реакций, как правило, зависит от температуры, поэтому при измерении активности ферментов применяется термостатирование проб. В портативных (переносных) приборах [1] необходимость термостатирования приводит к увеличению габаритов и энергопотребления, а также к снижению оперативности анализа. Альтернативным путем исключения влияния температуры окружающей среды на результат анализа является пересчет его к выбранной стандартной температуре исходя из значения температуры, измеренного при проведении анализа, и соответствующей градуировочной зависимости.
Цель настоящей работы — получение градуировочных зависимостей для измерения активности холинэстераз крови человека в разрабатываемых портативных приборах без термостатирования при применении известной [2] методики с использованием реактива БАС-Cl. Известно, что в крови человека содержатся две холинэстеразы — ацетил-холинэстераза эритроцитов (АХЭ) и холинэстераза плазмы (ХЭ). Методика предусматривает измерение суммарной активности в пробах цельной крови и активности ХЭ отделенной плазмы с последующим расчетом активности АХЭ.
Активность ферментов, по определению, является скоростью реакции, т. е. количеством продукта реакции, накапливаемого в единицу времени, при некоторых стандартных условиях, задающих тип субстрата, температуру и условия среды, в которых проводятся измерения скорости.
Скорость ферментативной реакции является при прочих равных условиях функцией концентрации субстрата, описываемой уравнением Ми-хаэлиса—Ментен:
v =
V m • ^
m где v — скорость реакции; Vm — максимальная скорость реакции; S— концентрация субстрата; Km — константа Михаэлиса.
В принципе, зависимость скорости от температуры при выбранной концентрации субстрата могла бы быть определена исходя из температурных зависимостей характеристических параметров Vm и Km . Для холинэстераз крови этот подход неприменим, поскольку уравнение (1) не соблюдается из-за эффектов торможения реакции высокой концентрацией субстрата АХЭ и активации высокой концентрацией субстрата ХЭ. Поэтому задачей настоящей работы стало получение эмпирических зависимостей скоростей реакций холинэстераз крови от температуры с целью использования их в качестве градуировочных при обработке данных на приборах, работающих без термостатирования измеряемой пробы, в заданных методикой условиях по составу реакционной смеси.
АППАРАТУРА И МЕТОДЫ
Опорные измерения активности холинэстераз проводили на спектроколориметре Spekol 221 (Zeiss, Jena). Этот прибор оснащен монохроматором, обеспечивающим выбор длины волны света (в отличие от большинства колориметров, использующих полосовые светофильтры), и термостатируемой измерительной кюветой малого объема (0.2 мл). Программное обеспечение прибора создает возможность проведения кинетических измерений, т. е. определение скорости прироста оптической плотности в измерительной кювете с задаваемым временным интервалом и регулируемым лаг-периодом. Активность ферментов определяли известным методом с использованием реактива Эллмана [3].
Использованы ферменты: АХЭ — препарат ацетилхолинэстеразы из эритроцитов крови человека с активностью 3.2 Е/мг производства пермского НПО "Биомед" (ацетилхолин: ацетилгидро-лаза, НФ 3.1.1.8) и ХЭ — холинэстераза из плазмы крови человека с активностью 7.4 Е/мг (ацилхо-лин: ацилгидролаза, НФ 3.1.1.7), полученная ранее описанным способом [4]. В качестве субстрата использовали ацетилтиохолин иодид (АТХ).
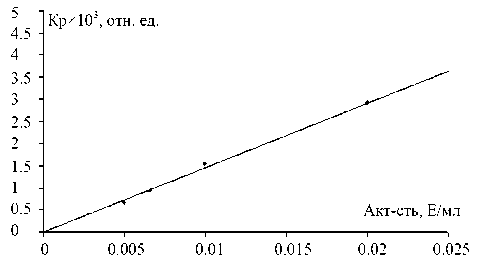
Рис. 1. Корреляция результатов измерения активности АХЭ при разных величинах активности в пробе. По оси абсцисс — величина активности, измеряемой на спектроколориметре, по оси ординат — величина, пропорциональная активности, измеряемой на МБ
Для получения зависимостей скоростей ферментативных реакций от температуры модель фотометрического блока (МБ) разрабатываемого прибора помещали в специальное термостабилизирующее устройство (ТС), обеспечивавшее равномерный медленный нагрев или охлаждение этого блока. Скорость изменения температуры не превышала 0.05-0.08 ° С в минуту при времени измерения скорости реакции в одной пробе не более 3 минут. Температуру контролировали с помощью системы встроенных датчиков с точностью до 0.1 ° С.
Перед измерением каждая проба выдерживалась в специальных гнездах ТС до достижения выравнивания температуры пробы с температурой фотометрического блока.
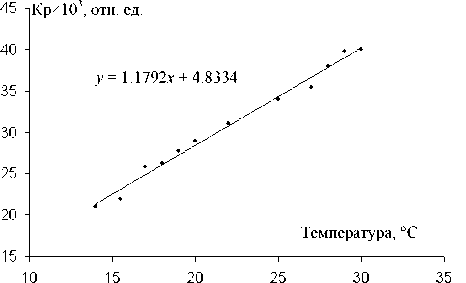
Рис. 2. Зависимость скорости реакции АХЭ, измеряемой на МБ, от температуры. На графике представлено уравнение линейной регрессии
При проведении экспериментов ТС подвергали предварительному охлаждению до 10 ° С или нагреву до 40 ° С с использованием внешних охлаждающих и нагревательных устройств. Измерения проводили в интервале от 15 до 35 ° С.
Регистрацию данных проводили с использованием ПК, оснащенного платой ввода-вывода типа Fastwell AI8S-5a и специально разработанной программой. При этом регистрировали сигналы от фотодиода датчика и от датчиков температуры с периодом 0.5 с. Полученные данные регистрировали в массивы для дальнейшего расчета скоростей реакций. Скорость реакции рассчитывали как коэффициент линейной регрессии (Кр) зависимости логарифма сигнала фотодатчика от времени.
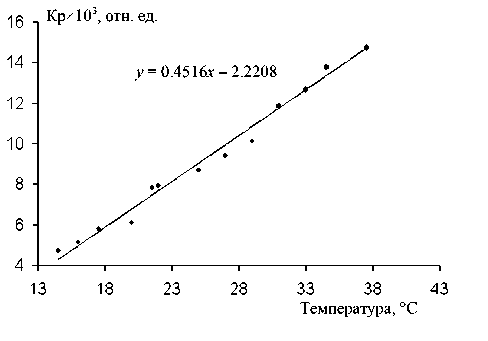
Рис. 3. Зависимость скорости реакции ХЭ, измеряемой на МБ, от температуры. На графике представлено уравнение линейной регрессии
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На начальном этапе работы проведен анализ корреляции результатов, получаемых при измерении скорости реакции на МБ, т. е. величины Кр, с величиной, измеряемой на спектроколориметре Spekol 221 в кинетическом режиме, т. е. приростом оптической плотности за единицу времени (1 минуту). Для этого проводили измерения скорости реакций при разных концентрациях ферментов при одинаковой температуре 25 °С. Эти измерения проведены при одинаковых составах реакционной смеси, за исключением того, что при измерениях на спектроколориметре в качестве реагента на SH-группу использовали реактив Эллмана, а при измерениях на МБ — реактив БАС-Cl. Результаты, получаемые на спектроколориметре, могут быть приведены к значениям активности фермента в пробе пересчетом с использованием молярного коэффициента экстинкции окрашенного продукта реакции (13600) при проведении измерений в области максимума полосы поглощения этого продукта (412 нм, оптическая ширина щели 3 нм).
Во всех измерениях найдена удовлетворительная линейная корреляция результатов, полученных на МБ и спектроколориметре. В качестве примера на рис. 1 представлены данные для фермента АХЭ.
Результаты измерений скорости реакции, измеряемой модельным фотометрическим устройством, при различных температурах для АХЭ человека, представлены на рис. 2, а для ХЭ человека — на рис. 3 в интервале температур от 15 до 30 ° С.
Хорошо известно, что зависимость скоростей ферментативных реакций в достаточно широком интервале температур не является линейной функцией температуры и имеет, как правило, более сложный характер, чем для "обычных" химических реакций. Однако, как видно из данных, представленных на рис. 1 и 2, в использованном сравнительно узком интервале температур при условиях эксперимента для обоих изученных ферментов полученные зависимости близки к линейным. Это позволяет использовать при градуировке приборов, основанных на фотометрической схеме, аналогичной изученному МБ, сравнительно простое представление градуировочной зависимости.
Линейная корреляция величин, измеряемых МБ, с величинами скоростей, измеряемых на спек-троколориметре, позволяет проградуировать его в значениях скорости реакции, определяемых методом Эллмана; применение температурной калибровки позволяет проводить расчет ферментативной активности, отнесенной к 25 ° С, из данных, полученных при любой температуре в пределах этой калибровки.
Для получения величин активности холинэстераз крови может быть рекомендована следующая схема измерений и расчетов. Должны быть проведены измерения активности цельной крови (т. е. АХЭ + ХЭ) и плазмы (ХЭ) при известных (возможно, разных) температурах. По калибровке активность ХЭ должна быть пересчитана к температуре, при которой измерена активность цельной крови; после этого активность АХЭ рассчитывается как разность активности цельной крови и активности ХЭ при температуре измерения цельной крови. Значения при этой температуре с помощью калибровочных зависимостей должны быть пересчитаны к стандартной (вероятно, 25 ° С) температуре. Вся процедура расчета может быть выполнена относительно простым встроенным процессором прибора.
Полученные в настоящей работе данные относятся к ферментным препаратам, которые, хотя и получены из крови человека, но не содержат большей части белков (и иных веществ) крови. Не исключено, что какие-то параметры калибровочных зависимостей для цельной крови могут отличаться от тех, которые определены на частично очищенных препаратах. Поэтому, для использования в приборах, предназначенных для контроля крови человека необходима проверка калибровочных зависимостей непосредственно на образцах крови.


