Температурные зависимости термических характеристик силицидов хрома переменного состава
Автор: Груба О.н, Рябухин А.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (65), 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156535
IDR: 147156535 | УДК: 536.75
Текст обзорной статьи Температурные зависимости термических характеристик силицидов хрома переменного состава
Наряду с алюмотермическим способом производства металлического хрома в настоящее время широко используется метод силикотермии, что позволяет в ряде случаев получить металл необходимого качества, но с меньшими затратами на производство, главным образом благодаря снижению стоимости восстановителя. В ходе процесса восстановления оксида хрома свободным кремнием при высокой температуре в качестве промежуточных продуктов образуется смесь силицидов хрома различного состава.
Диаграмма состояния системы хром-кремний [1] носит весьма условный характер. Найдено, что основное количество силицидов образуется при температурах выше 873 К [2]. В системе обнаружены следующие кристаллические силициды хрома: Cr3Si (15,9 % (мае.) Si), CrSi (64,93 % (мае.) Si) и CrSi2 (48,07 % (мае.) Si). По данным [1, 3, 4] возможно существование Cr2Si и Cr5Si3. Большинство соединений принято считать фазами переменного состава с широкими областями гомогенности. Выбор рациональных условий проведения процесса сипикотермического восстановления затруднен отсутствием достоверной информации о термодинамических параметрах силицидов хрома и их температурных зависимостях.
ТЕПЛОЕМКОСТЬ И ЭНТРОПИЯ
Поле диаграммы «свойство - состав» разбивается на области твердых растворов (ОТР), включающие в себя соединения одинакового (или близкого) типа кристаллической структуры.
В каждой области выделяется кристаллообразующий (КО) компонент. В первой ОТР кристаллообразующим всегда является сам металл. В последующих областях твердых растворов (ОТР-2, ОТР-3 и т.д.) за КО принимается устойчивое стехиометрическое соединение с известной структурой и свойствами.
Постепенное изменение состава внутри каждой ОТР приводит к преобразованию пространственного расположения частиц. Количественно этот переход от одной кристаллической формации к другой отражается объемной структурной постоянной К„, являющейся характерной величиной для каждой конкретной области. Для определения К„ используются структурные константы к [5] кристаллических решеток граничных соединений.
В модели расчета молярной энтропии принимается, что абсолютная энтропия сложного вещества определяется суммой двух величин: А5„ (от mass), связанной с массой и AS,,, (от interaction), определяемой межчастичным взаимодействием:
S = AS + ДЕ .
Здесь массовая составляющая ДЕ„ =—RhM, где 2
R - универсальная газовая постоянная; М - относительная атомная (молекулярная) масса, отнесенная к одному молю металла. AS,„ рассчитывается как разность известных величин S и ДЕт.
В пределах одной ОТР зависимости обратной теплоемкости и обратной энтропии взаимодействия являются линейными функциями состава х. Расчеты молярных теплоемкости и энтропии взаимодействия для соединения любого состава (если компонент А при стандартных условиях — кристаллическое вещество) проводится по уравнениям вида:
с;*(МеАу) = с;1(ко)±
+------------------ (2)
~ (А)+ Ср (КО)] ’
A5-1(MeAj = AS"1(KO)±
+-------------------- (3)
^[хпА5ДА)+Д5л,(КО)]’ где хко и х - мольная доля компонента А в КО и в рассматриваемом соединении соответственно; хп -координата внешней границы рассматриваемой ОТР.
Расчеты молярных теплоемкости и энтропии силицидов хрома произвольного состава проведены для стандартных условий [6, 7]. Однако несомненный практический интерес представляет определение термодинамических характеристик для температур, отличных от 298 К.
При определении температурных зависимостей теплоемкостей и энтропий бинарных соединений произвольного состава принято, что в области устойчивости кристаллообразующего компонента (отсутствие в данном температурном интервале полиморфизма) структурная постоянная К„ не зависит от температуры.
Таким образом, теплоемкость соединения МеА, определяется температурными зависимостями теплоемкостей металла, кристаллообразующего вещества и компонента А. Расчеты проводятся с использованием базовых ур. (2) и (3) с использованием приведенных в литературе зависимостей [8,9]: Ср (Ст) = 25,357 + 9,881 ■ 10"3 Т - 3,684 • 105 Г2, (4) Ср (Si) = 23,90 + 4,26 • 1О"3 Т - 4,44 ■ 105 Г2, (5)
Ср (CrSi) = 48,506 +17,151 ■ 10 3 Т - 7,5 81 • 105 Г2 , (6) Ср (Cr3Si) = 96,737 + 36,693 • 10 3 Т -16,873 • 105 Г2, (7)
Cp (Cr5Si3) = 201,090+78,446• 103 Т-35, 471 • 105 Г2, (8) Cp (CrSi2) = 67,020 + 26,362-10 3Т-9,896- 105Т 2. (9) Анализ кристаллических структур силицидов хрома при температуре 298 К показывает, что диаграмма Ср1 - х должна состоять из двух ОТР.
ОТР-1: Сг - Cr4Sh (х = 0+0,75). КО - Сг
с;1 (CrSi) = с;1 (Сг) —Р-----------------=,
Р М K,[o,6.c,(si)+c,(cr)]
(^ =1,09808 [7]). (10)
В пределах первой области твердых растворов структурная постоянная Кх остается неизменной и теплоемкость MeSix определяется температурными зависимостями теплоемкостей металла и второго компонента - кремния.
OTP-2: Cr4Sh-CrSi,. (х = 0,75+2,0). КО-CrSi
с;1 (CrSi) = CI* (CrSi)--==—_±2^о-------
1 7ф,О.СД80+СДСгЯ)]
(К2 =1,81066 [7]). (11)
Во второй области твердых растворов Q(MeSix) определяется температурной зависимостью кремния и кристаллообразующего соединения - силицида CrSi
Таблица 1
Молярная теплоемкость Ср силицидов хрома при различных температурах
|
№ |
Вещество |
Температура, К |
|||||
|
298 |
400 |
600 |
800 |
1000 |
1200 |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Сг |
23,550+0,126 |
27,007 |
30,262 |
32,686 |
34,870 |
36,958 |
|
2 |
Si |
20,042+0,042 |
22,829 |
25,223 |
26,614 |
27,716 |
28,704 |
|
3 |
Cr3Si CrSio.33333 |
87,446+1,464 88,426 |
100,869 101,442 |
114,066 113,837 |
123,455 123,203 |
131,743 131,656 |
139,597 139,816 |
|
4 |
Cr2Si CrSio.5 |
67,431 |
77,384 |
86,919 |
94,206 |
100,806 |
107,210 |
|
5 |
Cr5Si3 CrSi0.6 |
184,389+0,920 184,502 |
210,209 211,793 |
238,215 238,050 |
258,214 258,291 |
275,899 276,671 |
292,672 294,568 |
|
6 |
Cr4Si3 CrSio,75 |
168,138 |
188,813 |
211,333 |
227,434 |
241,582 |
255,021 |
|
7 |
CrSi |
45,104+0,837 45,106 |
50,628 50,633 |
56,691 56,689 |
61,042 61,050 |
64,899 64,893 |
68,561 68,540 |
|
8 |
Cr3Si4 СгЗцззззз |
149,925 |
168,193 |
188,403 |
203,114 |
216,138 |
228,484 |
|
9 |
Cr2Si3 CrSiL5 |
105,652 |
118,483 |
132,758 |
143,215 |
152,497 |
161,290 |
|
10 |
CrSi2 |
63,597+0,335 63,735 |
71,380 71,378 |
80,088 80,064 |
86,563 86,580 |
92,392 92,421 |
97,967 97,943 |
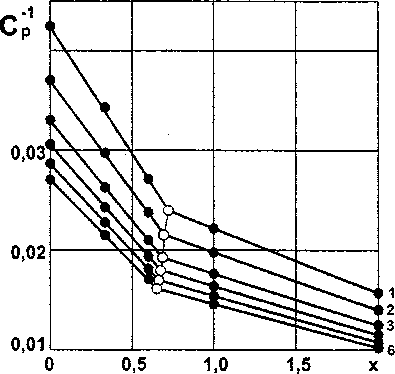
Рис. 1. Изотермы зависимости обратной теплоемкости силицидов хрома (CrSix) от состава (• - эксперимент, — - расчет): 1 - 298 К, 2 - 400 К, 3 - 600 К, 4- 800 К, 5 - 1000 К, 6 -1200 К
Результаты расчета теплоемкости Ср компонентов и силицидов хрома при различных температурах по ур. (10) и (11) с учетом ур. (6)-(9) приведены в табл. 1 и на рис. 1.
В верхних строках табл. 1 приведены значения, рассчитанные по аналитическим зависимостям Ср =f(T), приведенных в справочной литературе; в нижних - рассчитанные по изложенной методике. Результаты расчета молярных теплоемкостей малоизученных силицидов хрома при различных температурах могут быть представлены в форме традиционных полиномов:
Ср (Cr2Si) = 73,320+28,831 • 10"3 Г -12,690 • 105 Г2, (12) Cp(Cr2Si3) = 112,596+41,594-10-3Т-17,181-Ю5 7^2.(13)
Совместное решение уравнений модели для сопряженных областей позволяет аналитически определить координату границы (состав) между областями твердых растворов (табл. 2).
Таблица 2 Теплоемкости силицидов хрома, отвечающих границам раздела ОТР, при различных температурах
|
Величина |
т,к |
|||||
|
298 |
400 |
600 |
800 |
1000 |
1200 |
|
|
*1-2 |
0,72228 |
0,69393 |
0,68746 |
0,67531 |
0,66310 |
0,65084 |
|
c4CrSi,J |
41,719 |
46,497 |
51,949 |
55,716 |
58,975 |
62,037 |
При повышении температуры граница раздела областей смещается к соединениям с меньшим содержанием кремния. Температурная зависимость молярной теплоемкости силицидов хрома, составы которых отвечают границе раздела первой и второй областей твердых растворов имеет вид:
Ср (CrSiX] J = 45,093 +14,555 • 10"’ 7 -6,889 ■ 105 7~2. (14)
При расчете стандартной энтропии силицидов хрома на диаграмме S^ - х выделено три области твердых растворов [7].
OTP-1: Cr-CnSi (х = 0-0,33333). КО-Сг
^(CrSi^^^Cr)-
" ^ [0,33333 • Д5/п (Si) ч^ССг)]’
(К, =0,52269 [7]). (15)
OTP-2: Cr2Si-CrSi (х = 0,33333-1,0). KO CnSi
ASr^CrSiJ-AS^CrSi^
__х-0,33333__________ l^OAS^SO + ASjCrSi0,333333 )]
(Я2 =1,12500 [7]). (16)
OTP-3: CrSi-CrSi, (х = 1,0-2,0). KO-CrSi
^(CrSiJ^'tCrSi)-
__ х-1,0 __________
^[2,0.AS,,(Si) + AS,„(CrSi)]’
(К3 =2,76074 [7]). (17)
В пределах первой области твердых растворов 5,„(CrSix) определяется температурными зависимостями Sm основного компонента - хрома и кремния. Расчеты проводятся с использованием уравнения (15). В последующих областях Sin (CrSi r) также будет определяться температурной зависимостью S^ кремния и силицида, выбранного в качестве кристаллообразующего. Во второй ОТР для расчета используется ур. (16), в третьей - ур. (17).
В табл. 3 и на рис. 2 приведены результаты расчета энтропий S силицидов хрома при различных температурах по ур. (15)—(17) с учетом ур. (4)-(9). В верхних строках таблицы приведены значения, рассчитанные по литературным аналитическим зависимостям Ср =f(T), в нижних - рассчитанные по излагаемой методике. Для малоизученных карбидов хрома воспользуемся полученными ранее полиномами температурной зависимости молярной теплоемкости (ур. (12)-(13)) и уравнением Кирхгоффа. Результаты расчетов также приведены в верхних строках табл. 3 в круглых скобках.
Совместное решение ур. (15) и (16), (16) и (17) позволяет определить границы между ОТР. В табл. 4 приведены координаты границ раздела областей твердых растворов при различных температурах и величина энтропии взаимодействия, отвечающая данному составу.
Таблица 3
Молярные энтропии силицидов хрома при различных температурах
|
№ |
Вещество |
Температура, К |
|||||
|
298 |
400 |
600 |
800 |
1000 |
1200 |
||
|
1 |
Сг |
23,604±0,209 |
30,859 |
42,071 |
50,831 |
58,139 |
64,499 |
|
2 |
Si |
18,859±0,034 |
26,219 |
36,685 |
44,386 |
50,559 |
55,761 |
|
3 |
Cr3Si Сг810ззззз |
95,814±1,464 95,902±0,089 |
123,806 123,806 |
167,439 167,441 |
201,582 201,567 |
230,032 230,020 |
254,750 254,732 |
|
4 |
Cr2Si CrSi05 |
68,181 |
(89,526) 88,388 |
(122,818) 120,201 |
(148,905) 145,094 |
(170,676) 165,902 |
(189,616) 184,094 |
|
5 |
Cr5Si3 CrSio.6 |
177,402±3,138 178,056 |
235,712 231,190 |
326,778 315,341 |
398,163 381,565 |
457,726 438,883 |
509,537 485,106 |
|
6 |
CrSi |
45,020±0,837 44,932±0,085 |
59,149 59,154 |
80,930 80,917 |
97,854 97,839 |
111,895 111,854 |
124,053 124,041 |
|
7 |
Cr2Si3 CrSi । 5 |
99,520 |
(132,603) 130,080 |
(183,593) 177,842 |
(223,260) 215,248 |
(256,220) 246,228 |
(284,805) 269,94 |
|
8 |
CrSi2 |
55,647±l,046 55,870 |
75,585 72,353 |
106,314 98,773 |
130,266 119,671 |
150,215 136,980 |
167,555 148,006 |
Таблица 4
Энтропия взаимодействия и состав силицидов хрома, отвечающих границам раздела ОТР при различных температурах
|
Величина |
т,к |
|||||
|
298 |
400 |
600 |
800 |
1000 |
1200 |
|
|
*1-2 |
0,33176 |
0,25095 |
0,19345 |
0,16996 |
0,15625 |
0,14732 |
|
S-(C'Si,J |
14,808 |
23,036 |
35,893 |
45,924 |
54,266 |
61,513 |
|
*2-3 |
1,00686 |
1,03930 |
1,02304 |
1,00829 |
0,99433 |
0,98445 |
|
^„(CrSi,,,) |
26,844 |
41,300 |
63,000 |
79,818 |
93,525 |
105,530 |
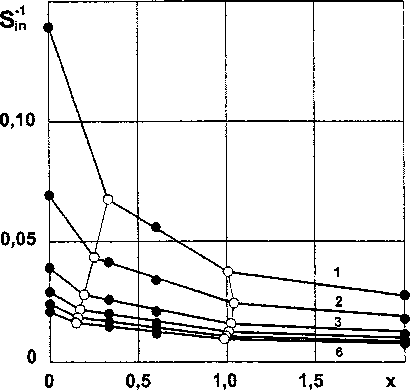
Рис. 2. Изотермы зависимостей обратной энтропии взаимодействия силицидов хрома от состава: 1 - 298, 2 - 400, 3 - 600, 4 - 800, 5 - 1000, 6 - 1200 К (• - эксперимент, — - расчет)
Как следует из данных табл. 4 и рис. 2 содержание кремния в соединениях, отвечающих границе между ОТР-1 и ОТР-2, при возрастании температуры до 1200 К уменьшается более чем в 2 раза. Граница между 2 и 3 ОТР до температуры приблизительно 400 К вначале незначительно обогащается кремнием (х23 меняется от 1,00686 до
1,03930), затем смещается к силицидам с меньшим содержанием растворенного компонента и при температуре 1200 К составляет 0,98445. Количество областей при повышении температуры не изменяется.
ЭНТАЛЬПИЯ И ЭНЕРГИЯ ГИББСА
ОБРАЗОВАНИЯ
Энтальпии образования силицидов хрома при различных температурах рассчитывались по ур. Кирхгоффа с использованием ур. (6)-(9), (12), (13). При расчетах были использованы величины АуЯ"^ [7]. Результаты расчетов Ау.Н“ приведены в табл. 5.
Расчет AfG проводился по уравнению Гиббса:
^/G®=^/H®-T^/S®.
Для определения энтропии образования вещества использовали свойства Г-потенциала [10], что позволило согласовать величины \jH и AyG соединений:
Р = k/S” - 8°т,
Р(МеуАг) = уР(Ме) + хР(А) =
=-yS(Me)-zS(A).
Результаты расчетов приведены в табл. 6.
Таблица 5 Энтальпии образования силицидов хрома произвольного состава при различных температурах
|
№ |
Вещество |
Температура, К |
|||||
|
298 |
400 |
600 |
800 |
1000 |
1200 |
||
|
1 |
Cr3Si |
-13 8,072+6,276 -136,824 |
-127,094 |
-105,484 |
-81,702 |
-56,172 |
-29,034 |
|
2 |
Cr2Si |
-115,082 |
-107,663 |
-91,173 |
-73,002 |
-53,465 |
-32,670 |
|
3 |
CfsSig |
-326,352+6,092 -326,470 |
-306,202 |
-261,095 |
-211,372 |
-157,921 |
-101,036 |
|
4 |
CrSi |
-71,128+6,27 -67,271 |
-62,362 |
-51,577 |
-39,791 |
-27,192 |
-13,844 |
|
5 |
Cr2Si3 |
-131,770 |
-120,275 |
-95,028 |
-67,401 |
-37,825 |
-6,441 |
|
6 |
CrSi2 |
-59,831+4,184 -60,212 |
-53,284 |
-38,069 |
-21,386 |
-3,485 |
+15,554 |
Таблица 6
Энергии Гиббса образования силицидов хрома произвольного состава при различных температурах
|
№ |
Вещество |
Температура, К |
|||||
|
298 |
400 |
600 |
800 |
1000 |
1200 |
||
|
1 |
Cr3Si |
-137,134 -138,707 |
-128,587 |
-106,838 |
-83,099 |
-57,675 |
-30,665 |
|
2 |
Cr2Si |
-115,712 |
-107,797 |
-90,986 |
-72,718 |
-53,186 |
-32,472 |
|
3 |
Cr5Si3 |
-328,662 -327,500 |
-305,677 |
-259,584 |
-209,659 |
-156,881 |
-99,644 |
|
4 |
CrSi |
-71,889 -67,981 |
-62,981 |
-52,221 |
-40,572 |
-28,132 |
-14,971 |
|
5 |
Cr2Si3 |
-130,499 |
-117,207 |
-90,154 |
-61,569 |
-31,350 |
+1,409 |
|
6 |
CrSi2 |
-58,734 -58,587 |
-50,023 |
-33,102 |
-15,446 |
+3,154 |
+23,902 |
Выводы
-
1. Разработаны математические модели расчета температурной зависимости молярных теплоемкости и энтропии для бинарных соединений металлов. Корректность разработанных математических моделей расчета подтверждена согласием с имеющимися справочными данными по кристаллическим силицидам хрома.
-
2. Математической обработкой результатов расчетов теплоемкостей при различных температурах получены полиномы Ср = ДТ) для малоизученных силицидов хрома.
-
3. Опираясь на результаты расчетов 5°, определенные ранее величины А///”98, AyG°9S, а так же известные теоретические зависимости, рассчитаны энтальпии и энергии Гиббса образования силицидов хрома для различных температур.
Список литературы Температурные зависимости термических характеристик силицидов хрома переменного состава
- Хансен М., Андерко К. Структура двойных сплавов -М.: Металлургиздат, 1962. -Т. 1, 2 -1188 с.
- Кремний и его сплавы/В.М. Денисов, С.А. Истомин, О.И. Подкопаев и др. -Екатеринбург: УрО РАН, 2005. -467 с.
- Рысс М.А. Производство ферросплавов. -М.: Металлургия, 1985. -344 с.
- Диаграммы состояния двойных металлических систем: Справочник: в 3 т.: Т. 2./Н.П. Лякишев, О.А. Банных, Л.Л. Рохлин и др.; Под общ. ред. Н.П. Лякишева. -М.: Машиностроение, 1997. -1024 с.
- Мелвин-Хьюз Э.А. Физическая химия. -М.: МИЛ, 1962. -Кн. 1, 2. -1148 с.
- Груба О.Н., Рябухин А.Г. Расчет стандартной теплоемкости нестехиометрических силицидов хрома//Компьютерное моделирование физико-химических свойств стекол и расплавов: Труды VIII Российского семинара/Под общей ред. Б.С. Воронцова. -Курган: Изд-во Курганского ун-та, 2006. -С. 72-74.
- Рябухин А.Г., Груба О.Н. Термические характеристики силицидов хрома при стандартных условиях//Вестник ЮУрГУ. Серия «Металлургия». -2006. -Вып. 7. -№ 10(65). -С. 19-26.
- Плинер Ю.Л., Игнатенко Г.Ф., Лаппо С.И. Металлургия хрома. -М.: Металлургия, 1965. -183 с.
- Термодинамические свойства неорганических веществ: Справочник/У.Д. Верятин, В.П. Маширев, Н.Г. Рябцов и др.; Под общ. ред. д.т.н. А.П. Зефирова. -М.: Атомиздат, 1965. -460 с.
- Рябухин А.Г. Р-потенциал//Изв. ЧНЦ УрО РАН. -1999. -Вып. 3. -С. 23-25.


