Температурный стресс и термопокой семян овощных зонтичных культур. Особенности индукции,проявления и преодоления (часть первая)
Автор: Бухаров А.Ф., Балеев Д.Н.
Журнал: Овощи России @vegetables
Рубрика: Семеноводство и семеноведение овощных культур
Статья в выпуске: 2 (19), 2013 года.
Бесплатный доступ
При воздействии на семена овощных зонтичных культур высокотемпературным стрессом в течение 5 или 20 суток происходит снижение активности роста зародыша и ингибирование прорастания семян. Постинкубационное проращивание исследуемых семян различных видов на фоне пониженных стратификационных температур способствует возобновлению роста зародыша, однако, как правило, рост менее интенсивен по сравнению с контролем. Изученные культуры семейства зонтичные, проявили особенности прорастания семян и развития зародышей на различных температурных фонах и в зависимости от времени инкубационного воздействия высокой температуры.
Семена, прорастание семян, высокотемпературный стресс, степень недоразвития зародыша (снз), зародыш, зонтичные, термопокой, термотоустойчивость, чувствительность к высокой температуре
Короткий адрес: https://sciup.org/14025006
IDR: 14025006 | УДК: 631.531:
Текст научной статьи Температурный стресс и термопокой семян овощных зонтичных культур. Особенности индукции,проявления и преодоления (часть первая)
Покой является важнейшим свойством семян, которое выражается в способности задерживать прорастание для снижения риска гибели или отрицательного действия неблагоприятных условий внешней среды. Переход в состояние покоя является эффективной пассивной адаптацией (хотя по сложности и многочисленности биохимических и физиологичес- ких процессов, механизм этого явления далеко не пассивен), выработанной в процессе эволюции. Причины, вызывающие покой, глубину его проявления и условия преодоления чрезвычайно разнообразны. Природа покоя и процессы, связанные с его нарушением на протяжении длительного времени подвергаются интенсивным исследованиям, поскольку познание этого явления имеет большое значе- ние для сельскохозяйственной практики [13, 19].
В настоящее время явление покоя изучается не только на уровне организма и тканей, но и на уровне клетки [8, 18, 19, 30]. На глубину покоя оказывает влияние структура покровных тканей семени (плода), являющихся естественной преградой при прорастании, роль, которых изучена недостаточно [15, 32]. Возможность корешка преодо- леть сопротивление покровных тканей зависит от способности его клеток к растяжению, определяющих силу роста зародыша [12, 23]. Показано, что гиббереллин (ГК) обеспечивает ростовой потенциал зародыша, необходимый для прорыва семенной оболочки [31].
Подробно исследуются физиология и биохимия покоя. Известно, что покой сопровождается подавлением гидролитических процессов, а прорастание связано с их активизацией [27]. Основную роль при этом играют два фитогормона – абсцизовая кислота (АБК) и гиббереллин, а точнее баланс между ними [14, 17]. Кроме стрессовых факторов на баланс АБК/ГК могут оказывать влияние другие гормоны и гормоноподобные вещества, такие как этилен, способный выступать антагонистом АБК [22]. Обсуждается роль жасмоновой кислоты, стригалактонов и каррикинов в качестве экзогенных и эндогенных факторов покоя [11, 33]. Познается механизм действия сигнальных систем, обеспечивающих чувствительность к гиббереллину, активизирующих синтез белков экспрессии АБК. Выявлена ключевая роль тио-редоксинов во взаимоотношении эндосперма с зародышем [21, 28].
Бесспорно, что покой и процессы его обусловливающие находятся под влиянием как экологических, так и генетических факторов, находящихся в состоянии сложного взаимодействия и взаимовлияния. С помощью QTL-анализа у пшеницы, ячменя, риса, араби-допсиса выявлено до 40 локусов влияющих на продолжительность и глубину периода покоя, действующих как непосредственно, так и опосредованно [6, 9, 16, 29]. Выявлены локусы и механизмы их экспрессии, определяющие снижение или повышение чувствительности к ГК (Rht) и АБК (Em), фотопериоду (Ppd, PIL 5), холоду (SPT) и регулирующие процесс перехода в состояние покоя или выхода из него. Тем не менее, большинство генов, контролирующих признак покоя семян, до сих пор не идентифицировано, поскольку действуют они на разных уровнях органи- зации и обладают высокой специфичностью [18, 24, 26].
Под влиянием внешних и внутренних факторов покой семян, и его глубина могут изменяться во времени. Органический покой, возникающий в период формирования и созревания, достигает максимального уровня у свежеуб-ранных семян. В процессе сухого хранения семян органический покой, как правило, снижается [7]. Под действием специфичных факторов (пониженная температура, свет, влага, гормоны и гормоноподобные вещества) в ходе набухания семян покой может прерываться [13, 20]. Однако этот процесс имеет обратимый характер. Под влиянием высокой температуры, высокой концентрации углекислого газа, аллелопатических веществ может происходить индукция вторичного покоя [1, 10, 25].
В связи с изменением климата, изучение последствий высокотемпературного стресса, термопокоя и защитных реакций растений на их действие, приобретает большую актуальность, как с теоретической, так и с практической точки зрения. Знания, полученные в процессе этих исследований, будут полезны при совершенствовании технологии выращивания семян, при их доработке и сушке.
Материал и методы
Объектом исследований являлись семена укропа (сорт Кентавр), моркови (сорт Рогнеда), петрушки корневой (сорт Любаша), сельдерея корневого (сорт Купидон), любисто-ка лекарственного (сорт Дон Жуан), кориандра (сорт Янтарь) и пастернака (сорт Кулинар), хранившиеся в течение 1 года в лабораторных условиях.
Инкубация семян изучаемых культур проводилась в условиях повышенной температуры (t = +30°С) во влажном состоянии в течение 5 и 20 суток без доступа света. Повторность опыта трехкратная, в каждой повторности использовали 1000 семян. После указанного срока инкубации семена извлекали и промывали в проточ- ной воде, затем закладывали на постинкубационное проращивание.
Изучение динамики постинкубационного прорастания семян исследуемых культур проводили на разных температурных фонах, в т. ч.: t = +20°С (st); t = +3°С; t = +3 °C (8 час.) / +20 °C (16 час.), при этом другие факторы: влажность, аэрация, свет (все варианты проращивались без доступа света) были равнозначны. В исследованиях рассчитывали показатели: ТНП – время от постановки семян на прорастание до наступления прорастания, Tmax ν – число суток до наступления максимальной скорости прорастания семян [5], T 50 – теоретически рассчитанное время, за которое прорастет 50 % семян. Повторность опыта трехкратная, в каждой повторности исследовали 100 шт. семян.
Измерения длины зародыша во время инкубации и последующего прорастания проводили с помощью микроскопа «Микромед» при 40 кратном увеличении, с использованием программы Scope Photo. Статистический и математический анализ осуществляли по Б. А. Доспехову [3] и с использованием пакета программ Statistica 8.0. Повторность опыта трехкратная, в каждой повторности исследовали не менее 10 шт. семян.
Результаты исследований и обсуждение
Одним из самых значимых абиотических факторов является температура, а при ее повышении выше оптимальной становиться сильнейшим стрессором. Степень отрицательного действия высокотемпературного стресса зависит от его продолжительности. Наиболее общим проявлением действия стрессоров, в частности высокотемпературного стресса, является подавление роста и развития растений. Стрессоры приводят к снижению скорости роста. Растения относятся к эктотермным организмам, не способным поддерживать температуру своих органов и тканей на постоянном уровне, и поэтому, у растений приспособления к изменяющимся температурным условиям не связаны со стратегией избежания, а основаны на механизме резистентности [4]
Ранее проведенные исследования показали, что инкубация семян семи изучаемых овощных культур, представителей семейства зонтичные, при постоянной температуре 30°С и отсутствии света, оказывает ингибирующее действие на их прорастание и рост зародыша [2]. При этом на начальном этапе под воздействием повышенной температуры у всех культур отмечено кратковременное повышение интенсивности роста зародыша. Максимальный всплеск скорости роста зародыша до 0,05 – 0,08 мм/сутки отмечен у кориандра, пастернака и петрушки корневой на вторые сутки после закладки опыта. Пик интенсивности роста для укропа приходится на четвертые сутки и достигает 0,05 мм/сутки. Минимальная активизация ростовых процессов зародыша, зафиксирована у моркови и сельдерея корневого. Для всех изученных культур отмечена, характерная особенность – ритмичность изменения скорости роста зародыша при наличии двух или трех пиков за период наблюдения, выраженная в той или иной степени (рис. 1).
Дальнейшая инкубация в условиях повышенных температур без доступа света привела к постепенному снижению интенсивности роста зародыша у всех изучаемых культур, при наличии
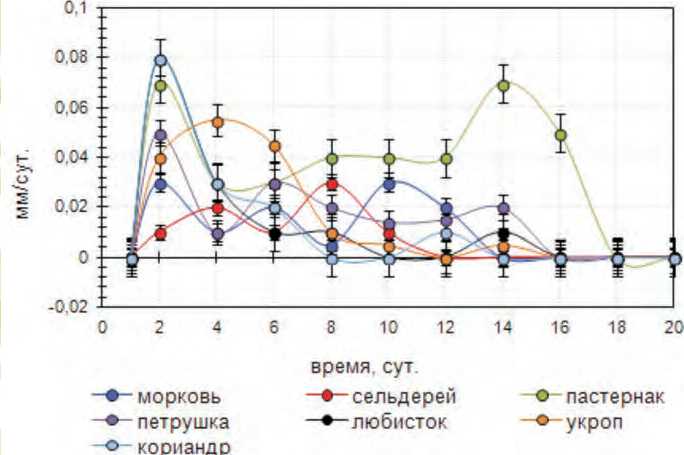
Рис. 1. Динамика изменения скорости роста зародыша овощных зонтичных культур, под влиянием высокотемпературного стресса
определенной специфики. Отмечено, что на 5 сутки инкубации семян скорость роста зародыша находится в диапазоне от 0,01 до 0,06 мм/сутки в зависимости от изучаемой культуры. Так в семенах моркови, сельдерея корневого, петрушки корневой, пастернака скорость роста зародыша резко падает, в то время как в семенах любистока лекарственного, кориандра и укропа еще сохраняется на достаточно высоком уровне.
На 20 сутки эксперимента зафиксировано практически полное подавление ростовых процессов зародыша у всех изучаемых культур. Следует отметить, что в семенах моркови и петрушки корневой на протяжении 16 суток инкубации зародыши росли достаточно интенсивно, со средней скоростью 0,03 и 0,02 мм/сутки соответственно. При этом эндосперм активно расходовался на рост зародыша, а сам зародыш постепенно заполнял всю полость семени, и создавалось впечатление, что скоро наступит прорастание. Однако в течение нескольких последующих суток происходил автолиз семян.
После инкубации семян семи изучаемых культур в течение 5 суток при температуре 30°C и перенесении их в стандартные условия (t = +20°С), ростовые процессы в семенах постепенно возобновились. В то же время все изучаемые показатели, характе- ризующие интенсивность ростовых процессов оказались ниже, чем в контроле. Так показатель TНП у семян моркови, укропа, любистока лекарственного и кориандра изменялся от 7 до 9 суток, что на 3-5 суток больше чем в контрольном варианте (таблица). Петрушка корневая, сельдерей корневой и пастернак увеличили значение TНП на 7-9 суток по сравнению с контролем.
Показатель Tmax v для изучаемых культур, после 5 суток инкубации, превысил контроль на 14-82%. Максимальное значение Tmax v отмечено у петрушки корневой, сельдерея корневого и особенно у пастернака, от 17,3±0,2 до 27,3±0,3 суток соответственно.
Показатель T 50 , дает возможность более корректно сравнивать варианты между собой. После инкубации семян в течение 5 суток и последующем проращивании при температуре t = +20°С все культуры увеличили значение T 50 на 48-84 % по сравнению с контролем. Наиболее резкая реакция на температурный шок, отмечена у пастернака.
Для характеристики процесса прорастания семян важное значение имеет соотношение показателей Tmax v и T 50 . Такие культуры как морковь, укроп, любисток лекарственный и кориандр, при проращивании в условиях постоянной положительной температуры (20°C) после инкубации в течение 5 суток, имеют T 50 и Tmax v близкие по значению (разница не превышает 0,9-2,9 суток). У культур, семена которых активно реагируют на высокотемпературный фактор, как например, пастернак и сельдерей, различия между T 50 и Tmax v составляют 9,3 и 7,4 суток соответственно.
Изучение прорастания семян, испытавших воздействие высокотемпературного стресса в течение 5 суток, при пониженной температуре (t = + 3°C) показывает, что для всех культур требуется больше времени для прорастания семян, как по сравнению с контрольным вариантом (Tmaxv увеличивается на 2,4-11,7 суток, T50 на 7,5-15,6 суток), так и по сравнению со стандартным режимом (t = +20°С) проращивания (Tmaxν увеличивается на 10,2-12,4 суток, T50 на 8,7-19,8 суток). Одновременно разница между показателями Tmaxν и T50 становится более резкой, достигая 1,0-6,6 суток.
Действие переменных температур (t = +3/+20°С) при проращивании семян изучаемых культур, подвергнутых воздействию высокой температуры в течение пяти суток, обеспечило положительный эффект для сельдерея корневого и пастернака, снижая Tmax ν на 7,3 и 8,8, а T 50 на 7,9 и 15,0 суток соответственно по сравнению со стандартом. Для остальных культур Tmax ν и T 50 при проращивании в условиях переменной температуры оказались выше, чем при постоянном (t = + 20°C) режиме.
Использование для проращивания семян переменной температуры (t = +3/+20°С) в целом снижает негативное действие высокотемпературного шока. Увеличение значений Tmax ν и T 50 под влиянием пятисуточной инкубации семян по сравнению с контролем для большинства изученных культур составило 22-66 % и 54-89 % соответственно. Для кориандра эти показатели даже снизились на 11 и 18 %.
После воздействия ингибирующей температуры в течение 20 суток ростовые процессы в семенах возобновляются еще более замедленными темпами. Постоянная положительная температура (t = + 20°C) не обеспечивает прорастание семян сельдерея корневого и пастернака. Укроп и кориандр задерживают начало прорастания на 8 суток по сравнению с контролем, но по сравнению с инкубацией в течение 5 суток показатель TНП практически не изменился. Действие высокой температуры при инкубации увеличивает показатель Tmaxν этих культур до 24,3±2,2 и 35,0±2,8 суток, что на 11,7 и 24,3; 16,5 и 25,6 суток соответственно выше, чем в контроле. Показатель T50 при этом у названных культур увеличивается до 34,2±1,9; 208,7±13,8 суток. Любисток лекарственный при этом слабее реаги- рует на действие высокой температуры, снижая показатель Tmaxν (12,3+1,0 суток) по сравнению с 5 сутками инкубации на 1,4 суток, а по сравнению с контролем увеличивая на 3,1 суток. T50 при этом находится на уровне 17,9±2,1 суток, что на 1,3 суток выше инкубации в течение 5 суток и на 7,1 суток выше контроля.
Проращивание семян при пониженной (t = +3°C) температуре (после инкубации в течение 20 суток) имеет некоторое преимущество по сравнению со стандартным (t = + 20°C) режимом. Так семена пастернака и сельдерея корневого, несмотря на значительную задержку, начинают прорастать. Однако все показатели, характеризующие темпы прорастания, имеют высокое значение. T НП для этих культур составляет 29 и 24 суток, Tmax ν находится на уровне 53,5±0,4 и 44,1±1,6 суток, а T 50 достигает 80,9±1,4 и 53,0±2,6 суток соответственно.
Ряд культур неоднозначно реагирует на проращивание при пониженной (t = +3°C) температуре. Кориандр по сравнению со стандартным температурным режимом уменьшает Tmax ν на 6,6 и T 50 на 163,5 суток. Укроп, напротив, увеличивает Tmax ν на 12,6 суток, а T 50 на 9,9 суток. Любисток лекарственный при увеличении времени действия высокотемпературного стресса с 5 до 20 суток, снижает значение Tmax ν на 7,7 и T 50 на 4,8 суток.
Для большинства культур переменная (t = +3/+20°С) температура, по сравнению с другими температурными режимами проращивания, как правило, способствует снижению показателей (ТНП, Tmax ν , T 50 ), характеризующих продолжительность прорастания семян, подвергнутых воздействию высокими температурами в течение 20 суток. Можно констатировать, что семена всех изучаемых культур, которые подвергались инкубации в течение 20 суток, при переменной температуре прорастают значительно быстрее в сравнении с другими температурными режимами.
По мере увеличения длительности действия высокотемпературного стресса с 5 до 20 суток пастернак увеличивает TНП с 13 до 20 суток. При этом Tmaxν достигает 28,0±0,8 суток, а T50 32,8±0,8 суток, что на 14,7 и 19,4 суток выше контроля.
Семена укропа и сельдерея корневого после действия высокотемпературного стресса продолжительностью 5 и 20 суток, проращиваемые при переменной температуре, имеют показатели Tmax ν и T 50 , близкие по значению, но превышающие контроль на 1,8-5,5 и 5,7-7,2 суток соответственно.
Любисток лекарственный, при переменном температурном режиме проращивания семян, после 20 суток воздействия повышенной температурой сокращает Tmax ν (до 9,4±1,1 суток), что на 1,9 суток ниже контроля, и сохраняет T 50 (14,2±0,3 суток) на уровне контроля, что значительно (на 7,6 суток) ниже, чем после действия пятисуточного температурного стресса.
Показатели ТНП и Tmax ν кориандра, на фоне переменной температуры, находятся на одном уровне не зависимо от времени инкубации. Однако T 50 при 20 суточном воздействии высокими температурами составляет 20,7±0,8 суток, что на 2,1 суток выше контроля и на 5,5 суток выше 5 суточного стресса.
На рисунке 2 показано влияние продолжительности инкубации семян при температуре 30°C на скорость роста зародыша при последующем проращивании на различных температурных фонах. В постинкубационный период при проращивании семян исследуемых культур на фоне положительной постоянной температуры (t = + 20°C) происходит снижение скорости роста зародыша при увеличении продолжительности стресса. Если зародыш в семенах укропа в контрольном варианте растет со скоростью 0,15 мм/сутки, то после 5 суток инкубации скорость роста зародыша снижается до 0,03 мм/сутки, а под влиянием 20 суток – до 0,02 мм/сутки. Зародыш кориандра, который в контроле растет со скоростью 0,04 мм/сутки, по мере последовательного увеличения времени инкубации снижает ско-
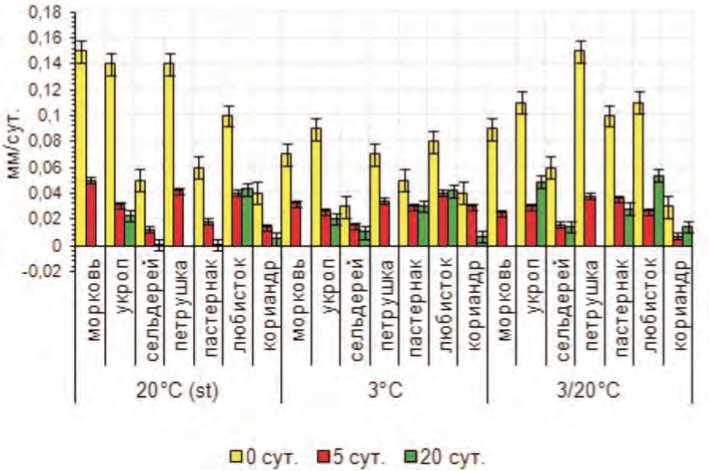
Рис. 2. Средняя скорость роста зародыша овощных зонтичных культур на различных температурных фонах после воздействия высокотемпературного фактора различной продолжительности
рость роста до 0,01 мм/сутки и 0,005 мм/сутки.
В семенах сельдерея корневого и пастернака скорость роста зародыша в контроле составляет 0,05 и 0,06 мм/сутки, после воздействия высокой температурой в течение 5 суток скорость роста зародыша снижается до 0,01 и 0,02 мм/сутки, а после 20
суток воздействия скорость резко (в 55-75 раз) падает.
При пониженной температуре (t = + 3°C) в среднем скорость роста зародыша в постинкубационный период, оказывается ниже (на 64 %), чем при стандартном температурном режиме. Для большинства изучаемых культур отмечено закономерное снижение скорости роста зародыша при увеличении времени действия ингибирующего фактора.
Заключение
Повреждающее действие высокотемпературного стрессового фактора определяется не только его интенсивностью, но и продолжительностью действия, совокупность которых следует рассматривать в качестве дозы. Скорость роста зародыша после 5 суток снижается на 60-80 % , а после 20 суток на 70-98 % по отношению к контролю, после чего ростовые процессы, практически, полностью останавливается.
При перенесении семян после температурного стресса действующего 5 или 20 суток в более благоприятные условия рост зародыша возобновляется, но идет, как правило, менее интенсивно по сравнению с контролем. Все семь изученных культур – представители семейства зонтичные, проявили особенности прорастания семян и развития зародышей на различных температурных фонах и в зависимости от времени инкубационного воздействия высокой температуры.
1. Изменение временных показателей, характеризующих темпы прорастания семян овощных зонтичных культур под влиянием высокотемпературного стресса и последующих условий проращивания
|
Культура |
Время инкубации при t = 30 °С, сут. |
T НП , сут. |
Tmax , сут. |
T50 , сут. |
||||||
|
t = 20°С (st) |
t = 3°С |
t = 3/20°С |
t = 20°С (st) |
t = 3°С |
t = 3/20°С |
t = 20°С (st) |
t = 3°С |
t = 3/20°С |
||
|
морковь |
0-контроль |
3 |
9 |
4 |
7,6±0,7 |
15,2±0,4 |
10,1±0,3 |
8,8±0,6 |
16,2±0,4 |
12,4±1,0 |
|
5 |
7 |
14 |
11 |
12,1±0,1 |
23,3±0,7 |
17,1±0,4 |
13,0±0,3 |
28,4±1,2 |
19,1±0,8 |
|
|
0-контроль |
3 |
9 |
5 |
7,8±0,3 |
15,0±1,7 |
11,0±1,1 |
9,0±0,4 |
16,4±1,3 |
9,3±0,3 |
|
|
укроп |
5 |
8 |
17 |
10 |
12,6±0,6 |
22,8±0,5 |
13,4±0,5 |
13,4±0,9 |
23,7±0,7 |
14,2±0,6 |
|
20 |
8 |
17 |
5 |
24,3±2,2 |
36,9±0,9 |
12,8±0,4 |
34,2±1,9 |
44,1±0,6 |
14,8±0,5 |
|
|
0-контроль |
5 |
13 |
6 |
10,8±0,4 |
22,8±0,8 |
10,3±0,3 |
14,6±0,3 |
24,0±1,2 |
10,5±0,6 |
|
|
сельдерей |
5 |
14 |
21 |
14 |
20,2±1,9 |
32,6±1,3 |
17,6±1,0 |
27,6±0,5 |
36,3±1,9 |
18,4±1,3 |
|
20 |
- |
24 |
10 |
- |
44,1±1,6 |
16,0±0,4 |
- |
53,0±2,6 |
17,7±1,1 |
|
|
петрушка |
0-контроль |
4 |
11 |
5 |
11,1±0,9 |
19,6±0,7 |
9,9±0,4 |
12,5±1,6 |
21,8±1,1 |
10,3±0,7 |
|
5 |
11 |
20 |
13 |
17,3±0,2 |
31,3±0,4 |
20,2±0,6 |
20,8±0,2 |
35,8±1,3 |
21,6±0,5 |
|
|
0-контроль |
8 |
16 |
7 |
15,0±1,2 |
25,1±0,2 |
13,3±0,8 |
19,9±0,2 |
27,6±1,2 |
13,4±1,5 |
|
|
пастернак |
5 |
17 |
25 |
13 |
27,3±0,3 |
38,6±0,5 |
22,1±1,0 |
36,6±1,4 |
43,2±1,3 |
25,3±1,9 |
|
20 |
- |
29 |
20 |
- |
53,5±0,4 |
28,0±0,8 |
- |
80,9±1,4 |
32,8±0,8 |
|
|
0-контроль |
5 |
6 |
5 |
9,2±0,6 |
12,6±0,4 |
11,3±0,1 |
10,8±1,0 |
15,5±1,1 |
14,5±0,2 |
|
|
любисток |
5 |
9 |
12 |
8 |
13,7±0,7 |
23,0±0,6 |
17,2±0,3 |
16,6±0,8 |
29,6±2,2 |
21,8±0,7 |
|
20 |
4 |
9 |
3 |
12,3±1,0 |
15,3±0,4 |
9,4±1,1 |
17,9±2,1 |
24,8±0,2 |
14,2±0,3 |
|
|
0-контроль |
4 |
13 |
7 |
9,4±0,2 |
22,1±1,4 |
14,9±0,9 |
12,0±0,8 |
23,5±1,1 |
18,6±2,1 |
|
|
кориандр |
5 |
7 |
10 |
7 |
10,7±0,4 |
24,5±0,9 |
13,2±0,2 |
11,2±0,4 |
31,0±3,5 |
15,3±1,1 |
|
20 |
8 |
19 |
6 |
35,0±2,8 |
28,4±1,1 |
14,0±1,0 |
208,7±13,8 |
45,2±1,5 |
20,7±0,8 |
|
Список литературы Температурный стресс и термопокой семян овощных зонтичных культур. Особенности индукции,проявления и преодоления (часть первая)
- Балеев Д. Н., Бухаров А. Ф. Аллелопатия овощных зонтичных (Umbelliferae). Торможение прорастания и индукция состояния покоя семян. Saarbrücken: LAP Lambert Academic Publishing GmbH & Co. KG, 2012. 128 с.
- Балеев Д. Н., Бухаров А. Ф. Специфика прорастания семян овощных зонтичных культур при различных температурных режимах//Овощи России, 2012. № 3 (16). С. 38 46.
- Доспехов Б. А. Методика полевого опыта. М.: Агропромиздат, 1985. 351 с.
- Кошкин Е. И. Физиология устойчивости сельскохозяйственных культур. М.: Дрофа, 2010. 638 с.
- Леманн Е., Айхеле Ф. Физиология прорастания семян злаков//пер. с нем. В. А. Бриллиант, М. Ф. Лилиенштерн. М.: Сельхозгиз, 1936. 489 с.
- Alonso-Blanco C., Bentsink L., Hanhart C.J., Blankestijn-de Vries H., Kornneef M. Analysis of natural variation at seed dormancy loci of Arabidopsis thaliana//Genetics, 2003. Vol. 164. pp. 71 1 729.
- Baskin J.M., Baskin C.C. A classification system for seed dormancy//Seed Science Research, 2004. Vol. 14. pp. 1 16.
- Bentsink L., Hanson J., Hanhart C.J. Natural variation for seed dormancy in Arabidopsis is regulated by additive genetic and molecular pathways//Proceedings of the National Academy of Sciences of the United States of America, 2010. Vol. 107. pp. 4264 4269.
- Bentsink L., Jowett J., Hanhart C.J., Koornneef M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis//Proceedings of the National Academy of Sciences of the United States of America, 2006. Vol. 103. pp. 1742 1747.
- Berges J. A., Varela D. E., Harrison P. J. Effects of temperature on growth rate, cell composition and nitrogen metabolism in the marine diatom Thalassiosira pseudonana (Bacillariophyceae)//Mar. Ecol. Prog. Ser., 2002. Vol. 225. pp. 139 146.
- Chiwocha D. S. Karrikins: a new family of plant growth regulators in smoke//Plant Sci., 2009. Vol. 177. pp. 252 256.
- Endo A., Tatematsu K., Hanada K. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds//Plant and Cell Physiology, 2012. Vol. 53. pp. 16 27.
- Finch-Savage W. E., Leubner-Metzger G. Seed dormancy and the control of germination//New Phytologist, 2006. Vol. 171. pp. 501 523.
- Finkelstein R., Reeves W., Ariizumi T., Steber C. Molecular aspects of seed dormancy//Annual Review of Plant Biology, 2008. Vol. 59. pp. 387 415.
- Flintham J. E. Different genetic components control coat-imposed and embryo-imposed dormancy in wheat//Seed Sci. Res., 2000. Vol. 10. pp. 43 50.
- Gu X.Y., Chen Z.X., Foley M.E. Inheritance of seed dormancy in weedy rice//Crop Science, 2003. Vol. 43. pp. 835 843.
- Gubler F., Millar A. A., Jacobsen J. V. Dormancy release, ABA and pre-harvest sprouting//Curr. Opin. Plant Biol., 2005. Vol. 8. pp. 183 187.
- Holdsworth M.J., Bentsink L., Soppe W.J.J. Molecular networks regulating Arabidopsis seed maturation, after-ripening, dormancy and germination//New Phytologist, 2008. Vol. 179. pp. 33 54.
- Kendall S.L., Hellwege A., Marriot P., Whalley C., Graham I.A., Penfield S. Induction of dormancy in Arabidopsis summer annuals requires parallel regulation of DOG1 and hormone metabolism by low temperature and CBF transcription factors//The Plant Cell, 2011. Vol. 23. pp. 2568 2580.
- Kilian B., Ozkan H., Pozzi C., Salamini F. Domestication of the Triticeae in the fertile crescent. In Genetics and Genomics of the Triticeae//In: Plant Genetics and Genomics: Crops and Models. New York: Springer Science + Business Media, 2009. pp. 81 119.
- Li Y.-C., Ren J.-P., Cho M.-J., Zhou S.-M., Kim Y.-B. The level of expression of thioredoxin is linked to fundamental properties and applications of wheat seeds//Mol. Plant, 2009. Vol. 2. pp. 430 441.
- Linkies A., Leubner-Metzger G. Beyond gibberellins and abscisic acid: how ethylene and jasmonates control seed germination//Plant Cell Reports, 2012. Vol. 31. pp. 253 270.
- Linkies A., Müller K., Morris K. Ethylene interacts with abscisic acid to regulate endosperm rupture during germination: a comparative approach using Lepidium sativum and Arabidopsis thaliana//The Plant Cell, 2009. Vol. 21. pp. 3803 3822.
- Oh E., Kang H., Yamaguchi S., Park J., Lee D., Kamiya Y., Choi G. Genome-wide analysis of genes targeted by Phytochrome Interacting Factor 3-LIKE5 during seed germination in Arabidopsis//The Plant Cell, 2009. Vol. 21. pp. 403 419.
- Oracz K., Voegele A., Tarkowska D., Jacquemoud D. Myrigalone A inhibits Lepidium sativum seed germination by interference with gibberellin metabolism and apoplastic superoxide production required for embryo extension growth and endosperm rupture//Plant and Cell Physiology, 2012. Vol. 53. pp. 81 95.
- Penfield S., Josse E.-M., Kannangara R., Gilday A.D., Halliday K.J., Graham I.A. Cold and light control seed germination through the bHLH transcription factor SPATULA//Current Biology, 2005. Vol. 15. pp. 1998 2006.
- Sabelli P. A., Larkins B. A. The development of endosperm in grasses//Plant Physiol., 2009. Vol. 149. pp. 14 26.
- Shahpiri A., Svensson B., Finnie C. From proteomics to structural studies of cytosolic/mitochondrial-type thioredoxin systems in barley seeds//Mol. Plant, 2009, Vol. 2. pp. 378 389.
- Sugimoto K., Takeuchi Y., Ebana K. Molecular cloning of Sdr4, a regulator involved in seed dormancy and domestication of rice//Proceedings of the National Academy of Sciences of the United States of America, 2010. Vol. 107. pp. 5792 5797.
- Utsugi S., Nakamura S., Noda K., Maekawa M. Structural and functional properties of Viviparous 1 genes in dormant wheat//Genes. Genet. Syst., 2008. Vol. 83. pp. 153 166.
- Walker Simmons M. ABA levels and sensitivity in developing wheat embryos of sprouting resistant and susceptible cultivars//Plant Physiol., 1987. Vol. 84. pp. 61 66.
- Warner R. L., Kudrna D. A., Spaeth S. C., Jones S. S. Dormancy in wheat-grain mutants of Chinese spring wheat (Triticum aestivumL.)//Grain Sci. Res., 2000. Vol. 10. pp. 51 60.
- Xie X., Yoneyama K., Yoneyama K. The strigolactone story//Annu. Rev. Phytopathol, 2010. Vol. 48. pp. 93 -117.


