Теоретическое исследование диффузии лития в поверхностных слоях диоксидов титана и олова
Автор: Елисеева Наталья Сергеевна, Попов Захар Иванович, Федоров Александр Семенович, Кузубов Александр Александрович, Высотин Максим Александрович
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Технологические процессы и материалы
Статья в выпуске: 4 (50), 2013 года.
Бесплатный доступ
Методом формализма функционала плотности DFT проведено исследование геометрической структуры пластин нанометровой толщины составов SnO 2 и TiO 2, а также свойств диффузии атомов лития в них. Рассчитано оптимальное положение атомов лития на поверхности и в приповерхностных слоях нанопластин. Показано, что атомы лития эффективно адсорбируются на поверхности оксидов, причем наиболее выгодным положением атома лития при сорбции на поверхности является положение над атомом металла. Рассчитаны высоты потенциальных барьеров перехода атомов лития между оптимальными положениями и показано, что атомы лития могут проникать внутрь пластин только путем близлежащей трансформации структуры оксида.
Оксид олова, оксид титана, литий, первопринципные расчеты, диффузия
Короткий адрес: https://sciup.org/148177145
IDR: 148177145 | УДК: 544.18
Текст научной статьи Теоретическое исследование диффузии лития в поверхностных слоях диоксидов титана и олова
В настоящее время в связи с удорожанием углеводородов, уменьшением их запасов и ростом экологических проблем в энергетике все чаще используются подходы так называемой альтернативной энергетики. Наиболее часто используемый способ получения альтернативной энергии основан на расщеплении ядер тяжелых атомов в атомных электростанциях. Полученная таким способом электроэнергия составляла 34 % от общего количества произведенной энергии в Европе в 2002 г. [1]. Несмотря на то, что выбросы углекислого газа при таком способе производства энергии пренебрежимо малы по сравнению с теплоэлектростанциями, вокруг атомной энергетики не утихают споры из-за высокой радиоактивности образующихся отходов, многие из которых обладают огромным периодом полураспада. Другой широко используемый метод получения альтернативной электрической энергии – гидроэлектростанции. К сожале- нию, их использование зависит от наличия значительных гидроресурсов. При этом электроэнергия является наиболее удобным видом энергии, экологически чистым и очень эффективно передаваемым на большие расстояния.
К сожалению, данный вид энергии тяжело поддается аккумулированию, хотя при этом есть огромное количество мобильных потребителей, в которых необходимо запасать эту энергию. Прежде всего, это потенциально огромная армия электромобилей, при переводе на которые экологическая обстановка, особенно в крупных городах, кардинально улучшится. Второе бурно растущее направление – это рынок мобильных устройств, в которые постоянно включаются все новые и новые устройства (портативные компьютеры, мобильный электроинструмент и др.). И здесь одними из самых перспективных типов аккумуляторов являются литий-ионные аккумуляторы.
Развитие данного типа аккумуляторов в настоящее время является одной из самых актуальных задач в области источников тока ввиду их перспективности, широкого использования в электронных устройствах и даже в автомобилестроении ближайшего будущего. По сравнению с другими перезаряжаемыми батареями, такими как кислотно-свинцовые, никелькадмиевые и никель-металл-гидридные, литий-ионные батареи обладают большим удельным зарядом, рабочим напряжением и меньшим током саморазряда. К тому же они не имеют эффекта памяти.
На сегодняшний день основным материалом анодов современных литий-ионных батарей является графит, который обладает адсорбционной емкостью по литию 372 мА*ч/г, а также материалы на его основе, например кокс. При внедрении ионы лития слегка раздвигают слои углеродной матрицы (графеновых листов) и располагаются между ними, образуя интер-калаты. Ввиду достаточно большого расстояния между слоями sp2-гибридизированного углерода, удельный объем углеродных материалов в процессе интер-каляции/деинтеркаляции ионов лития меняется незначительно, что является положительной чертой данных материалов. К сожалению, в таких материалах происходит значительный перенос электрического заряда с атомов лития на слои графита, что ведет к существенному отталкиванию ионов лития. Это приводит к тому, что максимальное содержание лития в графите соответствует фазе LiC 6 . Поэтому сейчас широко изучаются материал для следующего поколения литий-йонных батарей [2; 3]. Перспективными материалами для анодов в литий-ионных аккумуляторах могут выступить диоксиды титана и олова TiO 2 и
SnO 2 [4] в структуре рутила. Теоретическое исследование диффузии лития в приповерхностных слоях этих материалов представлено в нашей работе.
Все расчеты в работе проводились с помощью квантово-химического моделирования в лицензионном программном пакете VASP 5.3 (Vienna Ab-initio Simulation Package) [5–7] в рамках метода функционала плотности (DFT) [8; 9] с использованием базиса плоских волн и PAW формализма [10; 11]. Вычисления проводились в рамках обобщенного градиентного приближения (GGA) – обменно-корреляционого функционала PBE (Perdew-Burke-Ernzerhof) c коррекцией Grimme, учитывающей вандерваальсово взаимодействие [12].
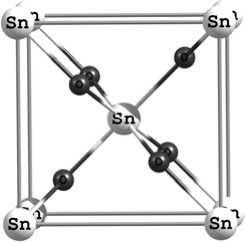
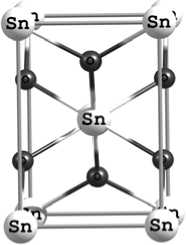
На начальном этапе работы была смоделирована структура объемных материалов TiO 2 и SnO 2 типа рутила. Элементарные ячейки этих материалов показаны на рис. 1. Элементарная ячейка типа рутила SnO 2 и TiO 2 содержит 2 атома металла и 4 атома кислорода и принадлежит к пространственной группе P 42/mnm.
При оптимизации геометрии элементарной ячейки первая зона Брюллюэна (1BZ) обратного пространства автоматически разбивалась на сетку 12×12×12, выбранную по схеме Монхорста–Пака [13]. Энергия обрезания плоских волн Ecutoff в расчетах была равна 400 эВ. При моделировании всех исследуемых структур оптимизация геометрии проводилась до значения максимальных сил, действующих на атомы, равных 0,01 эВ/Ǻ.
Полученные в ходе расчета параметры решеток TiO 2 и SnO 2 хорошо согласуются с экспериментальными [14–16] и теоретически полученными ранее данными [17] (табл. 1).
a
б
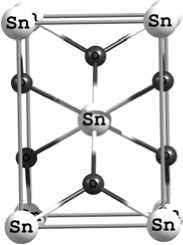
Рис. 1. Элементарная ячейка SnO2, вид: a – 001; б – 010; в – 001
Экспериментально определенные и рассчитанные параметры решеток TiO2 и SnO2
Таблица 1
|
Параметры решетки |
a , Å |
b , Å |
c , Å |
||
|
TiO 2 |
Экспериментальные [14] |
4,5936 |
4,5936 |
2,9587 |
|
|
Рассчитанные |
Данная работа |
4,5680 |
4,5680 |
2,9633 |
|
|
Работа [17] |
4,5936 |
4,5936 |
3,0040 |
||
|
SnO 2 |
Экспериментальные [15; 16] |
4,7250 |
4,7250 |
3,1657 |
|
|
Рассчитанные |
Данная работа |
4,7274 |
4,7274 |
3,2280 |
|
|
Работа [17] |
4,7370 |
4,7370 |
2,9683 |
||
Далее, исходя из параметров элементарной ячейки, проводилось моделирование тонких периодических пластин TiO2 и SnO2 с поверхностью (110), которые представляли собой суперячейки, содержащие 1×1×2, 1×1×3, 1×1×4 ячейки с данным типом поверхности (110), покрытой атомами кислорода. Из-за использования программы с периодическими граничными условиями в процессе моделирования пластин между ними задавался вакуумный промежуток 20 Å вдоль нормали к поверхности пластины. Его величина подбиралась исходя из предположения, что при таком расстоянии соседние поверхности не будут взаимодействовать друг с другом. При нахождении оптимальной геометрии пластин количество k -точек вдоль каждого из направлений составляло 6×10×1. Минимальная толщина пластинки подбиралась исходя из значений поверхностной энергии. Согласно полученным результатам толщины пластин 1×1×3 TiO 2 (110) (19,72 Å) и SnO 2 (110) (20,22 Å) были достаточны для корректного описания поверхностной энергии. Полученные значения поверхностной энергии равнялись 0,67 Дж/м2 (TiO 2 (110)) и 1,47 Дж/м2 (SnO 2 (110)), что хорошо согласуется с рассчитанными другими авторами значениями 0,67 Дж/м2 [17] и 1,56 Дж/м2 [17].
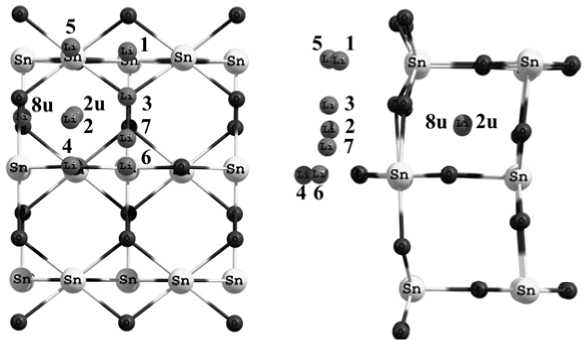
Для изучения сорбции и диффузии атома лития по поверхности и в приповерхностных слоях TiO2 (110) и SnO2 (110) была смоделирована пластина в виде су-перячейки 2×4×3 ячейки. При этом для нахождения оптимальной геометрии пластин, ввиду достаточно больших размеров суперячейки, количество k -точек вдоль каждого из направлений составляло 2×2×1. Для определения наиболее выгодных позиций одиночного атома лития на поверхности и в приповерхностных слоях TiO 2 (110) и SnO 2 (110) были рассчитаны структуры с различным его расположением (рис. 2).
Расчет энергии связи Ebind атома лития с поверхностью SnO2 (110) (табл. 2) рассчитывался по формуле
Ebind = ELiMO2 –EMO2 – ELi, (1)
где ELiMO2 – полная энергия системы TiO2 (110) (SnO2 (110)) с адсорбированным атомом лития; EMO2 – полная энергия суперячейки TiO2 (110) (SnO2 (110)); ELi – полная энергия в расчете на один атом лития в его кристаллической решетке (BCC).
Как видно из табл. 2, атомы лития эффективно адсорбируются на поверхности оксидов, причем наиболее выгодным положением атома лития при сорбции на поверхности является положение 5 (над атомом металла).
Следующим шагом были рассчитаны величины потенциальных барьеров для перехода атома лития по поверхности и в приповерхностных слоях пластины. Данные расчетов представлены в табл. 3 для переходов в структуре SnO 2 и TiO 2 .
Из табл. 3 видно, что переход с поверхности в объем материала сопровождается высоким потенциальным барьером, что свидетельствует о невозможности такого процесса. Экспериментально наблюдаемая диффузия лития внутрь данных структур рутила очевидно связана с глубокой перестройкой кристаллической решетки, содержащей атомы лития в порах, о чем убедительно свидетельствуют экспериментальные данные из [18].
В ходе выполнения работы с помощью проведения первопринципных DFT-расчетов были получены значения высот потенциальных барьеров для переходов атомов лития между оптимальными положениями в поверхностных и приповерхностных слоях оксидов титана и олова. Атомы лития эффективно адсорбируются на поверхности оксидов, причем наиболее выгодным положением атома лития при сорбции на поверхности является положение над атомом металла. При этом диффузия лития внутрь данных структур рутила, очевидно, связана с глубокой перестройкой кристаллической решетки материала.
б
Рис. 2. Различные положения атома лития на поверхности и в приповерхностных слоях SnO2 (110): а – вид сверху; б – вид сбоку
Таблица 2
Величины энергии связи Ebind атома лития с поверхностью TiO2 (110) и SnO2 (110) в зависимости от его расположения
|
Положения атома лития |
Энергия связи, эВ |
|
|
TiO 2 |
SnO 2 |
|
|
1 |
–0,997 |
–1,585 |
|
2 |
–1,831 |
–2,604 |
|
3 (переход в положение 7) |
–1,999 |
–2,997 |
|
4 |
–1,413 |
–2,632 |
|
5 |
–2,018 |
–3,096 |
|
6 |
–0,433 |
–0,941 |
|
7 |
–2,014 |
–3,002 |
|
2u |
–1,747 |
–2,526 |
|
8u |
–2,008 |
–2,240 |
Таблица 3
Величины потенциальных барьеров перехода атома лития по поверхности и в приповерхностных слоях TiO2 (110) и SnO2 (110) в зависимости от пути миграции
|
Путь миграции атома лития |
Потенциальный барьер перехода, эВ |
|||
|
В прямом направлении |
В обратном направлении |
|||
|
TiO 2 |
SnO 2 |
TiO 2 |
SnO 2 |
|
|
1-6 |
0,60 |
0,64 |
0,03 |
0,00 |
|
1-7 |
0,06 |
0,01 |
1,09 |
1,43 |
|
2-4 |
0.48 |
0,05 |
0,05 |
0,08 |
|
2-6 |
1,43 |
1,70 |
0,01 |
3,36 |
|
2-7 |
0,12 |
0,01 |
0,30 |
0,41 |
|
5-4 |
0,65 |
0,47 |
0,04 |
0,00 |
|
5-7 |
0,07 |
0,09 |
0,07 |
0,00 |
|
2u-8u |
0,07 |
0,02 |
0,31 |
0,30 |
|
2u_2u (продвижение вглубь) |
2,50 |
2,55 |
2,77 |
2,65 |
|
8u-8u (движение вдоль одного слоя) |
2,68 |
2,91 |
2,67 |
2,91 |
|
2-2u |
2,24 |
2,31 |
2,17 |
1,95 |


