Теоретическое исследование сорбции и диффузии водорода в интерметаллиде Mg 2Ni
Автор: Елисеева Наталья Сергеевна, Кузубов Александр Александрович, Краснов Павел Олегович, Федоров Александр Семенович, Лыхин Александр Олегович
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Технологические процессы и материалы
Статья в выпуске: 5 (45), 2012 года.
Бесплатный доступ
Представлено теоретическое исследование интерметаллида Mg 2Ni как потенциального материала для абсорбирования водорода. Рассмотрены процессы сорбции и диффузии водорода в объеме данного материала. Изучено влияние структурных характеристик на энергию сорбции атомов водорода.
Водородная энергетика, сорбция, диффузия, теория функционала плотности (dft)
Короткий адрес: https://sciup.org/148176946
IDR: 148176946 | УДК: 544.18,
Текст научной статьи Теоретическое исследование сорбции и диффузии водорода в интерметаллиде Mg 2Ni
Важное значение для решения проблем водородной энергетики имеют гидриды интерметаллических соединений (ИМС) общей формулы A m B n H x , где AmBn – соединение двух или более металлов из ряда ИМС, один из которых (А) образует стабильный бинарный гидрид, а другой (В) в обычных условиях с водородом не взаимодействует, но является катализатором диссоциации молекул H 2 . Гидридообразующие интерметаллиды принято классифицировать, исходя из соотношения m/n их компонентов. Из большого числа семейств гидридообразующих ИМС наиболее практическое значение имеют AB 5 (структура типа CaCu 5 ), АВ 2 (фаза Лавеса), АВ (структура типа CsCl) и А2В (структура типа В2Al). В соединениях AB5 в качестве компонента А используют редкоземельные металлы (РЗМ) или кальций, в АВ 2 и АВ – элементы подгруппы титана, в А 2 В – главным образом магний. Компонент В во всех семействах преимущественно включает переходные металлы (Fe, Co, Ni, V, Mn, Cr) [1].
Интерметаллические гидриды имеют подходящую для прикладного использования кинетику поглоще-ния/выделения водорода в мягких условиях и поэтому в наибольшей мере подходят для создания систем хранения водорода [2; 3]. Однако практическое хранение водорода в таких связанных состояниях сталкивается с рядом сложностей. Основные трудности, которые необходимо решить для этих материалов – это увеличение скорости процессов сорбции-десорбции водорода и повышение циклической устойчивости материала адсорбента. Для их преодоления требуются углубленные теоретические и экспе- риментальные исследования в области физикохимических свойств интерметаллидов и гидридов на их основе.
Интерметаллиды на основе магния считаются наиболее перспективными материалами для хранения водорода за счет их высокой емкости, широкой распространенности магния в земной коре и его низкой стоимости по сравнению с альтернативными материалами [4]. Из всех сплавов на основе магния интерметаллическое соединение Mg 2 Ni, обладающее гексагональной кристаллической решеткой, может быть легко синтезировано. При этом оно быстро реагирует с водородом, образуя гидрид Mg 2 NiH 4 , что делает его перспективным материалом для хранения водорода [5; 6]. После гидрирования Mg 2 Ni претерпевает структурную перегруппировку, переходя в гидрид Mg 2 NiH 4 [7]. Под давлением 1 атм. этот гидрид переходит из высокотемпературной (ВТ) кубической фазы в низкотемпературную (НТ) моноклинную фазу, температура перехода составляет 518–483 К [8–10].
Ввиду того, что для практического применения адсорбентов водорода наиболее подходящим является материал, поглощающий водород при низком давлении и невысоких температурах, низкотемпературная фаза Mg2NiH4 привлекает большее внимание исследователей в области водород-аккумулирующих материалов [11–14]. Myers и другие [11] исследовали термодинамические, электронные и оптические свойства моноклинной НТ-Mg 2 NiH 4 на основе ab-initio расчетов. Было установлено, что геометрия комплекса NiH 4 в НТ-фазе близка к правильному тетраэдру, что согласуется с данными нейтронной дифракции [15].
Были рассчитаны теплота образования Mg2NiH4 из H 4 и Mg 2 Ni, а также энтальпия фазового перехода Mg2NiH4 из НТ в ВТ-Mфазу, хотя полученные значения оказались значительно выше экспериментальных. Haussermann и другие [12] исследовали структурную стабильность НТ-Mg 2 NiH 4 и Ba 2 PdH 4 , используя DFT расчеты. Разница в связывании водорода этими соединениями объясняется различием в силе взаимодействий групп Ni(Pd)-H и Mg(Ba)-H. Авторами было предложено, что температура десорбции водорода из Mg2NiH4 может быть снижена путем введения дефектов (например, замена атома Mg на атом Al) вблизи тетраэдрического комплекса NiH4. Jasen и др. [13] также провели расчет электронной структуры НТ-Mg2NiH4 в рамках приближения локальной плотности (LDA). Ими был сделан вывод, что связь водорода с никелем сильнее, чем с магнием, и взаимодействие sp-оболочек Ni с s-оболочкой водорода является основным в гидриде. На основании расчетов [14] теплоты реакции гидрирования, энтальпии образования и энергии, необходимой для отрыва атома водорода, был сделан вывод, что при гидрировании Mg 2 Ni вероятность образования НТ-фазы Mg 2 NiH 4 выше, чем ВТ-фазы. Также было установлено, что для удаления водорода при низких температурах из НТ-Mg 2 NiH 4 , обладающим высокой структурной стабильностью, необходимо вводить в состав материала примесей-катализаторов, облегчающих кинетику процессов сорбции/десорбции. Однако для этого необходимо детальное изучение кинетики диффузии водорода внутри чистой фазы Mg 2 Ni. Поэтому целью данной работы и являлось теоретическое исследование сорбции и диффузии водорода в интерметаллическом соединении Mg2Ni.
Исследования осуществлялись с помощью квантово-химического моделирования в лицензионном программном пакете VASP 5.3 (Vienna Ab-initio Simulation Package) [16–18] в рамках метода функционала плотности (DFT) [19–20] с использованием базиса плоских волн и PAW формализма [21–22]. Вычисления проводились в рамках обобщенного градиентного приближения (GGA) – обменно-корреляционого функционала PBE (Perdew-Burke-Ernzerhof) c коррекцией Grimme, учитывающей ванн-дер-ваальсово взаимодействие [23]. Для нахождения переходного состояния и потенциальных барьеров при переходе атома водорода внутри Mg 2 Ni был применен метод упругой ленты (nudged elastic band).
На начальном этапе работы была смоделирована элементарная гексагональная ячейка Mg 2 Ni. При оптимизации ее геометрии для интегрирования по первой зоне Брюллюэна (1BZ) эта зона автоматически разбивалась на сетку 12 × 12 × 2, выбранную по схеме Монхорста-Пака [24]. Далее, для изучения диффузии атома водорода в объеме Mg 2 Ni, была сконструирована суперячейка из 3 × 3 × 1 элементарных ячеек. При нахождении оптимальной геометрии суперячейки, ввиду достаточно больших ее размеров, количество k -точек вдоль каждого из направлений составляло 2 × 2 × 2. Энергия обрезания плоских волн E cutoff в расчетах была равна 269,5 эВ. При моделировании всех исследуемых структур оптимизация геометрии проводилась до значения максимальных сил, действующих на атомы, равных 0,01 эВ/Ǻ. Для определения наиболее выгодных позиций атома водорода в объеме Mg 2 Ni были рассчитаны структуры с различным его расположением (рис. 1).
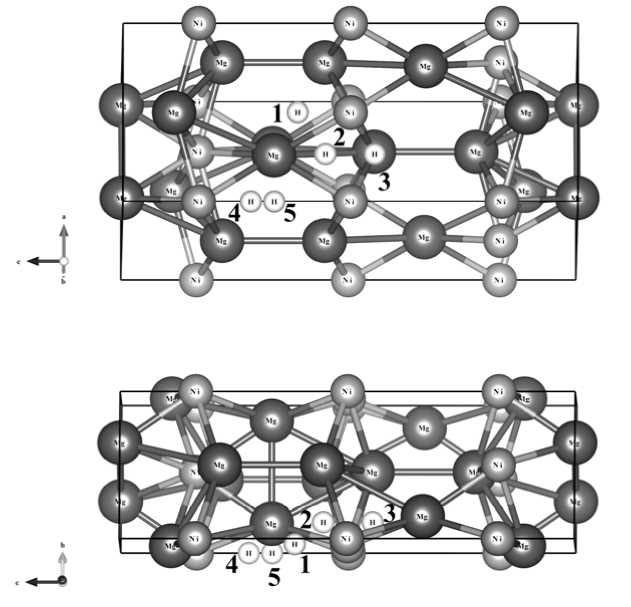
Рис. 1. Cорбционные положения атома водорода в интерметаллиде Mg2Ni
Экспериментально определенные и рассчитанные параметры решетки Mg2Ni
Таблица 1
|
Параметры решетки |
a, Å |
b, Å |
c, Å |
|
Экспериментальные |
5,205 |
5,205 |
13,236 |
|
Рассчитанные |
5,125 |
5,125 |
13,026 |
Таблица 2
Значения энергии образования соединения на один атом водорода и расстояния Ni-H в зависимости от положения сорбции водорода в Mg2Ni
|
Положение водорода |
Энергия связи Е , эВ |
Расстояние Ni-H, Å |
|
1 |
0,3717 |
1,5120 |
|
2 |
–0,1087 |
1,5825 |
|
3 |
–0,1042 |
1,5848 |
|
4 |
0,4063 |
1,4981 |
|
5 |
0,6011 |
1,8253 |
Таблица 3
Значения энергии образования соединения на один атом водорода и расстояния Ni-H в зависимости от положений сорбции двух и четырех атомов водорода в Mg2Ni
|
Положения водорода |
Энергия связи Е , эВ |
Расстояние H-H, Å |
Угол H-Ni-H, º |
|
2a, 2c |
–0,144 |
2,0574 |
77,5, 78,0 |
|
2c, 2b |
–0,177 |
3,0820 |
153,2 |
|
2c, 2d |
–0,182 |
2,6940 |
115,5 |
|
3a, 3b |
–0,185 |
2,6392 |
111,9 |
|
3a, 3d |
–0,453 |
2,7444 |
119,0 |
|
2d, 3d |
0,028 |
1,7762 |
64,8, 64,9 |
|
3b, 3d |
–0,138 |
2,0830 |
78,6, 78,8 |
|
2b, 3d |
–0,002 |
1,8109 |
66,8, 66,9 |
|
2c, 3d |
–0,185 |
2,6535 |
111,9 |
|
2c, 3b |
–0,178 |
3,1231 |
159,3 |
|
2a, 2b, 2c, 2d |
–0,148 |
2,1100; 2,6563 |
148,3; 108,4; 80,3 |
|
3a, 3b, 3c, 3d |
0,074 |
1,8173; 2,6647 |
154,2; 115,9; 69,9 |
|
2a, 2d, 3c, 3b |
0,009 |
1,8652; 2,5744 |
154,1; 105,3; 61,6 |
Расчет энергии образования соединения на один атом водорода в Mg2NiH реализовывался по формуле
E = ( E Mg2 N iH – E Mg2 N i – -0,5 E H2), (1)
где E Mg 2 NiH – полная энергия системы Mg 2 NiH; E Mg 2 Ni – полная энергия интерметалида Mg 2 Ni; E H 2 – энергия молекулы водорода.
В ходе оптимизации геометрии элементарной ячейки Mg 2 Ni была получена ее оптимальная геометрия, которая хорошо согласуется с установленной экспериментально (табл. 1) [10].
Далее, с помощью суперячейки Mg2Ni, смоделированной из оптимальной геометрии элементарной ячейки, было найдено наиболее выгодное сорбционное положение атома водорода (рис. 1, табл. 2).
Экспериментальные значения длины связи Ni-H в НТ-Mg2NiH4 колеблются в области 1,519–1,572 Å [25], согласно теоретическим работам – в интервале 1,537–1,579 Å [11]. Сравнивая эти данные с полученными нами (табл. 2), можно сделать вывод о том, что атом водорода изначально стремиться занять оптимальные положения 2 и 3 на рис. 1, соответствующие тетраэдрической конфигурации комплекса NiH4, так как именно эти положения являются выгодными. В остальных трех положениях (1, 4, 5) на рис. 1, атом водорода находится либо слишком близко к атому никеля, либо, наоборот, далеко, что в свою очередь негативно сказывается на энергетике системы. Этот факт можно объяснить наличием дополнительных сил (отталкивания/притяжения), действующих на атом водорода.
Для более детального изучения механизма сорбции внутри интерметаллического соединения Mg 2 Ni в процессе его полного наводороживания были рассмотрены структуры с двумя и четырьмя атомами водорода, сорбированных в наиболее выгодных положениях (табл. 3, рис. 2).
Для структуры с четырьмя сорбированными атомами водорода была рассчитаны три конфигурации, в которых атомы достаточно разнесены и максимально приближены к тетраэдрическому расположению. Это было вызвано тем, что среди систем Mg 2 NiH 2 стабильнее оказались структуры, где расстояние между атомами водорода D H-H превышает 2,0 Å, что соответствует экспериментальным данным D H-H = 2,4 Å [26] (табл. 3) и что можно объяснить уменьшением электростатического отталкивания между атомами водорода.
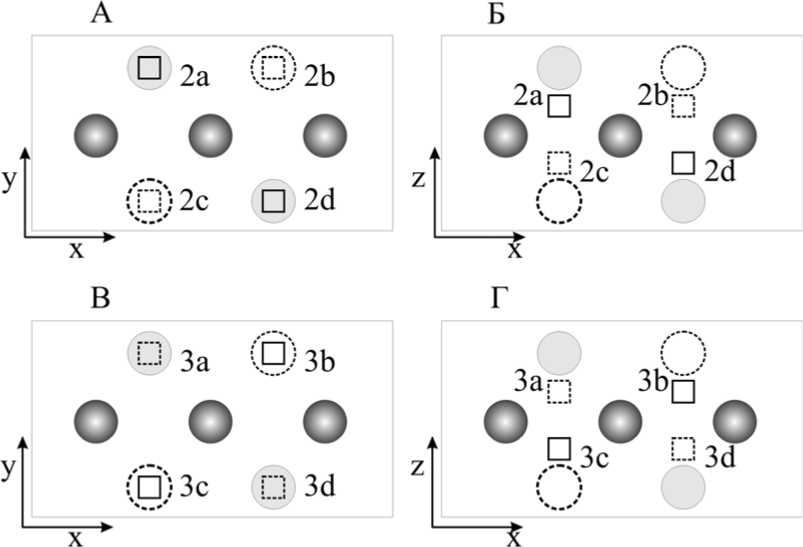
Рис. 2. Cорбционные положения атома водорода в Mg2NiH2:
А – вид сверху для положения 2; Б – вид сбоку для положения 2; В – вид сверху для положения 3, – вид сбоку для положения 3 (серые сферы соответствуют атомам Ni, квадраты – атомам H, круги – атомам Mg, пунктирной линией обозначены атомы слоя, расположенного под слоем никеля, сплошной линией – над слоем никеля)
Таблица 4
Значения величин потенциального барьера перехода в зависимости от пути миграции атома водорода
|
Начальное и конечное положения водорода |
Потенциальный барьер перехода, эВ |
|
|
в прямом направлении |
в обратном направлении |
|
|
4–3 |
0,08 |
0,59 |
|
1-3 |
0,03 |
0,51 |
|
3a–2a |
0,02 |
0,03 |
|
3a–2c |
0,05 |
0,05 |
|
3b–2a |
0,33 |
0,33 |
При этом величины углов H-Ni-H (119º, 111,9º) в данных системах Mg 2 NiH 2 близки к экспериментальным значениям (103,4º и 119,3º) [25] и полученным ранее теоретическим значениям (107,8º и 111,3º) [11]. Следует обратить внимание на то, что энергия образования рассматриваемых систем Mg 2 NiH x ( х = 1–4) очень зависит от структуры системы. Поскольку, несмотря на энергетическую стабильность положений 3a, 3d; 3a, 3b; 3b, 3d атома водорода в Mg 2 NiH 2 , структура Mg 2 NiH 4 , где атомы водорода находятся в положениях 3a, 3b, 3c, 3d, является неустойчивой. Это можно объяснить как изменением расстояний и углов (табл. 3) между атомами водорода, так и тем, что некоторые атомы водорода находятся очень близко друг к другу (D H-H = 1,82–1,86 Å).
Также нами был изучен процесс диффузии атома водорода в исследуемом материале Mg2NiH, т. е. на первой стадии гидрирования интерметаллида Mg2Ni. Были рассмотрены несколько возможных путей миграции одиночного атома водорода в структуре (табл. 4). Согласно проведенным расчетам большинство вели- чин потенциальных барьеров очень малы. Следовательно, атом водорода будет свободно перемещаться в объеме Mg2Ni.
В ходе работы с помощью DFT расчетов были определены наиболее выгодные положения для адсорбирования атомов водорода в объемном интерметал-лиде Mg 2 Ni. Были вычислены энергии абсорбирования атомов водорода внутри набора рассматриваемых систем Mg2NiHx ( х = 1–4), которые сильно зависят от структуры соединения потому, что атомы водорода стремятся образовать с атомом никеля правильный тетраэдрический комплекс. Исследование процесса диффузии одиночных атомов водорода в объеме Mg 2 Ni показало, что потенциальные барьеры для миграции атома H очень малы, что свидетельствует о свободном его перемещении. Следовательно, из полученных данных можно сделать вывод о перспективности применения Mg 2 Ni в качестве материала для хранения водорода.
Межведомственному суперкомпьютерному центру РАН (Москва), компьютерному центру СФУ, а также НИВЦ МГУ Лаборатории параллельных информационных технологий (система СКИФ МГУ «Чебышев») за предоставление возможности использовать вычислительные кластеры, на которых были проведены все расчеты.


