Теоретическое исследование сорбции молекулярного водорода на графане, допированном атомами лития
Автор: Антипина Л.Ю., Сорокина Т.П., Сорокин П.Б., Квашнина О.П.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Энергообеспечение и энерготехнологии
Статья в выпуске: 3, 2012 года.
Бесплатный доступ
В статье рассмотрен механизм сорбции молекулярного водорода на систему Li-графан. Показано, что данная система может сорбировать до 12 % вес. молекулярного водорода. Данный результат соответствует общепризнанным требованиям американского энергетического департамента (DOE) содержания адсорбированного водорода для его промышленного использования на транспорте (6-7 % вес.).
Графан, сорбция, водород, литий
Короткий адрес: https://sciup.org/14082271
IDR: 14082271 | УДК: 538.971.544.7
Текст научной статьи Теоретическое исследование сорбции молекулярного водорода на графане, допированном атомами лития
Введение. Отсутствие материала для эффективного хранения водорода – одна из основных проблем для его использования в качестве экологически чистого альтернативного топлива. Возможным решением этой проблемы является использования в качестве сорбента для водорода углеродных наноструктур в связи с их малым весом и большой удельной площади поверхности. Так, были опубликованы работы, посвященные исследованию нанотрубок [1,2], графена [3,4] и фуллеренов [5] как возможных эффективных сорбентов водорода. Однако данные системы показывают слишком маленькую энергию связи с адсорбированным водородом (~0,05 эВ/H 2 ), в то время как для эффективного использования в водородной энергетике значение энергии связи должно находиться в диапазоне 0,2 ~ 0,4 эВ/H 2 .
С другой стороны, углеродные наноструктуры с адсорбированными на них атомами щелочных (Li, Na, K) [6–9] металлов (металлоорганические комплексы) показывают хорошую энергию адсорбции молекулярного водорода на атом металла (~0,2–0,6 eV), делая их перспективными в качестве объекта сорбции. В насто- ящее время опубликован ряд работ по исследованию стабильности металлоорганических комплексов, состоящих из шелочных и щелочноземельных металлов и таких углеродных наноструктур, как фуллерен [10], нанотрубки [11,12], графен [6–9]. Для последнего в числе всего прочего было получено, что атомы Li, Na и К образуют с ним прочную связь с энергией связывания порядка 1 эВ.
Атомы металла в данных металлоорганических комплексах играют роль сорбента для молекул водорода, тогда как углеродная структура служит для них подложкой. Таким образом, уменьшение в размере материала подложки увеличит массовую долю и плотность адсорбции водорода. Следует также заметить, что ограничением в выборе подложки является, кроме необходимости ее малого веса, также запрет на кластеризацию атомов металла, так было показано в [1 3–15] в случае использования комплекса УНТ-Sr, малый барьер диффузии атомов металла на поверхности нанотрубки приводит к их агрегации в кластеры и значительному снижению потенциальной водородной сорцбии материала.
При данном подходе перспективным материалом для подложки может выступать графан (Gr) [16]. Графан был впервые предсказан в работе Софо и др. [17], его атомная структура представляет собой лист графена, в котором каждый атом углерода химически связан с атомом водорода. Все углерод-углеродные связи в структуре sp3 гибридизованы, таким образом в системе отсутствуют π-связи, отвечающие за проводимость, что приводит к тому, что в отличие от графена, графан проявляет диэлектрические свойства и является тончайшей алмазной пленкой. Сделанные теоретические предсказания были подтверждены экспериментом [18], в котором был проведен синтез графана и изучена его проводимость.
В данной работе проводилось исследование органометаллических комплексов графана с литием (Li-Gr) как возможных перспективных объектов для хранения водорода. В исследуемой системе атом металла замещал часть атомов водорода, присоединенных к углероду, формируя таким образом прочную ковалентную связь. Нами были найдены наиболее энергетически стабильные конфигурации Li-Gr с энергией связи, достаточной для их использования в качестве основы для последующей сорбции молекулярного водорода. Следует заметить, что проблема агрегации металлов на графане отсутствует в связи с тем, что каждый атом углерода, окружающего атом металла, связан с водородом, таким образом металл не может диффундировать по поверхности Gr.
Изучение термодинамики сорбции водорода на предложенных комплексах показало, что система Li-Gr может адсорбировать до 4 молекул водорода на атом лития с энергией связывания порядка 0,2 эВ, таким образом, предел содержания водорода в предложенной структуре составляет 12,2 % вес. Данный результат соответствует общепризнанным требованиям американского энергетического департамента (DOE) содержания адсорбированного водорода для его промышленного использования на транспорте (6–7 % вес.)
Параметры моделирования. Все представленные в работе расчеты были выполнены в рамках теории DFT c приближением LDA в параметризации Пердью-Зунгера [19] с использованием пакета Quantum Espresso [20]. Прежде чем проводить исследования, были проведены тестовые расчеты адсорбции атома лития на кластере адамантане, имеющего структуру алмаза, родственную графану. Полученное значение энергии связи лития с графеном (-1,52 эВ) находится в хорошем соответствии с результатами работы (-1,46 эВ) [20], поэтому можно ожидать такой же точности в расчете исследуемых структур. Параметры, которые использовались при проведении расчетов, были следующие: энергия обрезания 30 Ридберг, количество k-точек – (8х8х1).
Результаты и их обсуждение. Нами была проанализирована стабильность комплексов Li-Gr с различными концентрациями адсорбированного металла, чтобы выяснить, система с какой концентрацией и конфигурацией является наиболее энергетически стабильной. Расчет энергии связи проводился по формуле
E . ( Me ) = [ E c - m. - "E m. - E c ]/ " ■ (1)
где E C - Me , EC , и EMe - значения энергии системы Li-графан, графана без n атомов водорода, отдельного атома металла, соответственно;
n – количество атомов металла в элементарной ячейке.
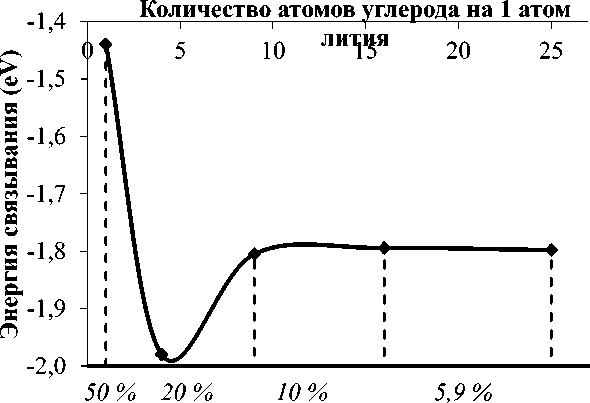
На рисунке 1 представлен график энергии связывания атомов лития с графеном в зависимости от их концентрации, при этом на графике каждая точка соответствует наиболее выгодной конфигурации атомов на поверхности для данной концентрации.
Концентрация металла в ячейке
Рис. 1. Энергия связывания лития с графеном и схематичное отображение наиболее энергетически
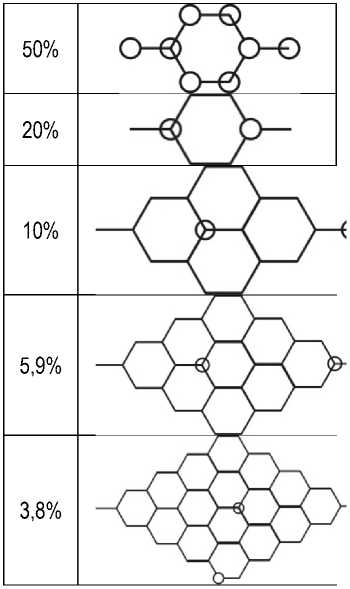
выгодного расположения атомов металла на графане для данной концентрации. Атомы углерода и водорода схематично изображены линиями, в то время как этомы металла изображены кружками
(пустой кружок – атом лития находится над поверхностью графана, кружок с крестом – атом находится под поверхностью графана)
Заметим, что энергия связи атома лития с графаном для концентрации 50% (атом лития сорбирован на каждом атоме углерода) находится в хорошем соответствии с работой [21], в которой энергия составила 1,4 эВ. В структуре с концентрацией 50% атомы металла находятся слишком близко (~4 А) и из-за взаимного кулоновского рассталкивания повышают энергию системы.
Структура с концентрацией металла 20% является наиболее энергетически выгодной для всех структур, при этом энергия связи -2 эВ свидетельствует о высокой стабильности системы, сравнимой с энергией связи лития с графеном [6] и фулереном [10]. При дальнейшем уменьшении концентрации металла происходит увеличение энергии до -1,8 эВ, при этом энергия практически перестает изменяться и выходит на плато. Таким образом можно сделать вывод, что при концентрациях менее 20% атомы металлов уже не взаимодействуют друг с другом и перестают стабилизировать структуру. Таким образом, для дальнейшего изучения сорбции молекулярного водорода на щелочных металлах мы рассматривали только концентрацию с наименьшей энергией (20%).
На рисунке 2 представлен график изменения энергии связывания молекул водорода в зависимости от их количества.
E bind ( H 2 ) = [ E
Gr - Me + nH 2
—
E
Gr - Me
—
где E Gr - Me + nH , EGr - Me , и E H^ - значения энергии системы Li-графан с n молекулами водорода, системы Li-графан с ( n -2) молекулами водорода и энергия отдельной молекулы водорода соответственно;
n - количество молекул водорода в системе.
Количество молекул H 2 на 1 атом лития
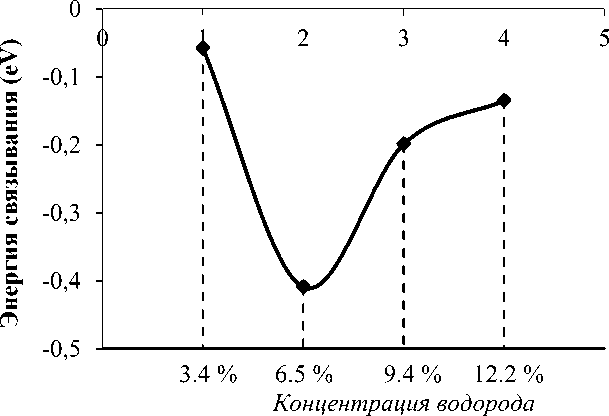
Рис. 2. Энергия связывания молекулы водорода с системой Li-Gr в зависимости от количества Н 2 на атом металла
Из представленных расчетов видно, что адсорбции уже 3 молекул водорода (9,5 % вес.) на атом металла достаточно для удовлетворения требований DOE. При связывании 3-й и 4-й молекул водорода происходит спад энергии связывания. При этом связывания с литием 4-й молекулы практически не происходит, поскольку она располагается на расстояние 3,68 Å.
Интересно рассмотреть механизм связывания графена с металлом и адсорбции водорода на комплексе. При связывании графаном атомов металла на углероде увеличивается отрицательный заряд (табл.) в связи с тем, что атом лития отдает свой электрон на атом углерода как менее электроотрицательный элемент (Х Li = 0,98, Х С = 2,55 по Полингу) с образованием полярной ковалентной связи. На металле при этом появляется положительный заряд (+0,22e). Однако при присоединении молекулярного водорода к литию заряд на нем уменьшается (до 0,03e при присоединении 4-х молекул Н 2 ).
Заряды на атомах (по Левдину, в единицах e) в системе Li-Gr с различной концентрациями адсорбированного водорода
|
Графан |
Графан+Li |
||||||
|
С i |
-0,12 |
Н i |
0,16 |
С i |
-0,09 |
Н i |
0,14 |
|
С Li |
-0,24 |
Li i |
0,22 |
||||
|
1 H 2 |
|||||||
|
С i |
-0,08 |
Н i |
0,13 |
H mol |
0,06 |
||
|
С Li |
-0,21 |
Li i |
0,10 |
||||
|
2 H 2 |
|||||||
|
С i |
-0,08 |
Н i |
0,14 |
H mol |
0,05 |
||
|
С Li |
-0,22 |
Li i |
0,05 |
||||
|
3 H 2 |
|||||||
|
С i |
-0,09 |
Н i |
0,13 |
H mol |
0,05 |
||
|
С Li |
-0,22 |
Li i |
0,04 |
||||
|
4 H 2 |
|||||||
|
С i |
-0,08 |
Н i |
0,12 |
H mol |
0,02 — 0,05 |
||
|
С Li |
-0,21 |
Li i |
0,03 |
||||
Примечание. C i – средний заряд атомов углерода, H i – средний заряд атомов водорода химически связанных с атомами углерода, C Li – средний заряд атомов углерода связанных с атомами лития, Li i – средний заряд атомов лития, H mol – средний заряд адсорбированных молекул водорода.
Присоединение лития приводит к тому, что его орбитали примешиваются в запрещенную зону графана, переводя его из диэлектрического состояния в металлическое. При этом происходит делокализация электронов между уровнями углерода и металла, обеспечивая, таким образом, более стабильную разреженную систему. При присоединении молекул водорода их орбитали занимают орбитали лития и уширяют запрещенную зону. Не занятые до этого орбитали лития образуют связь с молекулами водорода по донорноакцепторному механизму с понижением их энергия. Смешиваясь с орбиталями Н 2 , они уходят на более низкие энергии. Однако при присоединении 3-й молекулы H 2 орбитали лития насыщаются электронами, уменьшается запрещенная зона и стабильность структуры уменьшается, таким образом, третьей молекуле водорода становится сложнее присоединиться к комплексу. Присоединение же 4-й молекулы будет происходить по кулоновскому взаимодействию со значительным ослаблением энергии связывания.
Выводы
Была проанализирована стабильность комплексов Li-графан при различных концентрациях лития, получено, что наиболее система наиболее энергетически стабильна при значении концентрация 20 %. Было проведено изучение адсорбции молекулярного водорода на таком комплексе и получено, что его сорбционная емкость составляет 9.5 % вес., при этом энергией сорбции H 2 составляет 0,2 эВ на молекулу водорода, что позволяет говорить о комплексе Li-графан как о перспективном материале для хранения молекулярного водорода.


