Теоретическое исследование сорбции водорода в интерметаллических соединениях Al 3Ti, Al 3Ni и Al 4Pd
Автор: Куклин А.В., Елисеева Н.С., Кузубов А.А., Краснов П.О., Сержантова М.В.
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Технологические процессы и материалы
Статья в выпуске: 3 (49), 2013 года.
Бесплатный доступ
Представлено теоретическое исследование интерметаллидов Al 3Ti, Al 3Ni и Al 4Pd как потенциальных материалов, которые могут образовываться при синтезе тонких пленок титана, никеля и палладия на поверхности алюминия. При помощи теории функционала плотности изучена возможность образования гидридов данных соединений.
Водородная энергетика, сорбция водорода, теория функционала плотности (dft)
Короткий адрес: https://sciup.org/148177108
IDR: 148177108 | УДК: 544.18
Текст научной статьи Теоретическое исследование сорбции водорода в интерметаллических соединениях Al 3Ti, Al 3Ni и Al 4Pd
Водород, как высокоэффективный, возобновляемый и экологически чистый энергоноситель, имеет большие перспективы для широкого использования в энергетике, особенно как топлива для транспортных средств [1; 2].
Наиболее перспективным методом считается хранение водорода в абсорбированном состоянии. Гидриды металлов, такие как MgH2, AlH3, NaAlH4, LiH и другие, с разной степенью эффективности, могут быть использованы в качестве носителя для водорода, часто обратимо. Перспективным металлом для хранения водорода является алюминий ввиду низкой стои- мости, малой молярной массы, доступности и не токсичности.
Одной из проблем использования данного материала в качестве аккумулятора водорода является плохая кинетика реакции сорбции / десорбции. Причина медленной абсорбции водорода связана с высокой окислительной чувствительностью и затрудненностью диссоциации молекул водорода на поверхности, предшествующей диффузии внутрь. Улучшение кинетики реакции может быть достигнуто путем уменьшения размера частиц и модифицированием переходными металлами [3–5].
В обычных условиях гидрид алюминия (алан) имеет полимерную молекулярную структуру (AlH 3 ) n , при этом его кристаллическая форма существует в семи полиморфных модификациях: α-(AlH3)n, α1-(AlH 3 ) n , β-(AlH 3 ) n , δ-(AlH 3 ) n , ε-(AlH 3 ) n , γ-(AlH 3 ) n , ζ-(AlH 3 ) n [6]. Самой устойчивой является модификация α-(AlH3)n, имеющая гексагональную сингонию (пространственная группа R3c, а = 4,449 Å, b = 4,449 Å, c = 11,804 Å) [7; 8].
Авторами работы [9] показано, что размол AlH3 в шаровой мельнице приводит к увеличению скорости десорбции водорода, вероятно, из-за увеличения свободной от оксида поверхности. В работах [10–13] показано, что допирование алюминия переходными металлами, такими как никель и титан, улучшает кинетику реакции и способствует хемосорбции водорода. Замещение алюминия титаном кинетически стабильно при комнатной температуре. В этом случае титан преимущественно располагается в поверхностном и приповерхностном слое. Размещение титана в поверхностном слое располагает к образованию парных комплексов, которые улучшают диссоциацию водорода [13]. Сочетая поверхностную ИК-спектроскопию и теорию функционала плотности, авторами работы [10] показано, что добавление титана приводит к снижению образования больших аланов, за счет уменьшения мобильности водорода и захвата малых аланов. Титан тем самым препятствует олигомеризации. Добавление титана также резко понижает температуру десорбции с 290 до 190 К. Контролируя размещение титана, можно дополнительно снизить барьеры активации распада молекул водорода, а также улучшить диффузию водорода в объем [14].
Однако в данной области исследований остается много открытых вопросов. В частности, неясно какие процессы происходят при более высоких температурах, которые требуются для протекания абсорбции водорода.
Предположительно, при добавлении к алюминию небольшого количества титана, никеля или палладия и их совместном нагревании, будут образовываться соединения вида Al3Ti, Al3Ni и Al4Pd. Исходя из этого, целесообразно изучить поведение водорода в данных системах. Таким образом, целью работы являлось квантово-химическое исследование сорбции водорода в интерметаллических соединениях Al 3 Ti, Al 3 Ni и Al 4 Pd.
Моделирование исследуемых объектов проводили с использованием квантово-химического пакета VASP (Vienna Ab-initio Simulation Package) [15–18] в рамках формализма функционала плотности (DFT) [19, 20], основанного на градиентном приближении (GGA). В расчетах применяли обменно-корреляционный потенциал PBE (Perdew-Burke-Ernzerhof) [21] и метод PAW (projector augmented-wave) [22].
Для изучения сорбции водорода в интерметалли-дах, на начальном этапе работы были смоделированы элементарные ячейки Al 3 Ti, Al 3 Ni и Al 4 Pd с пространственными группами симметрии I4/mmm, Pnma и P3c1 соответственно. Обратное пространство в первой зоне Брюллюэна автоматически разбивалось на сетку по схеме Монхорста-Пака [23]. Количество k -точек вдоль каждого из направлений для Al 3 Ti, Al 3 Ni и Al 4 Pd составляло 8 × 8 × 6, 12 × 12 × 12 и 2 × 2 × 3 соответственно. При моделировании всех исследуемых структур оптимизация геометрии проводилась до значения максимальных сил, действующих на атомы, равных 0,01 эВ/Ǻ.
Получившиеся геометрии элементарных ячеек хорошо согласуются с экспериментальными данными (табл. 1).
Далее суперячейки всех интерметаллидов (3 × 3 × 2 для Al3Ti, 2 × 2 × 2 для Al3Ni и 1 × 1 × 2 для Al4Pd) были получены путем трансляции элементарной ячейки вдоль каждого из направлений.
Для определения наиболее выгодных позиций атома водорода в объеме интерметаллидов были рассчитаны структуры с различным его расположением (рис. 1, 2, 3). При расчете структуры суперячеек количество k -точек вдоль каждого из направлений составляло 3 × 3 × 3 для Al 3 Ti, 2 × 2 × 2 для Al 3 Ni и для Al 4 Pd.
Энергию связи между атомом водорода и супер-ячейкой для всех итерметаллидов рассчитывали по формуле:
, (1) где – полная энергия суперячейки с атомом водорода; – энергия суперячейки; – энергия, приходящаяся на один атом водорода в молекуле водорода.
Во всех интерметаллидах и для всех положений, энергии связи атома водорода со структурой супер-ячейки оказались положительными (табл. 2–4).
Сравнение рассчитанных и экспериментальных параметров решетки
(А)
Таблица 1
|
Параметр |
Al 3 Ti |
Al 3 Ni |
Al 4 Pd |
|||
|
DFT |
X-Ray [24] |
DFT |
X-Ray[25] |
DFT |
X-Ray[26] |
|
|
a |
3,8120 |
3,8537 |
6,5414 |
6,6114 |
13,010 |
13,086 |
|
b |
3,8120 |
3,8537 |
7,3271 |
7,3662 |
13,010 |
13,086 |
|
c |
8,6250 |
8,5839 |
4,7525 |
4,8112 |
9,674 |
9,633 |
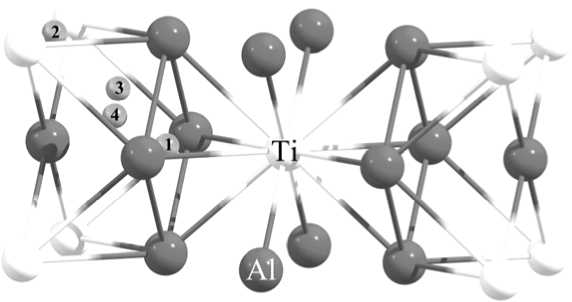
Рис. 1. Расположения атома водорода в структуре Al3Ti
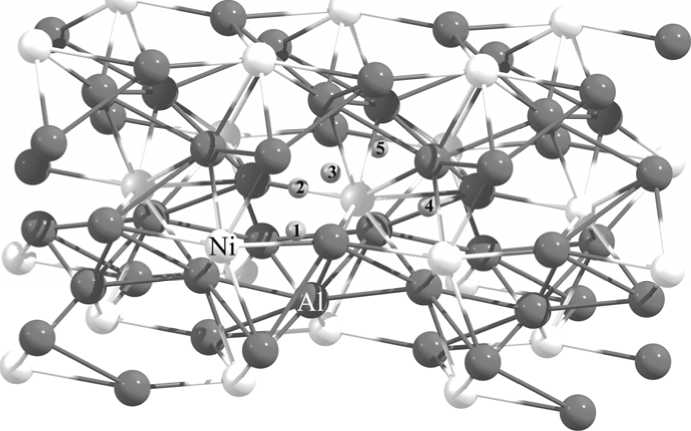
Рис. 2. Расположения атома водорода в структуре Al3Ni
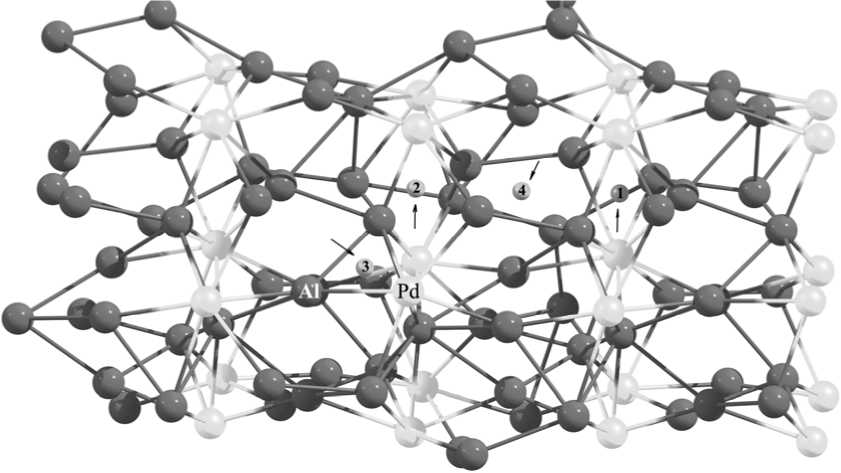
Рис. 3. Расположения атома водорода в структуре Al4Pd
Таблица 2
Энергии образования суперячейки Al3Ti с атомом водорода
|
Расположение атома водорода |
Энергия, eV |
|
1 |
0.0353 |
|
2 |
0.2441 |
|
3 |
0.2986 |
|
4 |
0.2972 |
Таблица 3
Энергии образования суперячейки Al3Ni с атомом водорода
|
Расположение атома водорода |
Энергия, eV |
|
1 |
1.0373 |
|
2 |
1.0380 |
|
3 |
0.1016 |
|
4 |
1.0024 |
|
5 |
1.2352 |
Таблица 4
Энергии образования суперячейки Al4Pd с атомом водорода
|
Расположение атома водорода |
Энергия, eV |
|
1 |
1.4190 |
|
2 |
1.4407 |
|
3 |
1.4310 |
|
4 |
0.8441 |
Исходя из данных таблиц, можно сделать вывод, что при нормальных условиях водороду несвойственно содержаться в данных соединениях. Эти теоретические выводы согласуются с экспериментальными данными работы [27], в которой проводилось исследование сорбции водорода в фазе Al3Ti при высокой температуре и высоком давлении. Авторы отмечают, что при 10 GPa и 898 K формируется гидрид с примерным составом Al 3 TiH x , где x = 0,4. Тем не менее, при понижении давления происходит дегидрирование и данная фаза гидрида не может быть восстановлена в условиях окружающей среды.
Таким образом, при высокотемпературном синтезе тонких пленок титана, никеля или палладия на границах взаимодействия металлов будут образовываться фазы состава Al 3 Ti, Al 3 Ni и Al 4 Pd, которые будут мешать протеканию гидрирования.


