Тепловой стресс стимулирует секрецию клетками колоректальной карциномы специфической популяции нановезикул с повышенным содержанием БТШ70 и измененным составом микроРНК
Автор: Назарова И.В., Забегина Л.М., Никифорова Н.С., Слюсаренко М.А., Сидина Е.И., Жахов А.В., Ищенко А.М., Маргулис Б.А., Гужова И.В., Малек А.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.21, 2022 года.
Бесплатный доступ
Введение. Температурный стресс стимулирует секрецию клетками белков теплового шока (БТШ) и внеклеточных нановезикул (ВНВ). Биологическая связь между этими явлениями изучена слабо. В случае клеток колоректального рака (КРР) секреция БТШ и ВНВ может участвовать в формировании клинического ответа на внутрибрюшные методы терапии перитонеального карциноматоза. Цель исследования - оценка эффекта теплового шока (ТШ) на способность клеток КРР секретировать ВНВ in vitro , выделение, количественный и качественный анализ популяции ВНВ, мембрана которых содержит БТШ70 (мБТШ70(+) ВНВ), анализ эффекта ТШ на активность секреции мБТШ70(+) ВНВ, оценка состава микроРНК в популяции ТШ-индуцированных ВНВ. Материал и методы. В работе использованы стабильные линии клеток КРР: colo320, Hct116, Ht29, dld1. Внеклеточные везикулы выделены методом дифференцированного ультрацентрифугирования, для их анализа использованы методы лазерной корреляционной спектроскопии, анализ траекторий наночастиц, атомная силовая микроскопия и проточная цитометрия. Для выделения и количественной оценки БТШ70(+) ВНВ были использованы суперпарамагнитные частицы (СПМЧ), «декорированные» антителами к мембранной форме БТШ70. Анализ микроРНК в составе ВНВ был проведен методом обратной транскрипции и последующей ПЦР. результаты. Тепловой шок индуцировал секрецию клетками КРР мБТШ70(+)ВНВ, наблюдалась корреляция между резистентностью клеток к ТШ и активностью ТШ-индуцированной секреции ВНВ. Состав микроРНК БТШ70(+)ВНВ имел качественные и количественные особенности. Концентрация miR-126-3p, - 181-5p, -155-5p, -223 была повышена в БТШ70(+)ВНВ, секретируемых тремя линиями клеток КРР. заключение. Тепловой шок стимулирует секрецию мБТШ70(+)ВНВ клетками КРР. Этот феномен может участвовать в формировании клинического ответа на интраперитонеальную химио-гипертермическую перфузию, проводимую в рамках терапии перитонеального карциноматоза.
Внеклеточные нановезикулы, колоректальный рак, тепловой шок, бтш70
Короткий адрес: https://sciup.org/140290558
IDR: 140290558 | УДК: 616.34-006.6:612.591:576.3 | DOI: 10.21294/1814-4861-2022-21-1-57-71
Текст научной статьи Тепловой стресс стимулирует секрецию клетками колоректальной карциномы специфической популяции нановезикул с повышенным содержанием БТШ70 и измененным составом микроРНК
Феномен секреции клетками различных по размеру, составу и функциям внеклеточных везикул активно исследуется в течение последних лет. Класс наноразмерных везикул (нановезикул), секретируемых путем формирования мультиве-зикулярных телец в цитоплазме и опорожнения их содержимого в межклеточное пространство, исследован наиболее полно [1]. Для везикул, секретируемых таким путем, характерен специфический набор признаков (размер, плотность, наличие белковых маркеров), который позволяет отличать их от везикулярных образований другой природы [2]. Внеклеточные нановезикулы (ВНВ), продуцируемые опухолевыми клетками, участвуют в процессах локального роста опухоли и прогрессирования онкологических заболеваний, поэтому они активно исследуются с целью разработки новых диагностических и терапевтических подходов [3].
Результаты ряда исследований указывают на существенную гетерогенность состава ВНВ, секретируемых клетками одного типа: ВНВ отличаются по размеру, плотности, составу протеинов и РНК
-
[4, 5]. Показано, что эти структурные различия определяют и функциональные особенности везикул. Например, различные по составу ВНВ, секретируемые клетками меланомы B16F10, оказывают различное влияние на эндотелиальные клетки в условиях in vitro [6]. Эти данные указывают на важность выделения и дифференцированного исследования отдельных популяций ВНВ. Особый интерес привлекает феномен стимуляции секреции ВНВ различными стрессорными факторами. На клеточном уровне стимулирующий эффект может оказывать потеря контакта эпителиальных клеток с мембраной [7], температурный стресс [8] или гипоксия [9]. Причем ВНВ, секретируемые клетками после воздействия стрессорных факторов, могут иметь особые функциональные характеристики и, возможно, являются особой популяцией «стрес-сорных» везикул.
Внеклеточные везикулы являются одной из форм секреции белков теплового шока (БТШ), характерной как для нормальных [10], так и для трансформированных клеток [11, 12]. БТШ представляют собой большое семейство сходных по функции белков, способных контролировать целостность внутриклеточных протеинов и поддерживать конформационный гомеостаз белков в нормальных условиях и при различных стрессорных воздействиях [13]. «Антистрессовая» внутриклеточная функция БТШ в контексте трансформированных клеток реализуется рядом «проопухолевых» качеств: эти белки способны ингибировать апоптоз [14], снижать чувствительность к цитостатической [15] и лучевой [16] терапии. Таким образом, внутриклеточные формы большинства БТШ (Hsp27, Hsp70, Hsp90) традиционно рассматриваются в качестве потенциальных мишеней противоопухолевой терапии [17, 18].
Физиологическое значение секретируемых форм БТШ пока недостаточно понятно, даже в контексте нормальных клеток [19]. Результаты исследований роли БТШ, секретируемых опухолевыми клетками, формируют крайне «пеструю» картину. Например, в ранних исследованиях было показано, что белок Hsp72, секретируемый клетками колоректального рака (КРР), угнетает противоопухолевый иммунитет [20]. Механизм инактивации иммунного ответа, опосредованный взаимодействием Hsp70(+) ВНВ, секретируемых опухолевыми клетками, и TLR2-рецепторов (tolllike receptor 2) на мембране клеток миелоидного происхождения (MDSC), был позднее исследован в контексте различных онкологических заболеваний [21]. В цитируемой работе показано, что блокада этого взаимодействия является универсальной стратегией активации противоопухолевого иммунитета, т.е. потенциальным методом противоопухолевой терапии. Однако в серии последующих исследований было показано, что внеклеточные БТШ образуют комплексы с опухолеспецифическими пептидами, такие комплексы обладают иммуногенными свойствами и могут быть использованы в качестве противоопухолевых вакцин [22]. БТШ в составе мембраны ВНВ опухолевого происхождения могут стимулировать активацию NK-клеток [23], макрофагов [24] и дендритных клеток [25]. В контексте этих данных везикулярная форма БТШ представляется «нативным» активатором различных звеньев противоопухолевого иммунитета и может быть использована в качестве комплексной вакцины [26].
В целом, выделение и структурный анализ ВНВ и везикулярных форм БТШ, секретируемых опухолевыми клетками в ответ на стресс, являются интересной фундаментальной задачей. Ее решение может иметь практическую значимость в контексте исследования реакции клеток колоректального рака (КРР) на сочетанное воздействие химиотерапии и высокой температуры в процессе интраперитонеальной химиогипертермической перфузии (ИХГТП), применяемой для лечения перитонеального канцероматоза [27]. Предпосылками эффективности ИХГТП являются отно- сительно низкая резистентность клеток опухоли к тепловому стрессу и эффект локального применения высокой концентрации химиопрепарата. Несмотря на долгую историю, этот метод пока не вошел в широкую практику. Можно предполагать, что ВНВ, секретируемые ККР под воздействием ИХГТП, содержат БТШ, имеют особый состав других компонентов и участвуют в формировании клинического ответа на ИХГТП.
Цель исследования – оценка эффекта теплового шока (ТШ) на способность клеток КРР секретировать ВНВ in vitro , выделение, количественный и качественный анализы популяции ВНВ, мембрана которых содержит БТШ70 (мБТШ70(+) ВНВ), анализ эффекта ТШ на активность секреции мБТШ70(+) ВНВ, оценка состава микроРНК в популяции ТШ-индуцированных ВНВ.
Материал и методы
В исследовании были использованы стабильные культуры клеток колоректального рака (COLO320, HCT116, HT29, DLD1) человека, которые культивировались в среде RPMI-1640 с L-глутамином, смесью антибиотиков Пени-Стреп и 10 % эмбриональной сыворотки телят (ООО «БиоЛот», СПб), при 37 °С и 5 % СО2.
Перед проведением эксперимента клетки (5×106) высаживали в культуральные флаконы Т-75 и культивировали в стандартных условиях до состояния 75–80 % конфлюентности, которое соответствует количеству клеток 7–7,5×106 / флакон. Время культивирования составляло от 24 до 48 ч, в зависимости от культуры. Для каждого эксперимента было параллельно приготовлено два флакона с равным количеством клеток. Клетки в одном из флаконов были подвержены тепловому шоку (ТШ) (heat shock, HS), путем инкубации на водяной бане при 42 °С 120 мин, затем культивировались в стандартных условиях еще в течение 6 ч. Клетки во втором флаконе культивировались параллельно в стандартных условиях. Для выделения ВНВ клеточную среду накапливали в течение нескольких (6–7) экспериментов до объема 60 мл в стеклянной посуде при +4 °С.
Нановезикулы из культуральной среды выделяли методом дифференциального центрифугирования (Beckman Coulter: Optima XPN 80, ротор 70.1 Ti / k-фактор 36). Накопленную среду центрифугировали последовательно: 300xG – 10 мин, 2000xG – 30 мин, 16000xG – 60 мин для осаждения крупных везикул и клеточного детрита, затем супернатант ультрацентрифугировали при 110 000 xG в течение 6 ч при +4 °С. Осадок ресуспендировали в 1x фосфатно-солевом буфере (ФСБ) и вновь ультрацентрифугировали. Полученный осадок, содержащий ВНВ из 60 мл среды, ресуспендировали в 100 мкл ФСБ. Оценка распределения везикул по размеру после выделения проводилась с помощью лазерной корреляционной спектроскопии (ЛКС) на аппарате Microtrac Nanotrac Wave II («Microtrac», Германия) в соответствии с рекомендациями производителя.
Анализ траекторий наночастиц,
АТН (Nanoparticle Tracking Analysis, NTA)
Перед измерением осадки нановезикул, полученные после второго раунда ультрацентрифугирования, ресуспендировались в 100 мкл ФСБ. Затем по 20 мкл (20 %) такой суспензии разводили в ФСБ до 1000 мкл. Измерения проводились на анализаторе Nanosight NS300 («Malvern», США). Обработка спектров проводилась в Nanosight NTA 3.2 Software. Уровень камеры: 14, ползунок затвора: 1259, усиление ползунка: 366, пороговый уровень – 5. Каждый образец прокачивался через камеру наблюдения анализатора так, чтобы провести 5 измерений на разных микрообъемах одного и того же образца. Каждое измерение имело длительность 60 с, что соответствовало 1498 кадрам. По результатам пяти измерений проводился расчет среднего арифметического значения и квадратичного отклонения.
Для выделения мБТШ70(+)ВНВ из тотальной популяции ВНВ использовали суперпарамагнитные частицы со стрептавидином (СПМЧ) (ООО «Силекс», РФ) и меченные биотином антитела к мембранной форме белка БТШ70 (мБТШ70). В работе использовали антитела, любезно предоставленные Dr. Gabriele Multhoff, – cmHsp70.1 [28], и моноклональные антитела 8D1, специфичные к неодетерминанте БТШ70, экспонированного на мембране опухолевых клеток (Патент РФ, 2 722 398, Моноклональное антитело к БТШ70, Бюл. № 16, 29.05.2020). Антитела инкубировали с СПМЧ в соотношении, рекомендованном производителем частиц, в течение одного часа при +4 °С для образования иммунокомплекса СПМЧ-АТ. Комплексы трижды отмывали в ФСБ и инкубировали с 50 мкл взвеси выделенных ВНВ в течение ночи при +4 °С при постоянном помешивании. Предполагалось, что в результате инкубации образовывались комплексы СПМЧ-АТ и мБТШ70(+) ВНВ. Удаление «СПМЧ-АТ-мБТШ70(+)ВНВ» приводило к истощению фракции мБТШ70(+)ВНВ и относительному возрастанию фракции мБТШ(-) ВНВ в составе оставшейся популяции везикул. После удаления комплексов на основе СПМЧ (1 экстракции) супернатант использовали для повторного выделения (2 экстракции) или для анализа оставшейся популяции ВНВ. Количество везикул «до» и «после» экстракции оценивалось с помощью АТН, перед измерением аликвоту суспензии (20 мкл) разводили в ФСБ до 1000 мкл.
Анализ популяции мБТШ70(+)ВНВ с помощью проточной цитометрии (ПЦ)
Комплексы СПМЧ-АТ-мБТШ70(+)ВНВ отмывали трижды ФСБ и концентрировали на магнитном штативе, затем добавляли 200 мкл 0,2 % блокирующего буфера Tropix i-Block (ThermoFisher, США), и инкубировали в течение 1 ч при +4°C. Для последующего анализа эффективности образования комплекса СПМЧ-АТ-мБТШ(+)ВНВ проводили мечение маркерных белков в мембране связанных везикул. Для этого комплексы инкубировали с антителами к тетраспанину CD63, меченные PERCP / Peridinin-Chlorophyll-Protein (ab77227 Abcam, США) или антителами к мБТШ70 (cmHsp70.1) в течение 2 ч при +4 °С. Связывание антител к БТШ70 c комплексом везикул оценивали путем инкубации образцов с вторичными антителами к IgG мыши, меченными PE / Phycoerythrin (F0102B, RnD Systems, США) в течение 30 мин при +4 °С в темноте. В качестве негативного контроля использовали образец комплекса СПМЧ-АТ без ВНВ. Эффективность окрашивания антителами образцов наблюдали на проточном цитометре CytoFLEX (Beckman Coulter, США). Полученные данные анализировались с помощью программного обеспечения CytExpert (Beckman Coulter, США) и Excel (Microsoft Office, США).
Проведена экспертная валидация экспериментальных параметров всех этапов работы с внеклеточными нановезикулами (ВНВ), включая выделение и анализ, с помощью платформы EV-track , которая является инструментом прозрачной отчетности и интеграции данных исследований, поддерживаемой ISEV (The International Society For Extracellular Vesicles). Отчет доступен по EV-track №: EV200175.
Для выделения тотальной РНК из различных популяций везикул использовали набор ЛИРА (ООО «БиоЛабМикс», г. Новосибирск, РФ). Выделение РНК проводили в соответствии с протоколом производителя. Концентрация и чистота выделенной РНК оценивались на спектрофотометре Implen50 (Implen GmbH, Германия). Профайлинг микроРНК был проведен с использованием набора реагентов для анализа 179 молекул микроРНК, преимущественно представленных в плазме Plasma focused miRNA PCR Panel и соответствующих ферментных смесей miRCURY LNA Universal RT microRNA Polyadenylation and cDNA synthesis Kit, ExiLENT SYBR Greenmaster mix (Qiagen, США). Анализ выбранных 13 молекул микроРНК проводился с помощью наборов для ОТ-ПЦР серии ALL-MIR (ООО «Альгимед-Техно», Беларусь). Набор этой же серии был использован для анализа miR-191-5p. Перед началом работы аналитические характеристики всех систем были протестированы с помощью разведений синтетических аналогов анализируемых молекул, все измерения биологических образцов проводились в диапазоне линейной зависимости значений пороговых циклов (Ct) от концентрации микроРНК. Анализ малой ядерной РНК U6 snRNA был проведен с помощью следующих олигонуклеотидов:
ОТ праймер: gtcgtgtctgaggctgactgagacctattcgcac ctgacacgacggccatgc
Прямой ПЦР праймер: ggccgcatacagagaagatta
Обратный ПЦР праймер: ctgaggctgactgagacct
ПЦР зонд: (R6G)-attcgcacc(T-BHQ1) gacacgacggccatgc-p
Все реакции проводили на приборе CFX96 Touch™ Real-Time PCR Detection System (Bio-Rad, США). Нормализацию результатов профайлинга производили относительного среднего для каждого эксперимента значения Ct (global Ct mean). Анализ отдельных молекул проводили в трех повторах ОТ-ПЦР, результаты усредняли и нормализовали относительно референсных микроРНК (U6 snRNA, miR-191-5p) по формуле 2^(Ct reference – Ct target).
Статистические расчеты и иллюстрации выполнены с помощью программ Graph Pad Prizm 6 (GraphPad Software, Inc., San Diego, California USA, , Sigma Plot 12 (Systat Software, Inc., San Jose, California USA, www.sigmaplot. . Воспроизводимость результатов повторных измерений оценивали путем вычисления значения стандартного отклонения. Оценку статистической значимости разницы исследуемого параметра между двумя «группами» результатов (n=3) проводили с помощью метода Mann–Withney.
Результаты
Характеристика везикул, секретируемых клетками КРР in vitro.
Согласно требованиям ISEV [29], перед началом исследований мы провели анализ основных характеристик внеклеточных нановезикул (ВНВ), выделяемых с помощью ультрацентрифугирования (УЦ) из среды после культивации клеток КРР. На рис. 1 представлены результаты анализа ВНВ, секретируемых клетками линии HT29. Размер (гидродинамический диаметр) мажорной популяции везикул, выделенных из культуральных сред, колебался в диапазоне 126–149 нм. Распределение выделенных везикул по размеру было относительно гомогенно, а сканируемая поверхность фиксированных везикул имела характерную для экзосом структуру (рис. 1Б). В состав поверхностной мембраны ВНВ входили белки, так называемые экзо-сомальные маркеры – тетраспанины CD9 и CD63 (рис. 1В). Ультраструктура везикул, выделенных из культуральной среды аналогичным методом, ранее была исследована с помощью криоэлектронной
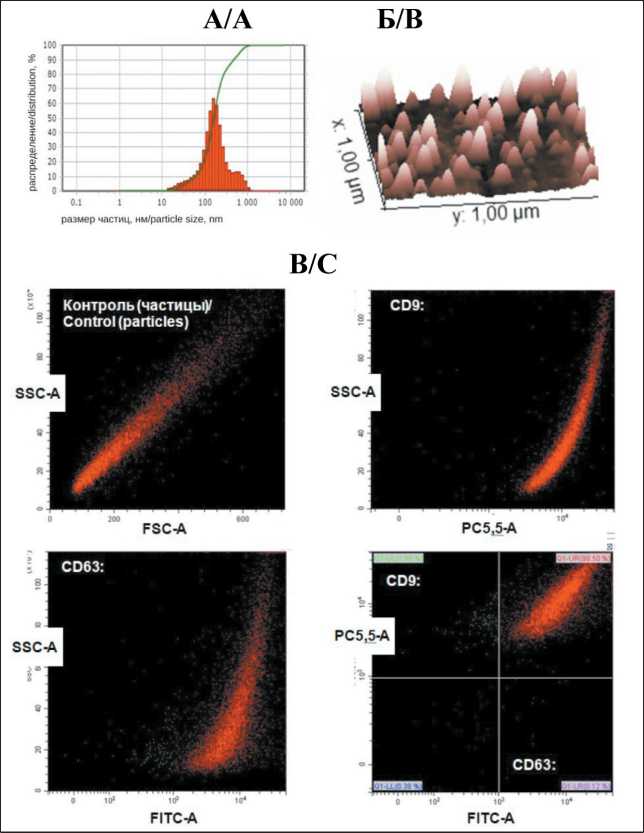
Рис. 1. Характеристика внеклеточных ВНВ: А – анализ распределения наночастиц по размеру (лазерная корреляционная спектроскопия, ЛКС); Б – анализ размера и морфологии наночастиц (атомная силовая микроскопия, АСМ); В – оценка экспрессии маркеров (тетраспанинов CD9, CD63) на поверхностной мембране везикул методом проточной цитометрии Fig.1. Characteristics of extracellular ENVs:
A – analysis of the size distribution of nanoparticles (laser correlation spectroscopy, LCS); B – analysis of the size and morphology of nanoparticles (atomic force microscopy, AFM); C – evaluation of the expression of markers (tetraspanins CD9, CD63) on the surface membrane of vesicles by flow cytometry таблица 1/table 1
Эффект тШ на активность секреции внв, оцененный с помощью атнeffect of Hs on eNVs secretion activity assessed by Nta
|
Клеточные линии/ Cell lines |
Контроль Всех/Of all |
Содержание ВНВ в 1 (37 ° C)/Control (37 ° С) 30–150 нм/30– |
мл среды/ENVs content in 1 ml of medium Тепловой шок (42 °С)/ Heat stress (42 ° С) 150 nm Всех/Of all 30–150 нм/30–150 nm |
|
|
COLO 320 |
(18 ± 2)×107 |
11×107 |
(72 ± 3)×107 |
23×107 |
|
HCT116 |
(98 ± 25)×107 |
7,8×107 |
(54 ± 7)×107 |
8,5×107 |
|
HT29 |
(27 ± 6)×107 |
4,5×107 |
(58 ± 4)×107 |
9,4×107 |
|
DLD1* |
(41 ± 5)×107 |
14×107 |
(78 ± 11)×107 |
17×107 |
Примечание: представлены усредненные значения, полученные после пяти измерений разных микрообъемов одного образца; * – результаты представлены на рис. 2Б
Note: the averaged values obtained from the results of five assays of different microvolumes of the same sample; * – the results are shown in Fig. 2B микроскопии [30]. По совокупности данных можно предполагать, что в состав популяций исследуемых ВНВ входили так называемые экзосомы, более детальное исследование физических характеристик везикул в составе смеси не входило в задачи исследования.
Тепловой шок (ТШ) стимулирует секрецию ВНВ клетками КРР
Этот феномен был показан для ряда клеточных культур (данные суммированы в обзоре [31]), но исследований, сфокусированных на клетках КРР, опубликовано не было. Мы использовали четыре линии, полученные из материала колоректальных карцином, которые были подвержены тепловому шоку (2 ч – 42 °С). После 6 ч инкубации в стандартных условиях среда была собрана для выделения и анализа количества ВНВ. Для получения достаточного для анализа количества везикул каждый эксперимент был проведен шесть раз. Образцы культуральной среды, полученные после отдельных экспериментов, были объединены в равных объемах. Полученная смесь объемом 60 мл была дополнена ФСБ до объема пробирки для ультрацентрифугирования (94 мл). После двух раундов ультрацетрифугирования осадки ресуспендирова-
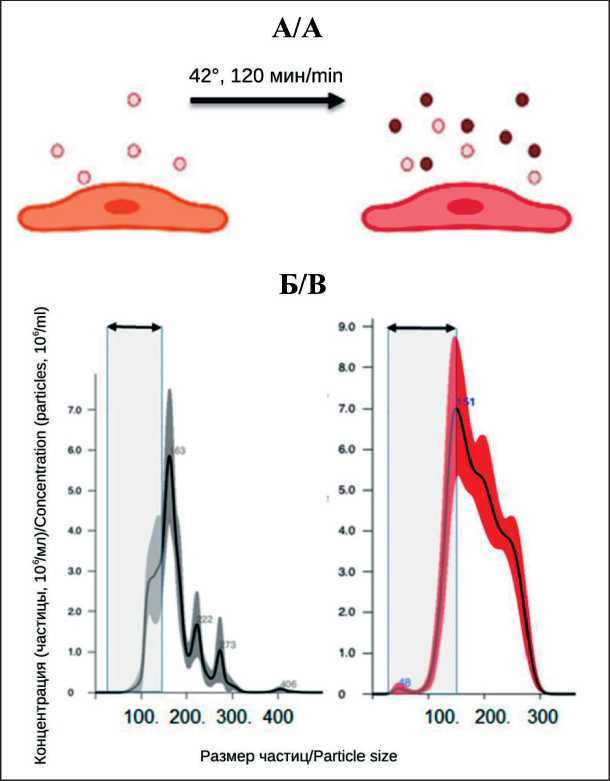
Рис. 2. Эффект ТШ на общее количество ВНВ (АТН): А – схема эксперимента; Б – анализ концентрации и размера ВНВ, выделенных из среды клеток DLD1 после культивации в стандартных условиях и после ТШ. Серым цветом выделен интервал размера ВНВ (30–150 нм). Была определена концентрация всех детектируемых ВНВ и везикул размером 30–150 нм Fig 2. Effect of HS on the total amount of ENVs (NTA): A – scheme of the experiment; B – analysis of the concentration and size of ENVs isolated from the medium of DLD1 cells after cultivation under standard conditions and after HS. The range of the size of the ENVs
(30–150 nm) is highlighted in gray. The concentration of all detectable ENVs and vesicles with a size of 30–150 nm was determined
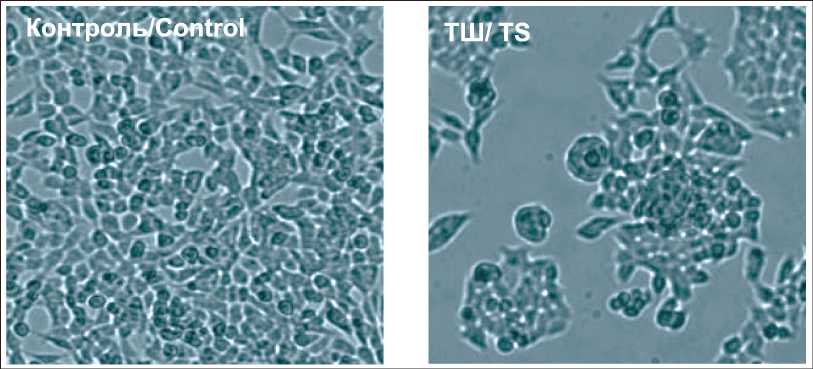
Рис. 3. Клетки линии HCT116 после культивации в стандартных условиях и после воздействия ТШ. Изображение получено через 6 ч после начала эксперимента с помощью цифровой камеры HC-HD-2 с программным обеспечением MC-View для инверсионного микроскопа МИБ-Р (АО «ЛОМО», СПб), ×40 Fig. 3. HCT116 cells after cultivation under standard conditions and after exposure to HS. The image was obtained 6 hours after the start of the experiment using a digital camera HC-HD-2 with MC-View software for the inversion microscope MIBR (Company «LOMO», St. Petersburg), ×40
лись и использовались для дальнейших измерений, которые в каждом случае отражали усредненные для шести идентичных экспериментов результаты. Подсчет числа всех везикул в составе суспензий был проведен с помощью АТН. Число ВНВ размера 30–150 нм в 1 мл было определено путем интегрирования усредненного значения пяти повторных измерений образца, с последующим вычислением значения среднего квадратичного отклонения. Результаты представлены в табл. 1, схема эксперимента и репрезентативный пример результатов анализа траекторий наночастиц – на рис. 2. Так, ТШ стимулировал секрецию ВНВ клетками трех линий: концентрация везикул в среде клеток COLO320 возросла в 4 раза, HT29 – в 2,2 раза, DLD-1 – в 1,9 раза по сравнению с контролем. В одном случае (HCT116) наблюдалось снижение числа нановезикул в среде после воздействия ТШ до 0,6 от значения концентрации ВНВ в контроле. Более того, ТШ вызывал заметные изменения морфологии клеток линии HCT116: округление, вакуолизация, потеря контакта с пластиком указывали на гибель части клеточной популяции (рис. 3). После 2–3 дней культивации в свежей среде жизнеспособность и пролиферативная активность клеточной линии восстанавливались. Характерные изменения морфологии и динамика их нормализации были воспроизведены в шести экспериментах, что указывало на особенности биологии клеток линии HCT116, которые оказались более чувствительны к воздействию ТШ, чем остальные.
ТШ индуцирует секрецию ВНВ, обогащенных мембранной формой БТШ70 (мБТШ70(+)ВНВ)
Известно, что ТШ стимулирует секрецию группы белков-шаперонов (белков теплового шока). Полученные экспериментальные данные продемонстрировали феномен ТШ-стимулированной секреции ВНВ. Но связь между этими явлениями изучена слабо. В частности, неизвестно, являются ли ВНВ просто одной из форм секреции БТШ и ТШ приводит к повышению содержания этих белков в составе везикул, или ТШ индуцирует формирование особой фракции ВНВ, обогащенных белками этого семейства. Для ответа на этот вопрос мы разработали технологию специфического выделения ВНВ, мембрана которых содержит БТШ70. Был выбран этот представитель семейства, так как его экспрессия в составе ВНВ была доказана рядом исследований (суммировано в обзоре [32]). Кроме того, для этого белка показаны существование мембранной формы и ее особые функциональные качества [33]. ВНВ, мембрана которых содержит белок БТШ70 (мБТШ70), были выделены из общей популяции везикул с помощью суперпарамагнитных частиц (СПМЧ), к поверхности которых были фиксированы антитела к мБТШ70 (СПМЧ-АТ). Количественная оценка ВНВ, фиксированных к поверхности СПМЧ, была проведена путем «мечения» тетраспанина CD63 в составе их мембраны и анализа методом проточной цитометрии. Для оценки факта выделения специфической мБТШ70(+) популяции везикул (мБТШ70(+) ВНВ) процедура экстракции этих везикул из супернатанта была проведена повторно. Сравнительный анализ эффективности двух последовательных экстракций мБТШ70(+)ВНВ позволил оценить факт «истощения» их фракции в составе тотальной популяции везикул. Изменение количества везикул в составе тотальной суспензии «до» и «после» двух последовательных экстракций оценивалось с помощью АТН и не превышало значений погрешности метода. Таким образом, выделенная фракция мБТШ70(+) везикул являлась минорной, так как ее выделение не приводило к значимому снижению исходной концентрации везикул. Схема эксперимента представлена на рис. 4А. Эксперимент был проведен с использованием ВНВ, выделенных из среды 4 клеточных линий в двух ситуациях: в нормальных условиях культивации и после ТШ. Во всех случаях первая процедура выделения приводила к детекции большего количества «меченых» частиц по сравнению с повторным выделением. Эти результаты указывали на наличие специфической популяции мБТШ70(+)ВНВ и ее «истощение» в результате связывания с СПМЧ-АТ. На рис. 4Б представлен пример результатов проточной цитометрии: заметен пик «меченых» частиц после первого выделения и практически
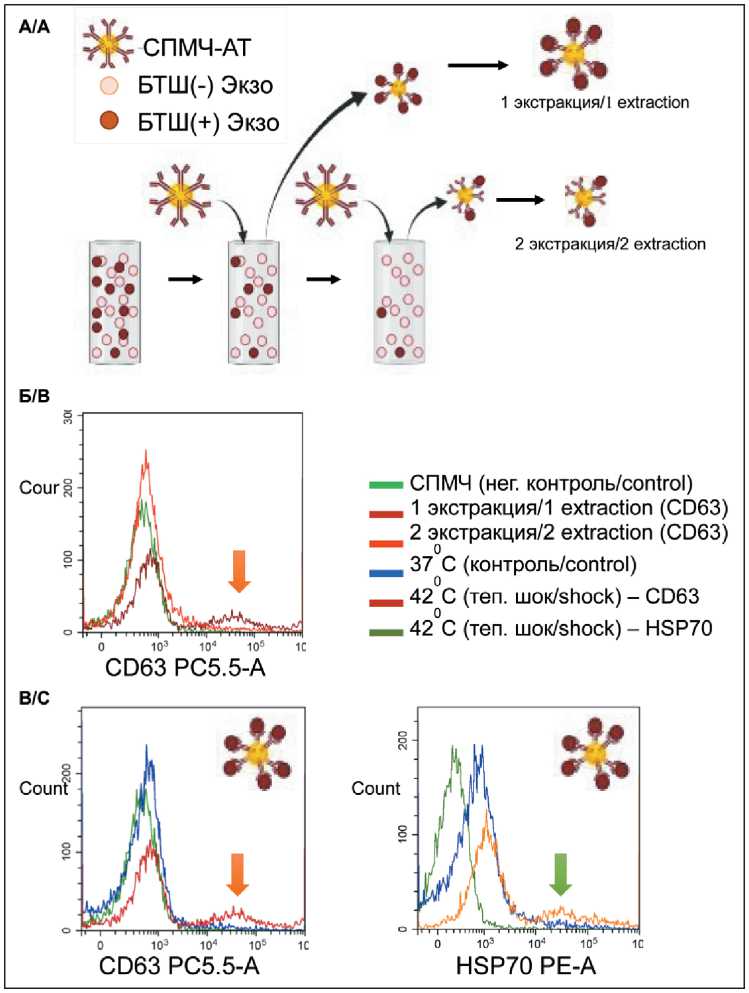
Рис. 4. Технология выделения и количественного анализа мБТШ70(+) ВНВ:
А – схема процедуры двухэтапного выделения и последующего мечения мБТШ70(+) ВНВ; Б – пример результатов анализа эффективности связывания (выделения) мБТШ70(+) ВНВ путем двух последовательных экстракций из среды после культивации клеток COLO320. Везикулы, фиксированные к СПМЧ, мечены с помощью антител к CD63; В – пример результатов анализа эффективности выделения мБТШ70(+) ВНВ из среды до и после температурного воздействия на клетки COLO320. Везикулы, фиксированные к СПМЧ, мечены с помощью антител к
CD63 (слева) и БТШ70 (справа)
Fig. 4. The technology of isolation and quantitative analysis of mHSP70 (+) ENVs:
A – diagram of the procedure for two-stage isolation and subsequent labeling of mHSP70 (+) ENVs; B – an example of the results of the analysis of the efficiency of binding (isolation) of mHSP70 (+) ENVs by two successive extractions from the medium after cultivation of COLO320 cells. Vesicles fixed to SPMP are labeled with anti-CD63 antibodies; C – an example of the results of the analysis of the efficiency of mHSP70 (+) ENVs isolation from the medium before and after exposure to heat stress on COLO320 cells. Vesicles fixed to SPMP were labeled with antibodies to CD63 (left) and HSP70 (right)
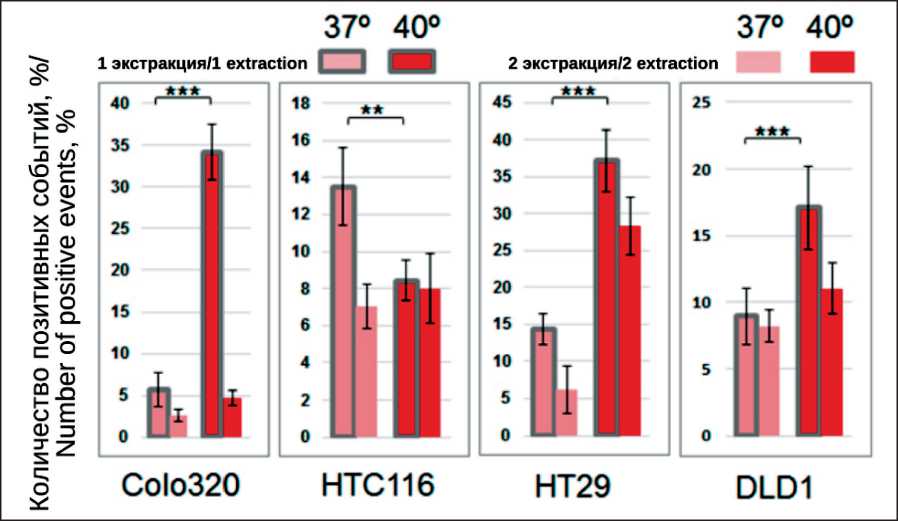
Рис. 5. Эффект ТШ на количество мБТШ70(+) ВНВ. Результаты анализа эффективности выделения мБТШ70(+) ВНВ из среды различных клеточных линий, перенесших ТШ, и контрольных, проведенного методом проточной цитометрии. Представлены результаты двух экстракций. Детекция мБТШ70(+) ВНВ, сорбированных на СПМЧ, была проведена с помощью антител с CD63. По оси ординат показаны значения (%) позитивных событий, детектированных по PERCP каналу флуоресценции. Представлены усредненные результаты двух экстракций и значения стандартных отклонений. Статистическая значимость отличий эффективности первой экстракции мБТШ70(+)ВНВ из среды контрольных клеток (37 °С) и клеток, перенесших ТШ (42 °С), определена с помощью U теста Mann–Whitney (** – p<0,005; *** – p<0,0005)
Fig. 5. Effect of HS on the number of mHSP70 (+) ENVs
Results of the analysis of the efficiency of isolation of mHSP70 (+) ENVs from the cell medium of various cell lines that underwent HS and control, carried out by flow cytometry. The results of the two extractions are presented. The detection of mHSP70 (+) ENVs adsorbed on SPMP was carried out using antibodies with CD63. The ordinate shows the values (%) of positive events detected by the PERCP fluorescence channel. The average of the two extractions and the standard deviations are shown. Statistical significance between efficacy of first extraction of mHSP70(+)ENVs from media of control (37 °С) and treated cells (42 °С) is evaluated using Mann– Whitney U test and indicated as asterisk (** – p<0.005; *** – p<0.0005)
таблица 2/table 2
анализ эффективности экстракции БтШ70(+) внв из тотальной популяции методом проточной цитометрии analysis of the efficiency of Hsp70 (+) eNVs extraction from the total population by flow cytometry
|
Экстракция/ Extraction |
Colo320* |
HCT116 1 |
2 |
HT29 |
DLD1 |
|||
|
1 |
2 |
1 |
2 |
1 |
2 |
|||
|
Детекция мБТШ70(+) ВНВ с помощью антител к CD63(PERCP)**/Detection of mHSP70 (+) ENVs using antibodies to CD63 (PERCP)** |
||||||||
|
Контроль, 37 ° С/ Control, 37 ° С |
5,71 |
2,67* |
13,50 |
7,05 |
14,27 |
6,22 |
8,96 |
8,22 |
|
ТШ, 42 ° С/ HS, 42 ° С |
34,21* |
4,74* |
8,45 |
8,00 |
37,11 |
28,33 |
17,08 |
11,02 |
|
Детекция мБТШ70(+)ВНВ с помощью антител к HSP70(PE)/Detection of mHSP70 (+) ENVs using antibodies to HSP70(PE) |
||||||||
|
Контроль, 37 ° С/ Control, 37 ° С |
9,78 |
8,00* |
16,03 |
7,00 |
17,88 |
5,52 |
11,12 |
8,34 |
|
ТШ, 42 ° С/ HS, 42 ° С |
34,47* |
17,41* |
10,33 |
8,17 |
43,66 |
29,22 |
22,93 |
6,22 |
Примечание: БТШ70(+) ВНВ выделялись путем иммуносорбции с помощью антител, фиксированных к поверхности СПМЧ, детекция сорбированных везикул проводилась с помощью антител флуоресцентно-меченных антител CD63(PERCP) и HSP70(PE); представлены усредненные значения, полученные по результатам трех экспериментов; результаты представлены как % «позитивных событий» при анализе в соответствующем канале; * – результаты представлены на рис. 4 Б и В; ** – результаты представлены на рис. 4.
Note: HS – heat stress; HSP70 (+) ENVs were isolated by immunoadsorption using antibodies fixed to the surface of the SPMP, detection of sorbed nanovesicles was carried out using antibodies of fluorescently labeled antibodies CD63 (PERCP) and HSP70 (PE); the averaged values obtained from the results of three repetitions of the experiment are presented; results are presented as % of “positive events” when analyzed in the corresponding channel; * – fhe results are shown in Fig. 4 B and C; ** – results are presented in Fig. 4.
отсутствует сигнал от частиц после повторного выделения мБТШ70(+)ВНВ из суспензии везикул культуральной среды клеток COLO320, перенесших ТШ (34,21 % vs 4,74 %). Результаты анализа эффективности экстракции мБТШ70(+)ВНВ из культуральных сред всех четырех линий (ТШ и контроль) и последующего мечения связанных везикул с помощью CD63(PERCP) представлены на рис. 5. Эти же данные и результаты мечения тех же комплексов антителом HSP70(PE) представлены в табл. 2.
Анализ данных позволяет оценить эффект ТШ. Сравнение эффективности первых экстракций мБТШ70(+)ВНВ из среды контрольных клеток (37 °С) и клеток, перенесших ТШ (42° С), демонстрирует статистически значимую разницу: в трех случаях (COLO320, HT29, DLD1) ТШ стимулировал секрецию ВНВ, в случае HCT116 секреция везикул угнеталась в результате ТШ (рис. 5). Особенности реакции клеток HCT116 на ТШ были сопоставимы при разных схемах анализа: СПМЧ-мБТШ70(+) ВНВ-CD63(PERCP) и СПМЧ-мБТШ70(+) ВНВ-HSP70(PE). Вероятно, биология этих клеток предполагает низкую резистентность к температурному стрессу и отсутствие способности к секреции ВНВ в ответ на ТШ.
Состав микроРНК в популяция мБТШ70(+) ВНВ обогащен количественно и качественно МикроРНК в составе ВНВ во многом определяет эффекты последних. Особое внимание привлекает микроРНК в составе везикул, секретируемых опухолевыми клетками [34]. Известно, что «упаковка» молекул микроРНК в ВНВ является
активным и регулируемым процессом. Более того, клетки могут секретировать биохимически отличимые популяции везикул с разным составом микроРНК [35]. На основе этих данных возникло предположение об измененном составе микроРНК в мБТШ70(+)ВНВ, секретируемых клетками КРР после воздействия ТШ. Клетки трех линий были подвержены ТШ, из тотальных популяций везикул были выделены фракции мБТШ70(+)ВНВ. На первом этапе проведен анализ экспрессии 179 молекул микроРНК в популяциях выделенных везикул (мБТШ70(+)ВНВ) и везикул, оставшихся после двукратных процедур экстракции, т.е. предположительно популяции мБТШ70(-) ВНВ. Исследование проведено с помощью набора для ОТ-ПЦР анализа молекул с относительно высокой концентрацией в плазме. Сравнение числа детектированных молекул выявило относительное обогащение состава микроРНК в мБТШ70(+)ВНВ. Данные по 3 клеточным линиям представлены в табл. 3; рис. 6 дает наглядное представление результатов микроРНК профайлинга клеток линии COLO320. В целом, ТШ-индуцированные изменения состава везикулярных микроРНК трех клеточных линий имели мало общего как в составе детектированных молекул, так и в соотношении концентрации молекул, детектированных в мБТШ70(+)ВНВ и мБТШ70(+)ВНВ фракциях. Относительная концентрация лишь 13 из 179 молекул была выше в популяции мБТШ70(+)ВНВ относительно популяции мБТШ70(-)ВНВ в трех клеточных линиях.
С целью верификации полученных экспресси-онных данных анализ этих 13 молекул проведен с помощью технологии «двухфланговой» ОТ и после-
таблица 3/table 3
результаты От-ПЦр анализа отдельных молекул микрорнк в популяциях БтШ(+) и БтШ(-) внв Results of Rt-pcR analysis of individual microRNa molecules in Hsp(+) and Hsp(-) eNVs populations
|
Клеточные линии/Cell lines |
Colo320 |
HT29 |
DLD1 |
|||
|
Статус БТШ ( + / - )/HSP status |
- |
+ |
- |
+ |
- |
+ |
|
Общее кол-во /Total number |
115 |
157 |
98 |
142 |
91 |
122 |
|
miR-126* |
0,18 |
1,11 |
0,10 |
2,14 |
0,19 |
1,05 |
|
miR-181-5p* |
11,1 |
48,17 |
0,13 |
39,13 |
0,53 |
67,1 |
|
miR-155* |
2,15 |
4,40 |
0,38 |
3,27 |
0,42 |
11,51 |
|
miR-223* |
13,05 |
414,75 |
23,42 |
389,88 |
22,99 |
99,64 |
|
miR-324-5p |
18,32 |
26,21 |
11,32 |
18,26 |
1,65 |
2,18 |
|
miR-486-5p |
21,11 |
28,54 |
2,43 |
3,23 |
18,44 |
23,18 |
Примечание: представлены усредненные результаты трех независимых экспериментов выделения БТШ(+) и БТШ(-) фракций ВНВ; в каждом случае ОТ-ПЦР анализ проводился в трех повторах, результаты нормализованы относительно miR-191-5p; * – результаты представлены на рис. 7.
Note: the averaged results of three independent experiments of the isolation of HSP(+) and HSP(-) ENVs fractions are presented. In each case, RT-PCR analysis was performed in triplicate: the results were normalized relative to miR-191-5p; * – the results are shown in Fig. 7.
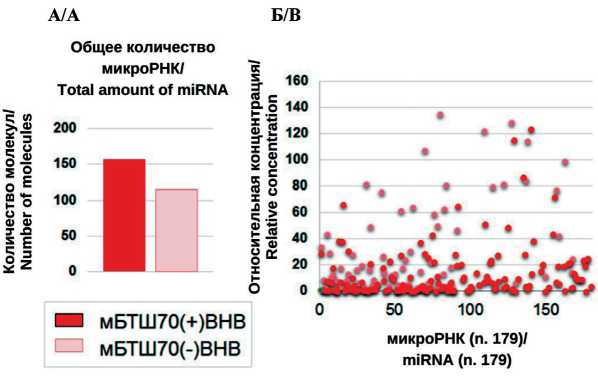
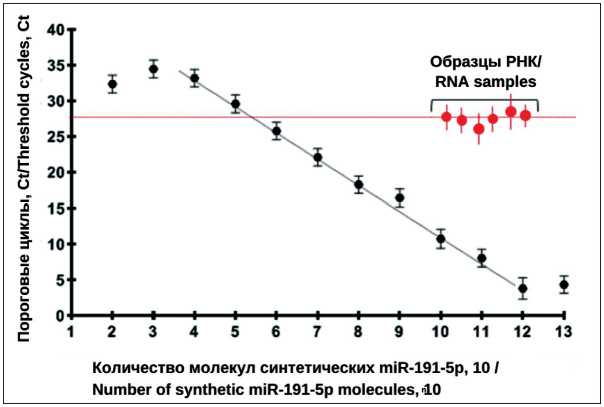
Рис. 6. Сравнение общего количества и профиля экспрессии молекул микроРНК в составе мБТШ70(+) ВНВ и мБТШ70(-) ВНВ, секретируемых клетками COLO320: А – общее количество детектированных молекул из 179, включенных в анализ; Б – сравнительный состав и уровень экспрессии (профиль) микроРНК в мБТШ70(+) ВНВ и мБТШ70(-) ВНВ, секретируемых клетками COLO320. Данные нормализованы относительно среднего значения Ct (global Ct) для всех детектированных молекул
Fig.6. Comparison of the total number and miRNA expression profile of molecules in the composition of mHSP70 (+) ENVs and mHSP70(-) ENVs secreted by COLO320 cells. A – the total number of detected molecules out of 179 included in the analysis; B – comparative composition and expression level (profile) of miRNA in mHSP70 (+) ENVs and mHSP70 (-) ENVs secreted by COLO320 cells. The data are normalized to the average Ct value (global
Ct) for all detected molecules
Рис. 7. Анализ эффективности детекции миР-191. Черным цветом показаны результаты анализа серийных разведений синтетического аналога молекулы miR-191-5p, входящие в состав набора серии ALL-MIR. Красным цветом показаны результаты анализа шести образцов РНК, выделенных из ВНВ, секретируемых клетками КРР (три культуры: мБТШ70(+) ВНВ и мБТШ70(-) ВНВ). Представлены усредненные результаты трех измерений (значения Ct без нормализации) и значения стандартных отклонений
Fig. 7. Analysis of the detection efficiency of miR-191. Black color shows the results of the analysis of serial dilutions of the synthetic analog of the miR-191-5p molecule included in the ALL-MIR kit. The red color shows the results of the analysis of six RNA samples isolated from ENVs, secreted by CRC cells (three cultures: mHSP70(+) ENVs and mHSP70(-) ENVs). The averaged results of three measurements (Ct values without normalization) and standard deviation values are shown
miR-155
miR-181a
miR-223
БТШ(+) BHB ■ БТШ(-) BHB
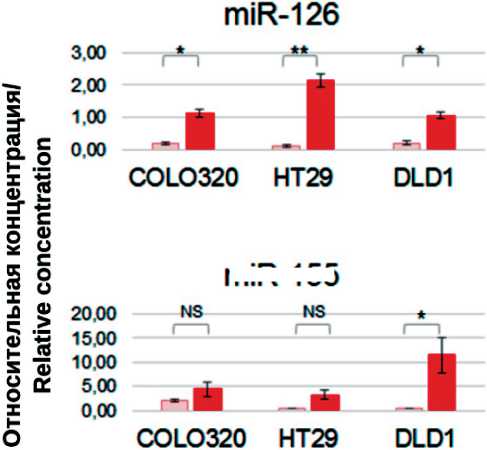
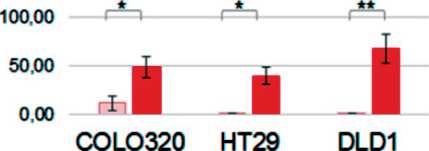
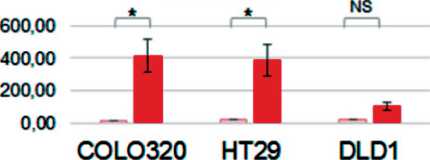
Рис. 8. Анализ концентрации миР-126, -181а, -155 и -223 в мБТШ70(+) и мБТШ70(-) ВНВ, секретируемых клетками разных линий КРР. Представлены усредненные данные трех экспериментов выделения мБТШ70(+) ВНВ и мБТШ70(-) ВНВ и значения стандартных отклонений. В каждом случае реакции ОТ-ПЦР проведены в трех повторах, данные усреднены и нормализованы относительно значения Ct (miR-191-5p). Сравнение статистической значимости разницы между «группами» результатов измерений (n=3) проведено методом Mann–Withney (* – p<0,05; ** – p<0,005; *** – p<0,0005)
Fig. 8. Analysis of the concentration of miR-126, -181a, -155 and -223 in mHSP70 (+) and mHSP70 (-) ENVs secreted by cells of different CRC lines. The averaged data of three experiments on the isolation of mHSP70(+) ENVs and mHSP70(-) ENVs and the values of standard deviations are presented. In each case, RT-PCR reactions were performed in triplicate, the data averaged and normalized relative to the Ct value (miR-191-5p). Comparison of the statistical significance of the difference between the «groups» of measurement results (n= 3) was carried out by the Mann– Withney method (* – p<0.05; ** – p<0.005; *** – p<0.0005)
дующей ПЦР с двумя микроРНК-специфичными праймерами, реализованной в наборах ALL-MIR (ООО «Альгимед Техно», Беларусь). Параллельно был проведен анализ экспрессии миР-191-5p и малой ядерной РНК U6 snRNA в качестве референсных молекул. В шести анализируемых образцах наблюдалась относительно стабильная экспрессия обеих молекул: Ct (U6)=24,3 ± 0,3; Ct (miR-191-5p)=27,1 ± 0,4, что позволило использовать их в качестве нормализаторов. На рис. 7 совмещены результаты анализа серийных разведений синтетической молекулы miR-191-5p, демонстрирующие аналитические характеристики системы ОТ-ПЦР анализа в диапазоне концентраций аналита 103–1012 молекул/реакцию, и результаты анализа этой молекулы в биологических образцах.
Анализ концентрации выбранных по данным профайлинга везикулярных микроРНК был проведен после трех независимых экспериментов по индукции ТШ и получения фракций мБТШ70(+) ВНВ и мБТШ70(-)ВНВ. Каждый раз ОТ-ПЦР анализ был проведен в трех технических повторах, разница не превышала 0,5 цикла. Полученные результаты усреднены, нормализованы относительно U6 и miR-191-5p. Для семи из 13 молекул результаты, полученные после трех экспериментов и нормализации относительно двух разных молекул (U6 и miR-191-5p), имели дискордантный характер. В шести случаях (miR-126-3p, miR-181-5p, miR-155-5p, miR-223, miR-324-5p, miR-486-5p (табл. 3)
разница содержания микроРНК в анализируемых везикулярных популяциях была воспроизводима и не зависела от метода нормализации. В ряде случаев наблюдаемая разница концентрации микроРНК в мБТШ70(+)ВНВ и мБТШ70(-) ВНВ была статистически значима (рис. 8).
Обсуждение
Результаты исследования выявили предсказуемый, но интересный факт разной чувствительности клеток КРР к воздействию высокой температуры. С практической точки зрения было бы важно идентифицировать молекулярные маркеры высокой чувствительности (или низкой резистентности) и использовать их для прогнозирования эффективности ИХГТП. Анализ заявленных производителем клеточных линий (ATCC, American Type Culture Collection) характеристик позволил сделать предположения относительно причин низкой устойчивости к температуре клеток линии HCT116. В этих клетках описана активирующая мутация в 13 кодоне протоонкогена RAS, что предполагает патологическую активность сигнального каскада MAPK. Если этот каскад задействован в реакции клеток на ТШ, то его постоянная активность может снижать потенциал ТШ-индуцированной активации и, соответственно, толерантность клеток к воздействию ТШ. Конечно, подтверждение или опровержение этой гипотезы требует дополнительных исследований.
В ряде ранее опубликованных работ показано, что ТШ стимулирует секрецию БТШ(+)ВНВ, например, лимфобластами [36] или мононуклеарами периферической крови [10]. Результаты нашего исследования дополняют эти наблюдения интересным феноменом обратной корреляции между чувствительностью культивируемых клеток к воздействию ТШ и их способностью активировать секрецию мБТШ70(+)ВНВ в ответ на это воздействие. Если расценивать секрецию мБТШ70(+) ВНВ как элемент «защитной реакции» клеток на стресс, то такая корреляция представляется логичной: клетки, способные «реагировать» на ТШ, оказываются более резистентными к его действию, чем клетки, не способные к такой реакции. Эта интерпретация находит подтверждение в результатах ряда современных исследований, показавших корреляцию уровня мБТШ70(+)ВНВ и маркеров цитотоксичности (Granzym B, Perforin) в плазме и перитонеальной жидкости пациентов с онко-гинекологическими заболеваниями. Результаты анализа биологических жидкостей не позволяют утверждать, что источником таких «индикаторов» стресса, как мБТШ70(+)ВНВ и молекулярные индукторы апоптоза, являются именно клетки опухоли. Однако наблюдавшаяся другими авторами связь между клиническим статусом пациентов и уровнем мБТШ70(+)ВНВ в циркуляции указывает на опухолевые клетки как на наиболее вероятный источник «стрессорных» везикул [37].
Отдельного обсуждения заслуживает показанный в нашем исследовании факт существования специфической популяции мБТШ70(+)ВНВ, экспрессия которой стимулируется ТШ. Возможность продукции ВНВ разного состава [4, 5] является известным фактом, наши данные дополняют существующие представления о механизмах регуляции этого процесса. Возможность ТШ-индуцируемой активации продукции именно (или преимущественно) мБТШ70(+)ВНВ указывает на существование различных, возможно независимых, регуляторных механизмов. Кроме того, выявлена разница (количественная и качественная) в составе микроРНК мБТШ70(+)ВНВ и остальных везикул, что подтверждает специфический биогенез ТШ-индуцируемой популяции. Повышение содержания ряда молекул микроРНК (miR-126-3p, miR-181-5p, miR-155-5p, miR-223-5p) в мБТШ70(+)ВНВ, наблюдавшееся во всех трех клеточных линиях,
Список литературы Тепловой стресс стимулирует секрецию клетками колоректальной карциномы специфической популяции нановезикул с повышенным содержанием БТШ70 и измененным составом микроРНК
- Тамкович С.Н., Тутанов О.С., Лактионов П.П. Экзосомы: механизмы возникновения, состав, транспорт, биологическая активность, использование в диагностике. Биологические мембраны. 2016; 33(3): 163–175. [Tamkovich S.N., Tutanov O.S., Laktionov P.P. Exosomes: Generation, Structure, Transport, Biological Activity and Diagnostic Application. Biology Membranes. 2016; 33(3): 163–175. (in Russian)]. doi: 10.7868/s0233475516020122
- Colombo M., Raposo G., Théry C. Biogenesis, Secretion, and Intercellular Interactions of Exosomes and Other Extracellular Vesicles. Ann Rev Cell Develop Biol. 2014; 30(1): 255–89.
- Малек А.В., Самсонов Р.Б., Кьези А. Перспективы разработки методов диагностики и мониторинга онкологических заболеваний на основе анализа экзосом, секретируемых опухолевыми клетками. Российский биотерапевтический журнал. 2015; 4(12): 9–18 [Malek A.V., Samsonov R.B., Chiesi A. Development of cancer diagnostics and monitoring methods based on analysis of tumor-derived exosomes. Russian Journal of Biotherapy. 2015; 14(4): 9–18. (in Russian)].
- Bobrie A., Colombo M., Krumeich S., Raposo G., Théry C. Diverse subpopulations of vesicles secreted by different intracellular mechanisms are present in exosome preparations obtained by differential ultracentrifugation. J Extracel Vesicles. 2012; 1(1): 18397.
- Tauro B.J., Greening D.W., Mathias R.A., Mathivanan S., Ji H., Simpson R.J. Two distinct populations of exosomes are released from LIM1863 colon carcinoma cell-derived organoids. Mol Cell Proteomics. 2013; 12(3): 587–98.
- Willms E., Johansson H.J., Mäger I., Lee Y., Blomberg K.E., Sadik M., Alaarg A., Smith C.I., Lehtiö J., El Andaloussi S., Wood M.J., Vader P. Cells release subpopulations of exosomes with distinct molecular and biological properties. Sci Rep. 2016; 6: 22519. doi: 10.1038/srep22519.
- Koumangoye R.B., Sakwe A.M., Goodwin J.S., Patel T., Ochieng J. Detachment of breast tumor cells induces rapid secretion of exosomes which subsequently mediate cellular adhesion and spreading. PLoS One. 2011; 6(9).
- Eguchi T., Sogawa C., Ono K., Matsumoto M., Tran M.T., Okusha Y., Lang B.J., Okamoto K., Calderwood S.K. Cell Stress Induced Stressome Release Including Damaged Membrane Vesicles and Extracellular HSP90 by Prostate Cancer Cells. Cells. 2020; 9(3): 755. doi: 10.3390/cells9030755.
- Shao C., Yang F., Miao S., Liu W., Wang C., Shu Y., Shen H. Role of hypoxia-induced exosomes in tumor biology. Mol Cancer. 2018; 17(1): 120. doi: 10.1186/s12943-018-0869-y.
- Lancaster G.I., Febbraio M.A. Exosome-dependent trafficking of HSP70: a novel secretory pathway for cellular stress proteins. J Biol Chem. 2005; 280(24): 23349–55. doi: 10.1074/jbc.M502017200.
- Santos T.G., Martins V.R., Hajj G.N.M. Unconventional secretion of heat shock proteins in cancer. Int J Mol Sci. 2017; 18(5): 946.
- Tang X., Chang C., Guo J., Lincoln V., Liang C., Chen M., Woodley D.T., Li W. Tumour-Secreted Hsp90α on External Surface of Exosomes Mediates Tumour – Stromal Cell Communication via Autocrine and Paracrine Mechanisms. Sci Rep. 2019; 9(1): 15108. doi: 10.1038/s41598-019-51704-w.
- Маргулис Б.А., Гужова И.В. Двойная роль шаперонов в ответе клетки и всего организма на стресс. Цитология. 2009; 51(3): 219–28 [Margulis B.A., Guzhova I.V. The dual role of chaperones in the response of the cell and the body to stress. Cytology. 2009; 51(3): 219–28 (in Russian)].
- Garrido C., Brunet M., Didelot C., Zermati Y., Schmitt E., Kroemer G. Heat shock proteins 27 and 70: Anti-apoptotic proteins with tumorigenic properties. Cell Cycle. 2006; 5(22): 2592–2601.
- Rérole A.L., Gobbo J., De Thonel A., Schmitt E., Pais de Barros J.P., Hammann A., Lanneau D., Fourmaux E., Demidov O.N., Micheau O., Lagrost L., Colas P., Kroemer G., Garrido C. Peptides and aptamers targeting HSP70: a novel approach for anticancer chemotherapy. Cancer Res. 2011; 71(2): 484–95. doi: 10.1158/0008-5472.CAN-10-1443.
- Kudryavtsev V.A., Khokhlova A.V., Mosina V.A., Selivanova E.I., Kabakov A.E. Induction of Hsp70 in tumor cells treated with inhibitors of the Hsp90 activity: A predictive marker and promising target for radiosensitization. PLoS One. 2017; 12(3).
- Gong J., Weng D., Eguchi T., Murshid A., Sherman M.Y., Song B., Calderwood S.K. Targeting the hsp70 gene delays mammary tumor initiation and inhibits tumor cell metastasis. Oncogene. 2015; 34(43): 5460–71. doi: 10.1038/onc.2015.1.
- Calderwood S.K., Gong J. Heat Shock Proteins Promote Cancer: It’s a Protection Racket. Trends Biochem Sci. 2016; 41(4): 311–23.
- De Maio A. Extracellular Hsp70: Export and Function. Curr Protein Pept Sci. 2014; 15(3): 225–31.
- Chalmin F., Ladoire S., Mignot G., Vincent J., Bruchard M., Remy-Martin J.P., Boireau W., Rouleau A., Simon B., Lanneau D., De Thonel A., Multhoff G., Hamman A., Martin F., Chauffert B., Solary E., Zitvogel L., Garrido C., Ryffel B., Borg C., Apetoh L., Rébé C., Ghiringhelli F. Membrane-associated Hsp72 from tumor-derived exosomes mediates STAT3-dependent immunosuppressive function of mouse and human myeloid-derived suppressor cells. J Clin Invest. 2010; 120(2): 457–71. doi: 10.1172/JCI40483.
- Gobbo J., Marcion G., Cordonnier M., Dias A.M.M., Pernet N., Hammann A., Richaud S., Mjahed H., Isambert N., Clausse V., Rébé C., Bertaut A., Goussot V., Lirussi F., Ghiringhelli F., de Thonel A., Fumoleau P., Seigneuric R., Garrido C. Restoring Anticancer Immune Response by Targeting Tumor-Derived Exosomes With a HSP70 Peptide Aptamer. J Natl Cancer Inst. 2015; 108(3). doi: 10.1093/jnci/djv330.
- Никитин К.Д., Барышников А.Ю. Противоопухолевые вакцины на основе белков теплового шока. 2007; 6(2): 3–12. [Nikitin K.D., Baryshnikov A.Yu. Heat shock protein-based anticancer vaccines. Russian Journal of Biotherapy. 2007; 6(2): 3–12. (in Russian)].
- Gastpar R., Gehrmann M., Bausero M.A., Asea A., Gross C., Schroeder J.A., Multhoff G. Heat shock protein 70 surface-positive tumor exosomes stimulate migratory and cytolytic activity of natural killer cells. Cancer Res. 2005; 65(12): 5238–47. doi: 10.1158/0008-5472. CAN-04-3804.
- Vega V.L., Rodríguez-Silva M., Frey T., Gehrmann M., Diaz J.C., Steinem C., Multhoff G., Arispe N., De Maio A. Hsp70 translocates into the plasma membrane after stress and is released into the extracellular environment in a membrane-associated form that activates macrophages. J Immunol. 2008; 180(6): 4299–307. doi: 10.4049/jimmunol.180.6.4299.
- Chen W., Wang J., Shao C., Liu S., Yu Y., Wang Q., Cao X. Efficient induction of antitumor T cell immunity by exosomes derived from heat-shocked lymphoma cells. Eur J Immunol. 2006; 36(6): 1598–607. doi: 10.1002/eji.200535501.
- Menay F., Herschlik L., De Toro J., Cocozza F., Tsacalian R., Gravisaco M.J., Di Sciullo M.P., Vendrell A., Waldner C.I., Mongini C. Exosomes Isolated from Ascites of T-Cell Lymphoma-Bearing Mice Expressing Surface CD24 and HSP-90 Induce a Tumor-Specific Immune Response. Front Immunol. 2017; 8.
- Pinto A., Pocard M. Hyperthermic intraperitoneal chemotherapy with cisplatin and mitomycin C for colorectal cancer peritoneal metastases: A systematic review of the literature. Pleura and Peritoneum. 2019; 4(2): 20190006.
- Théry C., Witwer K.W., Aikawa E., Alcaraz M.J., Anderson J.D., Andriantsitohaina R., Antoniou A., Arab T., Archer F., Atkin-Smith G.K., Ayre D.C., Bach J.M., Bachurski D., Baharvand H., Balaj L., Baldacchino S., Bauer N.N., Baxter A.A., Bebawy M., Beckham C., Bedina Zavec A., Benmoussa A., Berardi A.C., Bergese P., Bielska E., Blenkiron C., Bobis-Wozowicz S., Boilard E., Boireau W., Bongiovanni A., Borràs F.E., Bosch S., Boulanger C.M., Breakefield X., Breglio A.M., Brennan M.Á., Brigstock D.R., Brisson A., Broekman M.L., Bromberg J.F., Bryl-Górecka P., Buch S., Buck A.H., Burger D., Busatto S., Buschmann D., Bussolati B., Buzás E.I., Byrd J.B., Camussi G., Carter D.R., Caruso S., Chamley L.W., Chang Y.T., Chen C., Chen S., Cheng L., Chin A.R., Clayton A., Clerici S.P., Cocks A., Cocucci E., Coffey R.J., Cordeiro-da-Silva A., Couch Y., Coumans F.A., Coyle B., Crescitelli R., Criado M.F., D’Souza-Schorey C., Das S., Datta Chaudhuri A., de Candia P., De Santana E.F., De Wever O., Del Portillo H.A., Demaret T., Deville S., Devitt A., Dhondt B., Di Vizio D., Dieterich L.C., Dolo V., Dominguez Rubio A.P., Dominici M., Dourado M.R., Driedonks T.A., Duarte F.V., Duncan H.M., Eichenberger R.M., Ekström K., El Andaloussi S., Elie-Caille C., Erdbrügger U., Falcón-Pérez J.M., Fatima F., Fish J.E., Flores-Bellver M., Försönits A., Frelet-Barrand A., Fricke F., Fuhrmann G., Gabrielsson S., Gámez-Valero A., Gardiner C., Gärtner K., Gaudin R., Gho Y.S., Giebel B., Gilbert C., Gimona M., Giusti I., Goberdhan D.C., Görgens A., Gorski S.M., Greening D.W., Gross J.C., Gualerzi A., Gupta G.N., Gustafson D., Handberg A., Haraszti R.A., Harrison P., Hegyesi H., Hendrix A., Hill A.F., Hochberg F.H., Hoffmann K.F., Holder B., Holthofer H., Hosseinkhani B., Hu G., Huang Y., Huber V., Hunt S., Ibrahim A.G., Ikezu T., Inal J.M., Isin M., Ivanova A., Jackson H.K., Jacobsen S., Jay S.M., Jayachandran M., Jenster G., Jiang L., Johnson S.M., Jones J.C., Jong A., Jovanovic-Talisman T., Jung S., Kalluri R., Kano S.I., Kaur S., Kawamura Y., Keller E.T., Khamari D., Khomyakova E., Khvorova A., Kierulf P., Kim K.P., Kislinger T., Klingeborn M., Klinke D.J., Kornek M., Kosanović M.M., Kovács Á.F., Krämer-Albers E.M., Krasemann S., Krause M., Kurochkin I.V., Kusuma G.D., Kuypers S., Laitinen S., Langevin S.M., Languino L.R., Lannigan J., Lässer C., Laurent L.C., Lavieu G., Lázaro-Ibáñez E., Le Lay S., Lee M.S., Lee Y.X.F., Lemos D.S., Lenassi M., Leszczynska A., Li I.T., Liao K., Libregts S.F., Ligeti E., Lim R., Lim S.K., Linē A., Linnemannstöns K., Llorente A., Lombard C.A., Lorenowicz M.J., Lörincz Á.M., Lötvall J., Lovett J., Lowry M.C., Loyer X., Lu Q., Lukomska B., Lunavat T.R., Maas S.L., Malhi H., Marcilla A., Mariani J., Mariscal J., Martens-Uzunova E.S., Martin-Jaular L., Martinez M.C., Martins V.R., Mathieu M., Mathivanan S., Maugeri M., McGinnis L.K., McVey M.J., Meckes DG Jr., Meehan K.L., Mertens I., Minciacchi V.R., Möller A., Møller Jørgensen M., Morales-Kastresana A., Morhayim J., Mullier F., Muraca M., Musante L., Mussack V., Muth D.C., Myburgh K.H., Najrana T., Nawaz M., Nazarenko I., Nejsum P., Neri C., Neri T., Nieuwland R., Nimrichter L., Nolan J.P., Nolte-’t Hoen E.N., Noren Hooten N., O’Driscoll L., O’Grady T., O’Loghlen A., Ochiya T., Olivier M., Ortiz A., Ortiz L.A., Osteikoetxea X., Østergaard O., Ostrowski M., Park J., Pegtel D.M., Peinado H., Perut F., Pfaffl M.W., Phinney D.G., Pieters B.C., Pink R.C., Pisetsky D.S., Pogge von Strandmann E., Polakovicova I., Poon I.K., Powell B.H., Prada I., Pulliam L., Quesenberry P., Radeghieri A., Raffai R.L., Raimondo S., Rak J., Ramirez M.I., Raposo G., Rayyan M.S., Regev-Rudzki N., Ricklefs F.L., Robbins P.D., Roberts D.D., Rodrigues S.C., Rohde E., Rome S., Rouschop K.M., Rughetti A., Russell A.E., Saá P., Sahoo S., Salas-Huenuleo E., Sánchez C., Saugstad J.A., Saul M.J., Schiffelers R.M., Schneider R., Schøyen T.H., Scott A., Shahaj E., Sharma S., Shatnyeva O., Shekari F., Shelke G.V., Shetty A.K., Shiba K., Siljander P.R., Silva A.M., Skowronek A., Snyder O.L., Soares R.P., Sódar B.W., Soekmadji C., Sotillo J., Stahl P.D., Stoorvogel W., Stott S.L., Strasser E.F., Swift S., Tahara H., Tewari M., Timms K., Tiwari S., Tixeira R., Tkach M., Toh W.S., Tomasini R., Torrecilhas A.C., Tosar J.P., Toxavidis V., Urbanelli L., Vader P., van Balkom B.W., van der Grein S.G., Van Deun J., van Herwijnen M.J., Van Keuren-Jensen K., van Niel G., van Royen M.E., van Wijnen A.J., Vasconcelos M.H., Vechetti IJ Jr., Veit T.D., Vella L.J., Velot É., Verweij F.J., Vestad B., Viñas J.L., Visnovitz T., Vukman K.V., Wahlgren J., Watson D.C., Wauben M.H., Weaver A., Webber J.P., Weber V., Wehman A.M., Weiss D.J., Welsh J.A., Wendt S., Wheelock A.M., Wiener Z., Witte L., Wolfram J., Xagorari A., Xander P., Xu J., Yan X., Yáñez-Mó M., Yin H., Yuana Y., Zappulli V., Zarubova J., Žėkas V., Zhang J.Y., Zhao Z., Zheng L., Zheutlin A.R., Zickler A.M., Zimmermann P., Zivkovic A.M., Zocco D., Zuba-Surma E.K. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 2018; 7(1): 1535750. doi: 10.1080/20013078.2018.1535750.
- Shtam T., Naryzhny S., Samsonov R., Karasik D., Mizgirev I., Kopylov A., Petrenko E., Zabrodskaya Y., Kamyshinsky R., Nikitin D., Sorokin M., Buzdin A., Gil-Henn H., Malek A. Plasma exosomes stimulate breast cancer metastasis through surface interactions and activation of FAK signaling. Breast Cancer Res Treat. 2019; 174(1): 129–41. doi: 10.1007/s10549-018-5043-0.
- O’Neill C.P., Gilligan K.E., Dwyer R.M. Role of Extracellular Vesicles (EVs) in Cell Stress Response and Resistance to Cancer Therapy. Cancers (Basel). 2019; 11(2): 136. doi: 10.3390/cancers11020136.
- Albakova Z., Armeev G.A., Kanevskiy L.M., Kovalenko E.I., Sapozhnikov A.M. HSP70 Multi-Functionality in Cancer. Cells. 2020; 9(3): 587.
- Breuninger S., Stangl S., Werner C., Sievert W., Lobinger D., Foulds G.A., Wagner S., Pickhard A., Piontek G., Kokowski K., Pockley A.G., Multhoff G. Membrane Hsp70 – A Novel Target for the Isolation of Circulating Tumor Cells After Epithelial-to-Mesenchymal Transition. Front Oncol. 2018; 8: 497.
- Ingenito F., Roscigno G., Affinito A., Nuzzo S., Scognamiglio I., Quintavalle C., Condorelli G. The Role of Exo-miRNAs in Cancer: A Focus on Therapeutic and Diagnostic Applications. Int J Mol Sci. 2019; 20(19): 4687. doi: 10.3390/ijms20194687.
- Temoche-Diaz M.M., Shurtleff M.J., Nottingham R.M., Yao J., Fadadu R.P., Lambowitz A.M., Schekman R. Distinct mechanisms of microRNA sorting into cancer cell-derived extracellular vesicle subtypes. Elife. 2019; 8. doi: 10.7554/eLife.47544.
- Stangl S., Gehrmann M., Riegger J., Kuhs K., Riederer I., Sievert W., Hube K., Mocikat R., Dressel R., Kremmer E., Pockley A.G., Friedrich L., Vigh L., Skerra A., Multhoff G. Targeting membrane heat-shock protein 70 (Hsp70) on tumors by cmHsp70.1 antibody. Proc Natl Acad Sci U S A. 2011; 108(2): 733–8. doi: 10.1073/pnas.1016065108.
- Clayton A., Turkes A., Navabi H., Mason M.D., Tabi Z. Induction of heat shock proteins in B-cell exosomes. J Cell Sci. 2005; 118(16): 3631–8. doi: 10.1242/jcs.02494.
- Chanteloup G., Cordonnier M., Isambert N., Bertaut A., Marcion G., Garrido C., Gobbo J. Membrane-bound exosomal HSP70 as a biomarker for detection and monitoring of malignant solid tumours: A pilot study. Pilot Feasibility Stud. 2020.


