Термические эффекты при лазерной обработке суставного хряща
Автор: Иванников С.В., Лычагин А.В., Бобров Д.С., Юсупов В.И., Старцева Е.Д., Сурин В.В., Наиманн А.И., Жарова Т.А., Явлиева Р.Х., Ян Яньбинь
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 2 (48), 2022 года.
Бесплатный доступ
Обоснование: Остеоартроз - одно из наиболее распространённых заболеваний, приводящих к потере трудоспособности. Артроскопическая лазерная обработка суставного хряща является эффективным и перспективным методом лечения остеоартроза, однако её методика может быть улучшена за счёт результатов данного исследования.Цель: Определение степени термического воздействия двухволнового лазерного излучения ближнего инфракрасного диапазона на суставной хрящ при лазерной обработке.Методы: Образцы суставных хрящей быка были подвергнуты воздействию инфракрасного лазерного излучения с различными параметр. Во время воздействия расстояние от торца волокна до образца составляло 2 мм. При этом измерение поверхностной температуры хряща производилось при помощи тепловизионной камеры, а температура в объеме образца измерялась точечно при помощи термопары. Результаты: Изменение поверхностной температуры образцов хрящей при воздействии в течение 2 с излучением с λ= 0,97 мкм/7 Вт составило ΔT=2,4±0,5 °C, а с λ= 1,55 мкм/5Вт - ΔT=21,1 °C. Воздействие в течение 2 с двухволновым излучением с λ= 1,55/5 Вт + λ=0,97 мкм /3 Вт приводило к подъему поверхностной температуры на 21,8±0,5 °C. При воздействии в течение 2 с двухволновым излучением с λ= 1,55/5 Вт + λ=0,97 мкм /3 Вт увеличение температуры биоткани на глубине 1 мм составило: на оптической оси - ΔT=11 °C, на расстоянии 1 мм от оси - ΔT=4 °C, на расстоянии 2 мм от оси - ΔT=3 °C.Выводы: 1) При использовании двухволнового излучения λ=1.56 мкм и λ=0.97 мкм, наибольший вклад в нагрев хрящевой ткани вносит λ=1.56 мкм, поглощающееся в поверхностных областях, тогда как излучение λ=0.97 мкм поглощается слабее и проникает в более глубокие слои. 2) Максимальное увеличение температуры хряща происходит в пределах 1 мм от оси распространения лазерного излучения. Благодаря этому лазерная обработка позволяет эффективно добиваться «сглаживания» поверхности хряща при минимальном воздействии на ткани вне обрабатываемой области. 3) Лазерное излучение с используемыми параметрами помимо чисто термического воздействия на хрящевую ткань может запускать процессы ее регенерации по механизмам механобиологии и фотобиомодуляции.
Лазер, суставной хрящ, хондромаляция, двухволновое излучение, импульсно-периодический режим, длина волны, параметры излучения, лазерная обработка
Короткий адрес: https://sciup.org/142236566
IDR: 142236566 | УДК: 616.72-007.248 | DOI: 10.17238/2226-2016-2022-2-43-52
Текст научной статьи Термические эффекты при лазерной обработке суставного хряща
Остеоартроз — болезнь, проявляющееся повреждением суставного хряща, является одним из наиболее распространённых заболеваний, поражающая до 50 % взрослого трудоспособного населения старше 50 лет [1, 2, 3].
Лазерная обработка суставного хряща с целью сглаживания его разволокнённых участков может выполнятся во время артроскопии при артрозах.
Лазерные артроскопические инструменты позволяют дозировать термическое воздействие на хрящ за счёт настройки параметров излучения, а также небольшого диаметра светового пятна [4].
При лазерной обработке суставного хряща в жидкой среде, в связи с кипением жидкости у торца светопроводящего волокна, происходит образование пузырьковых струй и генерация широкополосных акустических колебаний, оказывающих механическое воздействие на хрящ. Это воздействие, по данным различных исследований, способно индуцировать регенерацию хряща, стимулируя активность хондробластов [5-18], а также образования в ткани под действием неоднородного нагрева многочисленных микропор, что способствует улучшению микроциркуляции и клеточного питания [19, 20, 21, 22].
Таким образом лазерные артроскопические инструменты при обработке очагов хондромаляции обладают следующими преимуществами перед другими типами инструментов:
-
- дозированность и высокая точность воздействия, позволяющие свести вероятность повреждений хряща вне обрабатываемой области к минимуму;
-
- стимуляция регенерации хрящевой ткани в очаге хон-дромаляции по механизмам механобиологии.
Также был проведен ряд экспериментов по изучению воздействия сочетанного двухволнового излучения λ=0,97 мкм + λ=1,55 мкм на хрящ. Оказалось, что при сочетанном двухволновом воздействии необходимый эффект («сглаживание» поверхности хряща) достигается при меньшей суммарной мощности. Установлено, что в среде 0,9% раствора NaCl «сглаживание» поверхности хряща при минимальном термическом воздействии на окружающие ткани происходит при использовании двухволнового излучения 1,55 мкм / 5 Вт и 0,97 мкм/3 Вт в импульсно-периодическом режиме (импульс/ пауза=100 мс/50 мс) с расстояния 2 мм в течении 2 с [22].
Целью настоящей работы является определение степени термического воздействия двухволнового лазерного излучения ближнего инфракрасного диапазона на суставной хрящ при лазерной обработке.
Материалы и методы:
Для проведения исследования в качестве источника лазерного излучения был использован двухволновый волоконный лазерный аппарат ЛСП – «ИРЭ-Полюс» (НТО «ИРЭ-Полюс», Россия) с длинами волн излучения λ=0,97 мкм (до 30 Вт) и λ=1,55 мкм (до 15 Вт). Для доставки излучения использовался волоконный хирургический инструмент (кварц-кварцевый световод) с диаметром светонесущей жилы 600 мкм и прямым выводом излучения.
В качестве объектов воздействия были использованы образцы суставных хрящей коленного сустава быка.
Обработка образцов суставных хрящей производилась в среде изотонического 0,9 % раствора NaCl для моделирования условий, соответствующих артроскопической операции.
Для регистрации термических эффектов в образцах хрящей использовалась точечная термопара Physitemp IT-23 (точность ±0.1 °C, частота 200 Гц, PhysitempInstruments, USA) диаметром 76 мкм, запись данных осуществлялась с помощью системы сбора данных DI-245 (Dataq Instruments, USA). Также регистрации поверхностных термических эффектов использовалась тепловизионная камера FLIR T650 SC (FLIRSystems, USA) с рабочим диапазоном длин волн 7.5 – 14 мкм (размер термограмм 640x480 точек, частота 30 Гц, точность измерения температуры ±1%). Тепловизионную камеру устанавливали под углом 30° к поверхности образцов на расстоянии 30 см от нее.
Всего было проведено две серии экспериментов.
Во время первой серии образцы суставных хрящей быка были закреплены в контейнере с 0.9% изотоническим раствором NaCl на глубине 300 мкм (Рис. 1). На поверхности образцов устанавливалась сапфировая пластинка толщиной 300 мкм. Таким образом, образец биоткани был погружен в раствор NaCl, как это происходит во время артроскопических операций. Что касается сапфировой пластинки, то она тоже была погружена в жидкость на свою толщину так, что ее верхняя поверхность оставалась на одном уровне с поверхностью жидкости, не погружаясь в неё. Эта пластинка свободно пропускала лазерное излучение, выходящее из волокна, которое поглощалось в образце нижележащей хрящевой ткани. При этом тепловое инфракрасное излучение нагревало сапфировую пластинку, что позволяло тепловизору снимать распределение тепловых полей с ее поверхности. Если бы такой пластинки не было, то тепловизор показал бы температуру на поверхности водного раствора над образцом хряща и такая картинка могла сильно отличаться от реального распределения температуры на поверхности хряща. Поскольку сапфир, как хорошо известно, обладает высокой теплопроводностью и малой теплоемкостью, то использование в такой конфигурации тонкой пластинки позволяет получать очень близкую к реальности картину распределения теплового поля на поверхности хряща.
Для уточнения влияния такой сапфировой пластинки на результаты температурных измерений были проведены следующие предварительные исследования. В воздушной среде с помощью тепловизионной камеры были измерены максимальные температуры открытой смоченной водой поверхности хряща и смоченной поверхности хряща, покрытой сапфировой пластинкой при одинаковом лазерном воздействии. В результате оказалось, что использование сапфировой пластинки приводит к уменьшению максимальных регистрируемых температур на поверхности хряща примерно на 2 °С.
Над образцами хрящей в растворе NaCl, покрытых сапфировой пластинкой, перпендикулярно к ним устанавливали волоконный хирургический инструмент (кварц-кварцевый световод) с диаметром светонесущей жилы 600 мкм, подсоединённый к двухволновому лазерному аппарату ЛСП – «ИРЭ-Полюс» (НТО «ИРЭ-Полюс», Россия). Расстояние от торца световода до поверхности образцов хрящей составляло 2 мм.
В экспериментах воздействие лазерным излучением с различными параметрами производилось в течении 2 с. Изменения температуры поверхности образцов хрящей регистрировалось в течении 5 с от начала воздействия.

Рис. 1. Экспериментальная установка для измерения тепловых полей, образующихся на поверхности образца хряща под воздействием лазерного излучения, регистрируемых при помощи тепловизионной камеры.
Во время второй серии экспериментов образцы суставных хрящей быка закрепляли в контейнере с 0.9% изотоническим раствором NaCl на глубине 3 см, для создания условий распространения излучения, соответствующих артроскопической операции. Схема установки представлена на рисунке 2.
Над образцами хрящей перпендикулярно к ним устанавливали волоконный хирургический инструмент (кварц-кварцевый световод) с диаметром светонесущей жилы 600 мкм, подсоединённый к двухволновому лазерному аппарату ЛСП – «ИРЭ-Полюс» (НТО «ИРЭ-Полюс», Россия). Расстояние от торца световода до поверхности образцов составляло 2 мм.
На поверхности образцов, противоположной той, с которой был размещён световод (то есть со стороны, обычно примыкающей к субхондральной кости), при помощи иглы создавали тонкий канал, куда была помещена точечная термопара диаметром 76 мкм. Термопару устанавливали в толще хрящевой ткани на глубине в 1 мм под поверхностью образцов вначале точно на оси распространения лазерного луча (shift=0), затем на расстоянии 1 мм (shift=1) и 2 мм (shift=0) от оси распространения лазерного луча.
На поверхность суставной ткани производилось воздействие двухволновым 1,55 мкм / 5 Вт + 0,97 мкм /3 Вт лазерным излучением в импульсно-периодическом режиме с длительностью импульса 100 мс и паузой 50 мс в течении 2 с. Изменение температуры образцов хрящей в зоне расположения термопары регистрировались в течении 5 с от начала воздействия.
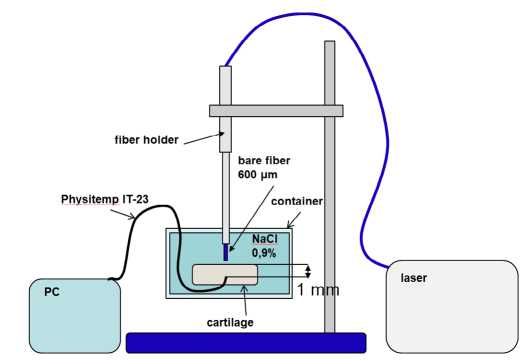
Рис. 2. Схема экспериментальной установки для регистрации при помощи термопары изменений температуры в образце хряща, происходящих при воздействии лазерного излучения.
Результаты:
Первая серия экспериментов: измерения с помощью тепловизионной камеры.
На рис. 3а показано распределение теплового поля на поверхности образца хряща при воздействии на него лазерным излучением 0,97 мкм /7 Вт в импульсно-периодическом режиме (100 мс/50 мс) в момент, когда была достигнута максимальная температура. На рис. 3b приведена динамика максимальной температуры на поверхности хряща.
Из рис. 3б видно, что после начала лазерного воздействия максимальная температура на поверхности образца хряща за 2 с увеличилась на 2,4 ±0,2 °C. Точка с максимальной температурой (стрелка 2 на рис. 3а) находится на оптической оси под волокном (стрелка 1 на рис. 3а), при этом видимая область теплового нагрева к 2 с составляет в диаметре около 2 мм (рис. 3а).
На рис. 4а представлено распределение теплового поля на поверхности образца хряща при воздействии на него лазерным излучением 1,55 мкм / 5 Вт в импульсно-периодическом режиме (100 мс/50 мс) в момент, когда была достигнута максимальная температура. На рис. 4b приведена динамика максимальной температуры на поверхности хряща.
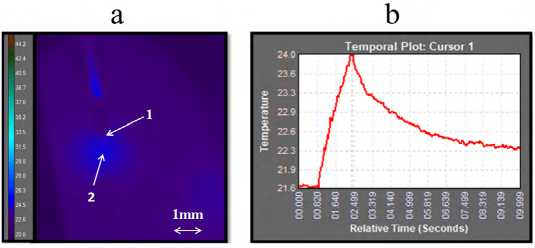
Рис. 3. Результаты тепловизионных измерений поверхностной температуры образца хряща при воздействии на него лазерным излучением 0,97 мкм /7 Вт в импульсно-периодическом режиме 100 мс/50 мс. а -распределение теплового поля в момент, когда была зарегистрирована достигнута максимальная температура. Цифрой 1 обозначен торец волокна, цифрой 2- точка на поверхности хряща с максимальной температурой.
b - динамика максимальной температуры. Серия экспериментов №1.
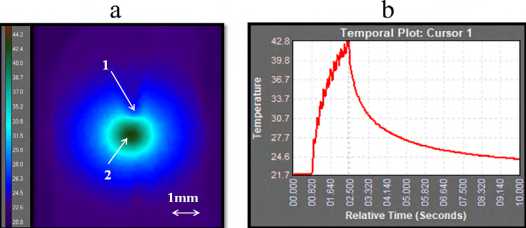
Рис. 4. Результаты тепловизионных измерений поверхностной температуры образца хряща при воздействии на него лазерным излучением
1,55 мкм / 5 Вт в импульсно-периодическом режиме 100 мс/50 мс. а -распределение теплового поля в момент, когда была зарегистрирована достигнута максимальная температура. Цифрой 1 обозначен торец волокна, цифрой 2- точка на поверхности хряща с максимальной температурой.
b - динамика максимальной температуры. Серия экспериментов №1.
Из рис. 4b видно, что после начала лазерного воздействия максимальная температура на поверхности образца хряща за 2 с увеличилась на 21,1 ± 0,4 °C. Точка с максимальной температурой (стрелка 2 на рис. 4а) находится на оптической оси под волокном (стрелка 1 на рис. 4а), при этом видимая область теплового нагрева к 2 с составляет в диаметре около 2 мм (рис. 4а).
Ниже в Таблице 1 представлены результаты максимального роста температуры на поверхности образцов хрящей, подвергнутых лазерному воздействию в импульсно-периодическом режиме (100 мс/50 мс) с различными параметрами.
Таблица 1
Максимальный рост температуры на поверхности препарата хряща при воздействии лазерного излучения в течении 2 с в импульсно-периодическом режиме (100 мс/50 мс) с различными параметрами. Серия экспериментов №1
|
Длина волны, мкм Wavelength, µm |
Мощность, Вт Power, W |
Δ Tемпературы, °C Δ Temp, °C |
|
0,97 |
3 |
1,3 ±0,2 |
|
0,97 |
5 |
1,7 ±0,2 |
|
0,97 |
7 |
2,4 ±0,2 |
|
1,55 |
1 |
14,8 ±0,3 |
|
1,55 |
3 |
12,3 ±0,3 |
|
1,55 |
5 |
21,1 ±0,4 |
После получения вышеуказанных данных ещё один образец хряща был подвергнут воздействию сочетанного двухволнового лазерного излучения 1,55 мкм / 5 Вт и 0,97 мкм /3 Вт. Режим излучения также был импульсно-периодическим с длительностью воздействия 100мс и паузой 50мс. Воздействие производилось также в течении 2 секунд, тепловые поля на поверхности образца хряща регистрировались также в течении 5 секунд.
На рис. 5а представлено распределение теплового поля на поверхности образца хряща при воздействии на него сочетанным двухволновым лазерным излучением 1,55 мкм / 5 Вт + 0,97 мкм /3 Вт в импульсно-периодическом режиме (100 мс/50 мс) в момент, когда была достигнута максимальная температура. На рис. 5b показана приведена динамика максимальной температуры на поверхности хряща.
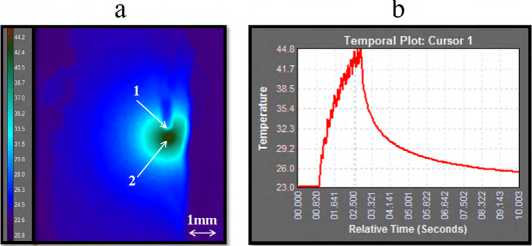
Рис. 5 . Результаты тепловизионных измерений поверхностной температуры образца хряща при воздействии на него двухволновым лазерным излучением 1,55 мкм / 5 Вт + 0,97 мкм /3 Вт т в импульсно-периодическом режиме 100 мс/50 мс. а - распределение теплового поля в момент, когда была зарегистрирована достигнута максимальная температура. Цифрой 1 обозначен торец волокна, цифрой 2- точка на поверхности хряща с максимальной температурой. b - динамика максимальной температуры. Серия экспериментов №1
Из рис. 5b видно, что после начала лазерного воздействия максимальная температура на поверхности образца хряща за 2 с увеличилась на 21,8 ±0,4 °C. Точка с максимальной температурой (стрелка 2 на рис. 5а) находится на оптической оси под волокном (стрелка 1 на рис. 5а), при этом видимая область теплового нагрева к 2 с составляет в диаметре около 2 мм (рис. 5а).
На рисунке 6 представлено сравнение максимальных изменений температуры препаратов хрящей при воздействии лазерных излучений с параметрами 0,97 мкм /7 Вт, 1,55 мкм / 5 Вт и 1,55 мкм / 5 Вт + 0,97 мкм /3 Вт в время первой серии экспериментов.
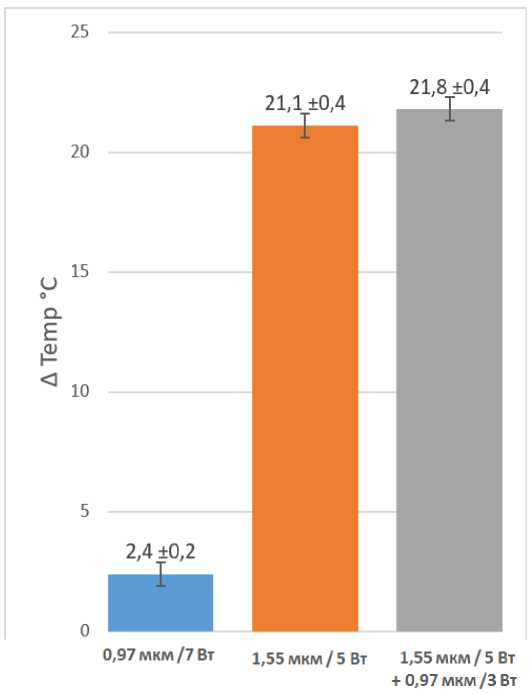
Рис. 6. Сравнение максимальных изменений температуры препарата хряща, при воздействии одноволновым лазерным излучением с параметрами 0,97 мкм /7 Вт, одноволновым лазерным излучением с параметрами 1,55 мкм / 5 Вт и двухволновым лазерным излучением с параметрами 1,55 мкм / 5 Вт + 0,97 мкм /3 Вт. Серия экспериментов №1
Исходя из полученных данных, можно сделать вывод, что при использовании двухволнового излучения с длинами волн λ=0.97 мкм и λ=1.56 мкм основной вклад в нагрев поверхности хряща вносит лазерное излучение с λ=1.56 мкм, поскольку изменение температуры при двухволновом воз- действии λ=0.97 мкм /3 Вт и λ=1.56 мкм / 5 Вт всего на 0,7 °C больше, чем при воздействии изолированным излучением 1,55 мкм / 5 Вт.
Вторая серия экспериментов: измерения с помощью термопары.
На рисунке 7 представлены результаты регистрации термических эффектов сочетанного двухволнового лазерного воздействия (1,55 мкм / 5 Вт и 0,97 мкм / 3 Вт) в импульснопериодическом режиме (100 мс / 50 мс) на образцы хрящей с помощью термопары, расположенной под осью лазерного луча (shift=0) во время второй серии экспериментов.
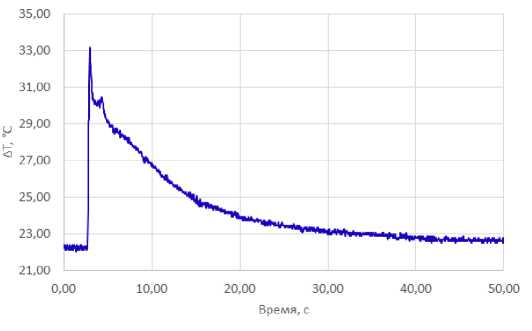
Рис. 7. Изменение температуры препарата хряща во времени на глубине в 1 мм под поверхностью хряща непосредственно под осью распространения лазерного луча (shift=0) при воздействии лазерного излучения 1,55 мкм / 5 Вт и 0,97 мкм /3 Вт в течении 2 с. Серия экспериментов №2
Исходя из полученных данных максимальная достигаемая во время воздействия температура составила 33,15 °С, а максимальное изменение температуры относительно температуры до начала воздействия составило 11 °С.
На рисунке 8 представлены результаты регистрации термических эффектов сочетанного двухволнового лазерного воздействия (1,55 мкм / 5 Вт и 0,97 мкм /3 Вт) в импульснопериодическом режиме (100 мс/50 мс) на образцы хрящей с помощью термопары, расположенной на расстоянии 1 мм от оси распространения лазерного луча (shift=1) во время второй серии экспериментов.
Исходя из полученных данных максимальная температура составила 26,15°С, а максимальное изменение температуры относительно температуры до начала воздействия составило 4°С.
На рисунке 9 представлены результаты регистрации термических эффектов сочетанного двухволнового лазерного воздействия (1,55 мкм / 5 Вт и 0,97 мкм /3 Вт) в импульснопериодическом режиме (100мс/50мс) на образцы хрящей с помощью термопары, расположенной на расстоянии 2 мм от оси лазерного луча (shift=1) во время второй серии экспериментов.
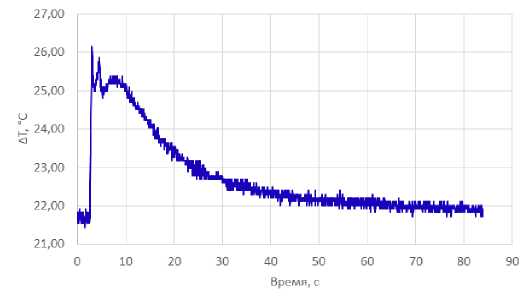
Рис. 8. Изменение температуры препарата хряща во времени на глубине в 1 мм под поверхностью хряща на расстоянии 1 мм от оси распространения лазерного луча (shift=1) при воздействии лазерного излучения 1,55 мкм / 5 Вт и 0,97 мкм /3 Вт в течении 2 с. Серия экспериментов №2.
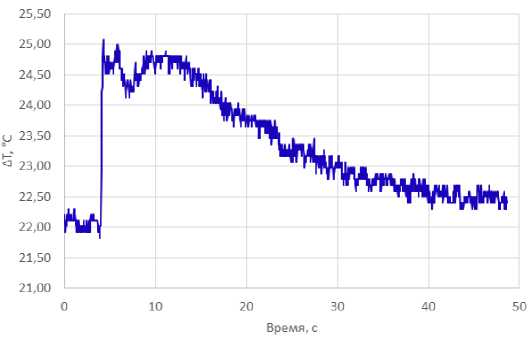
Рис. 9. Изменение температуры препарата хряща во времени на глубине в 1 мм под поверхностью хряща на расстоянии 2 мм от оси распространения лазерного луча (shift=2) при воздействии лазерного излучения 1,55 мкм / 5 Вт и 0,97 мкм /3 Вт в течении 2 с. Серия экспериментов №2.
Исходя из полученных данных максимальная температура составила 25,09°С, а максимальное изменение температуры относительно температуры до начала воздействия составило 3°С.
На рисунке 10 представлено сравнение максимальных изменений температуры препаратов хрящей на различном расстоянии от оси излучения во время второй серии экспериментов.
Таким образом можно сделать вывод, что наиболее значимое (Δ Temp = 11 °C) изменение температуры хряща (при измерении на глубине 1 мм под поверхностью образца) происходит в пределах до 1 мм (если считать расстояние по поверхности образца) от оси распространения лазерного излучения, так как на расстоянии 1 мм максимальное изменение температуры уже значительно меньше, а на расстоянии 2 мм отличается от расстояния в 1 мм всего на 1ºС.
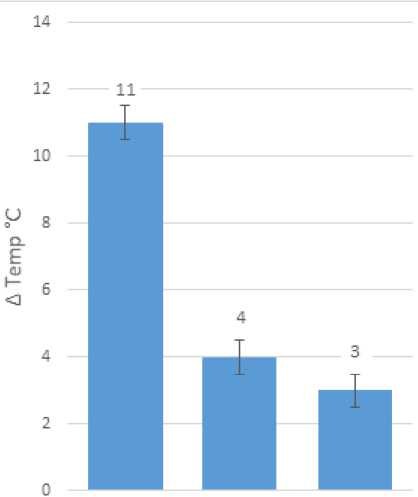
shift=OMM shift=lMM shift=2MM
Рис. 10. Сравнение максимальных величин изменения температуры препаратов хрящей при воздействии лазерного излучения
1,55 мкм / 5 Вт и 0,97 мкм /3 Вт на различных расстояниях от оси распространения лазерного луча. Серия экспериментов №2.
Обсуждение:
Измерения, полученные с помощью тепловизора, показали, что во время лазерного двухволнового воздействия с λ=0.97 мкм и λ=1.56 мкм в течение 2 с происходит постепенное увеличение температуры на поверхности хряща до 44 ºС, те произошел нагрев на 22 ºС. На кривой видны колебания температуры, связанные с колебаниями интенсивности лазерного излучения с λ=1.56 мкм с периодом 150 мс. На представленной термограмме видно, что спустя 2 с после начала лазерного двухволнового воздействия размер области на поверхности хряща с температурой >30 ºС составляет 10 мм.
Сравнение кривой нагрева для двухволнового воздействия с нагревом изолированными излучениями с λ=0.97 мкм / 7 Вт и λ=1.56 мкм / 5 Вт показывает, что основной вклад в нагрев поверхности хряща вносит лазерное излучение с λ=1.56 мкм. Это легко объянить, поскольку в ближнем инфракрасном диапазоне длин волн нагрев биоткани в основном связан с поглощением излучения в содержащейся в тканях воде, а излучение с λ=1.56 мкм поглощается в воде приблизительно в 2,8 раз сильнее по сравнению с излучением с λ=0.97 мкм.
Измерения, выполненные с помощью термопары, показали, что при сочетанном двухволновом лазерном воз- действии на поверхность хряща в течение 2 с максимальные температуры нагрева на глубине 1 мм при использовавшихся параметрах излучения значительно зависят от расстояния до оси распространения луча. В случае, когда термопара располагалась на оси распространения луча (shift=0), эти температуры в течение действия лазерного излучения лежали в диапазоне 30-32 ºС. При смещении термопары на 1 мм в плоскости, перпендикулярной оси распространения луча (shift=1), эти значения состапвляли 26 ºС, а при смещении термопары на 2 мм(shift=2) максимальный нагрев уменьшился до 25 ºС.
На подробном изображении начального участка графика для shift=0 отчетливо видно, что первоначально в течение Δt1=0.3 с происходит рост температуры до максимального значения. Затем температура несколько снижается на 2 ºС и, начиная с Δt2~2 с происходит монотонное уменьшение температуры. В то же время, исходя из физики процесса, внутри ткани в течение действия лазерного излучения (2 с) должно было происходить монотонное увеличение температуры. Наблюдаемый эффект резкого изменения температуры в течение Δt1=0.3 с, как хорошо известно, объясняется быстрым нагревом игольчатой термопары лазерным излучением. Поэтому в качестве максимальной температуры, до которой нагревается ткань в течение лазерного воздействия, следует брать значение в конце периода Δt2=2 с, когда произошло выключение лазерного излучения.
Отметим, что наблюдаемые при shift=1 мм и shift=2 мм кратковременные подъемы температуры связаны с распространением тепла от наиболее нагретой области вблизи оптической оси волокна. На распространение температурной волны указывает также то, что максимумы локальных подъемов для этих двух значений сдвигов разнесены во времени. Сначала через ~4.5 с возникает максимум на кривой, соответствующей shift=1 мм, а только спустя ~0.7 с наблюдается локальный максимум температуры для shift=2 мм.
Во время наших экспериментов, при использовании лазерного излучения в жидкой среде, жидкость у торца световода начинала быстро нагреваться до температуры кипения. В связи с возникающими при таком нагреве градиентами давления, а также периодическом образовании и схлопывании пузырьков возможен запуск стимулирования регенерации хряща по механизмам механобиологии [5, 6, 10]. Кроме этого, следует отметить, что интенсивность лазерного излучения в поверхностных слоях хрящевой ткани быстро убывает с глубиной (как из-за расхождения луча, так в результате рассеяния и поглощения). Поэтому в области лазерного воздействия в биоткани образуются обширные участки, в которых интенсивность лазерного излучения лежит в диапазоне 1-100 мВт/см2, те соответствует уровням, характерным для фотобиомодуляции [5, 10, 23]. А такое низкоинтенсивное лазерное излучение также может способствовать регенерации хряща.
Выводы:
-
1) При использовании двухволнового излучения λ=1.56 мкм и λ=0.97 мкм, наибольший вклад в нагрев хрящевой ткани вносит λ=1.56 мкм, поглощающееся в поверхностных областях, тогда как излучение λ=0.97 мкм поглощается слабее и проникает в более глубокие слои.
-
2) Максимальное увеличение температуры хряща происходит в пределах 1 мм от оси распространения лазерного излучения. Благодаря этому лазерная обработка позволяет эффективно добиваться «сглаживания» поверхности хряща при минимальном воздействии на ткани вне обрабатываемой области.
-
3) Лазерное излучение с используемыми параметрами помимо чисто термического воздействия на хрящевую ткань может запускать процессы ее регенерации по механизмам механобиологии и фотобиомодуляции.
Список литературы Термические эффекты при лазерной обработке суставного хряща
- Glyn-Jones S., Palmer A. J. R. Agricola, AJ Price, TL Vincent, H. Weinans . AJ Carr, Osteoarthritis. Lancet, 2015,vol 386, no 9991, pp. 376-87. Doi: 10.1016/S0140-6736(14)60802-3
- Madry H., Kon E., Condello V., Peretti G.M., Steinwachs M., Seil R., Berruto M., Engebretsen L., Filardo G., Angele P. (2016) Early osteoarthritis of the knee. Knee Surg Sports Traumatol Arthrosc, 2016, no 24, pp. 1753-1762. Doi: 10.1007/s00167-016-4068-3
- Корнилов Н. Н., Денисов А. А. Парадигма раннего гонартроза: обзор современных возможностей диагностики и лечения (часть 1) // Терапевтический архив // 2017. Т. 89. №. 12-2. С.238-243.
- Иванников С. В Лазерная артроскопическая хирургия (Дегенеративно-дистрофические поражения коленного сустава). Москва, 2001. 19 с.
- Перспективы лечения дискогенных компрессионных форм пояснично-крестцовых радикулитов с помощью пункционных неэндоскопических лазерных операций / Сандлер Б. И. [и др.]. Владивосток. 2004. 181 с.
- Лазерная инженерия хрящей / Баграташвили В. Н. [и др.]. Москва. 2006. 448с.
- Sobol E. etal. Laser regeneration of spine discs cartilage: mechanism, in-vivo study and clinical applications. Proceedings of Light-Activated Tissue Regeneration and Therapy Conference. Springer, Boston, MA, 2008. Pp. 259-266. Doi: 10.1007/978-0-387-71809-5_24
- Holden P. K. et al. The effects of laser irradiation of cartilage on chondrocyte gene expression and the collagen matrix. Lasers in Surgery and Medicine: The Official Journal of the American Society for Laser Medicine and Surgery, 2009 vol. 41, no. 7, pp 487-491. Doi: https://doi.org/10.1002/lsm.20795
- Wong B. J. F. et al. Identification of chondrocyte proliferation following laser irradiation, thermal injury, and mechanical trauma. Lasers in Surgery and Medicine: The Official Journal of the American Society for Laser Medicine and Surgery, 2005, vol. 37, no. 1, pp.89-96. Doi: https://doi.org/10.1002/lsm.20180
- Yusupov V. I., Chudnovskii V. M., Bagratashvili V. N. Laser-induced hydrodynamics in water-saturated biotissues. 1. Generation of bubbles in liquid. Laser physics, 2010, vol. 20, no. 7, pp. 1641-1646. Doi:10.1134/S1054660X1014001X
- Yusupov V. I., Chudnovskii V. M., Bagratashvili V. N. Laser-induced hydrodynamics in water-saturated biotissues: 2. Effect on delivery fiber. Laser Physics, 2011, vol. 21, no. 7, pp. 1230-1234. Doi:10.1134/S1054660X11140015
- Yusupov V. I. et al. Laser-induced hydrodynamics in water-saturated tissue: III. Optoacoustic effects. Laser Physics, 2013, vol. 24, no. 1, pp. 015601. Doi:10.1088/1054-660X/24/1/015601
- Yusupov V. I. et al. Generation of acoustic waves by cw laser radiation at the tip of an optical fiber in water. Acoustical Physics, 2016, vol. 62, no. 5, pp. 537-544. Doi:10.1134/S1063771016050183
- O’Conor C. J., Case N., Guilak F. Mechanical regulation of chondrogenesis. Stem cell research & therapy, 2013, vol. 4, no. 4, pp. 1-13. Doi:10.1186/scrt211
- Fahy N., Alini M., Stoddart M. J. Mechanical stimulation of mesenchymal stem cells: Implications for cartilage tissue engineering. Journal of Orthopaedic Research®, 2018, vol. 36, no. 1, pp. 52-63. Doi :10.1002/jor.23670
- Juang Y. M. et al. Proteomic analysis of chondrocytes exposed to pressure. Biomedical Chromatography, 2010, vol. 24, no. 12, pp. 1273-1282. Doi:10.1002/bmc.1436
- Mizuno S., Ogawa R. Using changes in hydrostatic and osmotic pressure to manipulate metabolic function in chondrocytes. American Journal of Physiology-Cell Physiology, 2011, vol. 300, no. 6, pp. 1234-1245. Doi:10.1152/ajpcell.00309.2010
- Karamesinis K. et al. Continuous hydrostatic pressure induces differentiation phenomena in chondrocytes mediated by changes in polycystins, SOX9, and RUNX2. Journal of Orofacial Orthopedics/Fortschritte der Kieferorthopädie, 2017, vol. 78, no. 1, pp. 21-31. Doi:10.1007/s00056-016-0061-1
- Sobol E. N. et al. Laser-induced regeneration of cartilage. Journal of Biomedical Optics, 2011, vol.16, no. 8, pp. 080902. Doi:10.1117/1.3614565
- Alexandrovskaya Y. M. et al. Mechanisms of laser activation of chondrocytes in osteoarthritis healing. Laser Physics Letters, 2018, vol. 15, no. 8, pp. 085601. Doi:10.1088/1612-202X/aac746
- Баум О. И. Механизмы модификации хрящевой ткани и тканей глаза под действием лазерного излучения. Москва. 2016. 22 с.
- Лазерная обработка хондромаляции суставного хряща / А.В Лычагин. и [др.]. //Лазерная медицина. 2022. Т. 25. №. 4. С. 9-15.
- Escudero J. S. B. et al. Photobiomodulation therapy (PBMT) in bone repair: A systematic review. Injury, 2019, vol. 50 no. 11, pp. 1853-1867. Doi: https://doi.org/10.1016/j.injury.2019.09.031


